p38丝裂原活化蛋白激酶在大鼠油酸型急性肺损伤中的作用*
2017-10-14王导新
黄 斌, 邓 旺, 王导新△
(1. 重庆医科大学附属第二医院重症医学科, 重庆 400010; 2. 重庆医科大学附属第二医院呼吸内科, 重庆 400010)
p38丝裂原活化蛋白激酶在大鼠油酸型急性肺损伤中的作用*
黄 斌1, 邓 旺2, 王导新2△
(1. 重庆医科大学附属第二医院重症医学科, 重庆 400010; 2. 重庆医科大学附属第二医院呼吸内科, 重庆 400010)
目的研究p38丝裂原活化蛋白激酶(p38MAPK)通路抑制剂SB203580对油酸性急性肺损伤(ALI)大鼠炎症反应及肺水清除的影响,探讨油酸性急性肺损伤中p38MAPK的作用机制,为p38MAPK抑制剂SB203580干预脂肪栓塞综合征诱导肺损伤提供新途径。方法24只SD雄性成年大鼠随机分为对照组(8只)、油酸模型组(8只)和SB203580干预组(8只)。油酸模型组大鼠经右颈静脉注射油酸0.20 ml/kg,造成急性肺损伤模型;SB203580组大鼠在油酸造模前30 min静脉注射SB203580;建模4 h后处死动物,检测血气分析、右下肺湿干重比(W/D)、肺系数(LI)、肺通透指数(PPI),ELISA法检测支气管肺泡灌洗液(BALF)中TNF-α含量,免疫组化和Western blot法检测肺组织p38MAPK、p-p38MAPK蛋白表达水平,检测肺组织病理变化。结果与对照组相比,油酸模型组大鼠PaO2及PaO2/FiO2明显降低,右下肺湿干重、肺系数和肺通透指数、BALF中炎症因子TNF-α的含量以及p-p38MAPK蛋白表达均明显增加(P<0.01),肺组织病理学显示明显的急性肺损伤;与油酸模型组相比,以上指标在SB203580干预组则明显改善(P<0.01)。结论p38MAPK 信号通路介导的炎性反应在油酸性肺损伤的发病机制中具有重要作用,p38MAPK抑制剂SB203580显著抑制炎症因子的表达,减轻肺水肿,对油酸性肺损伤具有明显的肺保护作用,意味着对p38MAPK的抑制可望为临床上伴有脂肪栓塞综合征(FES)的ALI的防治提供新途径。
急性肺损伤; p38丝裂原活化蛋白激酶;炎性反应;油酸
急性肺损伤(acute lung injury, ALI)以及其进一步发展所致的急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)是指各种非心源性因素导致的肺组织损伤,其主要临床表现为急性进行性呼吸衰竭[1,2]。ALI/ARDS发病机制复杂,且起病急、病情进展迅速,病死率高,到目前为止尚缺乏有效的临床预防及干预手段[3]。脂肪栓塞综合征( fat embolism syndrome,FES) 常为长骨骨折、骨科手术公认的潜在致命的并发症,可表现为 ALI,严重者可致 ARDS[4]。Bursten等[5,6]研究表明ALI/ARDS患者血液中油酸(oleic acid, OA)的比例较正常对照组明显增加,油酸削弱了肺的跨上皮活性钠转运机制,因而促进肺泡水肿形成和防止水肿消退,从而有助于ARDS的发展。对油酸性急性肺损伤动物模型的研究显示,其病因、病理生理表现与FES导致的ALI/ARDS相似[7]。有研究显示,p38丝裂原活化蛋白激酶信号通路在脂多糖(LPS)、高氧、脓毒症、肺缺血再灌注损伤等诱导的动物肺损伤中起着重要作用[8-12],但目前尚不清楚油酸性肺损伤模型中p38 MAPK的作用机制,是否与炎性调控有关,抑制p38MAPK是否对肺损伤有保护作用。本课题通过测定油酸性肺损伤模型中p38MAPK的表达,评价p38MAPK抑制剂SB203580对炎性介质、肺血管通透性、肺水清除的影响,并探讨其作用机制,以期为FES的ALI的治疗提供新途径。
1 材料与方法
1.1 实验动物及分组
成年SD大鼠,雄性,健康,清洁级, 体质量(220±20)g,购买于重庆医科大学实验动物中心。将实验动物随机分为3组(n=8):1)对照组(Control组): 经右侧颈静脉注入生理盐水(normal saline, NS)0.20 ml/kg, 30 min后再注射NS 0.20 ml/kg 。2)油酸组(Oleic acid model group,OA组):经右侧颈静脉注入油酸0.20 ml/kg,复制大鼠ALI模型,建模前30 min从静脉注射NS (剂量与SB203580组中的SB203580的液体剂量一致)。 3)SB203580干预组(SB203580 pretreatment group,SB203580组):经右颈静脉注射油酸0.20 ml/kg建立ALI模型前30 min,从颈静脉注入SB203580 5 mg/kg。动物于实验8 h前禁食, 4 h前禁水, 3.5%水合氯醛溶液1 ml/100 g腹腔注射麻醉,麻醉成功后经右颈静脉注入油酸建模,3组实验动物均于建立模型后4 h颈动脉放血处死。采集血标本进行血气分析。
1.2 试剂与仪器
油酸为Sigma-Aldrich (St. Louis, MO)产品。RIPA裂解液(RIPA Lysis Buffer)由上海申能博彩公司销售,大鼠TNF-α酶联免疫法试剂盒购买于四正柏生物公司,Polink-2plus免疫组化检测试剂盒购买于北京中杉金桥生物技术有限公司。SB203580由Promega公司提供,考马斯亮蓝法蛋白测试盒购买于南京建成生物工程研究所。兔抗p38MAPK,p-p38MAPK由Cell Signaling Technology提供。山羊抗GAPDH多克隆抗体由Santa cruz公司提供。NOVA血气分析仪 (Nova Biomedical, PHOX PLUS, USA)。日立7170全自动生化分析仪,Uv mini.1240紫外分光光度计(日本岛津公司)。
1.3 血气分析和呼吸频率测定
在注射油酸4 h 杀死动物前测定动脉血血气分析值(pH, PaO2, 与PaCO2)。 所用仪器为NOVA血气分析仪,动脉血样本量为1.0 ml。
1.4 右下肺湿干重比值、肺系数测定
放血处死大鼠,开胸迅速地摘取完整的双侧肺脏,并且仔细剔除肺以外的其它组织,用滤纸吸干表面的血污以后观察其大体的改变,用电子天平称取双肺的湿重,计算出肺系数(lung index, LI,肺系数=肺重量/体重×100%);采用干湿重的方法测右下肺湿干重比值(wet/dry, W/D),取出右下肺,称取其湿重,然后右下肺标本置于80℃的恒温烤箱烘烤72 h至恒重后,称取干重,计算右下肺湿重/干重比值(W/D)。
1.5 肺通透指数测定
放血处死大鼠后,留取动物的血清标本以待测血清蛋白含量。开胸,暴露气管,立即行气管切开,并用丝线结扎右支气管,予气管插管,用5 ml 4℃生理盐水经过气管插管反复的灌洗左肺5次后吸出,合并收集到的支气管肺泡灌洗液,回收率为80%~90%。BALF经过双层纱布过滤,用3 000 r/min离心15 min,取上清液到-70℃冰箱冻存以待测蛋白含量。血清蛋白的含量由全自动生化分析仪测定,BALF中蛋白含量通过考马斯亮蓝法来检测,BALF中蛋白含量除以血清蛋白含量等于肺通透指数(pulmonary permeability index, PPI)。
1.6BALF中炎症因子肿瘤坏死因子α含量的测定
用酶联免疫吸附法测定BALF中肿瘤坏死因子α(tumour necrosis factor-alpha, TNF-α)的含量,实验过程严格按照TNF-α酶联免疫吸附法的说明书步骤进行。
1.7 病理学观察
大鼠被处死后,将右肺上叶迅速取出,固定于4%多聚甲醛中,予石蜡包埋,制备厚度为5 μm的切片,HE染色、用普通光镜进行肺组织形态学观察。
1.8 肺组织p-p38MAPK免疫组化测定
肺组织中p-p38MAPK的表达通过二步法免疫组化进行测定。切片脱蜡脱水,予3% H2O2去离子水进行孵育,时间为10 min。PBS冲洗,滴加一抗,磷酸化p38单克隆抗体(1∶50),4℃过夜.二抗为HRP标记抗兔IgG(Poly-HRP anti-Rabbit IgG),孵育温度为37℃,时间为 20 min,DAB显色,予苏木素进行复染、封片。
1.9 免疫印迹法检测肺组织p38MAPK蛋白水平
用含RIPA的组织裂解液对肺组织蛋白进行提取,所提取的蛋白浓度通过考马斯亮蓝法测定后进行免疫印迹测定。选用的第一抗体分别为兔抗p38MAPK、p-p38MAPK单克隆抗体,其稀释度均为1∶1 000。蛋白条带由Quantity one ChemiDocXRS图像采集系统及其分析软件(Bio.Rad公司)分析处理,以目的条带校正容积与GAPDH校正容积的比值反映蛋白含量。
1.10 统计学处理
2 结果
2.1 血气分析和呼吸频率的测定
与对照组相比,油酸组大鼠呼吸频率增快,PaO2及氧合指数均降低(P<0.01);SB203580组有明显的肺保护作用,与油酸组相比,PaO2及氧合指数均有明显改善P<0.01,表1)。

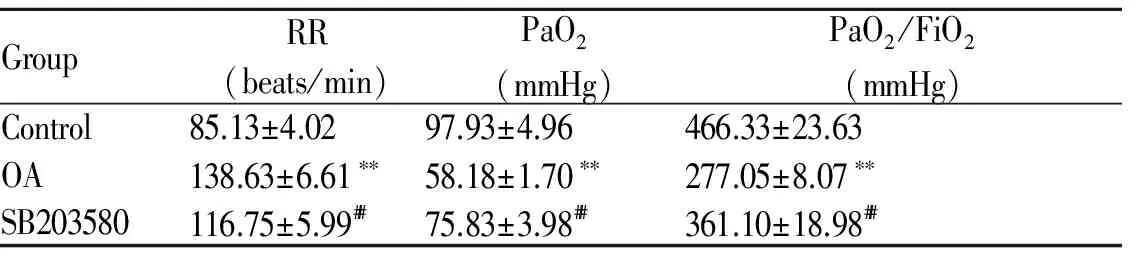
GroupRR(beats/min)PaO2(mmHg)PaO2/FiO2(mmHg)Control85.13±4.0297.93±4.96466.33±23.63OA138.63±6.61∗∗58.18±1.70∗∗277.05±8.07∗∗SB203580116.75±5.99##75.83±3.98##361.10±18.98##
Control: Control group; OA: Oleic acid model group; SB203580: SB203580 pretreatment group; RR: Respiratory rate; PaO2: Arterial partial pressure of oxygen
**P<0.01vscontrol group;##P<0.01vsOA group
2.2 右下肺湿干重比、肺系数的比较
与对照组相比,油酸组右下肺湿干重比、肺系数均明显增加(P<0.01);与油酸组相比,SB203580组右下肺湿干重比、肺系数均明显降低(P<0.01,表2)。


GroupW/D LI(%) Control4.51±0.140.56±0.07OA6.06±0.33∗∗1.08±0.10∗∗SB2035805.30±0.17##0.87±0.07##
Control: Control group; OA: Oleic acid model group; SB203580: SB203580 pretreatment group; W/D: Wet/dry weight ratio; LI: Lung index
**P<0.01vscontrol group;##P<0.01vsOA group
2.3肺通透指数、BALF中炎症因子TNF-α含量的比较
与对照组相比,油酸组肺通透指数及BALF中炎症因子TNF-α含量均明显增加(P<0.01);与油酸组相比,SB203580组肺通透指数及BALF中炎症因子TNF-α含量均明显降低(P<0.01,表3)。

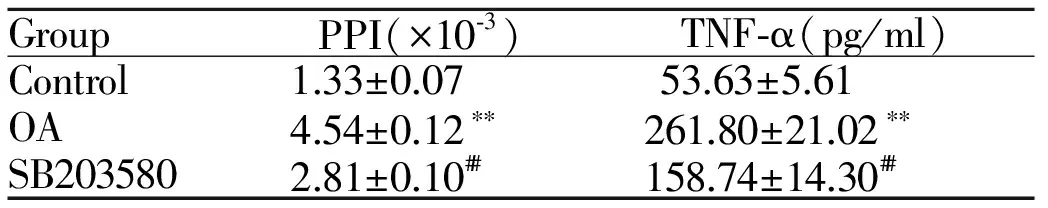
GroupPPI(×10⁃3)TNF⁃α(pg/ml)Control1.33±0.0753.63±5.61OA4.54±0.12∗∗261.80±21.02∗∗SB2035802.81±0.10##158.74±14.30##
Control: Control group; OA: Oleic acid model group; SB203580: SB203580 pretreatment group; PPI: Pulmonary permeability index; TNF-α:Tumour necrosis factor- alpha; BALF: Bronchalveolar lavage fluid
**P<0.01vscontrol group;##P<0.01vsOA group
2.4 肺组织病理学检查
对照组:镜下可见大鼠肺组织的结构完好,肺泡腔内清晰没有渗出物,未见炎细胞浸润。油酸组:镜下可见肺泡腔内渗出非常明显,肺泡隔增厚,炎细胞明显浸润。SB203580组光镜下观察,肺组织损伤程度较油酸组明显减轻(图1, A~C,图1见彩图页Ⅱ)。
2.5 肺组织p-p38MAPK免疫组化测定
胞核和或胞浆内可见棕黄色染色颗粒为p-p38MAPK阳性表达。阴性组(negative group)则无p-p38MAPK蛋白阳性反应细胞表达(图2A,2B,图2见彩图页Ⅱ)。对照组肺组织内p-p38MAPK蛋白阳性细胞较少,分布于气道粘膜上皮和肺泡上皮细胞(图2C,2D);p-p38MAPK蛋白阳性表达在油酸组肺组织明显增多,主要表现为血管内皮、气道上皮、肺泡上皮、浸润炎细胞内棕黄色颗粒明显增多,且染色较深(图2E,2F);SB203580组肺组织p-p38MAPK蛋白阳性细胞较油酸组明显减少(图2G,2H)。
2.6Westernblot测定肺组织p38MAPK蛋白表达
与对照组相比,油酸组p-p38MAPK蛋白表达相对含量明显增加(P<0.01);与油酸组相比,SB203580组p-p38MAPK蛋白表达相对含量明显降低(P<0.01).各组p38MAPK蛋白及GAPDH表达无差异(图3, 表4)。

Fig.3The protein level of p38MAPK and p-p38MAPK in lung tissues of rats were determined by Western blot Control: Control group; OA: Oleic acid model group; SB203580: SB203580 pretreatment group


Groupp⁃p38MAPK/p38MAPKControl0.23±0.02OA0.79±0.02∗∗SB2035800.39±0.01##
Control: Control group; OA: Oleic acid model group; SB203580: SB203580 pretreatment group
**P<0.01vscontrol group;##P<0.01vsOA group
3 讨论
油酸模型是ALI/ARDS的经典模型,在病因上较好地模拟了严重创伤、多发骨折、脂肪栓塞所致的ALI/ARDS[13,14]。本课题结果显示,与对照组相比,大鼠颈静脉注入油酸后出现了呼吸频率明显增快以及光镜下肺组织结构的病理变化,在血气分析方面,油酸组PaO2明显下降,肺湿干重比值则明显升高,上述结果与文献报道[15]相符,说明成功建立油酸诱导急性肺损伤动物模型。
肺泡上皮、肺微血管内皮广泛受损以及由此所致的肺水转运失衡为ALI的病理生理特征。LPI可作为评判ALI患者肺血管内皮细胞功能和肺水肿程度的敏感指标[16]。在本实验中,与对照组相比,油酸模型组肺通透指数、肺湿干重比值、肺系数均明显升高,说明该组出现了肺毛细血管膜的通透性增加和明显的肺水肿的典型ALI病理改变。
炎症因子的过度释放及炎症级联反应为ALI的重要发病机制。TNF-α在炎症的启动中发挥了非常重要的作用[17,18]。本课题结果显示,与对照组相比,在油酸型急性肺损伤BALF中炎症因子TNF-α表达明显增加,表明TNF-α可作为反应肺损伤严重程度的指标。
ALI/ARDS的发病机制错综复杂,虽经过多年的研究,但至今对其可能参与的信号传导机制尚未完全清楚。作为一种蛋白激酶,p38MAPK在炎症、应激等反应中起着十分重要的作用[19]。
既往对肺损伤的研究发现, p38MAPK通常认为具有诱导细胞死亡及炎症的作用。在对MLE-12细胞株氧化性损伤的体外研究[20,21]显示,无论是高氧诱导胀亡还是H2O2导致的凋亡,均存在p38MAPK和JNK1/2通路的活化,当用抑制剂抑制这两条通路时,MLE-12细胞株的存活率明显提高,意味着肺上皮细胞的这两种氧化应激导致的死亡过程与JNK、p38MAPK通路有关。Liu[22]等研究显示SB203580 (p38MAPK抑制剂)抑制炎症因子的产生,通过NF-κB通路减轻脂多糖诱导的动物肺损伤。
尽管p38MAPK被广泛认为与细胞死亡及炎症有关,但亦有证据表明其激活同样可对肺损伤起保护作用。Carvalho等[23]在原代ATII细胞,用H2O2诱导其凋亡,发现JNK、ERK、p38MAPK均被激活,当JNK、ERK、p38MAPK分别被反义寡核苷酸、PD98059、SB202190特异性抑制,研究结果表明活化的JNK具有促H2O2诱导的凋亡作用,而活化的p38和ERK1/2则具有抗凋亡、提高ATII细胞在氧化应激下的存活率的作用。
p38MAPK信号通路在肺损伤时既可起促进肺损伤的发展,也可能起保护作用,这可能与不同的肺损伤因素、不同条件有关,也可能与p38MAPK激活的持续时间不同有关。目前对于p38MAPK信号通路在油酸型急性肺损伤中的作用尚不清楚,亦未见通过p38MAPK抑制剂研究p38MAPK在油酸型急性肺损伤中作用的报道。作为p38MAPK特异性抑制剂,SB203580对炎症因子的表达起有效的抑制作用[24]。在本课题中观察到,与对照组相比,肺损伤组大鼠肺组织磷酸化p38MAPK的分布显著增加,免疫印迹检测显示,急性肺损伤后肺组织磷酸化p38MAPK蛋白表达明显增加,具有统计学意义,说明p38MAPK磷酸化参与油酸诱导的急性肺损伤过程。本实验显示,肺损伤组大鼠肺水肿明显增加,SB203580干预后可以显著减少肺损伤组大鼠肺系数、LPI和肺湿干重比值,显著改善肺损伤大鼠呼吸功能,肺组织病理变化较对照组显著好转,意味着SB203580可以显著减轻油酸型急性肺损伤,改善预后;SB203580显著抑制肺损伤组大鼠磷酸化p38MAPK水平,显著减少油酸型急性肺损伤大鼠肺组织中的TNF-α水平,意味着激活的p38MAPK介入炎性反应,参与油酸性肺损伤的发生过程。本实验中,油酸刺激导致的肺损伤中p38MAPK通路被显著激活,p38MAPK信号通路对炎性反应的调控机制可能与其磷酸化被激活,通过活化AP-1/NF-κB等转录因子,介导下游TNF-α、IL-l等大量炎性因子表达,引起炎症调控失衡有关[25,26]。
总之,p38MAPK 信号通路介导的炎性反应在油酸性肺损伤的发病机制中具有重要作用,p38MAPK抑制剂SB203580显著抑制炎症因子的表达,减轻肺水肿,对油酸性肺损伤具有明显的肺保护作用,意味着对p38MAPK的抑制可望为临床上伴有FES的ALI的防治提供新途径。
[1] Sharp C, Millar AB, Medford AR. Advances in understanding of the pathogenesis of acute respiratory distress syndrome[J].Respiration, 2015, 89(5): 420-434.
[2] Butt Y, Kurdowska A, Allen TC. Acute lung injury: a clinical and molecular review[J].ArchPatholLabMed, 2016, 140(4): 345-350.
[3] Villar J, Sulemanji D, Kacmarek RM. The acute respiratory distress syndrome: incidence and mortality, has it changed?[J].CurrOpinCritCare, 2014, 20(1): 3-9.
[4] Kao SJ, Yeh DY, Chen HI. Clinical and pathological features of fat embolism with acute respiratory distress syndrome[J].ClinSci(Lond), 2007, 113(6): 279-285.
[5] Bursten SL, Federighi DA, Parsons P,etal. An increase in serum C18 unsaturated free fatty acids as a predictor of the development of acute respiratory distress syndrome[J].CritCareMed, 1996, 24(7): 1129-1136.
[6] Vadász I, Morty RE, Kohstall MG,etal. Oleic acid inhibits alveolar fluid reabsorption: a role in acute respiratory distress syndrome [J]?AmJRespirCritCareMed, 2005, 171(5): 469-479.
[7] Ito K, Mizutani A, Kira S,etal. Effect of Ulinastatin, a human urinary trypsin inhibitor, on the oleic acid-induced acute lung injury in rats via the inhibition of activated leukocytes[J].Injury, 2005, 36(3): 387-394.
[8] Porzionato A, Sfriso MM, Mazzatenta A,etal. Effects of hyperoxic exposure on signal transduction pathways in the lung[J].RespirPhysiolNeurobiol, 2015, 209: 106-114.
[9] Yu X, Yu S, Chen L,etal. Tetrahydroberberrubine attenuates lipopolysaccharide-induced acute lung injury by down-regulating MAPK,AKT, and NF-κB signaling pathways[J].BiomedPharmacother, 2016, 82: 489-497.
[10]Zhao H, Zhao M, Wang Y,etal. Glycyrrhizic acid prevents sepsis-induced acute lung injury and mortality in rats[J].JHistochemCytochem, 2016, 64(2): 125-137.
[11]Wei CY, Sun HL, Yang ML,etal. Protective effect of wogonin on endotoxin- induced acute lung injuryviareduction of p38 MAPK and JNK phosphorylation[J].EnvironToxicol, 2017, 32(2): 397-403.
[12]陈海娥, 马迎春, 何金波, 等. 缺血后处理对肺缺血/再灌注损伤的保护作用及其机制[J]. 中国应用生理学杂志, 2014, 30(3): 251-256.
[13]Akella A, Sharma P, Pandey R,etal. Characterization of oleic acid-induced acute respiratory distress syndrome model in rat[J].IndianJExpBiol, 2014, 52(7): 712-719.
[14]Goncalves-de-Albuquerque CF, Silva AR, Burth P,etal. Acute respiratory distress syndrome: role of oleic acid-triggered lung injury and inflammation[J].MediatorsInflamm, 2015, 2015: 260465.
[15]Wang C, Huang Q, Wang C,etal. Hydroxysafflor yellow A suppresses oleic acid-induced acute lung injuryviaprotein kinase A[J].ToxicolApplPharmacol, 2013, 272(3): 895-904.
[16]Jiang W, Li M, He F,etal. Protective effects of asiatic acid against spinal cord injury-induced acute lung injury in rats[J].Inflammation, 2016, 39(6): 1853-1861.
[17]Lai TS, Wang ZH, Cai SX. Mesenchymal stem cell attenuates neutrophil-predominant inflammation and acute lung injury in aninvivorat model of ventilator-induced lung injury[J].ChinMedJ(Engl), 2015, 128(3): 361-367.
[18]王芳芳, 方以群, 攸 璞, 等. 不同压力氧气对大鼠潜水减压病的预防作用[J]. 中国应用生理学杂志, 2015, 31(5): 401-404.
[19]郑妩媚, 初海平, 王 燕, 等. 力竭运动后不同时相大鼠心肌p-p38MAPK、NF-kB、COX-2表达的动态变化[J]. 中国应用生理学杂志, 2016, 32(1): 88-91.
[20]Li Y, Arita Y, Koo HC,etal. Inhibition of c-Jun N-terminal kinase pathway improves cell viability in response to oxidant injury[J].AmJRespirCellMolBiol, 2003, 29(6): 779-783.
[21]Romashko J 3rd, Horowitz S, Franek WR,etal. MAPK pathways mediate hyperoxia-induced oncotic cell death in lung epithelial cells[J].FreeRadicBiolMed, 2003, 35(8): 978-993.
[22]Liu S, Feng G, Wang GL,etal. p38MAPK inhibition attenuates LPS-induced acute lung injury involvement of NF-kappaB pathway[J].EurJPharmacol, 2008, 584(1): 159-165.
[23]Carvalho H, Evelson P, Sigaud S,etal. Mitogen—activated protein kinases modulate H(2)O(2) induced apoptosis in primary rat alveolar epithelial cells [J].JCellBiochem, 2004, 92(3): 502-513.
[24]Wong J, Korcheva V, Jacoby DB,etal. Proinflammatory responses of human airway cells to ricin involve stress-activated protein kinases and NF-kappaB [J].AmJPhysiolLungCellMolPhysio, 2007, 293(6): 1385-1394.
[25]Rahman I, Gilmour PS, Jimenez LA,etal. Oxidative stress and TNF-α induce histone acetylation and NF-κB/AP-1 activation in alveolar epithelial cells: potential mechanism in gene transcription in lung inflammation [J].MolCellBiochem, 2002, 234-235(1-2): 239-248.
[26]Tirumurugaan KG, Jude JA, Kang BN,etal. TNF-α induced CD38 expression in human airway smooth muscle cells: role of MAP kinases and transcription factors NF-kappaB and AP-1[J].AmJPhysiolLungCellMolPhysiol, 2007, 292(6): 1385-1395.
Effectsofp38mitogen-activatedproteinkinaseinratswitholeicacid—inducedacutelunginjury
HUANG Bin1, DENG Wang2, WANG Dao-xin2△
(1. Department of Critical Care Medicine of the Second Affiliated Hospital of Chongqing Medical University, Chongqing 400010; 2. Department of Respiratory Medicine of the Second Affiliated Hospital of Chongqing Medical University, Chongqing 400010, China)
Objective: To study the effects of p38 mitogen-activated protein kinase (p38MAPK) signal transduction pathway inhibitor SB203580 on the inflammatory reaction and lung water clearance, and to explore the role of p38MAPK in acute lung injury, to provide new way for p38MAPK inhibitor -SB203580 intervene fat embolism syndrome induced lung injury.MethodsTwenty-four adult male SD rats were randomly assigned to normal control group (OA group) (n=8), oleic acid—induced lung injury group (OA group,n=8)and SB203580 pretreatment group (n=8) . OA-group was administered oleic acid (0.20 ml/kg)viaright jugular vein; In SB203580—group, SB203580(5 mg/kg) was injectedviajugular vein, followed 30 min before by OA infusion; At the 4 hours animals were sacrificed. Arterial blood gas, the wet/dry weight(W/D)of the right lower lung were examined, lung index(LI), pulmonary permeability index(PPI) and levels of tumor necrosis factor α(TNF-α) in bronchoalveolar lavage fluid(BALF) were examined. The expressions of p38MAPK and phospho—p38MAPK (p-p38MAPK) were determined by Western blot and immunohistochemical method. Pathological changes of the lung tissue were examined with light microscrope.ResultsCompared to control group, arterial oxygen partial pressure (PaO2) and PaO2/FiO2were decreased in the animals of OA- group, while right lower lung wet/dry ratio, lung index, PPI, levels of TNF-α in BALF and the protein expression of p-p38MAPK were increased significantly (P<0.01). The pathological changes were observed significantly in injured lung tissue. Compared to OA-group, those indexes were improved in SB203580 pretreated group.Conclusionp38MAPK signal transaction path mediated inflammatory response process and played an important role in acute lung injury. SB203580 could inhibit the expression of inflammatory cytokines, reduce lung edema, protect lung tissue of rats from OA-induced lung injury obviously. Therefore, inhibition of p38MAPK activity provides a new way for the clinical treatment of fat embolism syndrome induced lung injury.
acute lung injury; p38MAPK; inflammatory reaction; oleic acid
R563.8
A
1000-6834(2017)04-334-06
重庆市卫生局2009年度医学科研计划项目(2009-2-165);国家自然科学基金资助课题(81270141)
2017-01-11
2017-05-12
△
Tel: 023-63693093; E-mail: wangdaoxincq@yeah.net
10.12047/j.cjap.5552.2017.081
