马铃薯干腐病室内药剂筛选及防病研究
2017-10-13赵冬梅魏巍张岱谷青杨志辉朱杰华
赵冬梅+魏巍+张岱+谷青+杨志辉+朱杰华


摘要:采用生长速率法测定了咯菌腈、苯醚甲环唑、咪鲜胺、戊唑醇、氰烯菌酯和恶霉灵6种杀菌剂对4种马铃薯干腐病菌的室内毒力。结果表明,不同种类镰刀菌对药剂的敏感性存在差异。对4种镰刀菌抑制作用最强的药剂均为咪鲜胺,EC50值范围为0.010~0.057 μg/mL;氰烯菌酯对接骨木镰刀菌菌丝生长无抑制作用;而恶霉灵的抑菌作用普遍较差,EC50值为9.340~64.408 μg/mL;其他4种药剂效果较好。对接菌薯块进行药剂处理可抑制病斑横向扩展及病原菌纵向侵入,但不同杀菌剂防效不同。苯醚甲环唑、咪鲜胺和戊唑醇效果较佳。
关键词:马铃薯干腐病;镰刀菌(Fusarium);室内毒力;防效
中图分类号:S435.32;S482.2 文献标识码:A 文章编号:0439-8114(2017)17-3268-04
DOI:10.14088/j.cnki.issn0439-8114.2017.17.019
Studies on Screening for Fungicides and Disease Prevention of
Potato Dry Rot in Laboratory
ZHAO Dong-mei, WEI Wei, ZHANG Dai, GU Qing, YANG Zhi-hui, ZHU Jie-hua
(College of Plant Protection, Agricultural University of Hebei, Baoding 071000, Hebei, China)
Abstract: The toxicities of six fungicides including fludioxonil, difenoconazole, prochloraz, tebuconazole, cyanoacrylate and hymexazol against four pathogens were tested by the method of growth rate in laboratory. Results showed that, sensitivities to fungicides of different Fusarium species were different. The toxicity of prochloraz was the strongest and the EC50 value was from 0.010 to 0.057 μg/mL. The cyanoacrylate had no inhibitory effect on F. sambucinum. The inhibitory effect of hymexazol was poor generally and its EC50 value was between 9.340 and 64.408 μg/mL. The inhibitory effect of other four fungicides were better relatively. Potato tubers inoculated with F. sambucinum were treated with fungicides, which could inhibit the lesion transverse expansion and longitudinal infection of pathogen,but control efficiency of different fungicide was different. Difenoconazole,prochloraz and tebuconazole were better relatively.
Key words: potato dry rot; Fusarium; toxicity; control efficiency
由多种镰刀菌(Fusarium)引起的马铃薯干腐病是马铃薯贮藏期重要病害之一,其常年發病率为10%~30%,最高可达60%以上[1]。不仅危害马铃薯的种薯品质,还导致马铃薯块茎的商品薯率大幅度下降,严重影响其经济和食用价值。由于干腐病属土传病害,马铃薯连年规模种植、机械化收获和批量贮藏使得该病害发生愈加严重,现已成为马铃薯产业进一步发展的瓶颈问题。
国内外的科研人员也一直在积极寻找更高效、更安全、更环保的新型杀菌剂来防治马铃薯干腐病。2006年,张廷义等[2]用药剂熏蒸薯块的方法测定了6种药剂对马铃薯干腐病防治效果,研究表明58%的甲霜灵锰锌可湿性粉剂400倍液效果最好,防效为58.89%,缓解了马铃薯块茎上的病斑扩展;陈彦云[3]对宁夏西吉县贮藏期病害进行药剂防治研究,认为70%代森锰锌是防治贮藏期干腐病较适宜的药剂;2010年,雷玉明等[4]也针对马铃薯干腐病开展了室内药剂筛选工作,发现戊唑福美双、噁霉福美双对硫色镰刀菌抑制效果优于其他药剂,并且在低浓度下的抑菌作用比代森锰锌高浓度下的抑菌作用明显;2011年,任向宇[5]比较系统地研究了3种单剂噻菌灵、戊唑醇和咯菌腈对3个品种马铃薯接种接骨木镰刀菌后在贮藏期和田间生长期的防治效果,其中戊唑醇在马铃薯贮藏的过程中效果最好,但延缓了马铃薯出苗时间并对株高有抑制作用。李梅等[6]也比较了二氧化氯、仲丁胺和过氧乙酸3种药剂防治马铃薯干腐病的效果,以仲丁胺为最好。此外,一些非农药类化学物质,如水杨酸、草酸[7],柠檬酸[8],壳聚糖、硅酸钠[9],K2HPO4[10],苯甲酸钠[11]和硫酸钠[12]等对马铃薯干腐病也取得了较好的防效。
目前国内还没有防治干腐病的特效药剂。而在国外,噻菌灵曾被注册防治马铃薯干腐病,可随着药剂使用时间的延长,许多镰刀菌对噻菌灵都产生了抗性,导致该药剂在国外许多地区难以应用[13,14]。本研究选取作用机制不完全相同的6种杀菌剂,以期筛选到防治干腐病的最佳药剂。同时,模拟田间马铃薯收获过程设计试验,以探讨不同施药方法马铃薯干腐病的防治效果。endprint
1 材料与方法
1.1 材料
1.1.1 供试药剂 选取6种杀菌剂测定其对病原菌的室内毒力。药剂信息见表1。
1.1.2 供试菌株 选取从河北和内蒙古鉴定得到的4种镰刀菌,即接骨木镰刀菌、锐顶镰刀菌、尖孢镰刀菌和芬芳镰刀菌作为室内毒力测定的供试菌株。其中,接骨木镰刀菌为河北和内蒙古马铃薯干腐病菌的优势种群。
1.1.3 供试薯块 用于接种的健康薯块为外观整齐,大小一致,无任何损伤的荷兰十五薯块。
1.2 方法
1.2.1 杀菌剂室内毒力测定 采用生长速率法[15]测定杀菌剂对镰刀菌菌丝生长的抑制。鉴定的4种干腐病菌,每个种类随机选取1株。根据预试验,针对不同菌株对杀菌剂敏感性存在的差异,设置每种药剂的浓度梯度进行药剂的抑菌试验。采用系列稀释法,将6种杀菌剂的母液配置成试验浓度,分别取1 mL加入到99 mL培养基中迅速摇匀制成含药培养基,以加入灭菌水的培养基作为对照。将在25 ℃培养箱中黑暗培养7~10 d的菌株取出,用直径为5 mm的打孔器沿菌落边缘打取菌盘,待培养基凝固后,将菌盘接种到含药PSA(马铃薯200 g,蔗糖20 g,琼脂15~17 g,蒸馏水1 L)培养基的中央,每个菌株的每个处理重复3次。将接种后的平板置于25 ℃恒温培养箱中黑暗培养6~10 d,待对照菌落直径至少长至60 mm时,采用十字交叉法测量菌落直径,取其平均数作为菌落的大小。
根据以下公式计算6种杀菌剂对菌丝生长的抑制百分率(%),其中菌落增长直径等于菌落测量直径减去菌盘直径。
利用DPS V7.05版软件进行数据分析,求出6种药剂的抑制中浓度EC50值、回归方程以及相关系数(R)的值。
1.2.2 药剂处理对干腐病的防治
1)薯块选择:选择外观整齐,大小一致,无任何损伤的马铃薯块茎,用清水洗净晾干,然后用75%乙醇擦拭进行表面消毒。
2)孢子悬浮液的制备:将培养7 d的接骨木镰刀菌制成孢子悬浮液,用血球计数板将孢子悬浮液的浓度调至106个/mL。
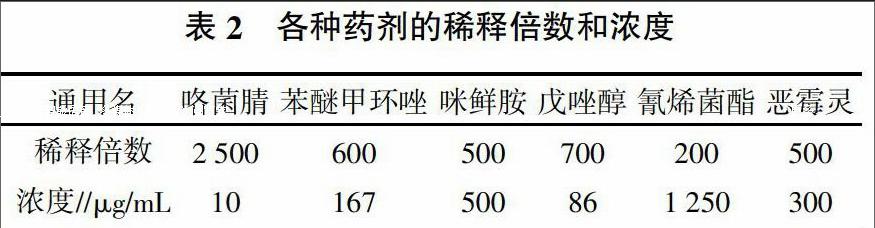
3)接种及药剂处理:将薯块分成Ⅰ、Ⅱ、Ⅲ3组,每组10个块茎,用灭菌铁钉在每块茎表面刺直径3 mm,深3 mm的伤口3个。Ⅰ组和Ⅲ组每个伤口立即接入接骨木镰刀菌孢子悬浮液20 μL,Ⅱ组立即喷施杀菌剂(按照药剂在生产中推荐的浓度进行稀释,见表2),每个薯块表面湿润即可;1 h后Ⅰ组喷施杀菌剂,Ⅱ组每个伤口接入接骨木镰刀菌孢子悬浮液20 μL,Ⅲ组不作任何处理,作为对照。
4)数据统计与分析:将3组薯块置于25 ℃培养箱中,20 d后用十字交叉法测量病斑扩展直径。同时,切开薯块,测量病菌侵染深度。病斑扩展直径应为病斑实际测量直径减去打孔的直径(3 mm),病菌侵染深度为实测深度减去打孔深度(3 mm);采用DPS数据分析软件进行数据处理,确定各组处理间病斑直径及病原菌侵染深度是否存在显著差异。
2 结果与分析
2.1 6种杀菌剂对马铃薯干腐病菌的室内毒力测定
采用生长速率法测定了咯菌腈、苯醚甲环唑、咪鲜胺、戊唑醇、氰烯菌酯和恶霉灵6种杀菌剂对接骨木镰刀菌、锐顶镰刀菌、尖孢镰刀菌和芬芳镰刀菌4种马铃薯干腐病菌的毒力。结果表明,不同种类的干腐病菌对同种杀菌剂的敏感性不同。对于接骨木镰刀菌,抑制作用最强的是咪鲜胺,EC50值为0.057 μg/mL,咯菌腈、戊唑醇、苯醚甲环唑和恶霉灵的抑制作用渐弱,而氰烯菌酯对接骨木镰刀菌没有抑制作用。对于锐顶镰刀菌,咪鲜胺的EC50值最小,为0.032 μg/mL,其他药剂的EC50值由低到高的顺序为氰烯菌酯、咯菌腈、苯醚甲环唑、戊唑醇和恶霉灵。对尖孢镰刀菌抑制作用最强的药剂仍为咪鲜胺,EC50值为0.026 μg/mL,咯菌腈、苯醚甲环唑、戊唑醇、氰烯菌酯和恶霉灵的抑制作用依次渐弱。对芬芳镰刀菌抑制作用强弱顺序为咪鲜胺、咯菌腈、苯醚甲环唑、戊唑醇、氰烯菌酯和恶霉灵,抑制作用最强的咪鲜胺的EC50值为0.010 μg/mL(表3)。
由上述结果可知,咪鲜胺对4种镰刀菌抑制作用均最强,而恶霉灵对以上病原菌的抑制作用均较差,其他4种药剂对马铃薯干腐病菌的抑制作用较明显。同种药剂对4种镰刀菌的毒力差异较大,以氰烯菌酯最为明显。它对接骨木镰刀菌无抑制作用,EC50值大于1 000 μg/mL;但对锐顶镰刀抑制作用较强,EC50值为0.129 μg/mL,对尖孢镰刀菌和芬芳镰刀菌的均有抑制作用,EC50值分别为3.813和3.917 μg/mL,该药剂对不同镰刀菌最大EC50值较最小EC50值相差7 000倍以上(表3)。
2.2 室内药剂处理对干腐病的防治
使用药剂喷施马铃薯薯块表面,无论是接菌后立即喷施药剂还是先喷施药剂后再接种病原菌,均能很好地控制病斑的扩展和病原菌的侵入,且苯醚甲环唑、咪鲜胺和戊唑醇在两种处理方法间无明显差异(图2)。但个别药剂两组处理方法间存在差异,如对于病斑扩展,咯菌腈和氰烯菌酯先接菌处理的效果要好于先施药处理的效果,且咯菌腈先施药处理的效果与对照组无差异。而对于侵染深度,恶霉灵先接菌的处理效果也较好。咯菌腈和氰烯菌酯不能抑制病原菌在薯块内部的侵染。病斑测量数据见表4。
3 讨论
本试验中,咯菌腈、苯醚甲环唑和戊唑醇对锐顶镰刀菌的抑制作用与对其他3种镰刀菌的抑制作用相比较差,EC50值均高于其他3种镰刀菌。而氰烯菌酯对锐顶镰刀菌的抑制作用强,同时对其他3种镰刀菌的抑制作用差,尤其是对接骨木镰刀菌几乎不起作用,氰烯菌酯理论上对4种干腐病菌的毒力差异大于7 000倍。不同种类的镰刀菌对同种杀菌剂的敏感性不同的现象很多。如本试验中咪鲜胺对4种镰刀菌的毒力差异最小,但最大EC50值较最小EC50值仍相差5.7倍。Hide等[16]测定的4种马铃薯干腐病菌中,茄病鐮刀菌蓝色变种和燕麦镰刀菌对噻菌灵敏感,而黄色镰刀菌和大部分硫色镰刀菌则表现为抗性;引起长叶松枯萎的4种镰刀菌中,只有茄病镰刀菌对噻菌灵产生了抗性[17];经过克菌丹处理的玉米种子接种不同镰刀菌后出苗率明显不同,其中,接种尖孢镰刀菌和禾谷镰刀菌的差异最大,分别为98.2%和50.6%[18];同为尖孢镰刀菌,西瓜专化型和黄瓜专化型对苯醚甲环唑的敏感性差异很大[19]。本试验中使用的氰烯菌酯是中国自主研发并完成农药登记的一种新型杀菌剂,其作用机制独特,对禾谷镰刀菌引起的小麦赤霉病[20,21]和串珠镰刀菌引起的水稻恶苗病具有很好的防治效果[22]。而本试验的结果说明该药剂对镰刀菌有很强的专化性,同时也可推测在氰烯菌酯作用位点上,接骨木镰刀菌和锐顶镰刀菌遗传差异很大。由于各地区引起马铃薯干腐病的镰刀菌种类不一,因此防治马铃薯干腐病时必须针对菌株种类选择有效药剂。锐顶镰刀菌是河北马铃薯干腐病的主要病原菌,由于氰烯菌酯的作用机制独特,与苯并咪唑类、麦角甾醇生物合成抑制剂类药剂无交互抗性[23],因此可以考虑氰烯菌酯与其他药剂混用,从而进行高效防治。endprint
咪鮮胺对4种病原菌的抑制作用均为最强,且可以有效抑制接种接骨木镰刀菌后的薯块发病。咪鲜胺对小麦赤霉病和水稻立枯病等其他病害也有很好的防治效果,对不同病原菌的EC50值的范围为0.062~2.19 μg/mL[24,25]。张廷义等[2]筛选出58%甲霜灵锰锌对干腐病的防治效果最好,但该药剂连续使用后易使病菌产生抗性,且与其他杀菌剂混用时又有限制。而咪鲜胺可以与大多数杀菌剂、杀虫剂、除草剂混用,因此,咪鲜胺可作为防治马铃薯干腐病的理想药剂。
由于不同种类镰刀菌对药剂的敏感性不同,因此在防治马铃薯干腐病时可以考虑使用不同的用药策略。既可以使用对不同种类镰刀菌抑制作用均较强的单剂进行防治,也可以根据镰刀菌对药剂的敏感性差异,研制复配药剂进行防治。
在室内干腐病防治试验中,大多数药剂均可抑制病斑的横向扩展和病原菌纵向侵入,表明田间收获马铃薯的同时喷施杀菌剂可有效防治马铃薯干腐病的发生。但室内毒力测定中,对接骨木镰刀菌无抑制作用的氰烯菌酯在马铃薯活体试验中却对病斑横向扩展有一定的抑制作用(对内部侵染无抑制作用)。产生这种现象的原因可能是寄主在与药剂接触之后,自身的防御系统被激活,从而对病原菌表现出了一定程度的抗病性,具有类似作用机制的药剂还有乙磷铝[26]。但该现象的具体原因还有待于深入研究。
咯菌腈对接骨木镰刀菌菌丝生长的抑制作用较好,但薯块药剂处理试验中不能有效抑制病原菌的侵入。最可能的原因是咯菌腈是一种非内吸性杀菌剂,其内吸进植物组织中的作用非常有限,故不能抑制病原菌在薯块内部的侵染。
本试验中先施药后接菌与先接菌后施药两个处理间无显著差异,可能的原因是施药与接菌的时间间隔(1 h)太短。由于本试验的主要目的是评价收获马铃薯时立即喷施杀菌剂防治干腐病的有效性,因此设置的时间间隔较短。为了准确比较药剂的保护与治疗作用效果的差异,可增加施药与接菌的时间间隔做进一步试验。
参考文献:
[1] 于俊琴.马铃薯种薯贮藏期间干腐病的发生及防治措施[J].天津农林科技,2002(4):9.
[2] 张廷义,魏周全.马铃薯贮藏期块茎干腐病药剂防治试验[J].中国马铃薯,2006,20(6):348-349.
[3] 陈彦云.宁夏西吉县马铃薯贮藏期病害调查及药剂防治研究[J].耕作与栽培,2007(3):15-16.
[4] 雷玉明,张建朝,邢会琴,等.防治马铃薯干腐病药剂室内筛选研究[J].长江大学学报(自然科学版,农学卷),2010,7(4):1-4.
[5] 任向宇.马铃薯干腐病田间及贮藏期化学防治效果和致病菌抗药性测定研究[D].呼和浩特:内蒙古大学,2011.
[6] 李 梅,田世龙,程建新,等.三种防腐剂对马铃薯薯块干腐病菌的毒力及抑制作用[J].植物保护,2013,39(6):188-192.
[7] BI Y,LI Y C,GE Y H. Induced resistance in postharvest fruits and vegetables by chemicals and its mechanism[J].Stewart Postharvest Review,2007,3(6):1-7.
[8] 张庆春,李永才,毕 阳,等.柠檬酸处理对马铃薯干腐病的抑制作用及防御酶活性的影响[J].甘肃农业大学学报,2009,44(3): 146-150.
[9] 李永才.壳聚糖和硅酸钠对马铃薯块茎干腐病的控制及其机理研究[D].兰州:兰州大学,2007.
[10] 汉瑞峰,李永才,毕 阳,等.K2HPO4采后处理对马铃薯干腐病的抑制[J].甘肃农业大学学报,2009,44(4):137-140.
[11] MECTEAU M R,ARUL J,TWEDDELL R J. Effect of organic and inorganic salts on the growth and development of Fusarium sambucinum,a causal agent of potato dry rot[J].Mycological Research,2002,106(6):688-696.
[12] KOLAEI E A,TWEDDELL R J,AVIS T J. Antifungal activity of sulfur-containing salts against the development of carrot cavity spot and potato dry rot[J].Postharvest Biology and Technology,2012,63(1):55-59.
[13] CARNEGIE S F,CAMERON A M. Resistance to thiabendazole in isolates of Polyscytalum pustulans (skin spot) and Fusarium solani var. coeruleum(dry rot) in Scotland[J].Plant Pathology,1992,41(5):606-610.
[14] CLEAR R M,KAWCHUK L M,HOLLEY J D,et al. Resistance to thiabendazole and thiophanate-methyl in Canadian isolates of Fusarium sambucinum and Helminthosporium solani[J].American Potato Journal,1994,71(3):185-192.endprint
[15] 吴文君.植物化学保护实验技术导论[M].西安:陕西科学技术出版社,1988.
[16] HIDE G A,READ P J,HALL S M. Resistance to thiabendazole in Fusarium species isolated from potato tubers affected by dry rot[J].Plant Pathology,2007,41(6):745-748.
[17] ALLEN T W,ENEBAK S A,CAREY W A. Evaluation of fungicides for control of species of Fusarium on longleaf pine seed[J].Crop Protection,2004,23(10):979-982.
[18] MUNKVOLD G P,O'MARA J K. Laboratory and growth chamber evaluation of fungicidal seed treatments for maize seedling blight caused by Fusarium species[J].Plant Disease,2002,86(2):143-150.
[19] 赵 杰,唐赵莲,周超英,等.5种杀菌剂对西瓜和黄瓜枯萎病菌的毒力测定[J].中国园艺文摘,2012(8):39-40.
[20] 陈 雨,张文芝,周明国.氰烯菌酯对禾谷镰孢菌分生孢子萌发及菌丝生长的影响[J].农药学学报,2007,9(3):235-239.
[21] 尤爱琴,张昌杰,胡宇峰,等.5种杀菌剂对小麦赤霉病的防治效果初探[J].浙江农业科学,2012(4):532-535.
[22] 陈亿兵,金焕贵,张永胜,等.25%氰烯菌酯悬浮剂防治水稻恶苗病田间药效评价[J].黑龙江农业科学,2011(1):66-67.
[23] 李恒奎,陈长军,王建新,等.禾谷镰孢菌对氰烯菌酯的敏感性基线及室内抗药性风险初步评估[J].植物病理学报,2006, 36(3):273-278.
[24] 秦 莉,李海燕,劉惕若,等.咪鲜胺和恶霉灵对水稻立枯病菌的室内毒力测定[J].黑龙江八一农垦大学学报,2007,19(1):18-21.
[25] 张长青,翟平平,洪少林,等.7种杀菌剂对小麦赤霉菌的抑制作用[J].中国植保导刊,2012,32(11):50-52.
[26] 徐汉虹.植物化学保护学[M].北京:中国农业出版社,2007.endprint
