大黄素对辣椒素诱导的TRPV1通道电流的抑制作用
2017-10-13WolfgangSchwarz
胡 益,张 迪,Wolfgang Schwarz
(1. 复旦大学 航空航天系,上海 200433;2. 上海市针灸机制与穴位功能重点实验室,上海 200433;3. 上海市针灸经络研究中心,上海 201203;4. 法兰克福大学 生物物理学系,法兰克福 60438)
大黄素对辣椒素诱导的TRPV1通道电流的抑制作用
胡 益1,2,3,张 迪1,2,3,Wolfgang Schwarz2,3,4
(1. 复旦大学 航空航天系,上海 200433;2. 上海市针灸机制与穴位功能重点实验室,上海 200433;3. 上海市针灸经络研究中心,上海 201203;4. 法兰克福大学 生物物理学系,法兰克福 60438)
本研究通过显微注射技术将TRPV1 cRNA(1ng/nL)注射至非洲爪蟾卵母细胞(20nL/个)体内,放置于G-ORi培养液中,并在(19±1)℃的恒温培养箱内表达.同时利用灌流技术将不同浓度梯度的大黄素、辣椒素按照设计顺序依次灌流进入流动腔,同时控制流速保证非洲爪蟾卵母细胞完全浸没于流动腔内.使用双电极电压钳技术记录0.1,1.0,10.0,50.0μmol/L浓度梯度的大黄素对500nmol/L浓度的辣椒素激活TRPV1电流的影响.得到大黄素作用辣椒素激活TRPV1通道的抑制作用表现出浓度依耐性和电压非依赖性,IC50=38μmol/L,Hill系数n=0.5.结果表明了大黄素对TRPV1位点的相互作用是负协同的,在天然药物里面是一类比较弱的拮抗剂,且大黄素在ORi溶液中开始析出沉淀的浓度在50~60μmol/L之间.我们首次发现了大黄素能够抑制TRPV1通道电流,这可能为开发新的镇痛药物提供理论基础.
TRPV1通道电流; 辣椒素; 大黄素; 镇痛机制; 双电极电压钳
TRPV1(Transient Receptor Potential Vanilloid subtype 1)通道蛋白被大量地发现分布在外周神经系统的三叉神经节、背根神经节(Dorsal Root Ganglion,DRG)、节状神经节中,这3类神经节在人体疼痛传递中起着重要的作用[1].与此同时,TRPV1通道蛋白也被证实存在于人类和大鼠中枢神经系统的脑神经元中并参与疼痛的传递[2-3].基因敲除也证明了TRPV1通道蛋白在炎症发生后的热痛觉过敏起着核心的作用[4].大量的文献均表明了TRPV1通道蛋白是参与中枢及外周神经系统疼痛信号传递的分子整合体[5],因此TRPV1通道成为了镇痛药物治疗的重要靶标.
国产中药大黄(Rhubarb)是历年来《中国药典》收载的常用镇痛中药[6],它的镇痛抗炎作用近年来被多次报导[7-9].大黄素(emodin)是大黄的主要有效成分[10],有实验报导应用细胞电生理记录到它能够下调DRG细胞上TRPV1通道蛋白的表达[11],然而并没有揭晓出其镇痛的机制.
本研究通过探讨大黄素对辣椒素激活TRPV1通道电流的影响,探讨其生理学和药理学特征,并揭晓作用机制,解释大黄这种镇痛中药能够镇痛的主要机理.
1 材料和方法
1.1材料
1.1.1 药品和试剂
3-(N-吗啉)丙磺酸(MOPS)、三羟甲基氨基甲烷(TRIS)、二甲基亚砜(DMSO)、间氨基苯甲酸乙酯甲磺酸盐(MS-222)、硫酸庆大霉素(Gentamicin-sulfate)、辣椒素(分析标准品),上海SIGMA-ALDRICH公司提供;大黄素(分析标准品),国药集团化学试剂有限公司提供;ORi(Oocyte Ringer’s)溶液: NaCl(90mmol/L)、KCl(2mmol/L)、CaCl2(2mmol/L)、MOPS(5mmol/L)均为分析纯,由国药集团化学试剂有限公司提供;实验用水: 蒸馏去离子水(Distilled and Deionized Water, DDW).
1.1.2 动物
非洲爪蟾(Xenopuslaevis),由上海茂生生物科技发展有限公司提供.
1.1.3 基因组
TRPV1 cRNA(1ng/nL),由上海南方模式生物科技发展有限公司及德国马克斯普朗克生物物理实验室提供.
1.1.4 仪器
电压钳放大器(TURBO TEC-03X),NPI electronics;示波器(TPS 1002),Tektronix;描笔记录仪(SERVOGOR 102),Kipp&Zonen;显微注射控制器(Micro4),World Precision Instruments;涡旋振荡器(QL-901),Vortex;显微拉制仪(PC-10, MF 830),Narishige Group;显微镜(SMZ 1000),Nikon Corporation;显微镜照明装置(C-F/230),Nikon Corporation;电极玻璃管(GB150TF-8P),Science Products GmbH;分析天平(AB104-S),Mettler Toledo.
1.2方法
1.2.1 非洲爪蟾卵母细胞的获取
取爪蟾一只,首先将其置于MS-222溶液(1g/L的Triacin用蒸馏水稀释获得)中麻醉15min.随后腹部向上放置于装满碎冰块的手术盘上,在其下腹用无菌手术刀剪开0.5~1cm的开口,使用无菌镊子取出足量卵母细胞.将2.5mg的胶原蛋白水解酶(collagenase)溶解到装有10mL的ORi溶液的离心管中,使用无菌镊子将整个卵母细胞团撕成小的分散细胞团.使用移液管将分散细胞团放入溶有胶原蛋白水解酶的离心管中,置于摇床上震荡12h.温度控制在(19±1)℃,转速在65r/min.
1.2.2 TRPV1 cRNA的显微注射与表达
精选出20~30个卵母细胞放置于带有栅栏式固定槽的陪替氏培养皿内,依次排开.待TRPV1 cRNA解冻后,使用显微注射控制器吸入约1μL的cRNA,随后每个细胞注射20nL的cRNA(1ng/nL).注射完成后,将卵母细胞放入含有抗生素G-ORi溶液的六孔培养皿中.未注射TRPV1 cRNA的卵母细胞也应该单独放入一个培养孔内作为对照组,随后置于(19±1)℃的恒温培养箱内表达.
1.2.3 主要溶液的配制
实验中所有的溶液都需配置在蒸馏去离子水中.我们主要测试的辣椒素、大黄素需溶解在DMSO溶液(DMSO已被证实不能够激活TRPV1通道)中,配成10mmol/L的母液.然后各自分装至小容量离心管中,放至-4℃冰箱,同时需要密封、避光保存,待实验需要时再稀释使用.另外鉴于大黄素在配制4h后溶液出现降解的现象[12],我们的大黄素测定实验均需在配制新鲜溶液4h内完成,否则需重新配制新液测试.
1.2.4 辣椒素及大黄素电流的记录
使用双电极电压钳记录: 1) 500nmol/L的辣椒素对注射TRPV1 cRNA(实验组)以及未注射(对照组)细胞膜电流的大小;2) 0.1,1.0,10.0,50.0μmol/L浓度的大黄素对500nmol/L辣椒素激活TRPV1通道电流的影响.同时使用描笔记录仪记录整个实验过程.
1.2.5 大黄素析出浓度的测试
配备新鲜大黄素溶液(1,10,50,60,80和100μmol/L),在4h内取样放置于4mL的离心管中,分别在普通室内光源和暗室单一光源的情况下观测大黄素溶液析出情况.
1.2.6 实验数据的分析
实验数据分析软件采用Origin Pro 9.0,该软件可以提供数据统计以及曲线拟合功能.
2 结果与分析
2.1卵母细胞表达的合适时间
12h培养后,在卵母细胞上未检测到任何激活电流.24h后,检测到了合适的电流,并且卵母细胞的死亡率仅为5%~10%(见图1(A)).36h时,检测到的激活电流偏大,卵母细胞的死亡率为20%~30%(见图1(B)).而当细胞培养到48h后,卵母细胞基本上全部死亡(见图1(C)).因此卵母细胞在19℃条件下表达24h,是本实验中培养细胞的合适时间.

图1 非洲爪蟾卵母细胞表达时间的分析测定Fig.1 Analytical determination of TRPV1 cRNA expression time in Xenopus laevis oocytes20ng TRPV cRNA(1ng/nL)注入卵母细胞内(2015年4月10日),19℃条件下表达(A)24h, (B)36h, (C)48h后卵母细胞的形态.可以观测到: (A)图细胞状态良好,(B)图有部分细胞白化死亡,(C)图大部分卵母细胞的细胞膜已经损坏不能够进行实验
2.2TRPV1cRNA成功表达
通过对比辣椒素通入流动腔后注射20ng TRPV1 cRNA(1ng/nL)的实验组卵母细胞与未注射TRPV1 cRNA的对照组卵母细胞(两组均放置于19℃的培养箱表达24h)I-V曲线(见图2(A)).可以得到注射组的卵母细胞在500nmol/L的辣椒素的刺激下能够产生明显的外向的L型TRPV1通道整流电流,这表明TRPV1 cRNA可能在卵母细胞内成功表达了.且对照组在同样加入辣椒素后没有产生任何激活电流,这表明辣椒素不能够激活卵母细胞自身内在的任何通道.从图中得到反转电位ERev=-15mV,且在-50mV的钳制电压时内向电流最大.
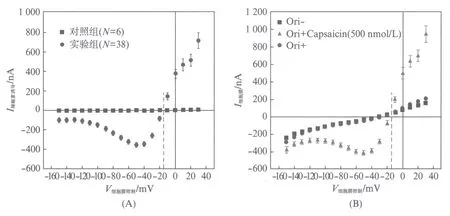
图2 辣椒素诱导TRPV1通道电流的分析测定Fig.2 Analytical determination of capsaicin-induced TRPV1 current(A) 圆点●表示的是实验组加入500nmol/L的辣椒素后的电流变化,正方形■表示的是对照组加入500nmol/L的辣椒素后的电流变化,实验数据取N=38,6次实验的平均值(±SEM);(B) 正方形■表示加入辣椒素之前,三角形▲表示加入辣椒素时,圆点●表示用ORi溶液冲洗辣椒素之后细胞膜电流的大小,数据均取32次实验的平均值(±SEM)
2.3通入辣椒素前后细胞膜上的电流
此处探究的是细胞膜上电流的情况,目的是探究冲洗掉辣椒素后TRPV1通道能否从激活状态返回到静息状态.图2(B)展示了500nmol/L辣椒素对TRPV1通道电流影响的I-V曲线.从图中可以观察到通入辣椒素前与洗掉辣椒素后细胞膜上的电流几乎一致,在ORi溶液的清洗下辣椒素所激活的电流消失.因此TRPV1通道能从激活状态返回到静息状态,整个激活过程是可逆的.
2.4大黄素对TRPV1电流抑制作用的浓度依赖性分析
我们测试0.1,1.0,10.0,50.0μmol/L的大黄素(以上浓度大黄素溶液均可以完全溶解,在实验的进行中没有析出)对500nmol/L的辣椒素激活TRPV1通道电流的影响.将不加入大黄素的500nmol/L的辣椒素在-60mV钳制电压下的激活的电流数值作为参照数值(-1),并进行标准化处理.最后得到了图3所示的I-V曲线.
从图3可以看出大黄素对辣椒素激活的TRPV1通道电流是具有抑制性的,且呈浓度依耐性,但当浓度到达测试最大值50μmol/L的时候,对电流的抑制作用并不是很强.另外当钳制电压为-150mV至-60mV之间时,I-V曲线几乎平行,这表明大黄素对电流抑制也可能不是电压依耐性的.我们没有使用高浓度的大黄素进行测试,是因为当其浓度增加至60μmol/L的时候溶液中便开始析出大黄素的沉淀,无法保证实验的精准.
2.5大黄素对TRPV1电流抑制作用的电压依赖性分析
取-60mV钳制电压下不同浓度大黄素所对应的抑制电流大小的数值,将不加入大黄素的500nmol/L的辣椒素在-60mV钳制电压下的激活的电流大小作为标准化的参照数值(-1),将其他数值标准化(用r辣椒素诱导电流表示),并用Hill方程进行数值拟合,得到了图4所示的-60,-80和-100mV下的大黄素对辣椒素激活TRPV1通道电流的浓度浓度依赖性曲线.
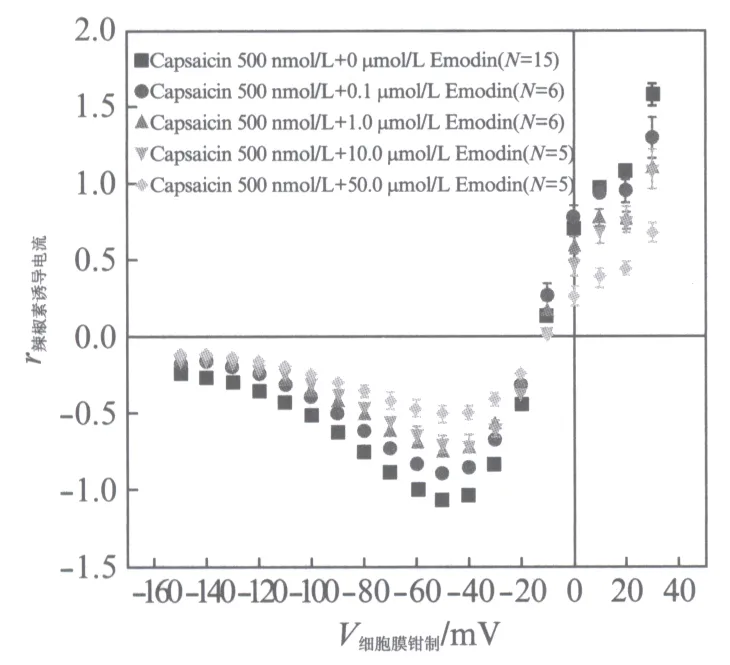
图3 0.1,1.0,10.0,50.0μmol/L的大黄素对500nmol/L的辣椒素激活TRPV1通道电流的I-V曲线Fig.3 Current-voltage dependencies of emodin on capsaicin-induced TRPV1 steady state current正方形■表示只加入500nmol/L辣椒素激活的TRPV1通道电流,圆点●、向上三角形▲、向下三角形、菱形分别表示0.1,1.0,10.0,50.0μmol/L大黄素加上500nmol/L辣椒素激活的TRPV1通道电流.数据分别取N=15,6,6,5,5次实验的平均值(±SEM)
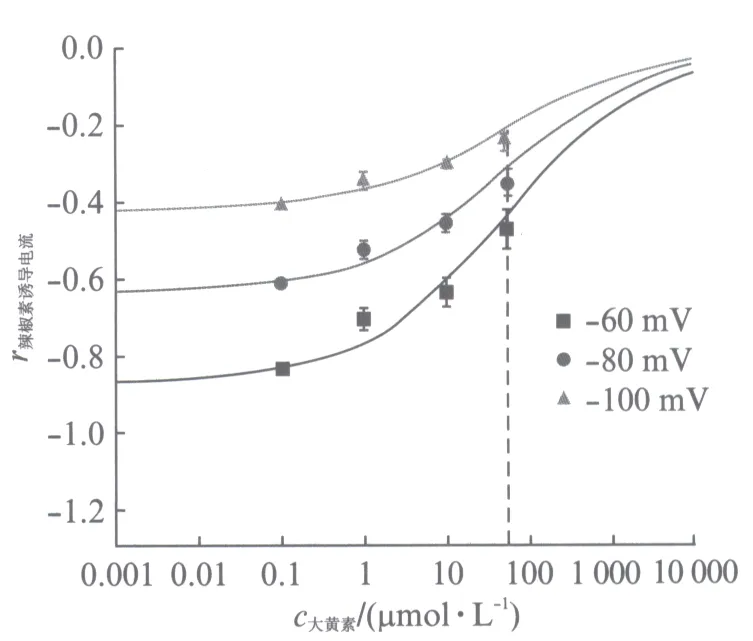
图4 -60,-80,-100mV钳制电压下大黄素对辣椒素激活TRPV1通道电流的浓度依赖曲线Fig.4 Dependence of TRPV1-mediated current on emodin concentration正方形■、圆形●、三角形▲分别表示在-60,-80,-100mV钳制电压时,0.1,1.0,10.0,50.0μmol/L大黄素条件下取6,6,5,5次实验的平均值(±SEM).利用Hill方程拟合数据得出IC50(拮抗剂半抑制浓度)均等于55μmol/L,且Hill系数也均等于0.5
可以得到在-60,-80和-100mV钳制电压下达到50%激活电流大小时对应的大黄素的浓度均为55μmol/L,且Hill系数也均等于0.5,这也证实了大黄素作为拮抗剂在抑制辣椒素激活TRPV1通道电流时,分子结合在TRPV1通道位点上是负协同作用的.另外,在改变电压情况下,IC50(拮抗剂半抑制浓度)均不发生变化,这表明大黄素抑制电流不是电压依耐性的.
2.6大黄素对TRPV1电流抑制作用的可逆性分析
2.6.1 可逆性拮抗描笔曲线
我们可以得出0.1,1.0,10.0,50.0μmol/L的大黄素对500nmol/L的辣椒素激活TRPV1通道电流有浓度依赖的抑制作用.在每次灌流大黄素作用后,再用含500nmol/L辣椒素的G-Ori溶液洗脱细胞,发现细胞电流恢复到大黄素作用之前.这提示大黄素在结合TRPV1位点后,不会一直保持结合的状态,会随着ORi的冲洗而离开位点,是可逆性拮抗.描笔曲线分析如图5(见第370页)所示.
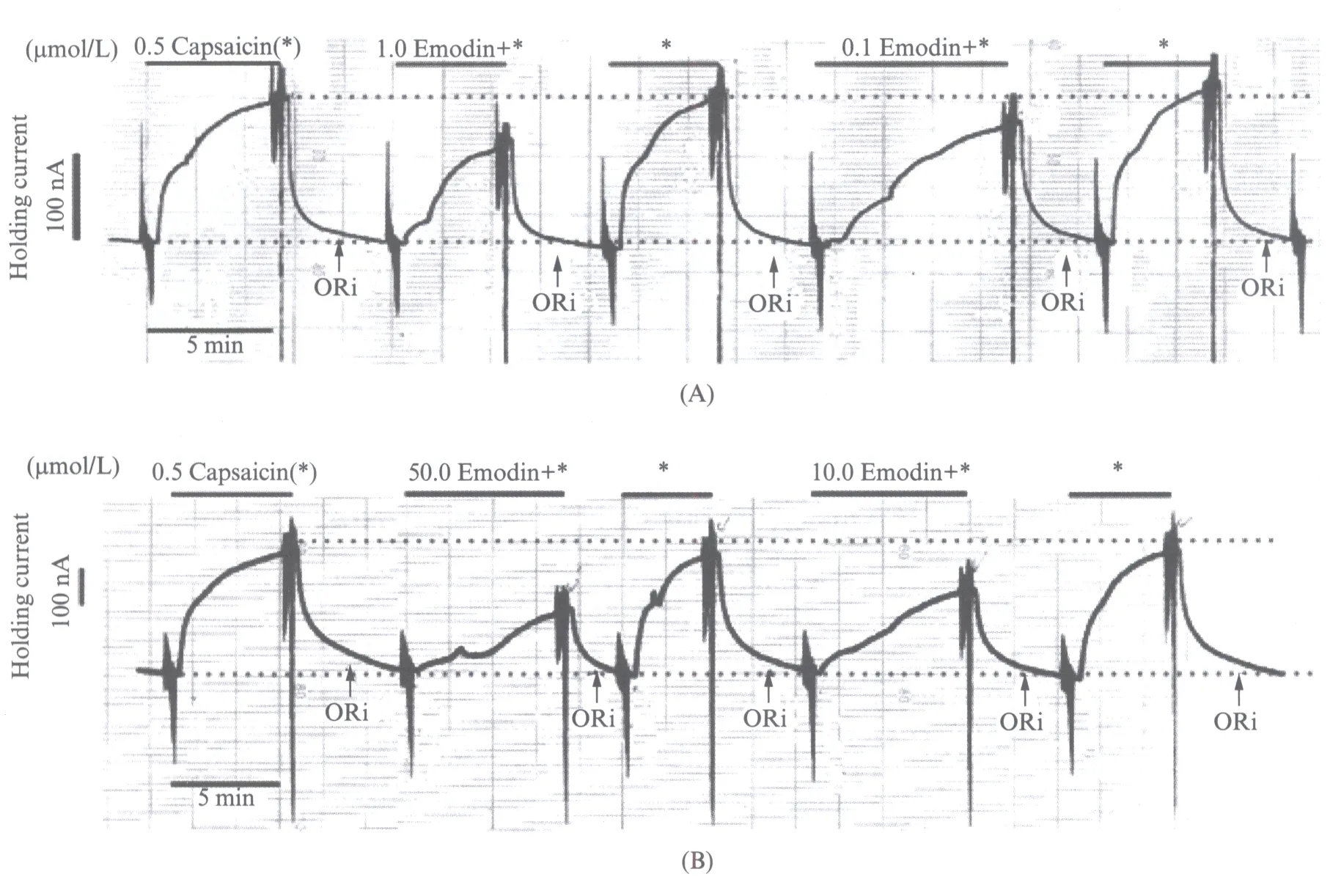
图5 描笔曲线的分析Fig.5 Analysis of pen recording curves(A)同一个卵母细胞实验中0.1,1.0μmol/L的大黄素对500nmol/L的辣椒素激活TRPV1通道电流作用时的描笔曲线(2015年1月21日记录).(B)同一个卵母细胞实验中10.0,50.0μmol/L的大黄素对500nmol/L的辣椒素激活TRPV1通道电流作用时的描笔曲线(2015年1月15日记录).两个细胞状态很好,随着实验的进行曲线未发生偏移,始终保持在中轴线上
2.6.2 可逆性拮抗I-V曲线
测量顺序为: 辣椒素(500nmol/L)第1次→ORi冲洗第1次→辣椒素(500nmol/L)+大黄素(0.1或50.0μmol/L)→ORi冲洗第2次→辣椒素(500nmol/L)第2次,依次测量每一步的细胞膜电流大小,得出图6(A),(B)(见第370页)的结果.
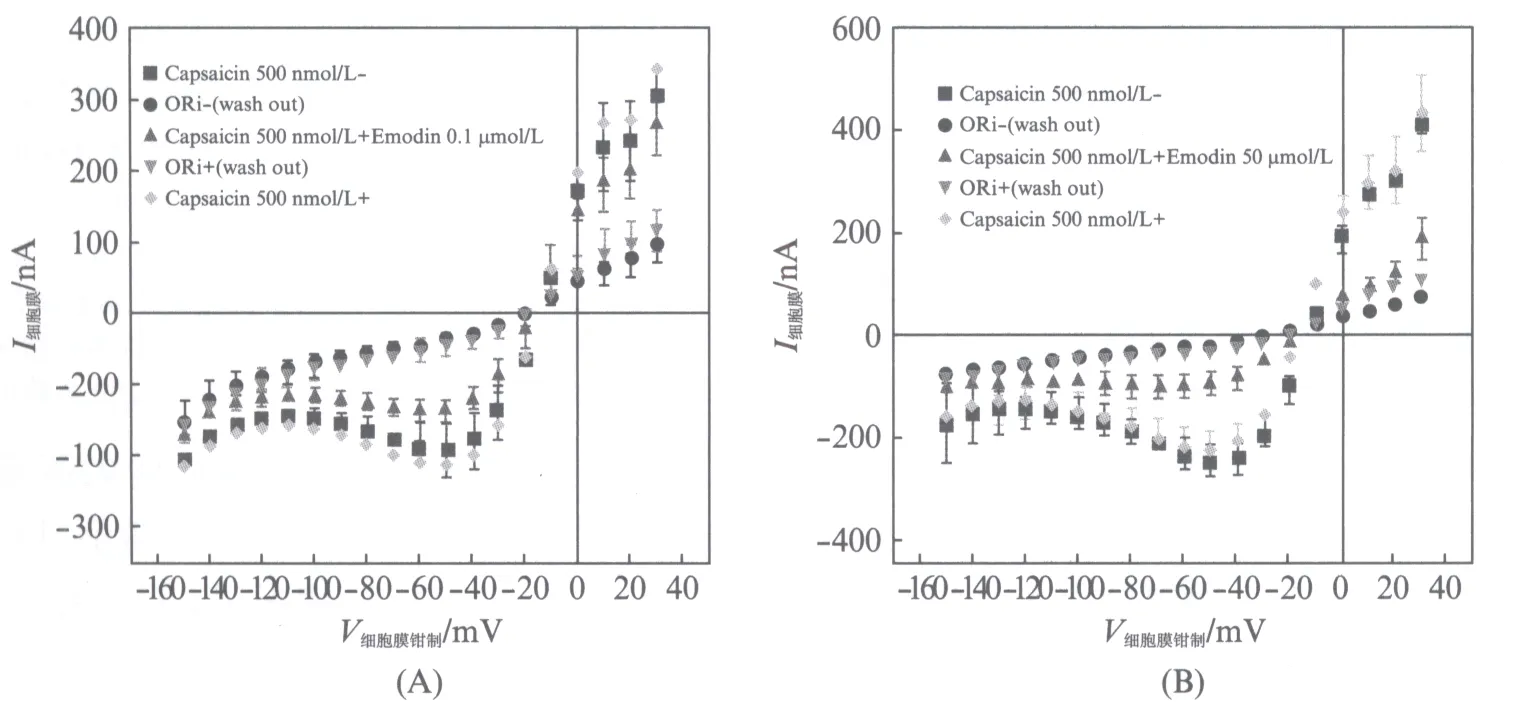
图6 大黄素的可逆性抑制作用Fig.6 Analysis of reversible antagonism of emodin(A),(B)分别表示当大黄素为0.1和50.0μmol/L时,测量顺序下每一步的I-V曲线.图中正方形■表示只加入500nmol/L辣椒素激活的TRPV1通道细胞膜上的电流;圆点●表示ORi溶液冲洗后细胞膜上的电流;向上三角形▲表示500nmol/L辣椒素加上0.1或50.0μmol/L大黄素后激活的TRPV1通道细胞膜上的电流;向下三角形表示第2次ORi溶液冲洗后细胞膜上的电流;菱形表示第2次单独加入500nmol/L辣椒素激活的TRPV1通道细胞膜上的电流.(A)或(B)数据分别都取N=3,5,3,5,3次实验的平均值(±SEM)
2.7大黄素析出沉淀的浓度
我们在实验过程中观察到当大黄素浓度增加至60μmol/L的时候溶液中便开始析出大黄素的沉淀,但在0至50μmol/L时,溶液则始终保持澄清状态(见图7).从图7(A)中可以明显地观测到随着大黄素浓度的增加,溶液颜色逐渐加深,其中1,10,50μmol/L样品未见沉淀析出,而从60μmol/L开始逐渐观测到有黄色絮状沉淀生成,80,100μmol/L样品的絮状沉淀更是布满了整个离心管.图7(B)是在暗室中单一冷光源观测到的大黄素样品的情况,仍然可以得出1,10,50μmol/L样品澄澈未见黄色丝絮状沉淀析出,而60,80,100μmol/L样品的絮状沉淀随着浓度的增大逐渐增多.因此可以得出大黄素沉淀开始析出的浓度在50μmol/L至60μmol/L之间.从这个析出点开始大黄素母液不能够完全地溶解在ORi溶液中,也不能够作为实验分析使用,因而无法继续探讨其作用机制.

图7 大黄素(DMSO母液)在ORi中沉淀析出点的分析Fig.7 Analysis of precipitation point of emodin(DMSO stock solution) in ORi(A)普通室内光源下观测到1,10,50,60,80和100μmol/L的大黄素溶解情况.所有样品溶液均从实验溶液中抽样获得(配备新鲜溶液后4h内取样),放置于4mL的离心管内对比观察.(B)暗室单一冷光源下观测到1,10,50,60,80和100μmol/L的大黄素溶解情况.所有样品溶液均从实验溶液中抽样获得(配备新鲜溶液后4h内取样),放置于4mL的离心管内对比观察
3 讨 论
3.1TRPV1通道蛋白的成功表达
我们可以通过两方面断定TRPV1通道蛋白已经成功地表达在了卵母细胞内.第一,注射TRPV1 cRNA组比对照组(未注射组)受辣椒素激活后产生的电流要高出几个数量级(图2).对照组受辣椒素激活的电流几乎为零,辣椒素不能够激活卵母细胞自身内在的任何通道.这可以说明有外源性通道成功地表达在了卵母细胞内,且能够被辣椒素激活产生电流.第二,我们得出的I-V曲线的特征为外向L型整流(图2(A)),跟其他研究者报导的均一致[13-15].以上都证实TRPV1已经功能性地表达在了卵母细胞内.
3.2大黄素对辣椒素激活TRPV1通道电流的抑制作用
大黄素到达测试的最大浓度50μmol/L时,对辣椒素激活的电流并没有表现出很强的拮抗性(见图3,图4),同时IC50为38μmol/L(见图4),表明大黄素为一种弱拮抗剂.另外大黄素跟育亨宾碱(yohimbine)(IC50=10~100μmol/L[16])的拮抗功能相当.这些都充分证明了大黄素在天然药物里面的拮抗功能是比较弱的.此外,大黄素的抑制性也具有电压非依赖性,对位点的相互作用是负协同的(见图4).且作为TRPV1通道的另外一种拮抗剂同样地表现出了抑制辣椒素激活过程的可逆性,导致TRPV1通道增敏的结果不明显(见图5,图6).最后,当大黄素浓度增加至60μmol/L后,观测到实验溶液出现有黄色絮状沉淀析出,而在50μmol/L时不存在此类情况(见图7),我们推测大黄素在ORi溶液中沉淀开始析出的浓度在50~60μmol/L之间.我们首次发现了大黄素能够抑制TRPV1通道电流,提示其可能为开发新的镇痛药物提供理论基础.
3.3大黄素拮抗机制探讨的展望
为了能够继续探讨大黄素对辣椒素激活TRPV1通道电流的拮抗作用机制,我们需要解决高浓度大黄素(大于50μmol/L)析出的问题.在图7中,我们的样品均在新鲜溶液配制后4h内获得,因此排除了大黄素发生降解的因素[12],这需要讨论大黄素的溶解度因素.由于大黄素极难溶解于水,因此在实验中我们将其首先溶解于DMSO中.据报道,DMSO能够溶解大多数的有机物,这当然包括大黄素,且DMSO属于高极性的有机溶剂,能够与任意比例水混合[17],迄今为止尚未有文献记载大黄素在DMSO中的具体溶解度.据实验观察,大黄素也被证实是完全可溶于DMSO溶液的,但由于大量的DMSO溶剂对卵母细胞有致命性的伤害,不可能被使用在实验中进行灌流.那么高浓度大黄素溶液的析出应该是母液在ORi溶液中稀释后发生的.我们尚不知大黄素在ORi溶液中的溶解度,但大黄素在另外一种类似于ORi的细胞培养液HBSS溶液中的溶解度(25℃)仅为0.014mg/mL[12],可以推断大黄素在ORi中的溶解度与这个数值应该相差不大.另外还有文献报导大黄素在pH值为6.5的磷酸盐缓冲液中溶解度最大[18],但是当细胞外界溶液的pH<6.3(H+)时,可以激活TRPV1通道[13],因此采取降低pH值的方法并不可行.还有学者观测到升温(从0.5℃到49.9℃)可以显著提升大黄素在乙醇或正辛醇中的溶解度[19],然而大于43℃的伤害性热刺激[20]也能够激活TRPV1通道,且乙醇被报导为TRPV1的一种激活剂[21],同时正辛醇不溶于水.在已报导的有机溶剂中,25℃下对大黄素溶解度最高的为甲醇(5.4mg/mL)、丙酮(8.1mg/mL)和二氯甲烷(13.5mg/mL)[12],尚未有文献记载这3种溶剂对卵母细胞的影响,但三者都皆有不同程度的毒性,且二氯甲烷只是微溶于水,因此可以考察的只有甲醇和丙酮.
[1] HELLIWELL R J A, MCLATCHIE L M, CLARKE M,etal. Capsaicin sensitivity is associated with expression of the vanilloid receptor mRNA in adult rat sensory ganglia [J].NeuroscienceLetters, 1998,250(3): 177-180.
[3] ROBERTS J C, DAVIS J B, BENHAM C D. [3H]Resiniferatoxin autoradiography in the CNS of wild type and TRPV1 null mice defines TRPV1(VR-1) protein distribution [J].BrainResearch, 2004,995(2): 176-183.
[4] CATERINA M J, LEFFLER A, MALMBERG A B,etal. Impaired nociception and pain sensation in mice lacking the capsaicin receptor [J].Science, 2000,288(5464): 306-313.
[5] SZALLASI A, CRUZ F, GEPPETTI P. TRPV1: A therapeutic target for novel analgesic drugs? [J].TrendsinMolecularMedicine, 2006,12(11): 545-554.
[6] 傅兴圣,陈菲,刘训红,等.大黄化学成分与药理作用研究新进展 [J].中国新药杂志,2011,20(16): 1534-1538.
[7] 刘管理,李国成,张俊芳.大黄附子汤的镇痛作用和对阳虚便秘动物肠运动的影响 [J].广东药学院学报,2009,25(13): 292-294.
[8] 陈一村,秦永洁,蔡聪艺,等.大黄总蒽醌对小鼠扭体模型的镇痛作用 [J].现代生物医学进展,2010,10(3): 558-559.
[9] 王梅,陈俊荣,宋翠荣,等.酒大黄的镇痛抗炎作用 [J].中国实验方剂学杂志,2013,19(5): 255-257.
[10] 王大增,王祖倩,张志枫.化瘀通腑法治疗子宫内膜异位症临床及实验研究 [J]. 中国中西医结合杂志,1991,11(9): 524-526.
[11] SUI F, HUO H R, ZHANG C B,etal. Emodin down-regulates expression of TRPV1 mRNA and its function in DRG neuronsinvitro[J].AmericanJournalofChineseMedicine, 2010,38(4): 789-800.
[12] 刘薇,叶玲,赵洁,等.高效液相色谱法考察大黄素在HBSS溶液中的溶解度及其稳定性 [J].中国卫生检验杂志,2009,19(8): 1775-1777.
[13] CATERINA M J, SCHUMACHER M A, TOMINAGA M,etal. The capsaicin receptor: A heat-activated ion channel in the pain pathway [J].Nature, 1997,389(6653): 816-824.
[14] RAISINGHANI M, PABBIDI R M, PREMKUMAR L S. Activation of transient receptor potential vanilloid 1(TRPV1) by resiniferatoxin [J].TheJournalofPhysiology, 2005,567(3): 771-786.
[15] GARCIA-MARTINEZ C, MORENILLA-PALAO C, PLANELLS-CASES R,etal. Identification of an aspartic residue in the P-loop of the vanilloid receptor that modulates pore properties [J].JournalofBiologicalChemistry, 2000,275(42): 32552-32558.
[16] DESSAINT J, YU W, KRAUSE J E,etal. Yohimbine inhibits firing activities of rat dorsal root ganglion neurons by blocking Na+channels and vanilloid VR1 receptors [J].EuropeanJournalofPharmacology, 2004,485(1/2/3): 11-20.
[17] HALLENBECK W H, CUNNINGHAM-BURNS K M. Dimethyl sulfoxide [M]. New York: Springer, 1985: 53.
[18] 严建业,王元清,黄丹,等. HPLC-DAD测定虎杖苷、白藜芦醇、大黄素的平衡溶解度及表观油水分配系数 [J].中成药,2015,37(12): 2628-2632.
[19] LÜ Y C, LIN Q, LUO G S,etal. Solubility of emodin in alcohols [J].ChineseJournalofChemicalEngineering, 2009,17(2): 251-253.
[20] BEVAN S, SZOLCSNYI J. Sensory neuron-specifications of capsaicin: Mechanisms and applications [J].TrendsinPharmacologicalSciences,1990,11(8): 331-333.
[21] TREVISANI M, SMART D, GUNTHORPE M J,etal. Ethanol elicits and potentiates nociceptor responses via the vanilloid receptor-1 [J].NatureNeuroscience, 2002,5(6): 546-551.
Abstract:Xenopuslaevisoocytes were selected and injected with 20 ng cRNA(at 1ng/nL) before the experiments, uninjected oocytes served as controls. The cells were stored at (19±1)℃ in G-ORi solution for incubation.Different gradient concentrations of emodin were perfused into chamber as arranged order in turns.Xenopuslaevisoocytes should be fully immersed in solutions under control of flow speed.Two-electrode voltage clamp was used to record the TRPV1 current activated by gradient concentrations of emodin. Inhibitory effects of 0.1, 1.0, 10.0, 50.0 μmol/L emodin on 500nmol/L capsaicin-induced TRPV1 currents have shown characters of concentration dependency and voltage independency as well, IC50=38μmol/L and Hill coefficientn=0.5. Results show emodin is a weak antagonist among natural compounds for TRPV1.The whole inhibition process is reversible, emodin exhibits no hypersensitization.Besides, sediment can be detected in the ORi solution when concentration of emodin reaches up to 50—60μmol/L. We suggest that the inhibition of TRPV1 may contribute to the analgesic effect ofRhubarbextracts, and emodin may form the basis for developing new analgesic drugs.
Keywords: TRPV1 current; capsaicin; emodin; analgesia mechanism; two-electrode voltage clamp
EmodinInhibitsCapsaicin-InducedTRPV1Current
HU Yi1,2,3, ZHANG Di1,2,3, Wolfgang Schwarz2,3,4
(1.DepartmentofAeronauticsandAstronautics,FudanUniversity,Shanghai200433,China; 2.ShanghaiKeyLaboratoryofAcupunctureMechanismandAcupointFunction,Shanghai200433,China; 3.ShanghaiResearchCenterofAcupunctureandMeridians,Shanghai201203,China; 4.InstituteforBiophysics,J.W.GoetheUniversity,FrankfurtamMain60438,Germany)
Q27
A
0427-7104(2017)03-0366-08
2016-05-09
国家自然科学基金(81590950,81102630);国家重点基础研究发展规划 (2012CB518502);上海市针灸机制与穴位功能重点实验室资助(14DZ2260500)
胡 益(1990—),男,硕士研究生;张 迪(1980—),女,副教授,通信联系人,E-mail: dizhang@fudan.edu.cn.
