城市生活污水SNAD生物膜脱氮特性
2017-10-13郑照明侯爱月赵白航杨京月
郑照明,李 军,侯爱月,马 静,杜 佳,赵白航,杨京月
城市生活污水SNAD生物膜脱氮特性
郑照明,李 军*,侯爱月,马 静,杜 佳,赵白航,杨京月
(北京工业大学国家工程实验室,北京市污水脱氮除磷处理与过程控制工程技术研究中心,北京 100124)
通过批试实验研究了同步亚硝化、厌氧氨氧化和反硝化(SNAD)生物膜的脱氮性能. SNAD生物膜具有良好的厌氧氨氧化和反硝化活性.厌氧氨氧化NH4+-N、NO2--N和总无机氮(TIN)去除速率分别为0.121,0.180,0.267kg N/(kg VSS·d);反硝化和亚硝态氮氧化活性分别为0.211,0.053kg NO2--N/(kg VSS·d).SNAD生物膜厌氧氨氧化适宜的pH值范围为5~9,生物膜有助于缓解pH值对厌氧氨氧化菌的抑制作用. SNAD生物膜对NO2--N和FNA的抑制作用表现出良好的耐受能力.当NO2--N浓度分别为100,150mg/L时,对应的FNA浓度分别为70, 100μg/L,厌氧氨氧化NH4+-N去除速率分别为0.087,0.029kg N/(kg VSS·d).扫描电镜显示,在SNAD生物膜表面主要是一些短杆菌.在SNAD生物膜内部主要为火山口状细菌,应为厌氧氨氧化菌.
SNAD生物膜;脱氮特性;厌氧氨氧化;亚硝态氮;pH值影响
含氮污水的大量排放会造成水体富营养化.传统生物脱氮采用硝化和反硝化技术,存在着曝气能耗高、污泥产量大、需要额外投加外碳源等的缺点[1].同步亚硝化、厌氧氨氧化和反硝化SNAD(simultaneous partial nitrification, anaerobic ammonium oxidization and denitrification)工艺是一种经济环保的脱氮工艺,在适宜的工况下,亚硝化菌、厌氧氨氧化菌和反硝化菌在一个反应器中实现总氮和有机物的去除[2].关于SNAD工艺的研究多集中于高氨氮污水的处理,针对城市生活污水处理的SNAD工艺研究报道较少[3].城市污水氨氮浓度较低,不利于抑制亚硝酸盐氧化菌(NOB, nitrite oxidizing bacteria)的活性,也不利于厌氧氨氧化菌的代谢生长.郑照明等[4]启动了处理城市生活污水的SNAD颗粒污泥反应器,但是反应器内溶解氧浓度较低(0.15~1.4mg/L),不利于好氧氨氨化菌(AOB, ammonia oxidizing bacteria)活性的发挥.Ge等[5]的批试研究表明对于低氨氮污水的处理,采用间歇曝气方式(曝气10min/非曝气20min)可以有效地抑制NOB的活性.本课题组采用间歇曝气方式在高溶解氧工况下启动了处理城市生活污水的SNAD生物膜反应器.
研究表明亚硝态氮浓度和环境pH值对厌氧氨氧化菌的活性具有重要影响[6-9].文献报道的亚硝态氮对厌氧氨氧化活性的抑制浓度不尽相同. Strous等[6]的研究表明亚硝态氮对厌氧氨氧化活性的抑制浓度为98mg/L.而Dapena-Mora等[7]和Lotti等[8]的研究表明当亚硝态氮浓度分别为350和400mg/L时,厌氧氨氧化活性被抑制50%.厌氧氨氧化颗粒污泥和生物膜工艺对于亚硝态氮的抑制作用具有较好的耐受能力[10-11].颗粒污泥和生物膜中的厌氧氨氧化菌密度较高,而且颗粒污泥和生物膜存在传质阻力,这些都有助于缓解底物浓度和外界环境对厌氧氨氧化菌的抑制作用.本研究通过批试实验考察了SNAD生物膜的脱氮性能,分析了不同NO2--N浓度和pH值对生物膜厌氧氨氧化活性的影响,以期为SNAD生物膜反应器的工程应用提供指导作用.
1 材料和方法
1.1 实验装置-SNAD生物膜反应器
SNAD生物膜反应器如图1所示.反应器为圆柱形结构,有效容积为89.5L (高径比为2.07).反应器采用SBR(sequencing batch reactor)运行方式,周期运行完毕之后马上进行下一个周期,反应器内填充鲍尔环作为生物膜载体(K3载体, AnoxKaldnes,北京),鲍尔环的直径为25mm,分成多个小格,每个小格的直径为4mm,鲍尔环堆积体积为34L,反应器有效盛水容积为77.7L,排水比为81%.鲍尔环生物膜照片如图2所示.在底部设置曝气盘,采用温度控制箱在线监测并控制反应器内水温,反应器侧壁(距底部以上20cm处)安装水力搅拌器,排水口设置在底部以上20cm处,排水口直径为20mm.在反应器稳定运行阶段,曝气量控制为500L/h,温度控制为30℃.
1.2 SNAD生物膜反应器稳定运行阶段工况
反应器进水为北京工业大学家属区生活污水,试验阶段主要水质指标如下: CODCr200~ 300mg/L; NH4+-N 60~80mg/L; NO2--N< 1mg/L; NO3--N<1mg/L; TOC 50~60mg/L; TN 100~ 140mg/L; pH值为7.5~8.0;碱度300~ 400mg/L.
周期运行工况为:进水(5min),间歇曝气循环(曝气20min/混合20min),后曝气(20min),沉淀(10min),排水(10min),静置(1min).间歇曝气循环次数为6次.在混合阶段,曝气停止,水力搅拌器启动,使载体处于流化状态,增加微生物和底物的接触.曝气和混合阶段反应器内的平均溶解氧浓度分别为5.6,0mg/L. SNAD生物膜反应器已稳定运行60d,具有良好的脱氮性能.出水NH4+-N, NO2--N, NO3--N和COD浓度平均值分别为2, 2, 7,50mg/L, COD平均去除率为71%, TIN去除率为80%~90%.
1.3 批试实验装置及其运行条件
1.3.1 批试污泥 取SNAD生物膜反应器稳定运行阶段中的鲍尔环进行生物膜的脱氮活性测定.试验前将鲍尔环置于30℃自来水中洗去表面的残留基质.
1.3.2 批试实验水质 试验采用模拟废水,配水氮素组分为NH4Cl, NaNO2.碳源采用无水乙酸钠.其他微量元素组分浓度参照Tang等[12]的文献.批试过程中采用HCl和NaOH实时调节pH.为了研究NO2--N对厌氧氨氧化活性的影响,批试过程中pH值控制为7.0,固定NH4+-N浓度为70mg/L, NO2--N浓度设定为70,100,150,200,250, 300mg/L.各脱氮活性测定时的配水组分见表1.
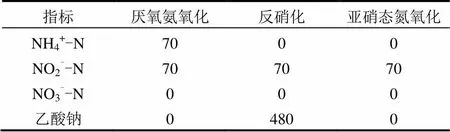
表1 批试实验主要配水组分(mg/L)
1.3.3 批试实验装置和程序 试验采用1000mL烧杯,烧杯内放置50个鲍尔环,进行3次平行重复实验.厌氧氨氧化和反硝化活性测定步骤参照文献[12]:(1)配置泥水混合液;(2)启动恒温磁力搅拌器,转速为500r/min,用保鲜膜密封烧杯口,通氮气10min (氮气纯度99.999%); (3)停止通氮气,将烧杯连同磁力搅拌器放入30℃的恒温培养箱中.亚硝态氮氧化活性测定:(1)配置泥水混合液; (2)往烧杯中鼓入空气,曝气量控制为250mL/min (周期内DO大于6mg/L),启动恒温磁力搅拌器,转速为500r/min,将烧杯连同磁力搅拌器放入30℃的恒温培养箱中.每隔一定时间取样测定主要组分浓度.污泥活性计算见公式(1).
污泥活性=(1)
式中:浓度单位为mg/L;计时终点单位为min; 挥发性物质质量单位为g.计时终点的确定:若在取样的时间内,批试装置内的NH4+-N或NO2--N浓度低于10mg/L,则以NH4+-N或NO2--N浓度刚低于10mg/L的取样时刻为计时终点;若在取样的时间内,批试装置内的NH4+-N或NO2--N浓度始终高于10mg/L,则以取样结束的时刻为计时终点.污泥活性单位为: kg N/(kg VSS·d).
1.3.4 鲍尔环污泥浓度的确定 用牙签刮落鲍尔环表面附着较为松散的生物膜,将残留有生物膜的鲍尔环放于烧杯中,盛适量水,采用超声设备(VCX105PB)进行处理,振幅为90%,超声时间为30min.待鲍尔环表面的生物膜完全脱落,将超声后的泥水混合液和前面的松散污泥混合用滤纸过滤,将截留污泥的滤纸经烘箱和马弗炉处理,烘干时间及温度与常规污泥浓度测量条件相同,得到鲍尔环污泥的干物质量和挥发性物质质量.
1.4 分析方法
NH4+-N:纳氏试剂光度法; NO2--N:N-(1-萘基)-乙二胺分光光度法; NO3--N:麝香草酚分光光度法;取NH4+-N, NO2--N和NO3--N浓度之和为TIN浓度; DO、pH值、温度:WTW/Multi 3420测定仪;扫描电镜:Hitachi S-4300扫描电子显微镜; CODCr:按中国国家环保局和美国环境总署发布的标准方法测定;扫描电镜(SEM)样品制备:固定、冲洗、脱水、置换、干燥、粘样、镀膜.取出反应器内鲍尔环生物膜载体,使用PBS清洗2~3次后,经2.5%戊二醛固定1.5h,再用PBS清洗3遍,随后经体积分数分别为50%, 70%, 80%, 90%和100%的乙醇进行梯度脱水,每次脱水10~15min,然后用乙酸异戊酯置换,置换后的样品于37℃干燥.干燥后,在样品表面镀上一层厚度为1500nm的金属膜,使用Hitachi S−4300型扫描电镜对样品进行观察.
FNA的计算公式参照文献[13].
式中:为温度(℃).
2 结果与讨论
2.1 SNAD生物膜脱氮性能
2.1.1 SNAD生物膜的厌氧氨氧化和反硝化活性 SNAD生物膜的厌氧氨氧化活性结果如图3所示.生物膜具有良好的厌氧氨氧化活性.初始NH4+-N和NO2--N浓度都为70mg/L,随着反应的进行, NH4+-N和NO2--N浓度逐渐降低, NO3--N浓度逐渐上升. △NO2--N/△NH4+-N= 1.45, △NO3--N/△NH4+-N=0.29,和Strous等[6]的研究结果相近.厌氧氨氧化NH4+-N、NO2--N和TIN去除速率分别为0.121, 0.180和0.267kg N/(kg VSS·d). SNAD生物膜的反硝化活性结果如图4所示.反硝化活性为0.211kg NO2--N/(kg VSS·d).
Strous等[14]的研究表明当氧分压超过0.5%的空气饱和度时,厌氧氨氧化菌的活性将会受到抑制.溶解氧的存在也不利于反硝化菌的代谢生长.本研究曝气和混合阶段反应器内的平均溶解氧浓度分别为5.6和0mg/L. SNAD生物膜仍具有良好的厌氧氨氧化活性和反硝化活性.可能的原因为本研究厌氧氨氧化菌和反硝化菌位于SNAD生物膜的内部,生物膜对溶解氧的传质具有阻碍作用[15],有助于缓解溶解氧对厌氧氨氧化菌和反硝化菌的抑制作用;同时,AOB倾向于生长在生物膜的外表面,厌氧氨氧化菌倾向于生长在生物膜的内部[16]; AOB和异养菌对于溶解氧的消耗有助于维持生物膜内部较低的溶解氧浓度[17];此外,本研究SNAD生物膜反应器采用间歇曝气运行方式,厌氧氨氧化菌和反硝化菌可以在厌氧混合阶段进行活性恢复,有助于缓解曝气阶段高溶解氧的抑制作用[18].
2.1.2 SNAD生物膜亚硝态氮氧化活性 SNAD生物膜的亚硝态氮氧化活性结果如图5所示. SNAD生物膜的亚硝态氮氧化活性较低,其值为0.053kg NO2--N/(kg VSS·d). SNAD生物膜反应器曝气阶段采用间歇曝气模式(曝气20min/混合20min),曝气和混合阶段反应器内的平均溶解氧浓度分别为5.6和0mg/L. Jardin等[19]的研究表明溶解氧浓度为1.0mg/L时,控制曝气和非曝气时间分别为8和18min,可以有效地抑制SNAD反应器内NOB的活性. Gilbert等[20]的研究表明NOB从厌氧环境进入好氧环境需要经过15~20min的迟滞期才能发挥出活性. SNAD生物膜表面的AOB和异养菌对于溶解氧的消耗和生物膜对溶解氧的传质阻碍也有助于维持生物膜内部较低的溶解氧浓度,从而抑制NOB的活性[15,17].Morales等[15]通过微电极分析了SNAD颗粒污泥内部的溶解氧浓度,当溶液中的溶解氧浓度分别为4mg/L和8mg/L时,在颗粒污泥内部150mm和250mm处,溶解氧的浓度降低为0mg/L.此外,生物膜内反硝化菌和厌氧氨氧化菌对亚硝态氮的利用也有助于抑制NOB的活性. Van der Star等[21]的研究表明厌氧氨氧化菌和反硝化菌对NO2--N的亲和能力比NOB更强.基于以上有利条件, SNAD生物膜中的NOB活性得到了一定程度的抑制,但是NOB的活性没有得到完全抑制. Gilbert等[20]的研究表明在间歇曝气工况下,高溶解氧浓度有助于提高NOB活性,减少NOB从缺氧进入好氧的适应时间.本研究曝气阶段SNAD生物膜反应器内的溶解氧浓度较高,可能会减小间歇曝气工况对NOB的抑制作用,需进一步研究在较低溶解氧浓度下间歇曝气工况对NOB活性的抑制特性.
2.2 NO2--N浓度对厌氧氨氧化NH4+-N去除速率的影响
NO2--N浓度对厌氧氨氧化NH4+-N去除速率的影响如图6所示.批试过程中NH4+-N浓度的变化情况如图7所示.随着NO2--N浓度的增加, NH4+-N去除速率逐渐减小. NH4+-N去除速率的最大值和最小值分别为0.099和0.009kg N/(kg VSS·d).当NO2--N浓度分别为100和150mg/L时,NH4+-N去除速率分别为0.087和0.029kg N/(kg VSS·d),分别为最大NH4+-N去除速率的87.4%和29.6%.
Strous等[6]的研究表明, NO2--N浓度达98mg/L时即可完全抑制厌氧氨氧化活性. Egli等[9]的批试研究表明当NO2--N浓度为180mg/L时,厌氧氨氧化反应经过3d时间才开始发生. Tang等[10]的研究表明在设置出水回流的工况下,进水NO2--N浓度为360mg/L时, UASB厌氧氨氧化颗粒污泥反应器去除效果良好,当进水NO2--N浓度超过700mg/L时,厌氧氨氧化活性受到抑制,出水水质恶化.Kimura等[11]的研究表明采用包埋材料固定厌氧氨氧化菌,进水NO2--N浓度为430mg/L时,厌氧氨氧化活性被抑制37%;当进水NO2--N浓度为750mg/L时,厌氧氨氧化活性被完全抑制.本研究厌氧氨氧化菌对NO2--N的耐受能力优于其他研究结果[6-9].可能的原因是本研究中的厌氧氨氧化菌位于SNAD生物膜的内部,生物膜对NO2--N的传质存在阻碍作用,有助于降低NO2--N对厌氧氨氧化的抑制作用.但是本研究厌氧氨氧化菌对NO2--N的耐受能力比Tang等[10]和Kimura等[11]的研究结果要差.原因可能为本研究采用生活污水培养SNAD生物膜,反应器内的NO2--N浓度长期低于10mg/L,厌氧氨氧化菌没有适应高NO2--N浓度的抑制.而且SNAD生物膜由亚硝化菌,厌氧氨氧化菌和反硝化菌等微生物组成,生物膜的厚度只有1~2mm,相对于厌氧氨氧化颗粒污泥和包埋材料, SNAD生物膜上厌氧氨氧化菌密度和胞外聚合物较少.研究表明在细胞密度较高时,厌氧氨氧化菌的生长速率更快,活性更高[22].Tan等[23]的研究表明细胞在高度聚集的条件下,基因表达能力更强,有助于增加对不利环境的适应能力.
Fernández等[24]的研究表明,FNA浓度为11μg/L时,生物膜的厌氧氨氧化活性被抑制50%. Puyol等[25]的动力学研究表明,FNA对颗粒污泥厌氧氨氧化活性的抑制常数为117μg/L.本研究FNA对厌氧氨氧化活性的抑制特性和Puyol等[25]的研究较为相近.近年来, Puyol和Lotti等的研究表明NO2--N (而不是FNA)对厌氧氨氧化活性起主要抑制作用[8,25]. Lotti等[8]的研究表明,厌氧氨氧化菌的生物膜由梯烷脂构成,有助于阻止FNA进入细胞内部.因此, NO2--N和FNA对SNAD生物膜厌氧氨氧化活性的抑制作用有待于进一步深入研究.
2.3 pH值对SNAD生物膜厌氧氨氧化活性的影响
图8为不同pH值条件下SNAD生物膜厌氧氨氧化氮素浓度变化情况.不同pH值条件下SNAD生物膜厌氧氨氧化总无机氮去除速率如图9所示.实验研究的pH值范围为4~9.当pH值为8时,厌氧氨氧化总无机氮去除速率达到最大值0.265kg N/(kg VSS·d);当pH值为4时,厌氧氨氧化总无机氮去除速率最小,其值为0.013kg N/(kg VSS·d);当pH值为5,6,7和9时,厌氧氨氧化总无机氮去除速率相差不大,其值分别为0.223,0.225,0.230,0.193kg N/(kg VSS·d). Strous等[26]的研究表明厌氧氨氧化适宜的pH值范围为6.7~8.3,最大反应速率出现在8.0附近. Egli等[9]的研究表明厌氧氨氧化发生的pH值范围为6.5~9.0,最大反应速率出现在8.0附近.本研究结果和Strous等[26]的研究结果较为接近,但是本研究厌氧氨氧化适宜的pH值范围更宽,可能的原因是厌氧氨氧化菌位于生物膜的内部,生物膜对氢离子的传递存在阻碍作用,有助于缓解pH值对厌氧氨氧化菌的抑制作用.相关研究也表明生物膜有助于缓解外界不利环境对厌氧氨氧化菌的抑制作用[27].
2.4 微生物形态
鲍尔环的扫描电镜照片如图10所示,在鲍尔环的外表面主要为短杆菌,短杆菌大小约为0.5mm´1mm.鲍尔环内表面主要为火山口状细菌,直径为0.8~1.2mm,这些火山口状细菌应为厌氧氨氧化菌,和其他研究一致[28].郭建华等[29]的研究表明亚硝化反应器中的AOB形态为短杆菌.但是,Xu等[30]的研究表明当反应器内的溶解氧为5mg/L时,在亚硝化颗粒污泥表面的细菌形态主要为球状菌和棒状菌.因此仅仅采用SEM无法准确辨别细菌的种类,需要进一步做分子生物学的研究.
3 结论
3.1 SNAD生物膜具有良好的厌氧氨氧化和反硝化活性.厌氧氨氧化NH4+-N、NO2--N和TIN去除速率分别为0.121, 0.180和0.267kg N/(kg VSS·d);反硝化和亚硝态氮氧化活性分别为0.211和0.053kg NO2--N/(kg VSS·d).
3.2 SNAD生物膜中的厌氧氨氧化菌对NO2--N和FNA的抑制作用表现出良好的耐受能力.厌氧氨氧化NH4+-N去除速率最大值和最小值分别为0.099,0.009kg N/(kg VSS·d).当NO2--N浓度分别为100,150mg/L时,对应的FNA浓度分别为70,100μg/L, NH4+-N去除速率分别为0.087,0.029kg N/(kg VSS·d).
3.3 SNAD生物膜厌氧氨氧化适宜的pH值范围为5~9.当pH值为8和4时,厌氧氨氧化总无机氮去除速率分别取得最大值[0.265kg N/(kg VSS·d)]和最小值[0.013kg N/(kg VSS·d)].生物膜对氢离子的传递存在阻碍作用,有助于缓解pH对厌氧氨氧化菌的抑制作用.
3.4 在鲍尔环的外表面主要为短杆菌,短杆菌大小约为0.5mm´1mm.鲍尔环内表面主要为火山口状细菌,直径为0.8~1.2mm,这些火山口状细菌应为厌氧氨氧化菌.
[1] Bagchi S, Biswas R, Nandy T. Autotrophic ammonia removal processes: ecology to technology [J]. Critical Reviews in Environmental Science and Technology, 2012,42(13):1353-1418.
[2] Chen H H, Liu S T, Yang F L, et al. The development of simultaneous partial nitrification,anammox and denitrification (SNAD) process in a single reactor for nitrogen removal [J]. Bioresource Technology, 2009,100(4):1548-1554.
[3] Zhang X J, Zhang H Z, Ye C M, et al. Effect of COD/N ratio on nitrogen removal and microbial communities of CANON process in membrane bioreactors [J]. Bioresource Technology, 2015,189: 302-308.
[4] 郑照明,李泽兵,刘常敬,等.城市生活污水SNAD工艺的启动研究[J]. 中国环境科学, 2015,35(4):1072-1081.
[5] Ge S, Peng Y, Qiu S, et al. Complete nitrogen removal from municipal wastewater via partial nitrification by appropriately alternating anoxic/aerobic conditions in a continuous plug-flow step feed process [J]. Water Research, 2014,55(0):95-105.
[6] Strous M, Heijnen J J, Kuenen J G, et al. The sequencing batch reactor as a powerful tool for the study of slowly growing anaerobic ammonium-oxidizing microorganisms [J]. Applied Microbiology and Biotechnology, 1998,50(5):589-596.
[7] Dapena-Mora A, Fernandez I, Campos J L, et al. Evaluation of activity and inhibition effects on Anammox process by batch tests based on the nitrogen gas production [J]. Enzyme and Microbial Technology, 2007,40(4):859-865.
[8] Lotti T, van der Star W R L, Kleerebezem R, et al. The effect of nitrite inhibition on the anammox process [J]. Water Research, 2012,46(8):2559-2569.
[9] Egli K, Fanger U, Alvarez P, et al. Enrichment and characterization of an anammox bacterium from a rotating biological contactor treating ammonium-rich leachate [J]. Archives of Microbiology, 2001,175(3):198-207.
[10] Tang C J, Zheng P, Hu B L, et al. Influence of substrates on nitrogen removal performance and microbiology of anaerobic ammonium oxidation by operating two UASB reactors fed with different substrate levels [J]. Journal of Hazardous Materials, 2010,181(1-3):19-26.
[11] Kimura Y, Isaka K, Kazama F, et al. Effects of nitrite inhibition on anaerobic ammonium oxidation [J]. Applied Microbiology and Biothehnology, 2010,86(1):359-365.
[12] Tang C J, Zheng P, Mahmood Q, et al. Start-up and inhibition analysis of the Anammox process seeded with anaerobic granular sludge [J]. Journal of Industrial Microbiology and Biotechnology, 2009,36(8):1093-1100.
[13] Anthonisen A C, Loehr R C, Prakasam T, et al. Inhibition of nitrification by ammonia and nitrous-acid [J]. Journal Water Pollution Control Fedration, 1976,48(5):835-852.
[14] Strous M, Vangerven E, Kuenen J G, et al. Effects of aerobic and microaerobic conditions on anaerobic ammonium-oxidizing (Anammox) sludge [J]. Applied and Environmental Microbiology, 1997,63(6):2446-2448.
[15] Morales N, Del Rio A V, Vazquez-Padin J R, et al. Influence of dissolved oxygen concentration on the start-up of the anammox- based process: ELAN (R) [J]. Water Science and Technology, 2015,72(4):520-527.
[16] Winkler M, Yang J J, Kleerebezem R, et al. Nitrate reduction by organotrophic Anammox bacteria in a nitritation/anammox granular sludge and a moving bed biofilm reactor [J]. Bioresource Technology, 2012,114:217-223.
[17] Siegrist H, Salzgeber D, Eugster J, et al. Anammox brings WWTP closer to energy autarky due to increased biogas production and reduced aeration energy for N-removal [J]. Water Science and Technology, 2008,57(3):383-388.
[18] Yang J J, Trela J, Zubrowska-Sudol M, et al. Intermittent aeration in one-stage partial nitritation/anammox process [J]. Ecological Engineering, 2015,75:413-420.
[19] Jardin N, Hennerkes J. Full-scale experience with the deammonification process to treat high strength sludge water - a case study [J]. Water Science and Technology, 2012,65(3):447- 455.
[20] Gilbert E M, Agrawal S, Brunner F, et al. Response of Different Nitrospira Species To Anoxic Periods Depends on Operational DO [J]. Environment Science and Technology, 2014,48(5):2934- 2941.
[21] van der Star W, Miclea A I, van Dongen U, et al. The membrane bioreactor: A novel tool to grow anammox bacteria as free cells [J]. Biotechnology and Bioengineering, 2008,101(2):286-294.
[22] Lu H F, Zheng P, Ji Q X, et al. The structure, density and settlability of anammox granular sludge in high-rate reactors [J]. Bioresource Technology, 2012,123:312-317.
[23] Tan C M, Saurabh S, Bruchez M P, et al. Molecular crowding shapes gene expression in synthetic cellular nanosystems [J]. Nature Nanotechnology, 2013,8(8):602-608.
[24] Fernández I, Dosta J, Fajardo C, et al. Short- and long-term effects of ammonium and nitrite on the Anammox process [J]. Journal of Environmental Management, 2012,95:S170-S174.
[25] Puyol D, Carvajal-Arroyo J M, Sierra-Alvarez R, et al. Nitrite (not free nitrous acid) is the main inhibitor of the anammox process at common pH conditions [J]. Biotechnology letters, 2014,36(3):547-551.
[26] Strous M, Kuenen J G, Jetten M. Key physiology of anaerobic ammonium oxidation [J]. Applied and Environmental Microbiology, 1999,65(7):3248-3250.
[27] Chen T, Zheng P, Shen L, et al. Kinetic characteristics and microbial community of Anammox-EGSB reactor [J]. Journal of Hazardous Materials, 2011,190(1–3):28-35.
[28] Kartal B, Rattray J, van Niftrik L A, et al. Candidatus "Anammoxoglobus propionicus" a new propionate oxidizing species of anaerobic ammonium oxidizing bacteria [J]. Systematic and Applied Microbiology, 2007,30(1):39-49.
[29] Guo J, Peng Y Z, Wang S Y, et al. Long-term effect of dissolved oxygen on partial nitrification performance and microbial community structure [J]. Bioresource Technology, 2009,100(11): 2796-2802.
[30] Xu G J, Xu X C, Yang F L, et al. Partial nitrification adjusted by hydroxylamine in aerobic granules under high DO and ambient temperature and subsequent Anammox for low C/N wastewater treatment [J]. Chemical Engineering Journal, 2012,213:338-345.
Nitrogen removal performance of SNAD biofilm cultured by domestic wastewater.
ZHENG Zhao-ming, LI Jun*, HOU Ai-yue, MA Jing, DU Jia, ZHAO Bai-hang, YANG Jing-yue
(National Engineering Laboratory for Advanced Municipal Wastewater Treatment and Reuse Technology, Engineering Research Center of Beijing, Beijing University of Technology, Beijing 100124, China).
The nitrogen removal performance of simultaneous partial nitrification, anaerobic ammonium oxidization and denitrification (SNAD) biofilm was investigated in batch tests. The SNAD biofilm performed good anammox and denitrification activities. The NH4+-N, NO2--N and total inorganic nitrogen (TIN) removal rates of anammox activity were 0.121, 0.180 and 0.267kg N/(kg VSS·d), respectively. The denitrification and nitrite oxidation activities were 0.211 and 0.053kg NO2--N/(kg VSS·d), respectively. The suitable pH ranges for anammox activity were 5.0 to 9.0. The the inhibition effect of pH on the anammox bacteria could be largely relieved by biofilm. Besides, the SNAD biofilm was found to perform high tolerance to the inhibition of NO2--N and free nitrous acid (FNA). The NH4+-N removal rates for anammox process were 0.087 and 0.029kg N/(kg VSS·d)with the NO2--N concentrations of 100mg/L (FNA concentration of 70μg/L) and 150mg/L (FNA concentration of 100μg/L), respectively. The SEM observations indicated that the bacteria in the outer part of the SNAD biofilm were mainly short rod-shaped. In the inner part of the SNAD biofilm, the bacteria were mainly crater-shaped, which should be anammox bacteria.
SNAD biofilm;nitrogen removal performance;anammox;nitrite;effect of pH
X703.5
A
1000-6923(2017)04-1322-09
2016-08-01
国家水体污染控制与治理科技重大专项(2014ZX 07201-011);国家自然科学基金青年基金(51308010);教育部博士点新教师(20131103120017);北京市博士后工作经费资助项目(2015ZZ-10)
郑照明(1989-),男,浙江嵊州市人,北京工业大学博士研究生,主要研究厌氧氨氧化,亚硝化脱氮和SNAD工艺.发表论文6篇.
* 责任作者, 教授, jglijun@bjut.edu.cn
, 2017,37(4):1322~1330
