离子膜电解还原Eu3+
2017-10-13刘志强张魁芳
朱 薇,刘志强,李 伟,张魁芳
离子膜电解还原Eu3+
朱 薇,刘志强,李 伟,张魁芳
(广东省稀有金属研究所广东省稀土开发及应用重点实验室,广州510650)
针对溶液中Eu3+离子难还原等问题,采用离子膜电解法对溶液中Eu3+的还原进行试验研究,考察不同阴、阳电极材料,阳极液、阴极液成份及酸度,电流密度等工艺条件对Eu3+还原的影响,确定最佳工艺参数。结果表明:钌系多元混合物涂层钛阳极、金属钛阴极,阳极液为含1 mol/L盐酸溶液的氯化钙溶液、阴极液为富铕料液,电流密度为500 A/m2时,经过7.5 h,Eu3+的电解还原率大于95.5%,电解还原电流效率大于80%,槽电压稳定,无铕损失;经过工业化连续运行,Eu3+的电解还原率大于94%。
稀土;离子膜电解;还原;铕
铕作为激活剂、标记试剂等被广泛应用于众多高新技术领域。随着高新技术领域的发展,高纯氧化铕的需求量迅猛增加[1−4]。铕在17个稀土元素之中含量相对较少,单纯采用离子交换或萃取法很难获得纯度大于99.99%(4N)的高纯氧化铕。目前,工业生产高纯氧化铕主要采用锌粉还原法将Eu3+还原成Eu2+,再将Eu2+与其他稀土元素分离[5−6]。采用锌粉还原时,由于引入了新的杂质锌,需追加后续工序除锌,加大了废水处理难度,并增加了重金属废渣等固体废弃物,该方法已无法满足国家日益严格的环保要求。
电化学还原法目前在许多有色金属冶炼上得到广泛应用,属于一种绿色工艺。20世纪80年代,国际上出现了电解还原Eu3+的方法,引起了稀土行业的广泛关注。目前研究电解还原Eu3+主要有3种方法:盐桥电解还原法、多孔碳隔膜电解法和离子交换膜电解法。这些方法存在着Eu3+还原电位低、析氢严重、铕还原率低、电极寿命短、易产生稀土沉淀堵塞离子膜等问题[7−15],导致工业上无法实现电解还原Eu3+。针对上述问题,本文作者采用离子交换膜电解法进行了Eu3+还原研究,筛选了阳、阴极,研究了还原工艺条件等,克服了上述问题,并进行了离子膜电解还原Eu3+工业化实验。
1 实验
1.1 实验原理
电极反应如下:
1) 阴极
Eu3++e→Eu2+([15]),
2H++2e→H2↑(); (1)
2) 阳极
2Cl−−2e→Cl2↑,2H2O−4e→4H++O2↑ (2)
稀土开始沉淀时pH值为5左右,离子膜电解过程中不能有沉淀产生,否则会导致电解无法进行。因此,离子膜电解过程中电解液pH值不能超过5。为了使Eu3+能还原成Eu2+,必须析氢电位比Eu3+还原Eu2+电位负,先发生Eu3+还原反应。Eu3+离子还原成Eu2+离子的电位为:
Eu3+离子还原率越高,它的还原电位越负。析氢电位:
从析氢电位和铕还原电位可以看出,电解液pH值低于5时,Eu3+还原电位比析氢电位负,先发生析氢反应。因此,在水溶液体系中要将Eu3+还原为Eu2+必须解决析氢问题,需要寻找一种氢超电位比较高的阴极材料,抑制析氢反应。同时,电解还原过程中不可避免地会有析氢反应发生,电解液体系pH值会不断增加,为了避免电解还原过程有稀土沉淀产生,在电解过程中必须维持电解液pH值的稳定。这些难题是造成目前离子膜电解还原Eu3+无法工业化应用的主要原因。
1.2 实验原料
实验原料:盐酸,氯化铕、氯化钙、FeC13、NH4SCN均为分析纯;富铕稀土料液([Eu3+]=0.70 mol/L,[RE3+]=1.0 mol/L,由稀土冶炼企业提供)。
1.3 实验设备
实验装置如图1所示。电解槽:由有机玻璃材料加工而成,单槽长×宽×高为180 mm×50 mm×200 mm。2个有机玻璃单槽通过螺栓固定在一起,并将离子膜夹在2个单槽中间;阴极板采用长×宽分别为150 mm×160 mm金属网;阳极板为长×宽分别为150 mm×160 mm的贵金属涂层钛板;甘汞电极(型号217,姜堰市国创分析仪器有限公司生产);电化学工作站(CHI660D);恒流电源(新威BTS节能型动力电池化成检测系统(0~20 A,0~30 V))。

图1 电解还原实验装置
1.4 实验方法
分别将配制的阴、阳电解液加入到电解槽中,阴极室加入1 cm厚煤油作保护液,然后将电极板按一定间距固定在电解槽中;电解槽阳极室采用循环系统,将配制好的阳极电解液通过恒流泵按流量=0.65 mL/s打入阳极室,使其两室的电解液维持至静态试验最佳条件范围内,溢流出的阳极电解液再返回电解液贮槽;开启阴极室搅拌器,通电后调节电流至设定值,进行电解。每隔10 min取出1 mL阴极液分析Eu2+浓度[16],计算电流效率和电能消耗。
1.5 分析检测
溶液中Eu2+离子分析:先加入100 mL左右去离子水于反应瓶中(如图2所示),滴加NH4SCN溶液(质量分数15%左右)2~5 mL;盖紧瓶塞,通入高纯N2约3~5 min赶尽整个装置中的空气后,取1 mL待测溶液加入反应瓶中,从滴定管中逐滴加入FeC13标准溶液,至红色不再消失即为终点,读记FeC13标准溶液消耗体积,然后求出Eu2+的浓度。Eu2+的浓度(mol/L)= FeC13标准溶液浓度(mol/L)×FeC13标准溶液消耗量(mL)。
电化学分析:采用循环伏安法对阴极、阳极进行电化学分析。所用设备为CHI660D 电化学工作站和三电极体系:辅助电极为铂电极;参比电极为饱和甘汞电极。扫描速率为20 mV/s,选择−1.2 V作为初始电位,扫描范围为−1.2~1.5V。
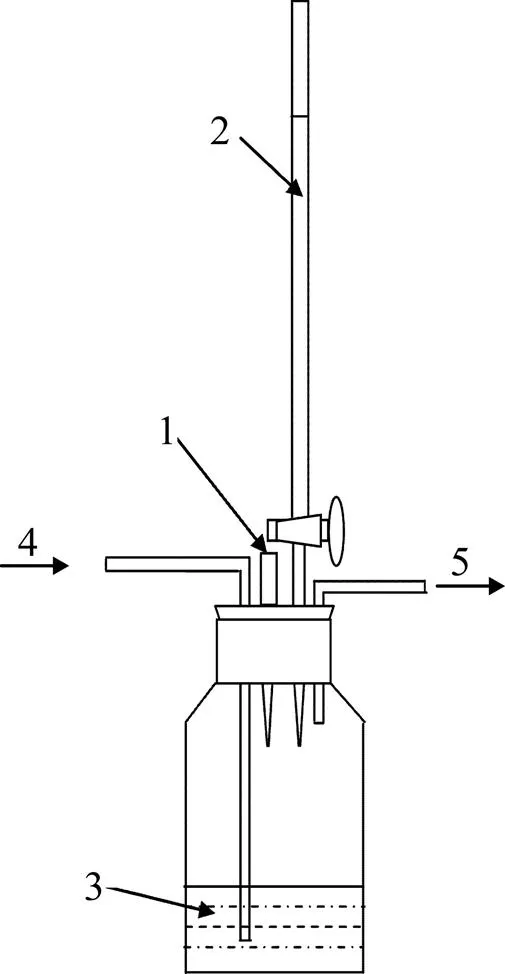
图2 Eu2+离子分析装置
2 结果与讨论
2.1 阳极、阴极的筛选
选取经过草酸蚀刻的涂敷钌、铱、钯、铑、钽等氯化物混和溶液的钛基活性涂层电极RT和IT,与铂阳极、铅银阳极一起进行筛选实验。RT是钌系多元混合物涂层钛阳极,IT是铱系多元混合物涂层钛阳极,实验结果见表1。由表1可知铅银阳极析氯电位最高,IT阳极析氯电位与铂阳极的接近,比RT阳极的高很多。但铅银阳极在本电解体系中易腐蚀,使用寿命不长;铂阳极为贵金属阳极,价格昂贵。在0.5 mol/L盐酸体系中,RT和IT两种阳极的循环伏安曲线如图3所示。由图3可知,在电流相同的情况下,IT阳极的析氯电位比RT阳极的高。综上所述,IT阳极与RT阳极相比,析氯电位更高,较难析出氯气。本实验选用铱系多元混合物涂层钛阳极(IT阳极)。
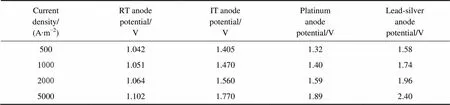
表1 不同阳极的析氯电位(饱和NaCL溶液;40 ℃;vs SCE)
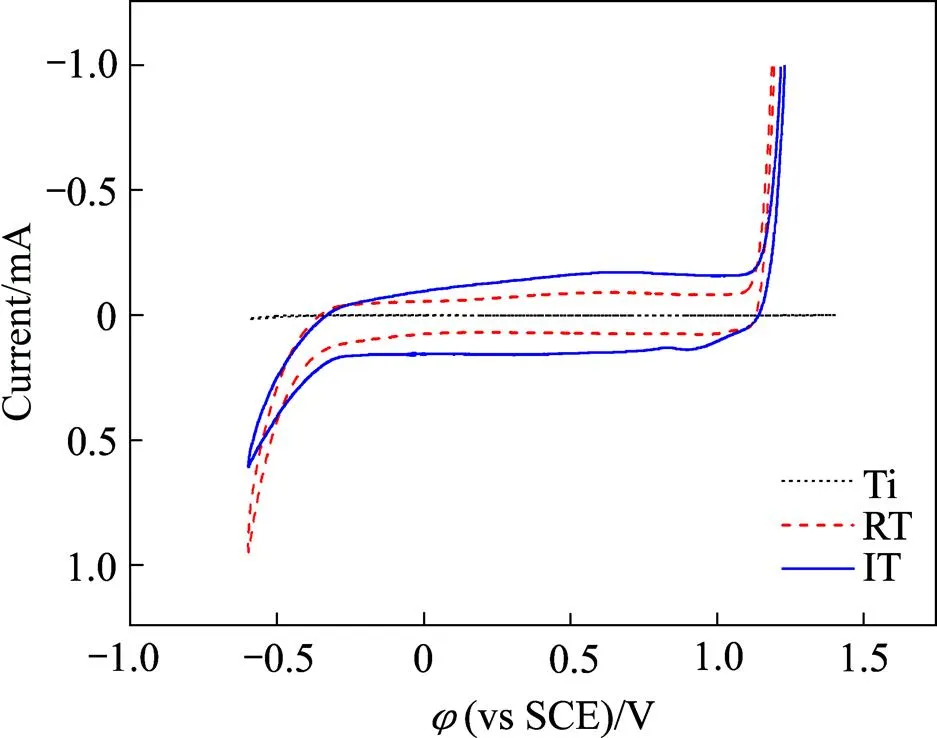
图3 在0.5 mol/L盐酸溶液中的循环伏安曲线(扫描速度0.02 V/S)
由于稀土开始沉淀pH为5,因此在pH<5的稀土溶液中,析氢电位高于−0.3 V。由于析氢电位比Eu3+还原电位高,H+更容易被还原为H2析出。H+在阴极表面与Eu3+形成竞争,会降低电流效率;H+的减少改变了阴极液的酸度,可能导致稀土生成沉淀。因此,必须选用氢超电压较高的金属作为阴极电极。本研究选取氯化物溶液中耐腐蚀性比较强并且氢超电位比较高的金属钛、钽金属电极进行筛选实验。分析了金属钛、钽在pH=2.0,[Eu3+]=0.5 mol/L的氯化铕溶液中的极化曲线,实验结果如图4所示。从图4可以发现,在同等条件下,金属钛的电流在−0.8~−0.6 V之间处现一个平台,根据资料可知此时氢在金属钛上的析氢电位,判断出在该平台处−0.6 V先进行Eu3+还原,到−0.8 V左右再析氢;因此,钛可以将Eu3+还原优先发生,随后再析氢;钽金属只在−0.6 V处出现一个小平台,没有明显的析氢峰出现,可能使用钽电极时Eu3+还原与析氢反应同时发生。因此,为了优先还原Eu3+,选择钛作为金属阴极比较合适。
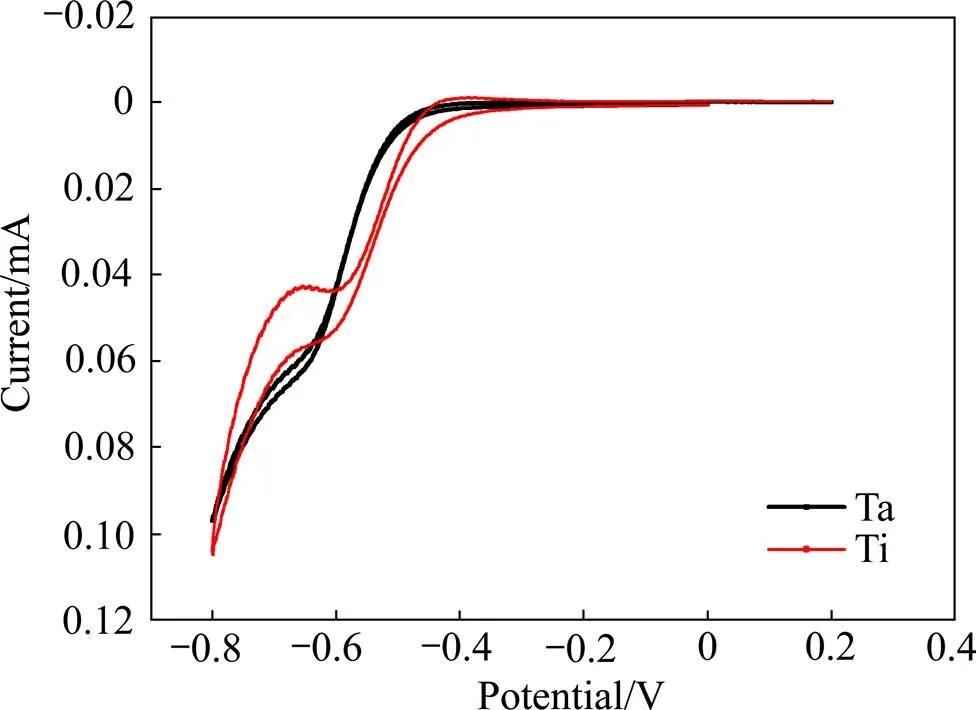
图4 不同金属阴极在氯化铕溶液中的极化曲线(扫描速度0.02 V/s)
2.2 不同电流对电解的影响
电流强度增加,会加快电解还原反应,但影响电流效率;电流强度较高,副反应加大,大量析氢,使槽电压升高,溶液pH值迅速升高,出现氢氧化物沉淀,电解液温度升高,导致能耗增加,电解无法顺利进行,离子交换膜使用寿命缩短;而电流强度低,则还原速率减小。电解条件如下:阴极液[Eu3+]=0.7 mol/L,pH=1.5,阳极液为HCl,[H+]=0.43 mol/L,铱系多元混合物涂层钛阳极,金属钛网为阴极,电流在4.0~10.0 A范围内。在此条件下考察了电流强度对电解的影响,槽电压在3~5 V变化。实验结果如图5所示。由图5可知,随着电流增加,还原速度加快,铕的还原率增加。电流密度在8 A以上时,铕还原率可高达94%。从图6和7可看出:随着电流的升高,电流效率逐步降低;随着电解还原时间的延长,电流效率逐步降低。
电解条件如下:纯氯化铕阴极液[Eu3+]=0.7 mol/L,阳极液HCl溶液的[H+]=0.43 mol/L,铱系多元混合物涂层钛阳极,金属钛网阴极,电流8 A。在此条件下考察了阴极液酸度对电解的影响,实验结果如图8所示。阴极液酸度有两方面作用:维持电解体系酸度防止沉淀析出和导电。实验中发现,随着电解的进行,阴极液酸度是降低的,这也说明还原过程中发生了析氢反应,且H+从阳极液迁移到阴极液的速率小于析氢反应的速率。从图8可知,当料液起始pH值较高时,体系电阻较高,槽电压高,电解还原速度较快,但pH值迅速升高,生成了氢氧化物沉淀,破坏电解体系,使电解无法进行;当阴极液起始pH值较低时,大量H+的存在使氢过电位降低,会先析出氢气,降低了电流效率,并且料液酸度越高,铕还原速度越小。当阴极液pH值在1~2之间时,铕还原率随电解时间的延长呈直线上升,并且还原速度较快,H+从阳极液迁移到阴极液的速率与析氢反应的速率相当,阴极液酸度变化不大,电解还原进行顺利。
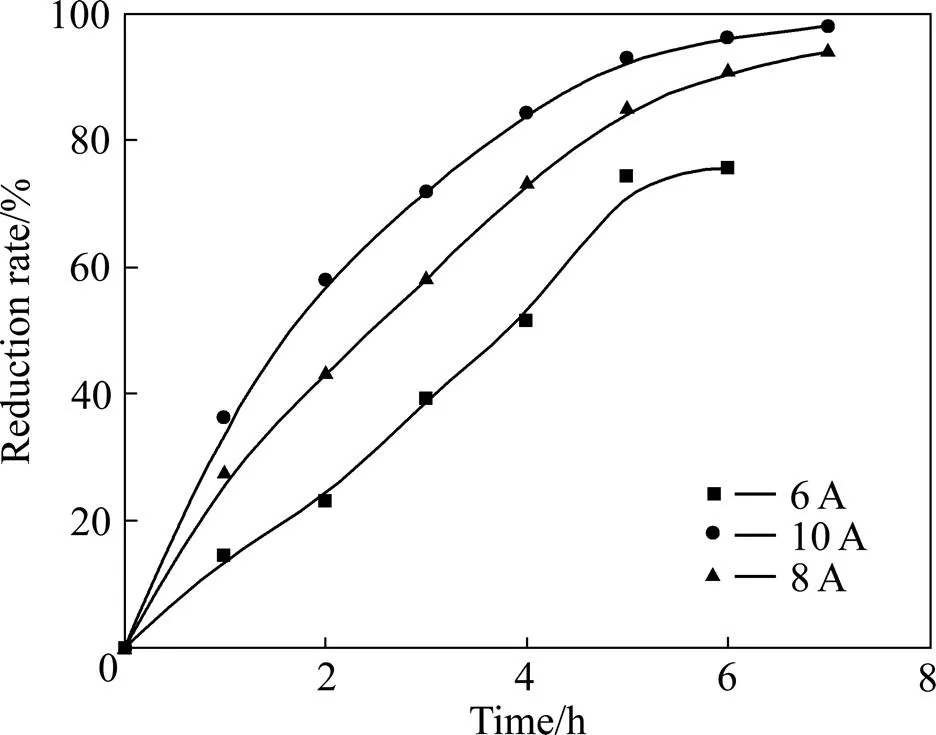
图5 不同电流下铕还原率与还原时间的关系
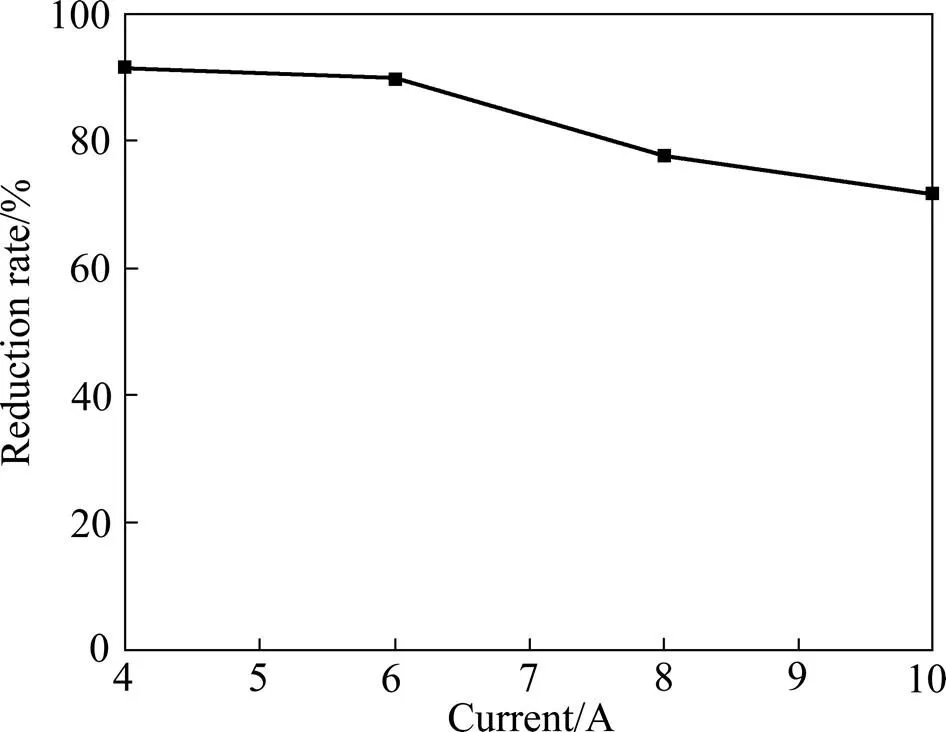
图6 还原电流效率与电流的关系(电解3 h)
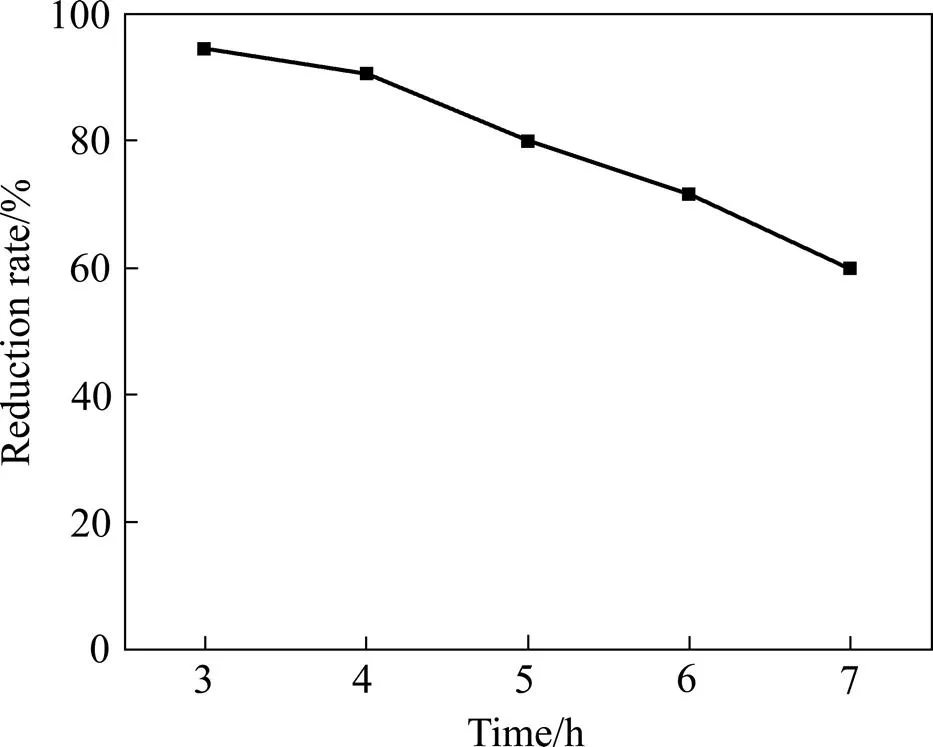
图7 还原电流效率与电解还原时间的关系
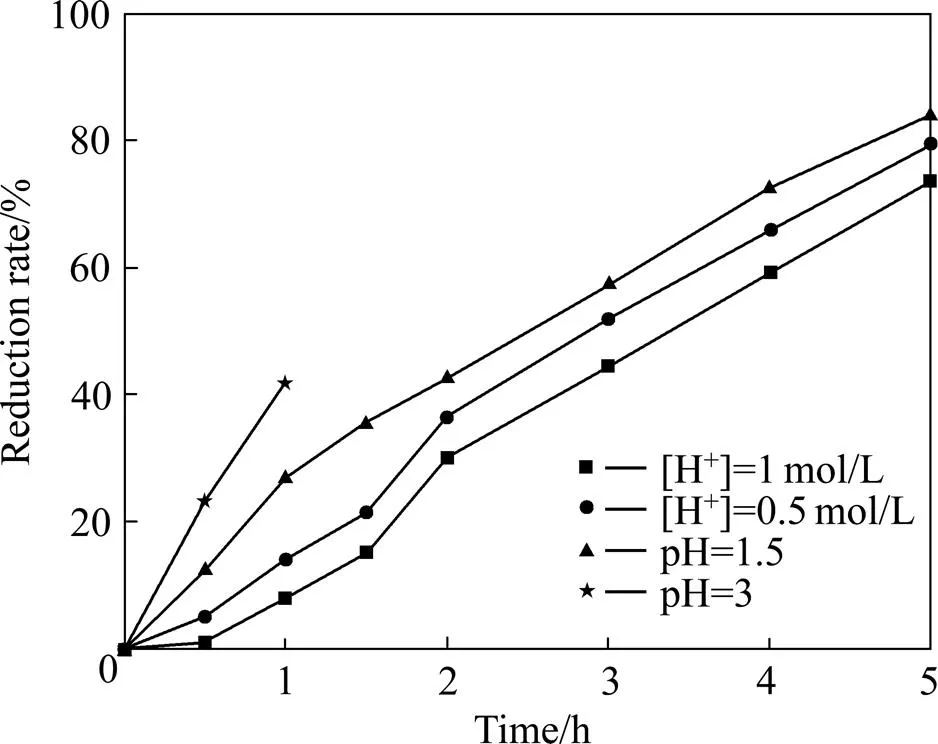
图8 阴极料液酸度与电解还原率的关系
电解条件如下:阳极液为HCl,[H+]=0.43 mol/L,铱系多元混合物涂层钛阳极,金属钛网阴极,电流8 A。在此条件下考察了不同铕浓度的纯氯化铕溶液的电解还原比较、阴极液为纯氯化铕溶液与富铕稀土料液的电解还原比较,结果见图9、10。由图9、10可知,铕浓度对电解还原几乎没有影响,阴极料液含杂质会影响电解还原率;虽然溶液中Eu3+浓度相同,但纯氯化铕的电解还原率明显好于富铕稀土料液的。
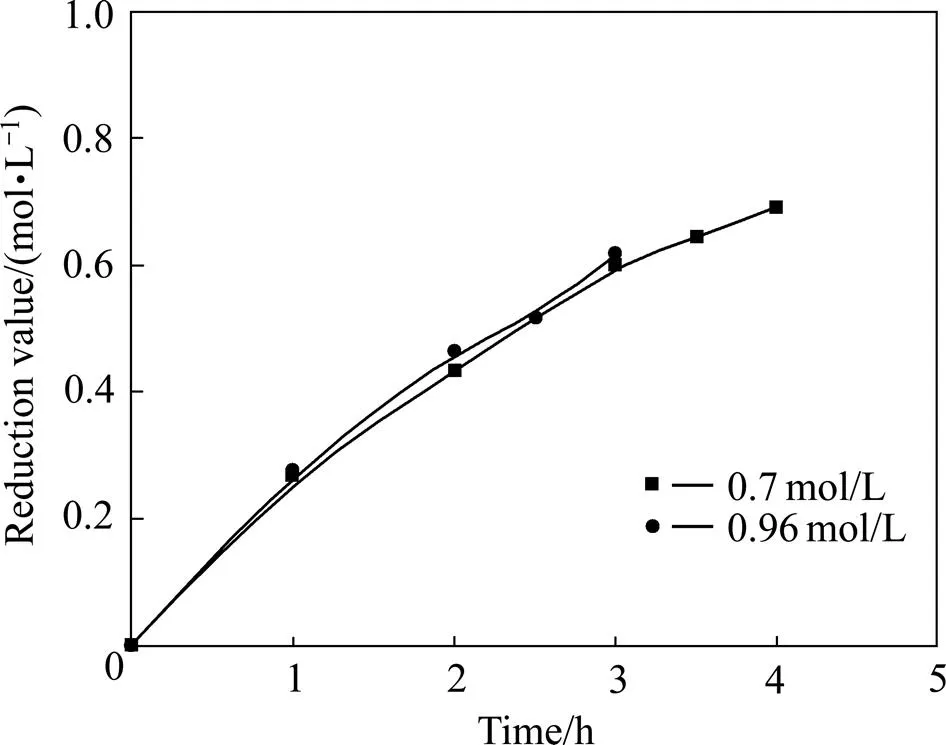
图9 不同铕浓度下的铕电解还原比较

图10 不同料液中铕还原率对比
电解条件如下:阴极液为纯氯化铕溶液,其中[Eu3+]=0.7 mol/L、pH=1.5,铱系多元混合物涂层钛阳极,金属钛网阴极,电流8 A。在此条件下考察了阳极液为纯盐酸溶液与氯化钙溶液的电解还原比较,阳极液酸度对电解的影响对电解的影响,结果见图11、12。当阳极液为HCl,[H+]=0.43 mol/L时的电解还原率明显低于阳极液为CaCl2,[Ca2+]=1 mol/L、[H+]=0.43 mol/L,主要原因为:当阳极液为HCl,[H+]=0.43 mol/L时,阳极液的离子浓度低于阴极液浓度,阳极液中的H+在浓差极化的作用下较难进入阴极室;当阳极液为CaCl2,[Ca2+]=1 mol/L、[H+]=0.43 mol/L时,阳极液的离子浓度高于于阴极液浓度,阳极液中的H+在电场的作用下较溶液进入阴极室,能维持阴极液体系的酸度。当阳极液为CaCl2,[Ca2+]=1 mol/L溶液时,阳极液的酸度对氧化铕的还原影响较大,当酸度太高或太低时,电解还原率不高,只有当酸度出于合适时,电解还原率才高。从前面的研究可知:阴极液的酸度对电解还原影响较大,阴极液酸度太高或太低时,电解还原率不高。当阳极液酸度太高时,进入阴极液的酸太多,导致阴极液酸度增加;当阳极液酸度太低时,进入阴极液的酸太少,导致阴极液酸度不够;因此,在电解过程中,H+会通过膜进入阴极室,影响阴极液的酸度从而影响电解还原。随着阳极液酸度降低,电解还原率和电流效率提高,但降低到一定程度时,阴极会出现沉淀,槽电压升高,影响电解的顺利进行。

图11 不同阳极液种类与电解还原率的关系

图12 阳极料液酸度与电解还原率的关系
综上所述,采用稀土冶炼企业的富铕料液作为阴极液,其中[RE3+]=1.0 mol/L、[Eu3+]=0.7 mol/L,阳极液为CaCl2溶液,其中[Ca2+]=1 mol/L、 [H+]=1.0 mol/L,铱系多元混合物涂层钛板为阳极,金属钛网为阴极,在电流12 A(即电流密度为500 A/m2时)下电解7.5 h,电解过程中阴极液清澈透明,无沉淀产生。电解过程槽电压变化如图13所示。由图13可看出,电解过程中,槽电压平稳。经分析计算:Eu3+的电解还原率大于95.5%,电解还原电流效率大于80%,铕的收率大于99.5%。
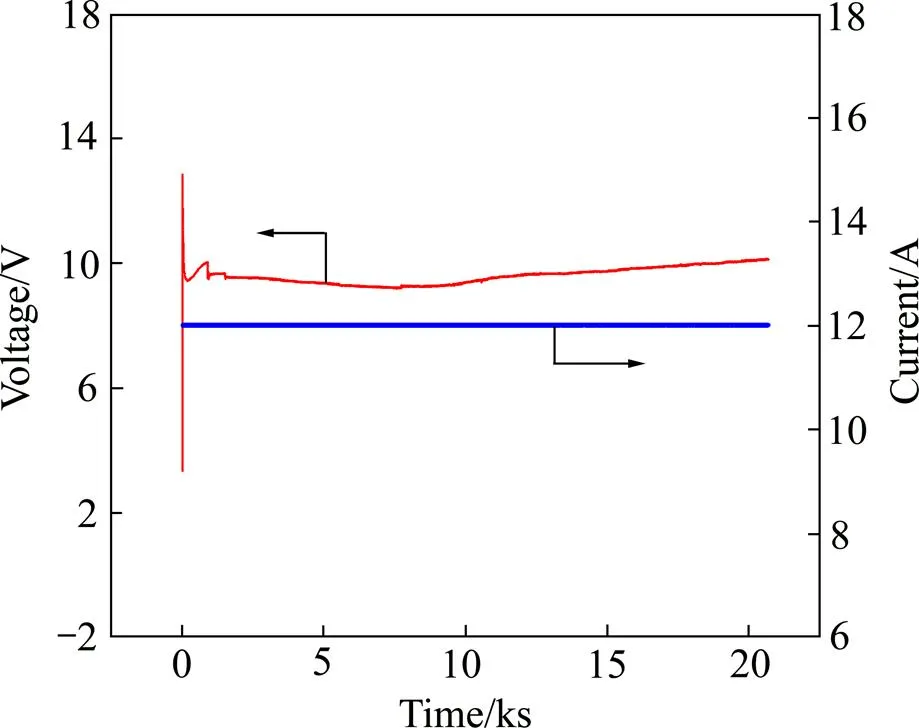
图13 电解过程槽电压随时间变化关系
2.5 连续动态还原工业化试验
工业化电解槽由有机玻璃材料加工而成,单槽 长×宽×高为500 mm×80 mm×630 mm。2 个有机玻璃单槽通过螺栓固定在一起,并将离子膜夹在两单槽中间;阴极板采用长×宽分别为380 mm×450 mm金属钛网;阳极板采用长×宽分别为380 mm×450 mm铱系多元混合物涂层钛阳极;在生产现场采用8级电解槽串联的连接方式,电极采用并联的方式连接;阴极液、阳极液流动采用并流的方式流动,设备连接图如图14所示。在生产现场将REO=1 mol/L,[Eu3+]=0.7 mol/L的富铕料液作为阴极液,CaCl2溶液(其中[Ca2+]=1 mol/L,[H+]=1.0 mol/L)作为阳极液,将阳极液和阴极液均按0.35 L/min的速度进入电解槽,单槽电流85 A进行电解,经过240 h连续运行,统计分析铕还原率大于94.3%。
3 结论
1) 在电流相同的情况下,铱系多元混合物涂层钛阳极(IT阳极)的析氯电位更高,较难析出氯气,比较适合作为阳极;金属钛耐腐蚀性强,并且氢超电位比较高,可以将Eu3+优先还原,随后再析氢,比较合适作为金属阴极。
2) 阳极液和阴极液的酸度对Eu3+的还原率影响较大。在采用钌系多元混合物涂层钛阳极、金属钛阴极、阳极液为含1 mol/L盐酸溶液的氯化钙溶液、阴极液为富铕料液的连续电解装置中,电流密度为500 A/m2时电解7.5 h, Eu3+的电解还原率大于95.5%,电解还原电流效率大于80%,电压稳定,无铕损失。经过工业化连续运行,Eu3+的电解还原率大于94%。

图14 连续动态还原工业化设备连接图
[1] 邵江娟, 高旭升, 王锦堂, 吴 昊. 稀土元素铕在生物技术领域的研究进展[J]. 生物加工过程, 2004, 2(1): 16−20. SHAO Jiang-juan, GAO Xu-sheng, WANG Jin-tang, WU Hao. Research progress on europium in the field of biotechnology[J]. Chinese Journal of Bioprocess Engineering. 2004, 2(1): 16−20.
[2] HAN Wei-wei, SHEN Shi-hua, TAI Pei-dong. Proteome analysis of inhibitory effect of gadolinium on sinorhizobium fredii[J]. Journal of Rare Earths, 2007, 25(1): 106−110.
[3] COOPER M E, SAMMES P G. Synthesis and spectral properties of a new luminescent europium(Ⅲ) terpyridyl chelate[J]. Perkin Transactions, 2000, 8(8):1695−1700.
[4] ZHAO Yan-zhong, ZHU Jun, ZHU Shai-hong, HUANG Yan-yan, LI Zhi-you, ZHOU Ke-chao. Synthesis and characterization of arginine-modified and europium-doped hydroxyapatite nanoparticle and its cell viability[J]. Transactions of Nonferrous Metals Society of China, 2011, 21(8): 1773−1778.
[5] 刘建刚. 电化学在稀土湿法冶金中的应用——Ⅱ. 铕的电解还原及分离工艺[J]. 稀土, 1996, 17(3): 51−56. LIU Jian-gang. Application of electro-chemistry in hydrometallurgy of rare earth—Ⅱ. Electrolysis Reduction and refining of europium[J]. Chinese Rare Earth, 1996, 17(3): 51−56.
[6] 王玫玫, 张其昕. Zn2+在电解还原铕(Ⅲ)过程中的催化行为研究[J]. 福建师范大学学报(自然科学版), 1992, 8(4): 64−68. WANG Mei-mei, ZHANG Qi-xin. Study on the catalytical action of zinc(Ⅱ) ion in the electrolytic reduction of europium(Ⅲ)[J]. Journal of FuJian Normal University, 1992, 8(4): 64−68.
[7] 刘柏峰, 董绍俊.稀土元素的汞阴极电解—钐、铕和镱在钙汞齐电极上的电沉积[J]. 化学通报, 1980(8): 20−22.LIU Bai-feng, DONG Shao-jun. Electrolysis of rare earth by mercury cathode—Electrodeposition of Sm, Eu and Yb by Ca-amalgam electrode[J]. Chemistry Online, 1980(8): 20−22.
[8] 韩旗英, 杨金华, 李景芬. 高纯氧化铕分离提纯工艺综述[J]. 湖南有色金属, 2012, 28(6): 26−29.HAN Qi-ying, YANG Jin-hua, LI Jing-fen. The review of high-purity europium oxide purification technology[J]. HuNan Nonferrous Metals, 2012, 28(6): 26−29.
[9] 刘 俊, 邰德荣, 曲宏甫.衫(Ⅲ)、铕(Ⅲ)、钆(Ⅲ)盐酸水溶液连续循环流动体系中铕(Ⅲ)的电解还原特性研究[J].稀土, 1994, 15(1): 9−13. LIU Jun, TAI De-rong, Qu Hong-pu. Study on electrolysis reducing characteristic of europium in Sm(Ⅲ)-Eu(Ⅲ)-Gd(Ⅲ) hydrochloride solution continuously cycling system[J]. Chinese Rare Earth, 1994, 15(1): 9−13.
[10] 邰德荣, 凌小平, 马栩泉. 铕的电化学还原动力学研究(Ⅰ): 铕在阴极上还原的极化特性[J]. 中国稀土学报, 1993, 11(3): 209−213. TAI De-rong, LING Xiao-ping, MA Xu-quan. Study of electrochemistry reduction dynamicsⅠ: Reduction polarization characteristic of europium on cathode[J]. Journal of the Chinese Rare Earth Society, 1993, 11(3): 209−213.
[11] 董绍俊, 李振祥, 唐功本, 赵喜鸾, 崔秀珍, 阎学伟. 一种还原铕的新方法[J]. 化学通报, 1980(5): 29−32. DONG Shao-jun, LI Zhen-xiang, TANG Gong-ben, ZHAO Xi-luan, CUI Xiu-zhen, YAN Xue-wei. A new process of reducing europium[J]. Chemistry Online, 1980(5): 29−32.
[12] 王秀艳, 刘建刚. 电解还原碱度法提铕[J]. 稀土, 2001, 22(6): 73−75. WANG Xiu-yan, LIU Jian-gang. Study on electro-reduction europium[J]. Chinese Rare Earths, 2001, 22(6): 73−75.
[13] 吴鹏超, 张 馨. 稀土铕离子的氧化还原性研究[J]. 内蒙古石油化工, 2011(4): 21−22. WU Peng-chao, ZHANG Xin. Study on the oxidation-reduction of rare earth europium ion[J]. Inner Mongolia Petrochemical Industry, 2011(4): 21−22.
[14] 金林培, 吴仲达. 铕(Ⅱ)的电解制备和电极过程的研究[J]. 北京师范大学学报, 1981(3): 53−59. JIN Lin-pei, WU Zhong-da. Study of electrolysis preparation and electrode process on europium(Ⅱ)[J]. Journal of Beijing Normal University, 1981(3): 53−59.
[15] 邰德荣, 凌小平, 马栩泉. 铕的电化学还原动力学研究(Ⅱ)[J]. 中国稀土学报, 1993, 11(4): 301−306. TAI De-rong, LING Xiao-ping, MA Xu-quan. Study of electrochemistry reduction dynamics (Ⅱ)[J]. Journal of the Chinese Rare Earth Society, 1993, 11(4): 301−306.
[16] 刘志强, 邱显扬, 朱 薇, 郭秋松. 一种电解还原铕的方法: 中国, ZL201210561672.0[P]. 2015−07−01.LIU Zhi-qiang, QIU Xian-yang, ZHU Wei, GUO Qiu-song. A process of electrolysis reducing europium: China, ZL201210561672.0[P]. 2015−07−01.
Electrochemical reduction of Eu3+using ion-exchange membrane
ZHU Wei, LIU Zhi-qiang, LI Wei, ZHANG Kui-fang
(Guangdong Province Research Institute of Rare Metals, Guangdong Province Key Laboratory of Rare Earth Development and Application, Guangzhou 510650, China)
Electrolysis of Eu3+solution using ion-exchange membrane was studied to achieve the reduction of Eu3+. Effects of electrode type (anode and cathode), electrolyte composition (anode and cathode electrolyte), acidity and electrolytic process parameters on reduction of Eu3+were investigated. The favored conditions were determined. The result shows that ruthenium based multi-component mixture coated titanium anode, Ti cathode, calcium chloride solution containing 1 mol/L hydrochloric acid anolyte, rich europium compound catholyte, current density of 500 A/m2, electrolysis time of 7.5 h. The best result of Eu3+reduction rate could be as high as 95.5% and the current efficiency is more than 80% in this work, below the premise of stable cell voltage and no loss of europium. Moreover, reduction rate of Eu3+is more than 94% in continuous industrial operation.
rare earth; ion-exchange membrane electrolysis; reduction; europium
(编辑 王 超)
Project(2012CBA01200) supported by the National Basic Research Development Program of China; Projects(2015B010105010, 2016B070701022) supported by Guangdong Science and Technology Plan, China
2016-02-20; Accepted date:2016-06-30
LIU Zhi-qiang; Tel: +86-20-37238410; E-mail: lzqgd168@126.com
1004-0609(2017)-02-0371-08
TF845
A
国家重点基础研究发展计划项目(2012CBA01200);广东省科技计划项目(2015B010105010,2016B070701022)
2016-02-20;
2016-06-30
刘志强,教授级高工;电话:020-37238410;E-mail:lzqgd168@126.com
