阴炎净洗剂对大鼠接触性皮炎湿疹的防治作用及机制研究Δ
2017-10-13肖作奇欧阳波肖素希潘涛湖南省妇幼保健院药学制剂部长沙40008中南民族大学生物医学工程学院武汉430074
肖作奇,欧阳波,肖素希,潘涛(.湖南省妇幼保健院药学制剂部,长沙40008;.中南民族大学生物医学工程学院,武汉 430074)
阴炎净洗剂对大鼠接触性皮炎湿疹的防治作用及机制研究Δ
肖作奇1*,欧阳波1#,肖素希2,潘涛1(1.湖南省妇幼保健院药学制剂部,长沙410008;2.中南民族大学生物医学工程学院,武汉 430074)
目的:研究阴炎净洗剂对大鼠接触性皮炎湿疹(ACD)的防治作用及机制。方法:将60只大鼠随机分为空白对照组、模型对照组、阳性对照组(地塞米松)和阴炎净洗剂高、中、低剂量组(分别给予2倍浓缩液、1倍浓缩液和原液),每组10只。除空白对照组外,其余各组大鼠均于腹、背(2 cm×2 cm)部涂布二硝基氯苯复制ACD模型。从造模第9天起,各给药组大鼠背部涂布相应药物100µL,空白对照组和模型对照组大鼠涂布纯化水100µL,每天给药3次,连续10 d。给药结束后,对皮肤变应性反应进行评分并测定皮肤肿胀度;采用苏木精-伊红染色观察皮肤病理变化;采用酶联免疫吸附法测定血清中白细胞介素2(IL-2)、IL-4、IL-6和干扰素γ(IFN-γ)含量。结果:与空白对照组比较,模型对照组大鼠变应性反应评分和皮肤肿胀度均显著升高(P<0.01);电镜下可见表皮结痂坏死、真皮层损伤严重、毛囊坏死;血清中IL-2、IL-4、IFN-γ含量显著增加(P<0.05或P<0.01),IL-6含量略有增加(P>0.05)。与模型对照组比较,除阴炎净洗剂低剂量组大鼠皮肤肿胀度、血清中IL-4含量以及各给药组大鼠血清中IL-6含量改善不显著外,其余指标均显著改善(P<0.05或P<0.01)。结论:阴炎净洗剂对大鼠ACD具有一定的防治作用,其机制可能与降低血清中IL-2、IL-4、IFN-γ含量有关。
阴炎净;接触性皮炎湿疹;白细胞介素;干扰素γ;大鼠
接触性皮炎湿疹(ACD)是临床常见的一种皮肤变态反应性疾病,表现为皮肤红肿、结痂或苔藓化,严重者伴有皮肤坏死[1]。国内外对于ACD的发病机制已有广泛研究,认为其主要是T淋巴细胞激活导致的免疫炎症反应,涉及白细胞介素2(IL-2)、IL-4、IL-17等炎症因子的激活与敏化[2]。目前,主要用于ACD治疗的药物有氯地松、地塞米松等糖皮质激素类[3-4]和阿奇霉素等抗生素类[2]消毒止痒的化学药品。而阴炎净洗剂(湖南省妇幼保健院院内制剂)是一种由蛇床子、地肤子、黄连、连翘、苦参等9味中药组成的复方洗剂,其特点是作用温和、毒副作用小,临床主要用于妇科炎症治疗及妇产科护理中,但医师在临床工作中发现其对新生儿ACD有明显疗效。然而,阴炎净洗剂对ACD的治疗作用还缺乏药理学实验支持。因此,本研究通过复制大鼠ACD模型,考察阴炎净洗剂在皮炎湿疹类疾病中的抗炎作用并初步探讨其作用机制,为该药的进一步开发和应用提供实验基础。
1 材料
1.1 仪器
3020-353酶标仪、D-34520高速离心机(美国Thermo Fisher Scientific公司);DP72显微成像系统(日本Olympus公司);CP114电子天平(美国OHaus公司)。
1.2 药品与试剂
阴炎净洗剂(由湖南省妇幼保健院提供,批号:201612001,规格:250 mL/瓶);地塞米松磷酸钠注射液(辰欣药业股份有限公司,批号:160502211,规格:1 mL∶5 mg);2,4-二硝基氯苯(DNCB,山东西亚化学股份有限公司,批号:W5656,临用时配成1%和7%丙酮溶液);大鼠IL-2、IL-4、IL-6和干扰素γ(IFN-γ)酶联免疫吸附(ELISA)试剂盒(北京雅安达生物技术有限公司,批号均为:20161204)。
1.3 动物
SPF级SD大鼠60只,♀♂各半,鼠龄18 d,体质量40~50 g,购自湖北省实验动物研究中心(合格证书编号:42000600019184)。将大鼠分笼饲养于12 h明暗交替的环境中,环境温度为18~21℃、相对湿度为(50±5)%,标准饲料喂养,可自由摄食、饮水。在适应性喂养1周后开始实验。
2 方法
2.1 分组、造模与给药
将60只大鼠随机分为6组,每组10只。分别为空白对照组、模型对照组、阳性对照组和阴炎净洗剂高、中、低剂量组。除空白对照组外,其余各组大鼠在给药前1 d均用电动剃毛刀去除腹部(2 cm×2 cm)的鼠毛,然后均匀涂布7%的DNCB丙酮溶液50 μL致敏;24 h后再用1%的DNCB丙酮溶液50 μL强化刺激;造模第5天时,除去大鼠背部(2 cm×2 cm)的鼠毛,并用1%的DNCB丙酮溶液50 μL致敏,然后每隔3 d重复敏化,一共3次。空白对照组大鼠采用不含DNCB的丙酮溶液给药,其余操作相同。从造模第9天开始,空白对照组和模型对照组大鼠涂布纯化水,阳性对照组大鼠涂布地塞米松注射液,阴炎净洗剂高、中、低剂量组大鼠分别涂布阴炎净洗剂2倍、1倍浓溶液和原液,每天早、中、晚各给药1次,给药剂量为100 μL,连续给药10 d。
2.2 皮肤变应性反应评分及皮肤肿胀度测定
大鼠在造模后给药前以及给药10 d后,均采用EASI评估方案[5]进行皮肤变应性反应评估评分:严重红肿并有苔藓化丘疹溃烂者,记4分;中度红肿,结痂,无溃烂、苔藓化者,记3分;有红肿但无丘疹者,记2分;轻度红肿者,记1分;无明显病变者,记0分。并在给药10 d后,用无菌手术煎分别煎下炎症区皮肤和对应侧健康皮肤,用打孔器分别取1 cm×1 cm的皮肤,用电子分析天平称质量并记录,以炎症皮肤质量与健康皮肤质量之差表示皮肤肿胀度。
2.3 皮肤的病理观察
将大鼠断头处死,取血并用手术剪取一小块给药部位中间部分的皮肤,置于培养皿中,用包埋剂OTC胶包埋,-40℃保存,冷冻切片(7 μm)。切片用甲醇洗脱30 s,甩干,行苏木精-伊红(HE)染色,显微成像系统下观察皮肤病理变化。
2.4 血清指标检测
将血样于室温下静置20 min,然后在4℃条件下以离心半径为10 cm、3 000 r/min离心10 min取血清,剔除溶血样本。每组选取6只大鼠的血清样本,每个样本400 μL,分装成每管 100 μL,-80 ℃冻存。严格按照ELISA试剂盒说明书操作步骤进行试验,检测血清中IL-2、IL-4、IL-6、IFN-γ的含量。
2.5 统计学方法
3 结果
3.1 皮肤变应性反应评分与肿胀度测定结果
3.1.1 皮肤变应性反应评分结果 空白对照组大鼠给药前、后均无病变,评分均为0;其余各组大鼠在造模后给药前均可见典型的变应性反应特征,造模成功率为100%。在给药10 d后,各给药组大鼠皮肤的变应性反应均得到明显改善,变应性反应评分较模型对照组大鼠均显著降低(P<0.01)。给药前后各组大鼠皮肤病变照片见图1,给药后评分结果见表1。

图1 各组大鼠皮肤病理变化的肉眼观察结果Fig 1 Results of pathological changes of skin of rats by visual observation in each group
3.1.2 皮肤肿胀度测定结果 与空白对照组比较,其余各组大鼠的皮肤肿胀度均不同程度升高,除阴炎净洗剂高剂量组外差异均有统计学差异(P<0.01);与模型对照组比较,各给药组大鼠的皮肤肿胀度均有不同程度降低,除阴炎净洗剂低剂量组外差异均有统计学意义(P<0.05或P<0.01),结果见表1。
表1 各组大鼠变应性反应评分和皮肤肿胀度结果(±s)Tab 1 Results of allergic reaction scores and skin swelling degree of rats in each group(±s)
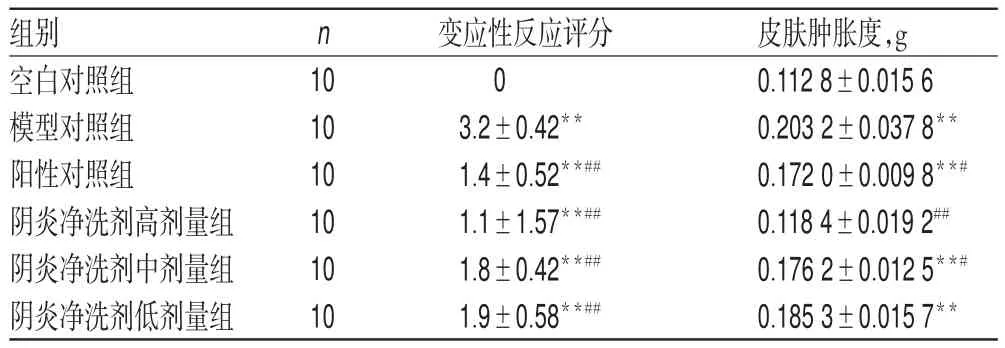
表1 各组大鼠变应性反应评分和皮肤肿胀度结果(±s)Tab 1 Results of allergic reaction scores and skin swelling degree of rats in each group(±s)
注:与空白对照组比较,**P<0.01;与模型对照组比较,#P<0.05,##P<0.01Note:vs.blank control group,**P<0.01;vs.model control group,#P<0.05,##P<0.01
组别空白对照组模型对照组阳性对照组阴炎净洗剂高剂量组阴炎净洗剂中剂量组阴炎净洗剂低剂量组皮肤肿胀度,g 0.112 8±0.015 6 0.203 2±0.037 8**0.172 0±0.009 8**#0.118 4±0.019 2##0.176 2±0.012 5**#0.185 3±0.015 7**n 10 10 10 10 10 10变应性反应评分0 3.2±0.42**1.4±0.52**##1.1±1.57**##1.8±0.42**##1.9±0.58**##
3.2 HE染色后皮肤病理变化的观察结果
与空白对照组比较,模型对照组大鼠的皮肤病理切片可见显著表皮结痂坏死,真皮层损伤严重,毛囊坏死。与模型对照组比较,阴炎净洗剂高剂量组大鼠皮肤明显愈合;阳性对照组和阴炎净洗剂中、低剂量组大鼠的皮肤愈合程度略差,可见表皮层坏死、难以区分真皮与表皮层,但是也有显著改善,结果见图2。
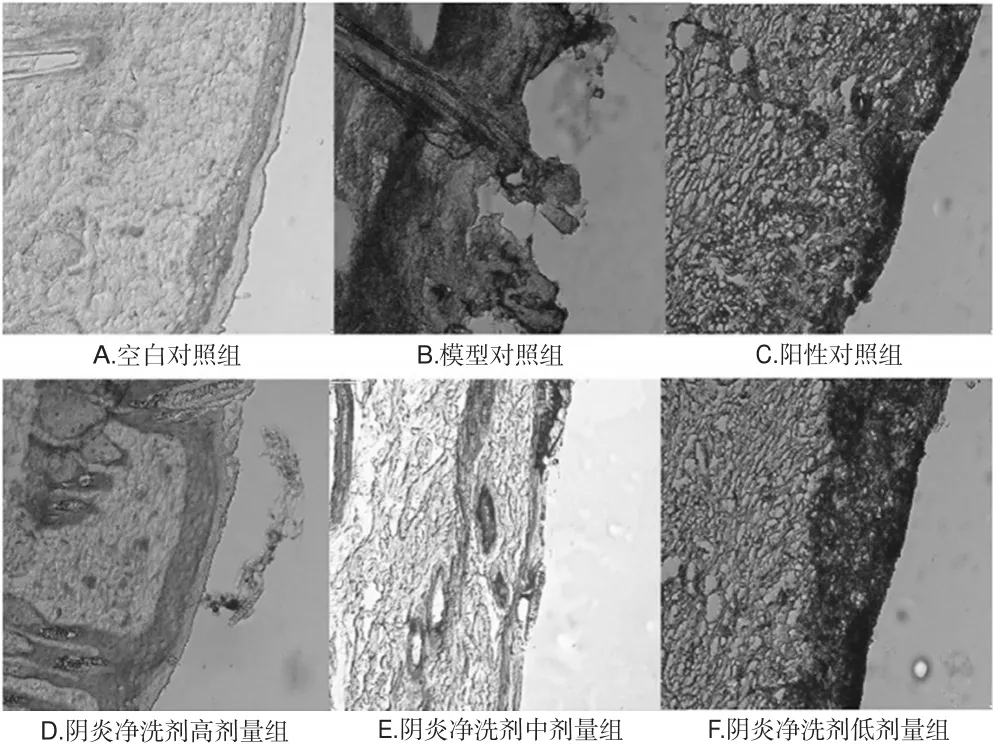
图2 各组大鼠皮肤病理变化的电镜观察结果(HE,×200)Fig 2 Results of pathological changes of skin of rats by electron microscopy in each group(HE,×200)
3.3 血清指标检测结果
与空白对照组比较,模型对照组大鼠血清中IL-4明显升高,地塞米松注射液和中、高剂量阴炎净洗剂能显著降低血清中IL-4含量(P<0.05),而低剂量阴炎净洗剂作用不明显。与模型对照组比较,各给药组大鼠血清中IL-2、IFN-γ含量均显著降低(P<0.05或P<0.01);IL-6含量略有上调,但差异无统计学意义(P>0.05),测定结果见图3。
4 讨论

图3 各组大鼠血清中IL-2、IL-4、IL-6和IFN-γ含量测定结果(±s,n=6)Fig 3 Determination results of contents of IL-2,IL-4,IL-6,IFN-γ in serum of rats in each group(±s,n=6)
ACD模型是较为常见的一种研究皮炎湿疹的动物模型。DNCB诱发的ACD模型具有成功率高、重复性好等特点[6]。为了更接近反映阴炎净洗剂对成年群体湿疹疾病的治疗作用,笔者选用18日龄的未成年大鼠作为研究对象[7]。
治疗皮炎湿疹的传统中草药有很多,治疗手段有内服、外用以及针灸。但是各种中药疗效不一,且对其药理机制的阐述不是很清楚[8]。李传应等[9]研究白芍总苷对慢性皮炎湿疹的抗炎作用,提出其作用机制是降低ACD模型小鼠血清中IL-2、IL-4水平,且认为其联合糖皮质激素给药疗效最佳;何文凤等[10]则认为变态反应性皮炎主要是受白三烯(LT)受体和凋亡相关的半胱氨酸蛋白激酶14(Caspase-14)的影响;还有文献报道,陈皮苷喂食可以明显抑制DNFB诱发的皮炎,并认为这是一种抗过敏机制[11]。以上研究均提示,中药提取物治疗皮炎湿疹可能是通过多层次、多靶点的作用,但主要是从抗炎和抗过敏机制两个方面进行探究。本研究主要通过初步考察阴炎净洗剂在治疗ACD中的抗炎作用,其抗过敏机制及更多作用在后续研究中有待进一步完善。
据报道,ACD的发病机制为特异性的刺激引起皮肤内CD8+杀伤细胞1/杀伤细胞17(Tc1/Tc17)和 CD4+T辅助细胞1/T辅助细胞17(Th1/Th17)细胞群激活,释放IL-6、TNF-α、IL-18等炎性因子入血[12],同时Th1和Th2细胞均能产生IL-2、IL-4和IFN-γ,从而导致炎症发生[13-14]。本研究结果表明,阴炎净洗剂能显著改善ACD大鼠的皮肤变应性反应,且以高剂量组的治疗效果尤为显著,疗效优于糖皮质激素类药物地塞米松。并且从ELISA检测结果看,阴炎净洗剂能调节大鼠血清中IL-2、IL-4、IL-6和IFN-γ含量,使给药后的上述血清指标含量趋于正常值。
综上所述,阴炎净洗剂对ACD具有较好的疗效,且高剂量的作用效果优于地塞米松。其作用机制可能与降低ACD大鼠血清中IL-2、IL-4和IFN-γ含量有关。
[1] Martin SF,Esser PR,Weber FC,et al.Mechanisms of chemical-induced innate immunity in allergic contact dermatitis[J].Allergy,2011,66(9):1152-1163.
[2] 杨登友.阴炎净与络合碘外涂治疗与护理新生儿皮疹80例[J].中医药导报,2010,16(10):97-98.
[3] 季蔚青,李惠仙.氯地松乳膏治疗皮炎湿疹类皮肤病的临床疗效评价[J].中国药房,2013,24(6):532-533.
[4] 周惠雅,杜华艳,殷湘洁.地塞米松注射液湿敷治疗PICC置管处湿疹的效果观察[J].医疗装备,2015(3):51-52.
[5] Germolec DR,Nyska A,Kashon M,et al.Extended histopathology in immunotoxicity testing:interlaboratory validation studies[J].Toxicol Sci,2004,78(1):107-115.
[6] Zhang EY,Chen AY,Zhu BT.Mechanism of dinitrochlorobenzene-induced dermatitis in mice:role of specific antibodies in pathogenesis[J].PLoS One,2009,doi:10.1371/journal.pone.0007703.
[7] Andreollo NA,Santos EF,Araújo MR,et al.Rat’s age versus human’s age:what is the relationship?[J].Arq Bras Cir Dig,2012,25(1):49-51.
[8] 王欣,孟丽华.特应性皮炎中医治疗进展与展望[J].中医药临床杂志,2005,17(3):309-311.
[9] 李传应,王春,魏伟.白芍总苷对小鼠慢性皮炎-湿疹的治疗作用及其部分机制[J].中国药理学通报,2008,24(10):1366-1369.
[10] 何文凤,屈双擎,霍春波,等.复方苦参止痒霜对变态反应性皮炎大鼠模型血清中白三烯B4及皮损部位炎性反应的影响[J].中华中医药杂志,2015,30(10):3726-3728.
[11] 冯宝民,蒋革,贾景明,等.柚皮苷和新橙皮苷抗过敏作用的研究[J].大连大学学报,2005,26(4):63-64.
[12] Martin SF,Esser PR,Weber FC,et al.Mechanisms of chemical-induced innate immunity in allergic contact dermatitis[J].Allergy,2011,66(9):1152-1163.
[13] Jacobs MJ,van den Hoek AE,van Lent PL,et al.Role of IL-2 and IL-4 in exacerbations of murine antigen-induced arthritis[J].Immunology,1994,83(3):390-396.
[14] 李春联,王学民.DNCB诱发小鼠耳肿胀与组织内IL-4和IFN-γ的相关性[J].中国皮肤性病学杂志,2013,27(7):667-669.
Study on the Prevention and Treatment Effect and Its Mechanism of Yinyanjing Lotion on Allergic Contact Dermatitis in Rats
XIAO Zuoqi1,OUYANG Bo1,XIAO Suxi2,PAN Tao1(1.Dept.of Pharmaceutical Preparations,Hunan Provincial Maternal and Child Health Care Hospital,Changsha 410008,China;2.College of Biomedical Engineering,South-central University for Nationalities,Wuhan 430074,China)
OBJECTIVE:To study the prevention and treatment effect and its mechanism of Yinyanjing lotion on allergic contact dermatitis(ACD)in rats.METHODS:60 rats were randomly divided into blank control group,model control group,positive control group(dexamethasone)and Yinyanjing lotion high-dose,medium-dose,low-dose groups(respectively given 2-fold concentrated solution,1-fold concentrated solution and original solution),10 in each group.Except for blank control group,rats in other groups smeared dinitrochlorobenzene in the abdomen and back(2 cm×2 cm)to induce ACD model.From the 9th of modeling,rats in each administration group were smeared 100 µL of related drugs in the back,and rats in blank control group and model control group smeared 100 µL of purified water,3 times a day,for 10 d.After administration,skin allergic reaction was scored and skin swelling degree was determined.HE staining was used to observe the pathological changes of skin.Enzyme-linked immunosorbent method was used to detect the contents of interleukin-2(IL-2),IL-4,IL-6 and interferon γ(IFN-γ)in serum.RESULTS:Compared with blank control group,allergic reaction scores and skin swelling degree in model control group were significantly increased(P<0.01).Electron microscopy showed epidermal scab necrosis,dermal layer damage,hair follicle necrosis.Contents of IL-2,IL-4,IFN-γ in serum were significantly increased(P<0.05 or P<0.01);IL-6 content was slightly increased(P>0.05).Compared with model control group,except that the skin swelling degree,IL-4 content in serum in Yinyanjing lotion low-dose group and IL-6 content in serum in each administration group were not significantly improved,other indexes were significantly improved(P<0.05 or P<0.01).CONCLUSIONS:Yinyanjing lotion has certain prevention and treatment effects on ACD in rats,the mechanism may be associated with reducing the contents of IL-2,IL-4,IFN-γ in serum.
Yinyanjing;Allergic contact dermatitis;Interleukin;Interferon γ;Rats
R285
A
1001-0408(2017)28-3931-04
2017-02-28
2017-05-15)
(编辑:林 静)
湖南省中医药科研计划项目(No.201671)
*主管药师,博士。研究方向:中药物质基础及活性研究。电话:0731-84332262。E-mail:xiaozuoqi87@126.com
#通信作者:副主任药师。研究方向:中药研究与开发。电话:0731-88905700。E-mail:1050495772@qq.com
DOI 10.6039/j.issn.1001-0408.2017.28.12
