基于化学成分临床利用量的郁金质量评价研究
2017-10-12刘晓凤蒋天宇徐滕达
刘晓凤, 蒋天宇, 徐滕达, 寇 强, 刘 涛
(1.四川天一学院, 四川 绵竹 618200; 2.成都大学 药学与生物工程学院, 四川 成都 610106)
基于化学成分临床利用量的郁金质量评价研究
刘晓凤1, 蒋天宇2, 徐滕达2, 寇 强2, 刘 涛2
(1.四川天一学院, 四川 绵竹 618200; 2.成都大学 药学与生物工程学院, 四川 成都 610106)
目的:通过姜黄素的临床利用量对郁金的品质进行评价研究.方法:采用单因素实验法考察郁金药材中姜黄素含量的测定方法,设计正交实验优选郁金中姜黄素的最佳提取工艺,根据最佳提取工艺采用HPLC法测定多批不同产地郁金中姜黄素的含量,从而计算其临床利用量对药材进行质量评价.结果:姜黄素含量测定供试品制备方法为取细粉2 g,加入20 mL甲醇,超声提取30 min;郁金姜黄素最佳提取工艺为药材加10倍量的60%乙醇提取3次,每次2 h.姜黄素的临床利用量与药材的真实含量呈正相关.结论:本研究建立的方法重视临床效果,体现了中医药特色,为郁金及其他中药材质量评价研究提供了一种新的思路.
郁金;临床利用量;质量评价
0 引 言
郁金为姜科植物温郁金、姜黄、广西莪术或蓬羲术的干燥块根,前两者分别称为“温郁金”和“黄丝郁金”,后两者按性状不同称为“桂郁金”或“绿丝郁金”[1].据相关文献报道,郁金的主要成分为姜黄素、挥发油等,其中姜黄素具有抗肿瘤、抗炎、抗菌、抗氧化等多种药理作用,且毒性较低,具有良好的临床应用潜力[2-6].
目前,业内主要采用以化学有效成分的量为指标的评价模式对中药材的品质进行评价,但有研究表明,以化学成分含量高低对药材品质评价的方法,与其是否在临床中被应用相关性不强,且存在一些缺陷,如药材中某些成分含量虽然较高,但提取转移率不高或不稳定,导致“质优用劣”的现象发生[7].化学成分临床利用量,是指在临床应用时,药材中的主要成分可被临床使用的量.对此,本研究以姜黄素的临床利用量对不同产地的郁金药材进行品质评价,希望对郁金药材质量控制及临床应用提供一定的参考.
1 仪器与试药
1)实验所用仪器.iChrom P5100型高效液相色谱仪(大连依利特分析仪器有限公司),FA2004型电子分析天平(上海良平仪器仪表有限公司),KQ-100E型超声波清洗器(昆山市超声仪器有限公司),HH-S6型电热恒温水浴锅(北京科伟永兴仪器有限公司).
2)实验所用试药.郁金,来自四川省中医药科学院,经成都大学刘涛研究员鉴定为姜科植物姜黄的干燥块根,即黄丝郁金;姜黄素对照品(批号,150824,HPLC>98%),购自成都植标化纯生物科技有限公司;甲醇与乙腈为色谱纯,水为怡宝纯净水,其余试剂均为分析纯.
2 方法与结果
2.1 色谱条件
实验的色谱条件为:色谱柱为Global Chromatography C18柱(250 mm×4.6 mm,5 μm);流动相为乙腈—4%冰乙酸溶液(48∶52);流速为1.0 mL/min;柱温为35 ℃;检测波长为430 nm;理论板数按姜黄素峰计算应不低于4 000[8-9].
2.2 对照品溶液的制备
称取姜黄素对照品适量,精密称定,置25 mL容量瓶中,加入甲醇溶解,并稀释至刻度,摇匀,配置成浓度为0.137 mg/mL对照品溶液.精密吸取上述溶液5 mL置25 mL容量瓶中,加入甲醇溶解,并稀释至刻度,摇匀,制得浓度为0.0137 mg/mL姜黄素对照品溶液.
2.3 供试品溶液的制备
2.3.1 提取方法考察.
称取黄丝郁金细粉(批号,20160409)4份, 每份约2 g,精密称定,分别置锥形瓶中,各精密加入甲醇20 mL,称定重量,分别加热回流60 min、超声提取60 min,放冷,再称定重量,用甲醇补足减失的重量,摇匀,过滤,精密移取续滤液1 mL置10 mL容量瓶中,用甲醇定容,摇匀,作为供试品并测定含量,结果见表1.

表1 提取方法考察结果
表1数据表明,利用回流法与超声法姜黄素含量相近,但超声法更便捷,故本实验优选超声法提取.
2.3.2 提取时间考察.
称取黄丝郁金细粉(批号,20160409)6份, 每份约2 g,精密称定, 分别置锥形瓶中,各精密加入甲醇20 mL, 称定重量,分别超声提取30、60、90 min,放冷, 再称定重量, 用甲醇补足减失的重量,摇匀, 过滤,精密移取续滤液1 mL置10 mL容量瓶中,用甲醇定容,摇匀, 作为供试品并测定含量, 结果见表2.
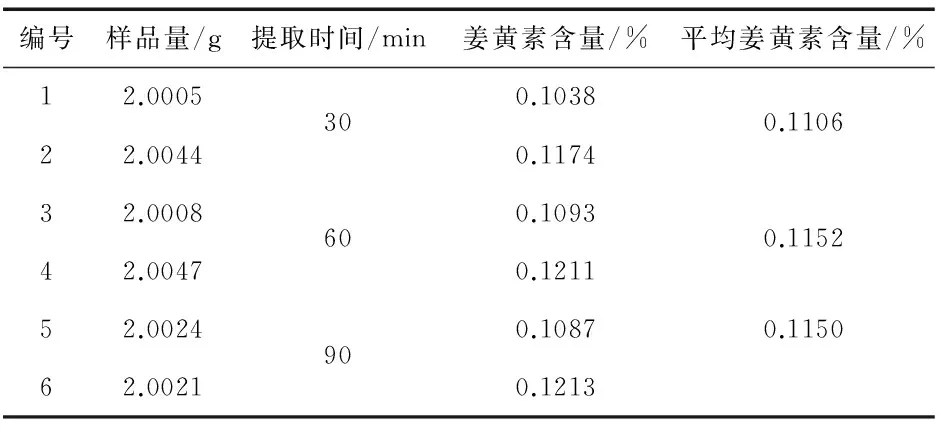
表2 提取时间考察结果
表2数据表明,在上述条件下超声提取30、60、90 min姜黄素含量相近,故本实验优选超声提取30 min.
2.3.3 提取溶媒考察.
称取黄丝郁金细粉(批号,20160409)8份,每份约2 g,精密称定,分别置锥形瓶中,各精密加入甲醇、70%甲醇、无水乙醇、乙醇各20 mL,称定重量,超声提取30 min,放冷,再称定重量,用溶媒补足减失的重量,摇匀,过滤,精密移取续滤液1 mL置10 mL容量瓶中,用甲醇定容,摇匀,作为供试品并测定含量,结果见表3.
表3数据表明,提取溶媒为甲醇时,姜黄素含量较高,故本实验优选甲醇为溶媒.
2.3.4 结 论
实验结果表明,郁金供试品溶液制备方法为,取黄丝郁金细粉约2 g,精密称定,置锥形瓶中,精密加入甲醇20 mL,称定重量,超声提取30 min,放冷,再称定重量,用甲醇补足减失的重量,摇匀,过滤,精密移取续滤液1 mL置10 mL容量瓶中,用甲醇定容至刻度,摇匀,作为供试品溶液.
3 方法学考察
3.1 线性考察
按“2.1”项下色谱条件,分别精密吸取对照品溶液2、4、6、8、10 μL进样,测定峰面积.以姜黄素对照品峰面积为纵坐标,进样量(μg)为横坐标,绘制标准曲线,计算得到回归方程为,Y=7789.5X+11.738,相关系数r=0.9999.结果表明,姜黄素对照品进样量在0.0274~0.1370 μg范围内与峰面积呈良好的线性关系.
3.2 精密度实验
按“2.1”项下色谱条件,每次精密吸取对照品溶液10 μL,注入高效液相色谱仪,测定5次.结果显示,姜黄素对照品峰面积RSD为0.58%,表明仪器精密度良好.
3.3 重复性实验
取同一批黄丝郁金细粉(批号,20160409)5份,每份约2 g,精密称定,分别按“2.3”项下供试品溶液制备方法处理后,按“2.1”项下色谱条件进行含量测定.结果显示,姜黄素供试品峰面积RSD为0.52%,表明本方法重复性良好.
3.4 稳定性实验
取黄丝郁金细粉(批号,20160409)约2 g,精密称定,按“2.3”项下供试品溶液制备方法处理后,按“2.1”项下色谱条件进行,精密吸取郁金供试品溶液10 μL,注入液相色谱仪,每隔1 h测定1次,考察8 h.结果显示,姜黄素供试品峰面积RSD为1.94%,表明,郁金供试品在8 h稳定.
3.5 加样回收率实验
称取已测含量的黄丝郁金药材细粉(批号,20160409)5份,每份约1 g,精密称定,各精密加入姜黄素对照品适量,分别按“2.3”项下供试品溶液制备方法处理,进行测定并计算回收率,结果见表4.结果显示,平均回收率为97.83%,RSD为3.85%.
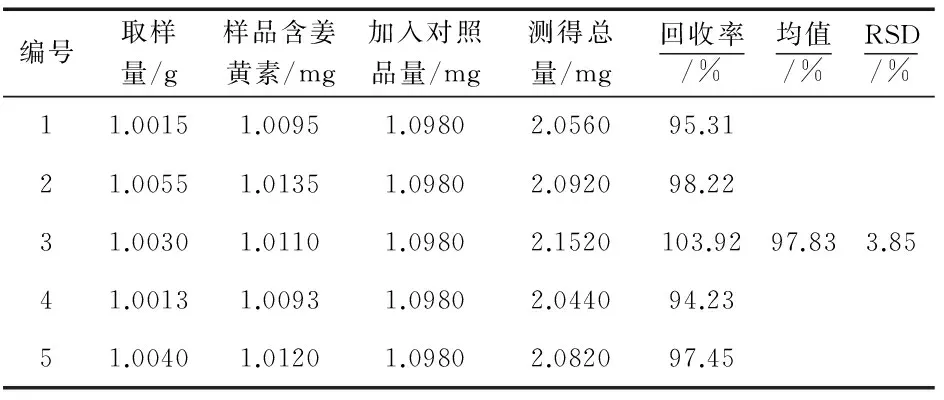
表4 加样回收率实验
4 多批样品含量测定
取不同批次黄丝郁金药材制按“2.3”项下供试品溶液制备方法处理后,分别进样测定姜黄素的含量,结果见表5.
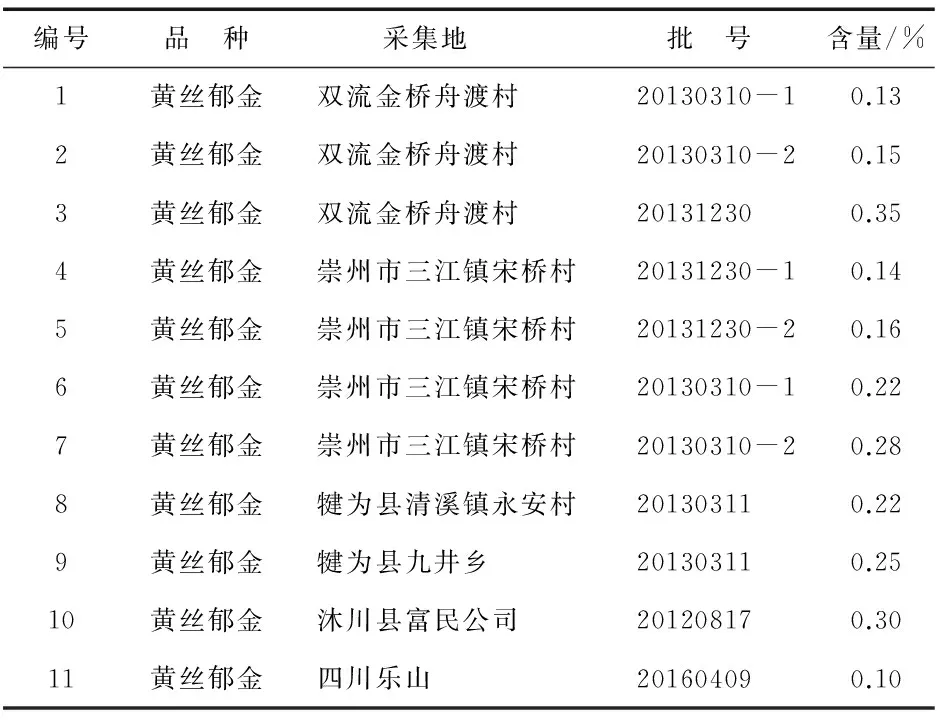
表5 多批样品含量测定
表5数据表明,不同产地或同一产地不同批次黄丝郁金中姜黄素含量存在明显差异,说明黄丝郁金品种品质良莠不齐,种质资源不稳定.据此,规定黄丝郁金中姜黄素含量应不低于0.10%.
5 最佳提取工艺考察
5.1 提取溶剂浓度考察
取黄丝郁金药材(批号:20160409)3份,每份约100 g,分别置于圆底烧瓶中,并加入10倍量的60%乙醇、70%乙醇、80%乙醇,然后在微沸状态下回流提取90 min,相同条件提取2次[10].合并2次样液并测定姜黄素含量,结果见表6.
表6数据表明,用60%乙醇作为提取溶剂提取效果最佳.
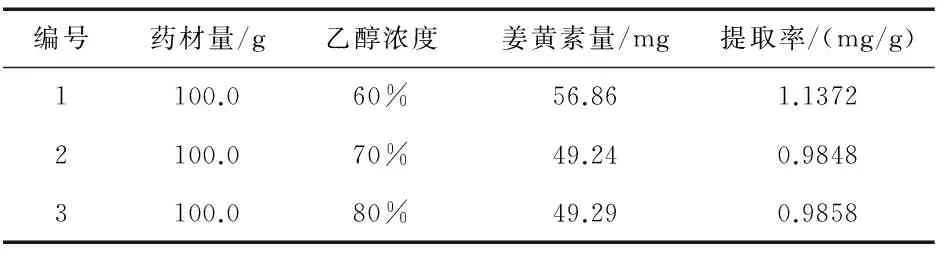
表6 提取溶剂浓度与结果
5.2 正交实验
5.2.1 因素水平表.
取每份50 g黄丝郁金药材(批号,20160409),以姜黄素含量为指标做L9(34)正交实验,选取溶剂倍量(A)、提取次数(B)和提取时间(C)作为影响提取效果的主要因素,每个因素各选3个水平,制定因素水平表如表7所示.

表7 实验因素水平表
5.2.2 提取工艺正交安排及结果分析.
根据正交实验设计表,按“2.1”项下色谱条件进行含量测定,以姜黄素含量为指标进行分析,正交实验设计与结果见表8,方差分析见表9.
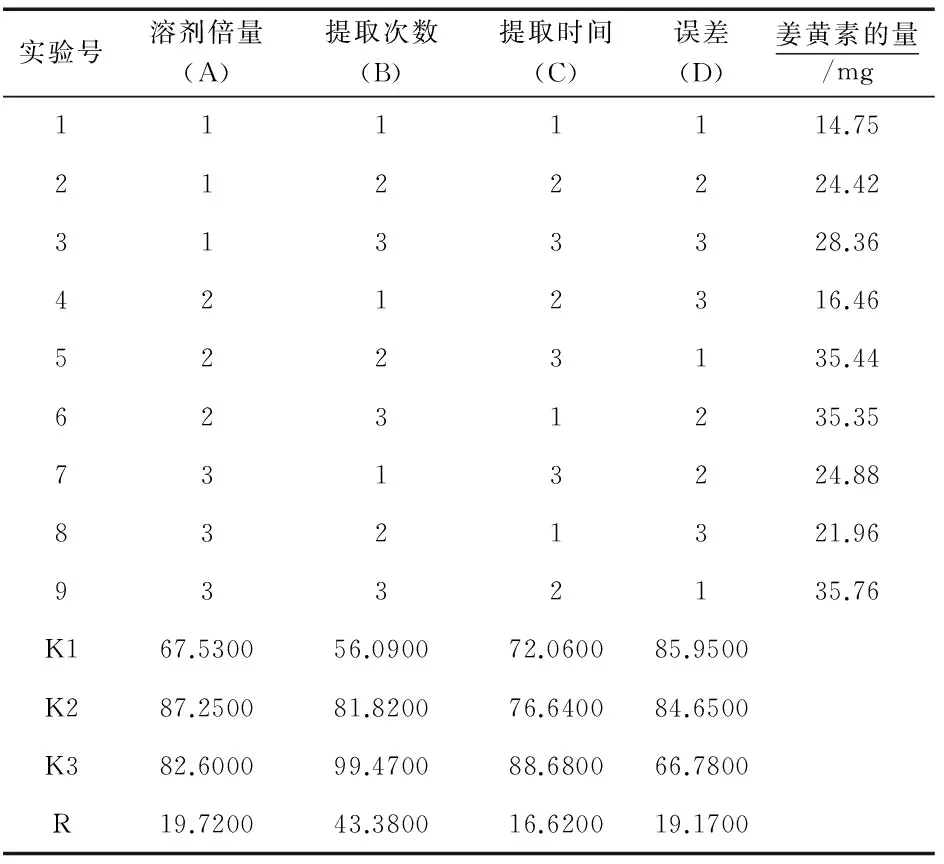
表8 正交实验设计及结果
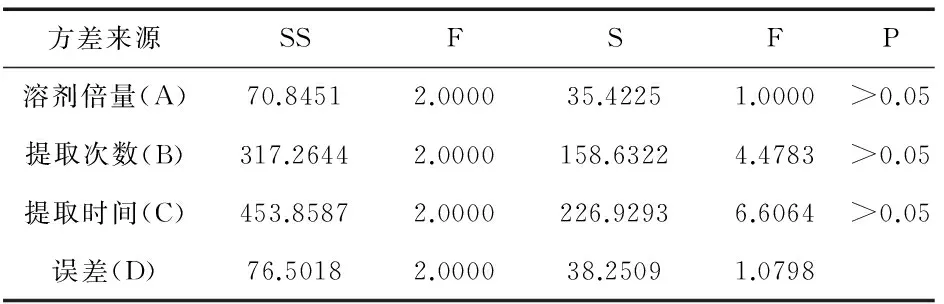
表9 方差分析表
由表8可知,溶剂倍量、提取次数与提取时间3个因素对姜黄素的提取影响程度不同,R值大小依次为RB>RA>RC,即提取次数对于含量的影响最大,且AK2>AK3>AK1、BK3>BK2>BK1、CK3>CK2>CK1.由表9可知,溶济倍量(A)、提取次数(B)与提取时间(C)对实验结果都无显著性差异.根据此分析结果,本实验的郁金姜黄素的最佳提取工艺为,A2B3C3,即采用10倍量60%乙醇提取3次,每次2 h.
5.3 提取工艺验证实验
取黄丝郁金药材(批号,20160409)3份,每份约50 g,分别置圆底烧瓶中,加入500 mL的60%乙醇,每次提取2 h,每份提取3次,合并提取液并测定提取液体积与姜黄素的量,结果见表10.
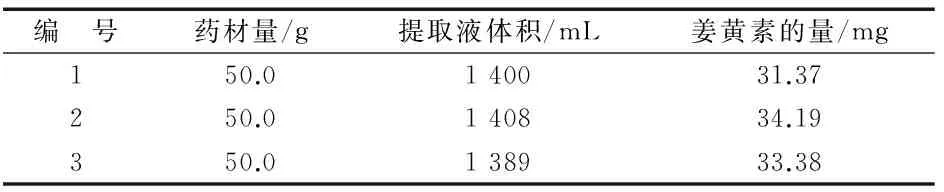
表10 姜黄素提取工艺验证
表10结果表明,所选择的提取工艺稳定、可行.
6 姜黄素“真实”含量及临床利用量测定
6.1 不同产地郁金中姜黄素“真实”含量测定
取一定量郁金药材,精密称定,粉碎,过六号筛,收集过筛后的全部药材细粉与未过筛的全部粉末,分别精密称定其重量,再按“2.3”项下供试品溶液制备方法和按“2.1”项下色谱条件分别测定其姜黄素含量,然后计算出郁金整体药材姜黄素含量,即为药材真实含量,结果如表11所示.
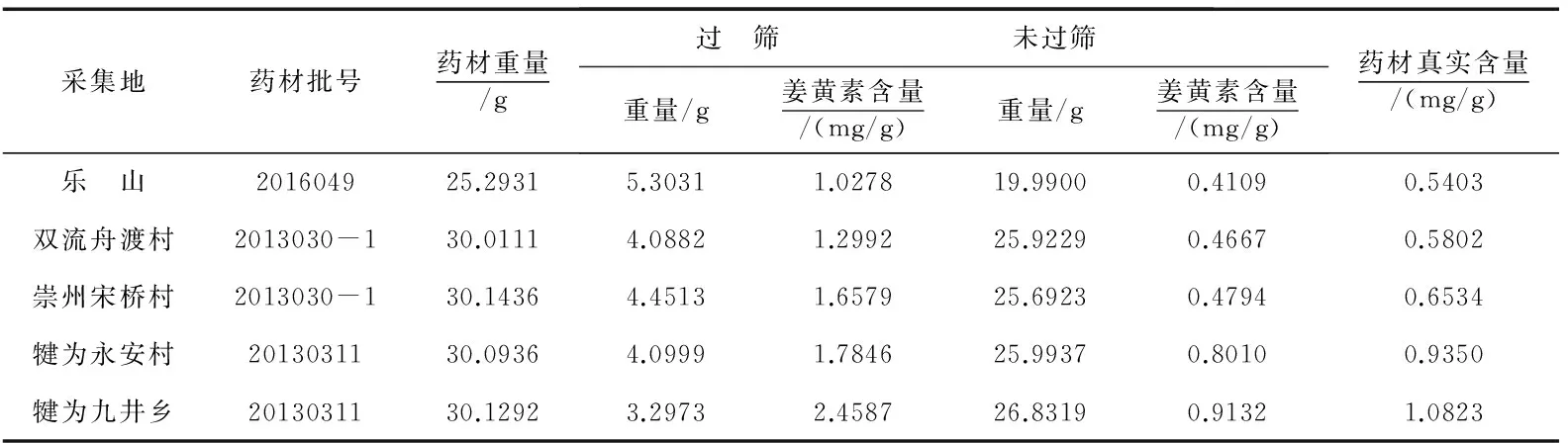
表11 姜黄素“真实”含量测定结果
注:用过筛的含量与未过筛的含量根据其所占的比例计算的含量,即为药材的真实含量.
6.2 不同产地郁金中姜黄素临床利用量测定
按照实验优选的提取工艺,对不同产地郁金药材进行提取,测定其姜黄素含量,计算提取转移率,并根据表11中药材真实含量计算姜黄素的临床利用量,结果见表12.
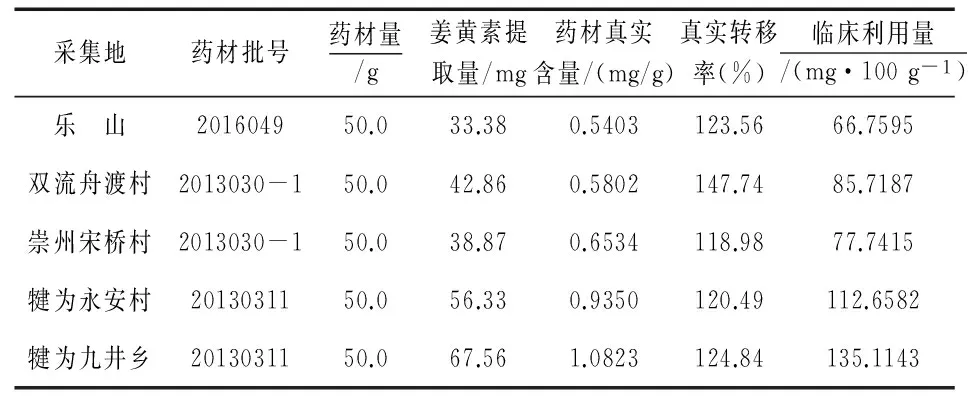
表12 临床利用量测定结果
注:姜黄素临床利用量=100 g×郁金药材真实含量×姜黄素提取转移率
由表12可知,采自犍为县的黄丝郁金真实含量最高,分别为0.9350、1.0823 mg/g,而采自乐山与双流的黄丝郁金真实含量最低,分别为0.5403、0.5802 mg/g,药材的真实含量均低于过筛粉末的含量.同时,由表12数据可知,除双流舟渡村外,其他产地的黄丝郁金真实转移率相近,但临床利用量不同.相关研究发现,药材真实含量越高其临床利用量越高,本实验也证明,姜黄素的临床利用量与郁金药材的姜黄素真实含量在一定程度上正相关.
7 结论与讨论
郁金药材在《中国药典》2015版中有4个品种,相关研究表明,黄丝郁金姜黄素含量远高于其他品种[11].本实验为便于研究仅选择了黄丝郁金为主要药材,研究结果对于另外3种郁金的相关性有待于进一步研究.
本实验在测定不同产地郁金中姜黄素临床利用量时仅选用了5种不同产地黄丝郁金药材,样品量较少,且双流舟渡村黄丝郁金数据异常,是否是药材本身问题所导致的数据异常,有待进一步研究.
以化学成分临床利用量的方式对郁金进行品质评价,重视临床效果,体现了中医药特色,本方法可为郁金及其他中药材品质评价研究提供一种新的思路.
[1]国家药典委员会.中华人民共和国药典[S].北京:中国医药科技出版社,2015.
[2]李艳萍.中药郁金的化学成分研究[J].西北大学学报,2000,30(5):411-414.
[3]张浩,谢成科,焦文旭.中药郁金中姜黄素类成分及微量元素分析[J].天然产物研究与开发,1997,9(4):37-40.
[4]兰凤英.郁金的药理作用及临床应用[J].长春中医药大学学报,2009,25(1):27-28.
[5]徐国钧,徐路珊.常用中药材品种整理和质圣研究(第一册)[M].福州:福建科学技术出版社,1994.
[6]刘华钢,刘俊英,赖茂祥,等.郁金化学成分及药理作用的研究进展[J].
[7]刘涛,苟小军,万德光,等.基于“中药成分临床利用率"的中药材药用品质评价模式的商建[J].中草药,2015,46(13):1863-1866.
[8]雷云霞,孙立立,杨书斌,等.高效液相色谱法测定郁金饮片中姜黄素的含量[J].科技交流,2007,10(6):603-605.
[9]贾海英,杜守颖,李冬雪,等.高效液相色谱法测定黄丝郁金中姜黄素的含量[J].时珍国医国药,2005,16(4):318-319.
[10]潘承锋,潘爱娟.郁金中姜黄素的提取工艺研究[J].中华中医药杂志,2013,28(6):1887-1889.
[11]李敏,唐远,付福友,等.郁金的研究进展[J].中医药现代化,2004,6(2):35-39.
Abstract:The paper evaluates the quality of curcuma aromatica through the clinical utilization quantity of curcumin.It also studies the content of curcumin in curcuma aromatica medicine by single factor experiment.Orthogonal experiment is used to optimize the extraction process of curcumin in curcuma aromatica.According to the best extraction process,the content of curcumin in curcuma aromatica of different batches is determined by HPLC.The quality of curcumin is evaluated by the quantity of its clinical use.The results show that the test preparation method for the curcumin content is as the following:fine powder 2 g,adding 20 mL of methanol,ultrasonic extraction 30 minutes.The best extraction process of curcumin in curcuma aromatica is the extraction of 60% ethanol with 10 times the amount of medicine,each time for 2 hours.The clinical use quantity of curcumin is positively correlated with the true content of herbs.The conclusion drawn from the study is that the method established in this paper attaches importance on clinical effects,which demonstrate the characteristics of Chinese medicine and provides a new idea for the quality evaluation of curcuma aromatica and some other Chinese herbal medicine.
Keywords:curcuma aromatica;clinical use;quality evaluation
StudyonQualityEvaluationofCurcumaAromaticaQualityBasedonAmountofClinicalUtilizationofChemicalComponents
LIUXiaofeng1,JIANGTianyu2,XUTengda2,KOUQiang2,LIUTao2
(1.Sichuan Tianyi University, Mianzhu 618200, China;2.School of Pharmacy and Bioengineering, Chengdu University, Chengdu 610106, China)
R286.0
A
1004-5422(2017)03-0225-05
2017-06-30.
刘晓凤(1987 — ), 女, 从事中成药质量评价研究.
刘 涛(1976 — ), 男, 博士, 研究员, 从事中成药新药开发与再评价研究.
