银川地区牛乳中头孢类药物与庆大霉素残留的检测
2017-10-11王艺晖王桂琴
陈 程,吴 帆,王艺晖,王桂琴
(宁夏大学农学院,宁夏银川 750021)
银川地区牛乳中头孢类药物与庆大霉素残留的检测
陈 程,吴 帆,王艺晖,王桂琴*
(宁夏大学农学院,宁夏银川 750021)
抗生素残留一直是威胁食品安全的重大问题,为了解银川地区牛乳中抗生素残留情况,采用间接竞争酶联免疫吸附试验(ELISA),对银川地区部分养殖场和超市共计350份乳样进行了头孢类药物和庆大霉素残留的检测。结果显示,来自养殖场的200份乳样中,有4份样品的头孢类药物检测结果不合格,5份样品的庆大霉素检测结果不合格,分别占检测样品的2%和2.5%。来自超市的150份乳样中,有3份样品的头孢类药物检测结果不合格,2份样品的庆大霉素检测结果不合格,分别占检测样品的2%和1.3%。说明在银川地区部分养殖场和超市的牛乳中均存在头孢类药物和庆大霉素残留超标的问题。
头孢类药物;庆大霉素;残留;酶联免疫吸附试验
牛乳及牛乳制品中含有人们需要的丰富的营养物质,牛乳中所含有的氨基酸、维生素等营养物质对人体的发育有着重要的促进作用。然而,近年来乳品不安全事件频发,抗生素残留超标问题让人们恐惧,人们一度谈“乳”色变[1]。因此,牛乳及牛乳制品的检测监控技术和体系建立已成为保障广大消费群体健康的重要课题[2]。酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)技术是20世纪70年代发展起来的一项非常成熟的检测技术,在医学、生化及食品检测等各个领域都有着广泛的应用。
头孢类药物和庆大霉素是宁夏地区兽医临床常用抗生素。头孢菌素(Cephalosporins) 类抗生素是一类具有β内酰胺环的广谱半合成抗生素[3],庆大霉素是一种氨基糖苷类抗生素。长期食用抗生素残留的动物源性食品会对人类的健康造成很大威胁。我国农业部规定牛乳中头孢氨苄、头孢噻呋等药物最高残留为100 ng/mL,庆大霉素最高残留为200 ng/mL[4]。为了解这两类抗生素在银川地区牛乳中残留的情况,本试验采用间接竞争酶联免疫吸附试验对牛乳中头孢类药物和庆大霉素的残留进行检测,以期为银川地区的牛乳中抗生素残留监测提供参考。
1 材料与方法
1.1 材料
1.1.1 乳样 鲜牛乳,采自银川地区10个规模化奶牛养殖场,共200份。超市成品乳,不同厂家、不同批次的市售纯牛乳,共150份。
1.1.2 主要仪器和试剂盒 离心机、微量移液器,Eppendorf有限公司产品;振荡器,中国其林贝尔仪器制造有限公司产品;酶标仪,美国Thermo公司产品;头孢类药物快速检测试剂盒(批号:20151203-1)、庆大霉素快速检测试剂盒(批号:20151104-12),深圳市宝安康生物技术有限公司产品。
1.2 方法
1.2.1 试剂盒与牛乳样品的前处理 ①从4℃冷藏环境中取出所需试剂,至室温(20℃~25℃)平衡30 min以上,注意每种液体试剂使用前均需摇匀,然后将2×浓缩复溶液用去离子水按照1∶1稀释,将40 mL浓缩洗涤液用去离子水按照1∶19稀释,或按所需用量配制洗涤液。②将样品和标准品对应微孔按序编号,每个样本和标准品做2孔平行,并记录标准孔和样本孔所在的位置,为了便于检测与测定过程中标准品与样品的辨别,按照微量测试孔条上的编号,分别在1号~2号和3号~12号微孔条上添加标准品和样品。③取1 mL乳样于4℃、3 000 r/min离心15 min后,去除上层脂肪,取上清液移至干净的离心管中,按1∶39的比例与配好的复溶液稀释后取50 μL进行ELISA分析。
1.2.2 ELISA试验 ①加标准品/样本50 μL/孔,然后加入抗体工作液50 μL/孔。振荡混匀,用盖板膜盖板,25℃环境中反应30 min。取出将孔内液体甩干,用洗液250 μL/孔洗板4次~5次,每次间隔15 s~30 s,用吸水纸拍干,拍干后未被清除的气泡可用干净的枪头刺破。②每孔加入酶标记物100 μL,盖板膜盖板后置25℃环境中反应30 min。将孔内液体甩干,用洗涤液250 μL/孔洗板4次~5次,用吸水纸拍干,拍干后未被清除的气泡可用干净的枪头刺破。③每孔加入底物A液50 μL,再加入底物B液50 μL,振荡摇匀,25℃环境中避光显色15 min。④每孔加入终止液50 μL,轻轻振荡混匀,设定酶标仪与450 nm处,测定OD值。
2 结果
2.1 头孢类药物测定结果
2.1.1 粗略判定 用样本的平均吸光度值与标准值比较即可得出其浓度范围(ng/mL)。假设样本1的光密度值为0.3,样本2的光密度值为1.0,标准液光密度值分别是:0为2.243,1 ng/mL为1.816,3 ng/mL为1.415,9 ng/mL为0.74,27 ng/mL为0.313,81 ng/mL为0.155。则样本1的浓度范围是27 ng/mL~81 ng/mL,样本2的浓度范围是3 ng/mL~9 ng/mL,乘以其对应的稀释倍数即为样本中头孢类药物实际浓度。
2.1.2 标准曲线的建立 所获得的每个浓度标准溶液和样本光密度值的平均值(B)除以第一个标准(0标准)的光密度值(B),再乘以100%,即百分光密度值。
以所获得的每个浓度标准溶液或样本光密度值的平均值为B,以标准品的光密度值为B0,以标准品百分吸光率(y=B/B0)为纵坐标,以头孢类药物标准品浓度(ng/mL)的半对数为横坐标,绘制头孢类药物快速检测试剂盒标准曲线(图1)。

图1 头孢类药物快速检测试剂盒标准曲线
将样本的百分吸光率带入标准曲线中,从标准曲线上读出样本所对应的的浓度,乘以其对应的稀释倍数即为样本中头孢类药物实际浓度,从而可知其头孢类药物残留量。由图1可得,标准曲线的线性回归方程为y=-20.224x+112.32,相关系数为0.996 8,可见其各数据之间具有非常好的相关性,表明该头孢类药物快速检测试剂盒针对头孢类药物残留的检测分析是准确可靠的。
2.1.3 乳样中头孢类药物检测结果 使用ELISA快速检测试剂盒对分别来自规模化奶牛养殖场和超市共计350份乳样进行头孢类药物残留检测,并使用药物类残留检测分析软件对检测结果进行分析。 经统计,在200份采自规模化奶牛养殖场的乳样中有4份不合格样品,即不合格率为2%;而来自150份超市的乳样有3份不合格样品,不合格率为2%(表1)。

表1 乳样中抗生素残留合格率的检测
2.2 庆大霉素测定结果
2.2.1 粗略判定 用样本的平均吸光度值与标准值比较即可得出其浓度范围(ng/mL),假设样本1的光密度值为0.310,样本2的光密度值为0.820,标准液光密度值分别是:0为1.510,0.1 ng/mL为1.320,0.3 ng/mL为1.030,0.9 ng/mL为0.660,2.7 ng/mL为0.389,8.1 ng/mL为0.198。则样本1的浓度范围是2.7 ng/mL~8.1 ng/mL,样本2的浓度范围是0.3 ng/mL~0.9 ng/mL,乘以其对应的稀释倍数即为样本中庆大霉素实际浓度。
2.2.2 标准曲线的建立 所获得的每个浓度标准溶液和样本光密度值的平均值(C)除以第一个标准(0标准)的光密度值(C),再乘以100%,即百分光密度值。
以所获得的每个浓度标准溶液或样本光密度值的平均值为C,以标准品的光密度值为C0,以标准品百分吸光率(y=C/C0)为纵坐标,以庆大霉素标准品浓度(ng/mL)的半对数为横坐标,绘制庆大霉素快速检测试剂盒标准曲线(图2)。
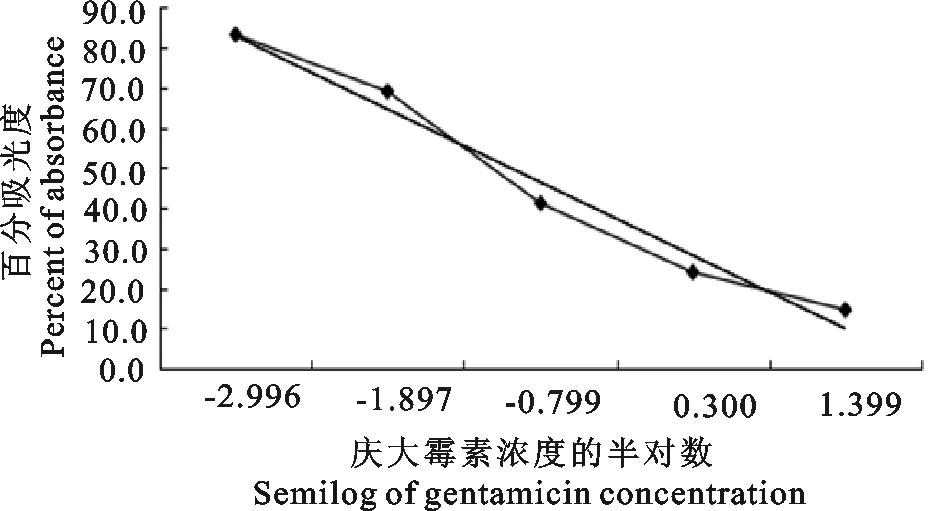
图2 庆大霉素快速检测试剂盒标准曲线
将样本的百分吸光率带入标准曲线中,从标准曲线上读出样本所对应的的浓度,乘以其对应的稀释倍数即为样本中庆大霉素实际浓度,从而可知庆大霉素残留量。由图2可得,标准曲线的线性回归方程为y=-18.215x+101.01,相关系数为0.992 5,可见其各数据之间具有非常好的相关性,表明该庆大霉素快速检测试剂盒针对庆大霉素的残留进行检测分析是准确可靠的。
2.2.3 乳样中庆大霉素检测结果 使用ELISA快速检测试剂盒对分别来自规模化奶牛养殖场和超市的350份乳样进行庆大霉素的残留进行检测,并使用药物类残留检测分析软件对检测结果进行分析。经统计,采自规模化养殖场的200份乳样中有5份不合格样品,即不合格率为2.5%,而来自超市的150份的乳样有2份不合格样品,不合格率为1.3%(表1)。
3 讨论
目前用于检测药物残留的方法主要有微生物法[5-7]、色谱法或色谱-质谱联用分析法[8-18]、免疫分析法等[19-23]。微生物检测法操作简单,但其检测周期长且结果误差较大。色谱法或色谱-质谱等联用技术虽然灵敏度高,但是样品前处理及测定操作繁琐、费用高,不适于大量样品的快速检测。而本试验所用ELISA检测的350个样品中每80个样品为一个检测批次,每批次检测用时仅75 min左右。从ELISA快速检测试剂盒标准曲线及相关系数(R2=0.989)可以看出,各标准品数据间相关性较高。由此可见,ELISA快速检测试剂盒具有较高的灵敏性、高效性、特异性和简便性等优点,可广泛用于兽药残留的现场监控和大规模样品筛查。
头孢菌素由于其具有杀菌力强、毒副作用小、过敏反应少等特点[23],在畜牧动物养殖中广泛用于奶牛乳房炎的预防与治疗,但由于其使用方法不当或不遵守休药期规定等多方面原因,在乳产品中残留过多,进而转移到人体中,对人体造成重大危害[24]。本试验利用ELISA方法对银川地区350份牛乳进行头孢类药物和庆大霉素残留检测,阳性率均为2%。我国各地区的牛乳中都有一定程度的抗生素残留,其阳性率有一定差异。导致阳性率差异的原因有多方面,可能与检测方法的特异性和灵敏度有关,另外可能还与抗生素的使用情况、乳牛的饲养管理等有关。
由于该试剂盒使用前是在2℃~8℃环境冷藏(不可冷冻),故使用前应当将试剂盒中所有试剂温度回升至室温20℃~25℃,否则会导致所有的OD值偏低。其次,从本试验各个环节和结果来看,在ELISA分析中的再现性,很大程度上取决于洗板的一致性,正确的洗板操作是ELISA测定程序中的要点。若在洗板过程中如果出现洗板干燥的情况,则会伴随着标准曲线不成线性、重复性不好的现象。所以洗板拍干后应立即进行下一步操作。在所有恒温孵育过程中,避免光线照射,用盖板膜盖住微孔板。另外,混合要均匀否则会出现重复性不好的现象。由于反应终止液为2 mol/L硫酸,试验过程中需做好防护工作,避免试剂接触皮肤,造成不必要的损伤。
本试验使用ELISA快速检测试剂盒分别对来自银川地区部分规模化奶牛养殖场和超市共计350份乳样进行头孢类药物和庆大霉素的残留检测,结果显示,银川地区部分养殖场的牛乳中头孢类药物残留检测合格率为98%,庆大霉素检测合格率为97.5%。来自超市的牛乳中头孢类药物残留检测合格率为98%,庆大霉素检测合格率为98.7%。说明在银川地区的牛乳中存在头孢类药物和庆大霉素残留及残留超标现象,需继续加大监控力度,确保乳品安全。
[1] Rajapandiyan P,Tang W L,Yang J.Rapid detection of melamine in milk liquid and powder by surface-enhanced Raman scattering substrate array[J].Food Control,2015,56(3):155-160.
[2] Ahmed K M F,Hafez R S,Morgan,et al.Detection of some chemical hazards in milk and some dairy products[J].African J Food Sci,2015,9(4):187-193.
[3] The European Commission.Commission Regulation (EU)N037/2010 0f 22 December 2009 on pharm acologically active substances and their classification regarding maximum residue limits in food stuffs of animal origin[J].Offical J Eur Commun,2010,15:1-27.
[4] 中华人民共和国农业部235号公告.关于发布《动物性食品中兽药残留最高残留限量的通知》[S].2002-12-24.
[5] 马丽苹,纠 敏,秦翠丽,等.微生物抑制法检测牛奶中青霉素类药物的残留[D].河南洛阳:河南科技大学,2013.
[6] Cazedey E C,Salgado H R.A novel and rapid microbiological assay for ciprofloxacin hydrochloride[J].J Pharmac Analy,2013,3(5):382-386.
[7] 王金凤,杨化新,陈金泉,等.新技术在氨基糖苷类药物质控方面的应用和进展[J].中国药事,2014,28(4):409-412.
[8] 郑 天,屠小燕.高效液相色谱法和液相色谱-质谱联用技术在食品工业上的应用[J].南京工业大学学报,2010,26(2):3-5.
[9] Han R W,Zheng N,Yu Z N,et al.Simultaneous determination of 38 veterinary antibiotic residues in raw milk by UPLC-MS/MS[J].Food Chem,2015,181:119-126.
[10] Gbylik-Sikorska M,Posyniak A,Sniegocki T,et al.Liquid chromatography-tandem mass spectrometry multiclass method for the determination of antibiotics residues in water samples from water supply systems in food-producing animal farms[J].Chemosphere,2015,119:8-15.
[11] 刘雪杰,邱宏端,陈济琛,等.牛奶抗生素残留检测方法研究进展[J].现代农业科技,2013(5):300-302.
[12] Pérez R.QuEChERS methodologies as an alternative to solid phase extraction (SPE) for the determination and characterization of residues of cephalosporins in beef muscle using LC-MS/MS[J].J Chromatog B,2012,899(9):57-65.
[13] Jank L,Hoff R B,Tarouco P C,et al.β-lactam antibiotics residues analysis in bovine milk by LC-ESI-MS/MS: a simple and fast liquid-liquid extraction method.[J].Food Addit Contamin Part A,2011,29(4):497.
[14] Kukusamude C,Burakham R,Chailapakul O,et al.High performance liquid chromatography for the simultaneous analysis of penicillin residues in beef and milk using ionpaired extraction and binary water-acetonitrile mixture.[J].Talanta,2012,92(92):38-44.
[15] Gáspár A,Andrási M,Kardos S.Application of capillary zone electrophoresis to the analysis and to a stability study of cephalosporins[J].J Chromatog B,2002,775(2):239-246.
[16] Storey J M,Clark S B,Johnson A S,et al.Analysis of sulfonamides,trimethoprim,fluoroquinolones,quinolones, triphenylmethane dyes and methyltestosterone in fish and shrimp using liquid chromatography-mass spectrometry.[J].J Chromatog B,2014,972:38-47.
[17] Liu X,Yu Y,Zhao M,et al.Solid phase extraction using magnetic core mesoporous shell microspheres with C18-modified interior porewalls for residue analysis of cephalosporins in milk by LC-MS/MS[J].Food Chem,2014,150:206-212.
[18] Yibar A,Ozcan A,Karaca M Y.Determination of erythromycin,spiramycin,tilmicosin and tylosin in animal feedingstuffs by liquid chromatography-tandem mass spectrometry[J].Kafkas Universitesi Veteriner Fakultesi Dergisi,2014,20 (3):439-444.
[19] 崔廷婷,钟建三,张 瑜,等.动物源性食品中红霉素残留的ELISA检测[J].四川畜牧兽医,2015(1):29-31.
[20] 韩 青,王 静,徐 豪,等.牛奶中替米考星间接竞争酶联免疫吸附检测法的建立[J].中国畜牧兽医,2015(10):2625-2630.
[21] Al-Delaimy K,Mahmoud I.Aflatoxin M1 in milk and milk products in Jordan and methods for its reduction:A preliminary study[J].Bri J Appl Sci Technol,2015,6(6):597-605.
[22] 邢广旭.氟喹诺酮类药物多残留免疫学检测技术研究[D].河南郑州:河南农业大学,2013.
[23] 洪云鹤,李伟青,林 中,等.动物源性食品中头孢菌素类药物残留检测方法研究进展[J].食品工业科技,2016(13):370-375.
[24] 许 娜,孙海新,张 慧,等.牛奶中头孢类药物残留的HPLC多联检测方法[J].中国乳品工业,2016(2):50-52,60.
Abstract:Antibiotic residues have been a major threat to food security.In order to understand the residues of cephalosporins and gentamicin in cow milk in Yinchuan,cephalosporins and gentamicin residues were tested on 350 milk samples collected from farms and supermarkets by indirect competitive enzyme-linked immunosorbent assay (ELISA).The results showed that 4 samples of cephalosporin test results and 5 samples of gentamicin test results were unqualified in 200 milk samples from the farms,which accounting for 2% and 2.5% of the samples respectively.From the market in 150 milk samples,3 samples of cephalosporin test results were unqualified and 2 samples of gentamicin test results were unqualified, which accounting for 2% and 1.3% of the samples respectively.It revealed that the cephalosporin and gentamicin excessive residues in milk existed in the farms and supermarkets of Yinchuan.
Keywords:cephalosporins;gentamicin;residue;enzyme-linked immunosorbent assay
文献综述
DetectionandAnalysisofCephalosporinsandGentamicinResiduesinCowMilkinYinchuan
CHEN Cheng,WU Fan,WANG Yi-hui,WANG Gui-qin
(CollegeofAgriculture,NingxiaUniversity,Yinchuan,Ningxia,750021,China)
S859.84
A
1007-5038(2017)08-0076-04
2016-07-19
国家自然科学基金项目(31360626)
陈 程(1992-),男,安徽安庆人,硕士研究生,主要从事兽医药理学研究。*
