苗药了哥王不同炮制品乙醇提取物对小鼠的急性毒性作用比较
2017-10-10冯果李玮何新郑传奇冷安碧田小芳
冯果,李玮,何新,郑传奇,冷安碧,田小芳
(1.贵阳中医学院药学院,贵阳550025;2.天津中医药大学中药学院,天津 300193;3.国家苗药工程技术研究中心,贵阳 550025)
苗药了哥王不同炮制品乙醇提取物对小鼠的急性毒性作用比较
冯果1,2,3*,李玮1,3,何新2,郑传奇1,冷安碧1,田小芳1
(1.贵阳中医学院药学院,贵阳550025;2.天津中医药大学中药学院,天津 300193;3.国家苗药工程技术研究中心,贵阳 550025)
目的:比较苗药了哥王生品、不同炮制品乙醇提取物对小鼠的急性毒性,为了哥王汗渍法炮制工艺优选及其安全用药提供依据。方法:采用汗渍法对了哥王的饮片炮制30 d得炮制品一,对了哥王粗粉分别炮制14、7 d得炮制品二和炮制品三。以70%乙醇为溶剂,采用渗漉法对了哥王生品及不同炮制品进行提取,并对不同乙醇提取物进行小鼠急性毒性实验。结果:了哥王生品、炮制品一乙醇提取物的半数致死量(LD50)分别为4.05、6.65 g/kg,相当于临床70 kg成人日用量的19、32倍。而了哥王炮制品二、炮制品三乙醇提取物的LD50无法测出;最大耐受量(MTD)分别为20.0、15.0 g/kg,相当于临床70 kg成人日用量的95、71倍;最大给药量(MLD)分别近似为30.0、20.0 g/kg,相当于临床70 kg成人日用量的143、95倍。结论:了哥王炮制品的毒性明显低于生品,且了歌王粗粉炮制14 d后毒性低于炮制7 d。
了哥王;汗渍法;炮制;急性毒性;小鼠
ABSTRACTOBJECTIVE:To compare the acute toxicity of ethanol extract from raw product and different processed products of Wikstroemia indica on mice,and provide basis for optimizing the processing technology of perspiration method for W.indica and medication safety.METHODS:Perspiration method was used to process the W.indica pieces for 30 d to get processed product 1 and process its coarse powder for 14,7 d to get processed product 2,processed product 3,respectively.Then using 70%ethanol as solvent,percolation method was used to extract the raw W.indica and its different processed products,and acute toxicity test was conducted on mice for different ethanol extracts.RESULTS:The median lethal dose(LD50)of ethanol extracts from raw W.indica and processed product 1 were 4.05 and 6.65 g/kg,equivalent to 19,32 times of the clinical daily dose of a 70 kg adult,respectively.While the LD50of ethanol extract from processed product 2 and processed product 3 can not be measured,the maximum tolerated dose(MTD)were measured as 20.0,15.0 g/kg,equivalent to 95,71 times of the clinical daily dose of a 70 kg adult,respectively;the maximum dose(MLD)were measured as approximately 30.0,20.0 g/kg,equivalent to 143,95 times of the clinical daily dose of a 70 kg adult,respectively.CONCLUSIONS:The toxicity of processed products of W.indica is obviously lower than that of raw products,and its toxicity after processing the coarse powder for 14 d is lower than that after processing the coarse powder for 7 d.
KEYWORDSWikstroemia indica;Perspiration method;Processing;Acute toxicity;Mice
了哥王为瑞香科植物南岭荛花[Wikstroemia indica(L.)C.A.Mey.]的根和根皮,其性寒,味苦、微辛,具有清热解毒、消肿散结、止痛等功效,可用于治疗瘰疬、痈肿、风湿痛、百日咳、跌打损伤等[1]。现代研究表明,了哥王具有抗菌、镇痛、抗炎、抗病毒、抗肿瘤等药理作用[2-4],临床主要用于治疗急性扁桃体炎、慢性支气管炎、肝炎、肝硬化、肾炎、肢体疼痛等,还可用于治疗多种癌症,如乳腺癌、恶性淋巴癌、肺癌及各种体表癌等[5-11],为苗族地区常用苗药。然而,该药虽疗效确切,但毒性较大,《生草药性备要》《广西中药志》《南宁市药物志》中均有关于其“大毒”或“有毒”的记载,中毒症状主要为呕吐、腹痛、腹泻和皮肤过敏等。
本课题组前期对了哥王不同溶剂提取物进行了初步的急性毒性研究,其乙醇提取物、石油醚提取物和乙酸乙酯提取物均有较大毒性[12]。此外,本课题组前期还对了哥王炮制工艺进行了初步考察[5,13],发现原“汗渍法”炮制周期太长,炮制一批药材需要30 d,且其炮制品的毒性仍然不小。本课题组推测其原因可能是“汗渍法”炮制所用药材为较厚的饮片,炮制过程中炮制液很难渗入饮片内部,因而减毒效果不好。故本课题组对了哥王的炮制工艺进行了进一步优化,将了哥王药材由原来的饮片改成粗粉,再对其进行不同时间的炮制,得到不同炮制品,并对其不同炮制品进行小鼠急性毒性的比较研究,以期为了哥王炮制工艺的优选、炮制机制的研究以及临床安全用药提供依据。
1 材料
1.1 仪器
FA2004电子分析天平(上海衡平仪器仪表厂);RE52-99旋转蒸发仪(上海亚荣生化仪器厂);JA2003电子天平(上海舜宇恒平科学仪器有限公司);180×1000自动渗漏管(北京六一仪器厂)。
1.2 药材与试剂
了哥王药材购自广西壮族自治区玉林市玉州区玉林银丰国际中药港(批号:20160115),经贵阳中医学院李玮副教授鉴定其为瑞香科荛花属植物了哥王[Wikstroemia indica(L.)C.A.Mey.]的根;所有试剂均为分析纯。
1.3 动物
SPF级KM小鼠190只,♀♂各半,体质量(20±2)g,购自湖南长沙市天勤生物技术有限公司,动物合格证号:43006700010081。小鼠饲养于12 h光照/12 h黑暗、温度为(25±1)℃、相对湿度为(50±10)%的动物房中,饲养期间给予标准饲料和饮用水。
2 方法
2.1 了哥王生品乙醇提取物及不同炮制品乙醇提取物的制备
2.1.1 了哥王生品乙醇提取物的制备 取了哥王生品药材饮片5 kg,以70%乙醇为溶剂,渗漉量为14倍药材量,以渗漉速度为5 mL/(min·kg)进行渗漉提取。提取液回收乙醇至无醇味,采用低压真空浓缩干燥法(温度60℃,真空度0.07~0.08 MPa)进行浓缩、干燥、粉碎成细粉,得了哥王生品乙醇提取物(简称为了哥王生品,干浸膏平均得率为10.08%)。
2.1.2 了哥王汗渍法炮制品一乙醇提取物的制备 取了哥王生品药材饮片5 kg,每天喷入1%人工汗液(含L-组氨酸盐酸盐0.5 g/L、氯化钠5 g/L、二水合磷酸二氢钠2.2 g/L,用0.05 mol/L氢氧化钠调节pH至5.5后即得),拌匀,闷润,待吸尽后置于(37±0.5)℃的烘箱内烘24 h。每100 kg了哥王用人工汗液30 kg,如此反复炮制30 d,即得了哥王汗渍法炮制品药材一。取了哥王汗渍法炮制品药材一,用“2.1.1”项下渗漉法提取,得了哥王炮制品一乙醇提取物(简称为了哥王炮制品一)。
2.1.3 了哥王汗渍法炮制品二、炮制品三乙醇提取物的制备 分别取了哥王生品药材饮片5 kg,粉碎成粗粉,每天喷入1%人工汗液,分别按“2.1.2”项下方法反复炮制14、7 d,得了哥王汗渍法炮制品药材二、炮制品药材三。再分别取了哥王汗渍法炮制品药材二、炮制品药材三,用“2.1.1”项下渗漉法提取,得了哥王炮制品二、炮制品三的乙醇提取物(分别简称为了哥王炮制品二、炮制品三)。
2.2 了哥王生品、不同炮制品对小鼠的急性毒性研究
参照经典的急性毒性[半数致死量(LD50)、最大耐受量(MTD)、最大给药量(MLD)]实验方法[14],考察了哥王生品、不同炮制品对小鼠的急性毒性作用。
2.2.1 了哥王生品、炮制品一对小鼠的LD50急性毒性实验 取小鼠130只,♀♂各半,随机分为13组,每组10只,分别为空白组、了哥王生品1~6组(给药剂量分别为9.00、6.30、4.41、3.10、2.16、1.15 g/kg)、了哥王炮制品一1~6组(给药剂量分别为10.50、7.88、5.52、3.86、2.70、1.89 g/kg)。实验前禁食不禁水12 h后,各给药组小鼠按20 mL/kg ig相应药物1次,计算单日内给药量;空白组小鼠ig等体积的1.0%羧甲基纤维素钠(CMC-Na)蒸馏水混悬液。给药后,各组小鼠正常饲养;给药后2 h内,每15 min左右观察1次小鼠中毒表现;给药后2~4 h之内,每30 min观察1次小鼠中毒表现;给药后4~8 h之内,每1 h观察1次小鼠中毒表现;给药后8~24 h之内,每4 h观察1次小鼠中毒表现。从给药后第2天起,每天观察1次小鼠中毒表现;每隔1天称取1次存活小鼠体质量,观察小鼠的活动、进食、饮水情况,连续14 d。并每天观察小鼠是否有异常肌肉运动、对外反应、瞳孔改变、眼球凸出、眼睑下垂、呼吸异常、异常分泌物、大小便异常、毛色及皮肤颜色改变等毒性反应和死亡情况。若有小鼠死亡,则记录小鼠死亡时间,并即时解剖死亡小鼠,肉眼观察其心、肝、脾、肺、肾、脑、胃、小肠等脏器的病理改变。14 d观察期结束后,次日将各组存活小鼠处死并进行解剖,按照上述方法对主要脏器的病理变化进行肉眼观察。
2.2.2 了哥王炮制品二和炮制品三对小鼠的MTD、MLD急性毒性实验 因预实验发现无法求出了哥王炮制品二和炮制品三的LD50值,故对其进行MTD、MLD急性毒性实验。取小鼠60只,按体质量和性别随机分为空白组、了哥王炮制品二组和了哥王炮制品三组,每组20只,♀♂各半。将各组乙醇提取物用1.0%CMC-Na配制成混悬液,实验前小鼠禁食不禁水12 h后,按最大给药剂量15 g/kg、最大给药体积40 mL/kg ig给药1次或多次,计算小鼠单日内的累积给药剂量;空白组小鼠ig等体积的1.0%CMC-Na混悬液,进行MTD、MLD急性毒性实验。给药后连续观察14 d,记录小鼠死亡及毒性反应症状。死亡小鼠即刻进行尸检,肉眼观察其主要脏器变化。每天称定存活小鼠的体质量,于实验第15天将存活小鼠处死并进行解剖。
2.3 统计学方法
采用SPSS 13.0软件对各组数据进行统计处理。计量资料以x±s表示,组间比较采用t检验。P<0.05表示差异有统计学意义。急性毒性实验LD50值的分析统计采用Bliss法。
3 结果
3.1 了歌王生品、炮制品一对小鼠的急性毒性实验结果
3.1.1 小鼠毒性症状观察结果 了哥王生品组小鼠ig给药后10 min左右,部分小鼠出现活动少、闭眼、蜷缩成团、不动、惊厥、抽搐、呼吸困难等中毒症状;第1天给药后的1.0~2.5 h之间,小鼠死亡数较多,且死亡数存在一定的剂量依赖性。了哥王炮制品一组小鼠给药后10~20 min内相继有小鼠出现活动少、闭眼、蜷缩成团、不动、惊厥、抽搐、呼吸困难等中毒症状,死亡数减少。对死亡小鼠及时解剖观察,发现给药后第1天内死亡的小鼠无明显的胃肠道胀气、充血、水肿等情况发生,其皮肤和肝的颜色较深,有淤血状,部分死亡小鼠胸腔有积水,心、脾、肺、肾等脏器未见明显异常;给药后第2天内死亡的小鼠胃肠道颜色加深,稍带黄色,且可见胃肠道胀气,肺可见部分小黑斑,心、肾、脾等脏器未见明显异常;给药多天后死亡的小鼠体形偏小。了哥王生品、炮制品一对小鼠急性毒性的症状谱见表1。
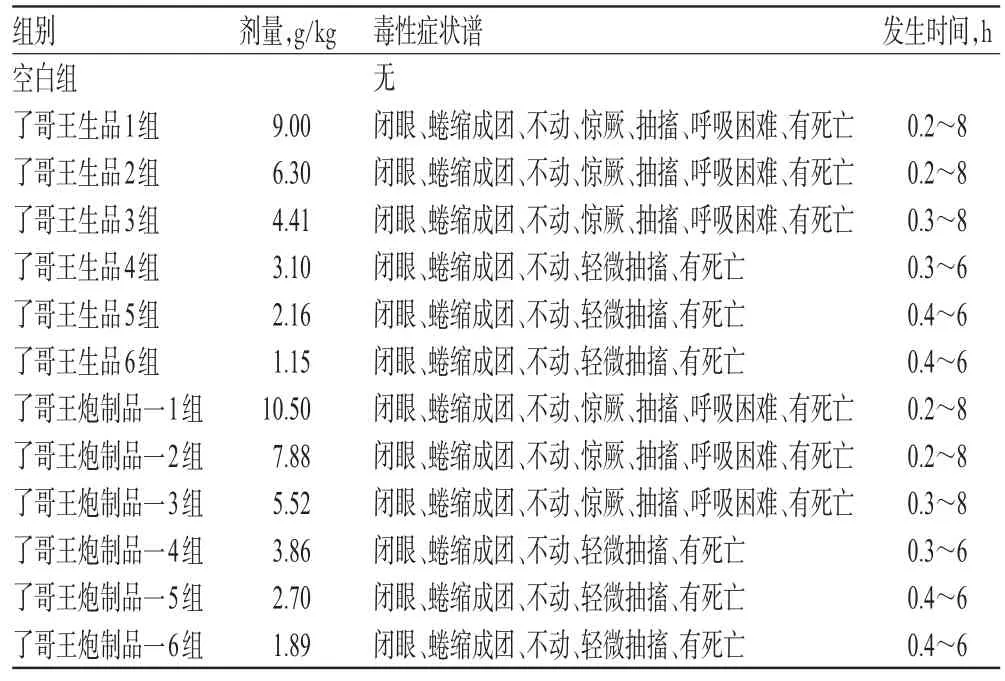
表1 了哥王生品、炮制品一对小鼠急性毒性的症状谱Tab 1 Symptom spectrums of acute toxicity of raw W.indica and processed product 1 on mice
3.1.2 小鼠体质量测定结果 空白组小鼠的体质量随着给药时间的延长呈稳定增长趋势,了哥王生品、炮制品一组小鼠体质量的增长均受到一定的抑制。分析小鼠自身体质量差异变化,发现了哥王生品组、炮制品一组小鼠自身体质量差异变化较大,特别是高剂量组小鼠给药后第1周内有负增长现象,结果见表2、图1。
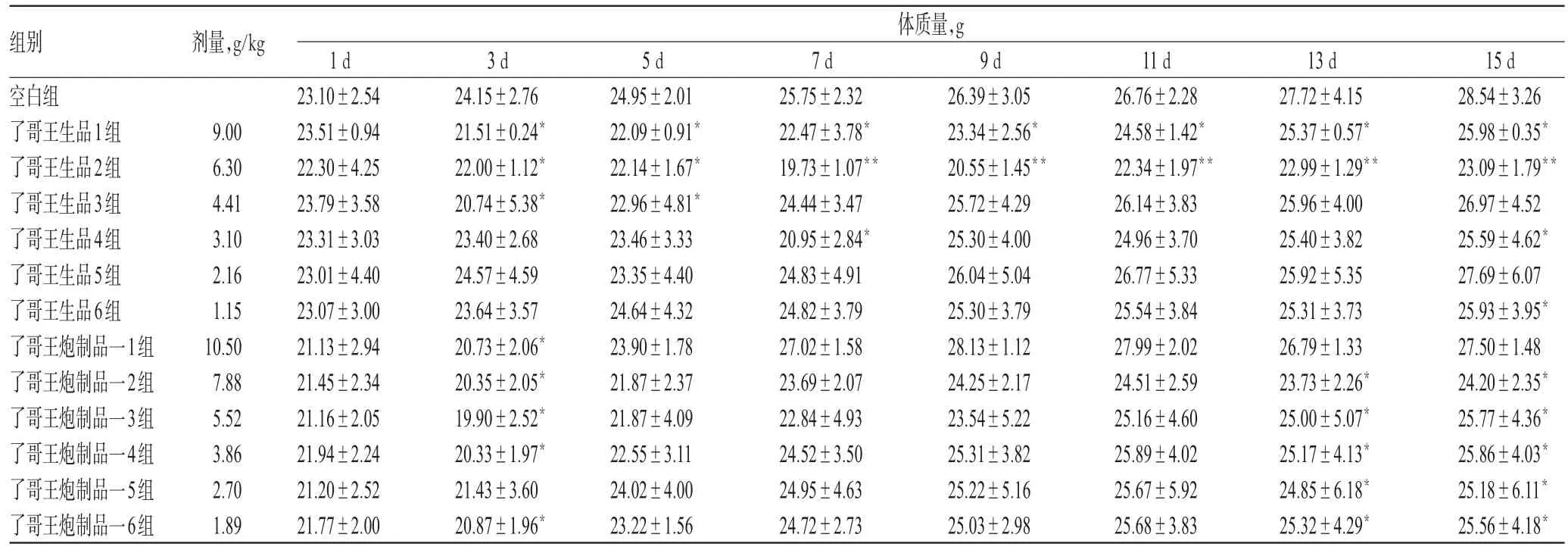
表2 了哥王生品、炮制品一组小鼠体质量的测定结果(x±s,n=10)Tab 2Determination results of body mass of mice in raw W.indica and processed product 1 groups(x±s,n=10)
3.1.3 小鼠急性毒性的LD50测定结果 了哥王生品组小鼠的给药剂量小于了哥王炮制品一组,但小鼠死亡率高于炮制品一组。生品LD50为4.05 g/kg,95%置信区间为2.70~6.10 g/kg;炮制品一LD50为6.65 g/kg,95%置信区间为2.82~15.69 g/kg。了哥王生品、炮制品一对小鼠的LD50测定结果见表3,小鼠生存率-时间曲线见图2。
3.2 了哥王炮制品二、炮制品三对小鼠的MTD、MLD急性毒性实验结果
3.2.1 小鼠体质量测定结果 空白组小鼠的体质量随着给药时间的延长呈稳定增长趋势;了哥王炮制品二、炮制品三组小鼠体质量的增长均受到一定抑制,且了哥王炮制品三对小鼠体质量抑制程度高于了哥王炮制品二,结果见表4、图3。
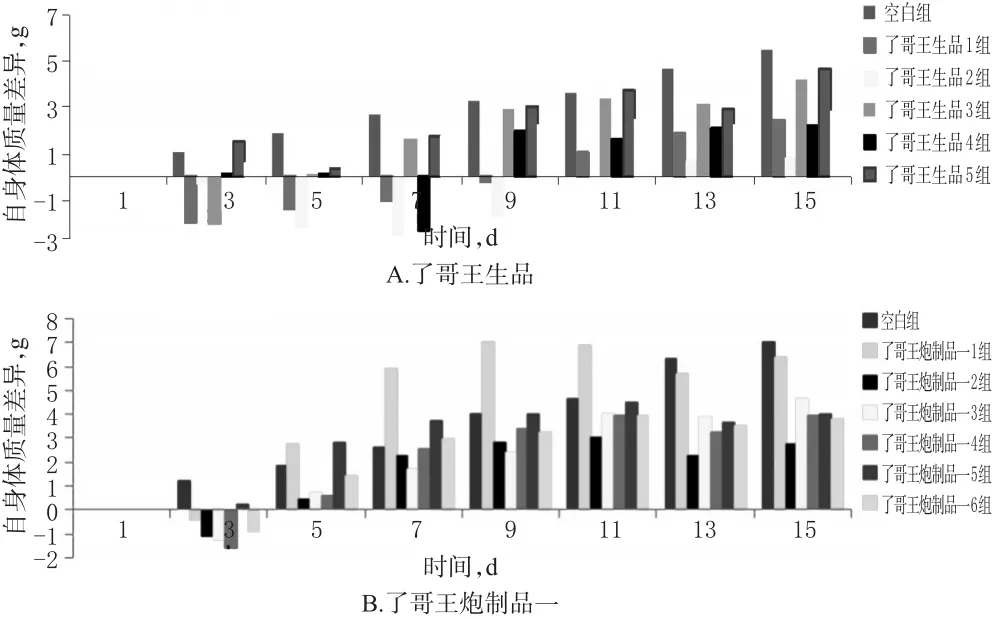
图1 了哥王生品、炮制品一不同剂量组小鼠自身体质量差异的变化Fig 1 Changes of body mass differences of mice in raw W.indica and processed product 1 groups with different doses
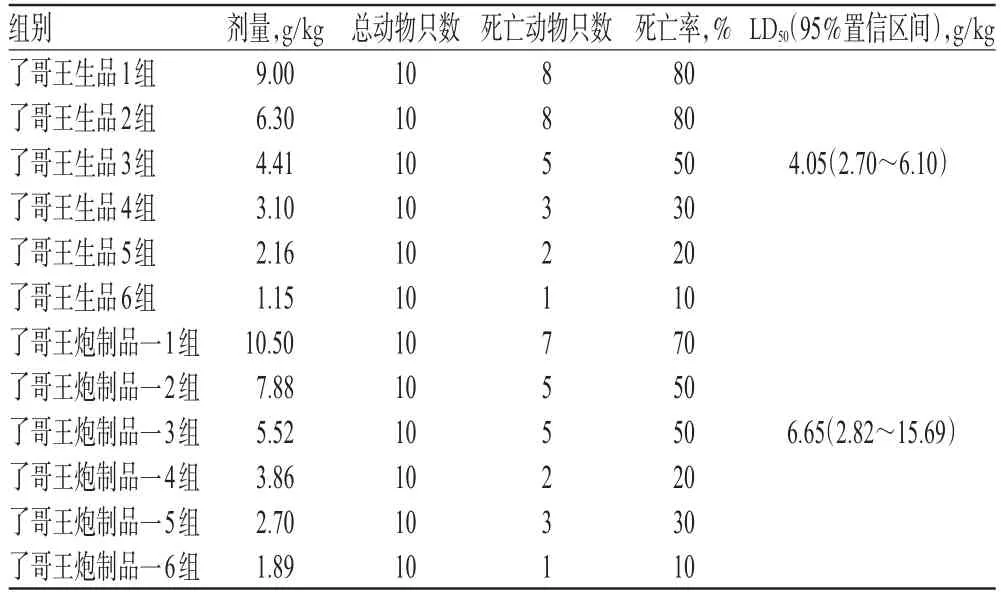
表3 了哥王生品、炮制品一的LD50测定结果Tab 3 Determination results of LD50for raw W.indica and processed product 1
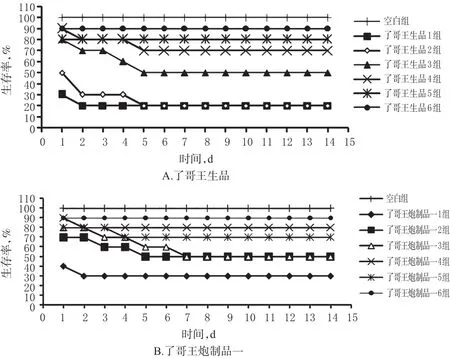
图2 了哥王生品、炮制品一对小鼠LD50急性毒性实验的生存率-时间曲线图Fig 2 Survival rate-time curves of LD50acute toxicity test in mice in raw W.indica and processed product 1 groups
3.2.2 小鼠急性毒性的MTD、MLD测定结果 了哥王炮制品二按最大给药体积40 mL/kg给药,当剂量达到20.0 g/kg时小鼠发生闭眼、蜷缩成团、不动等中毒症状,但没有小鼠死亡;当给药剂量达30.0 g/kg时有3只小鼠死亡(死亡率为15%)。可见了哥王炮制品二的MTD为20.0g/kg,MLD近似为30.0 g/kg。而了哥王炮制品三以最大给药剂量15.0 g/kg(最大质量浓度)和最大给药体积40 mL/kg给药后小鼠有闭眼、蜷缩成团、不动的中毒症状,但没有死亡;当剂量达到20.0 g/kg时,有1只小鼠死亡;当给药剂量达到30.0 g/kg时,有6只小鼠死亡(死亡率为30%)。可见了哥王炮制品三的MTD为15.0 g/kg,MLD近似为20.0 g/kg。当给药剂量达30.0 g/kg时,了哥王炮制品二组、炮制品三组小鼠均出现毒性症状,均有小鼠死亡,但了哥王炮制品三组小鼠的死亡数大于了哥王炮制品二组,可见了哥王炮制品三毒性大于了哥王炮制品二。小鼠生存率-时间曲线见图4。
表4 了哥王炮制品二、炮制品三组小鼠体质量的测定结果(x±s,n=20)Tab 4 Determination results of body mass of mice in W.indica processed product 2 and processed product 3 groups(x±s,n=20)
4 讨论

图3 了哥王炮制品二、炮制品三组小鼠自身体重差异的变化Fig 3 Changes of body mass of mice in W.indica processed product 2 and processed product 3 groups
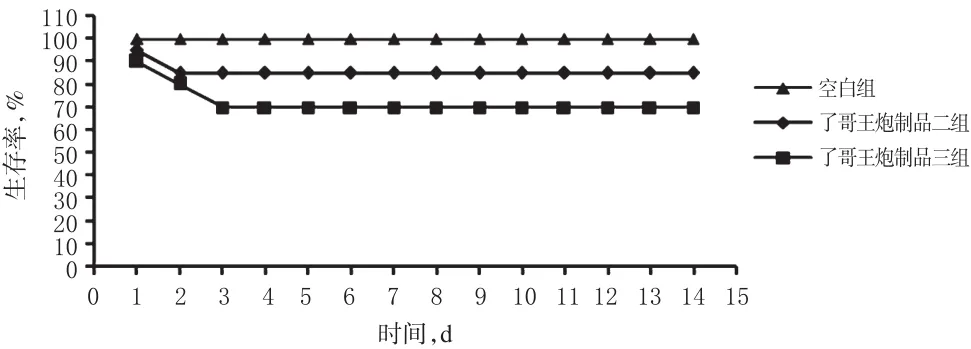
图4 了哥王炮制二、炮制品三对小鼠MTD、MLD急性毒性实验的生存率-时间曲线图Fig 4 Survival rate-time curves of MTD,MLD acute toxicity test in mice in W.indica processed product 2 and processed product 3 groups
本文以了哥王生品组和空白组作为对照组,对其原“汗渍法”工艺所得炮制品一及改进工艺后所得了哥王炮制品二、炮制品三进行了急性毒性的比较研究。预实验结果表明,了哥王生品、炮制品一可测出LD50,故在本研究中进行了了哥王生品、炮制品一的LD50急性毒性实验。结果了哥王生品的LD50为4.05 g/kg,95%置信区间为2.70~6.10 g/kg;了哥王炮制品一的LD50值为6.65 g/kg,95%置信区间为2.82~15.69 g/kg,分别相当于临床70 kg成人日用量的19、32倍。而了哥王炮制品二、炮制品三的毒性较小,当最高给药剂量达15 g/kg时,均没有出现小鼠死亡。受给药浓度限制,测不出LD50,但因有少数小鼠ig给药后有毒性症状,故对炮制品二和炮制品三进行了MTD、MLD急性毒性实验。结果显示,了哥王炮制品二的MTD为20 g/kg,MLD近似为30 g/kg,分别相当于临床70 kg成人日用量的95、143倍;了哥王炮制品三的MTD为15 g/kg,MLD近似为20 g/kg,分别相当于临床70 kg成人日用量的71、95倍。可见,了哥王生品及不同炮制品的毒性大小顺序为:生品>了哥王炮制品一>了哥王炮制品三>了哥王炮制品二。结果表明,了哥王生品的毒性比炮制品大,说明“汗渍法”炮制了哥王能有效降低其毒性;在炮制品中,了哥王炮制品一的毒性比了哥王炮制品三的毒性大,说明在采用“汗渍法”炮制了哥王时将药材饮片粉碎成粗粉后减毒效果更好;了哥王炮制品二的毒性又要比了哥王炮制品三略小,说明在采用“汗渍法”炮制了哥王时,炮制时间为14 d时其减毒效果更好。
在本研究进行生品和了哥王炮制品一LD50测定的正式实验前,本课题组进行了急性毒性预实验。预实验结果显示,了哥王生品、炮制品一的最小全死量(LD0)分别为9.0、10.50 g/kg,最大全不死量分别为1.15、1.89 g/kg,相邻两组剂量间比值(r)分别为0.7、0.75,故将其分组进行急性毒性实验时,其两组的剂量不一样。另外,在对了哥王“汗渍法”炮制工艺及炮制“减毒”研究的同时,本课题组也对其炮制前后物质基础变化进行了研究。结果表明,炮制后了哥王的主要有效成分含量不仅没有下降,而且还有一定的上升,而其主要毒性成分含量下降显著。“汗渍法”炮制了哥王具有“增效减毒”的作用,这部分研究内容将在后期进行报道。
综上所述,了哥王炮制品的毒性明显低于生品,且不同炮制品的毒性不同,采用“汗渍法”对了哥王粗粉炮制14 d后其毒性最小。本研究为苗药了哥王“汗渍法”炮制工艺的研究和临床用药的安全性提供了一定的依据,也为了哥王的毒性及炮制“增效减毒”机制研究奠定了基础。
[1] 张庆荣,夏光成.有毒中草药彩色图鉴[M].2版.天津:天津科技翻译出版公司,2006:131.
[2] 浙江植物志编委会.浙江植物志:第四卷[M].杭州:浙江科学技术出版社,1999:255-256.
[3] Shao M,Huang XJ,Liu JS,et al.A new cytotoxic biflavonoid from the rhizome of Wikstroemia indica[J].Nat Prod Res,2016,30(12):1417-1422.
[4]Huang WH,Zhou GX,Wang GC,et al.A new biflavonoid with antiviral activity from the roots of Wikstroemia indica[J].J Asian Nat Prod Res,2012,14(4):401-406.
[5] 张金娟,熊英,李玮,等.了哥王炮制前后的药效比较研究[J].时珍国医国药,2015,26(5):1118-1120.
[6] 邵萌,黄晓君,孙学刚,等.了哥王根茎中的酚性成分及其抗肿瘤活性研究[J].天然产物研究与开发,2014,26(6):851-855、875.
[7] 颜红,夏新华,王挥,等.西瑞香素对人肝癌HepG2细胞增殖、凋亡及细胞周期的影响[J].湖南中医药大学学报,2013,33(9):41-43.
[8] Lu CL,Zhu L,Piao JH,et al.Chemical compositions extracted from Wikstroemia indica and their multiple activities[J].Pharm Biol,2012,50(2):225-231.
[9] 姜洪芳,白雪,牛慧彦,等.西瑞香素对肺癌A549细胞侵袭及迁移能力的影响[J].实用药物与临床,2016,19(2):131-134.
[10] 段志富,陈建伟,李祥.伞形科药用植物中香豆素类成分及其药理作用研究现状[J].中国药房,2008,19(3):223-225.
[11] Wang LY,Unehara T,Kitanaka S.Anti-inflammatory activity of new guaiane type sesquiterpene from Wikstroemia indica[J].Chem Pharm Bull,2005,53(1):137-139.
[12] 张金娟,熊英,张贵林,等.了哥王提取物及其不同提取部位的急性毒性研究[J].时珍国医国药,2011,22(11):2829-2830.
[13] 王建科,李玮,郭建民,等.不同炮制方法对了哥王中总黄酮含量的影响[J].贵阳中医学院学报,2011,33(1):17-19.
[14] 徐叔云,卞如濂.药理实验方法学[M].3版.北京:人民卫生出版社,2002:227-229.
Comparison of Acute Toxicity Effects of Ethanol Extract from Different Processed Products of Miao Medicine Wikstroemia indica on Mice
FENG Guo1,2,3,LI Wei1,3,HE Xin2,ZHENG Chuanqi1,LENG Anbi1,TIAN Xiaofang1
(1.School of Pharmacy,Guiyang College of TCM,Guiyang 550025,China;2.School of TCM,Tianjin University of TCM,Tianjin 300193,China;3.National Engineering and Technology Research Center of Miao Medicine,Guiyang 550025,China)
R285
A
1001-0408(2017)25-3536-05
2017-01-23
2017-05-22)
(编辑:林 静)
DOI10.6039/j.issn.1001-0408.2017.25.22
国家中医药管理局中医药部门公共卫生服务项目(No.国中医药科技中药便函〔2015〕132号);国家级大学生创新创业训练计划项目(No.201610662025);贵阳中医学院基金项目(No.贵中医科院内〔2016〕40号);贵州省高校工程技术研究中心建设项目(No.黔教合KY字〔2012〕021号)
*副教授,博士。研究方向:中药新制剂新技术、中药药动力学。E-mail:453989352@qq.com
