食管鳞癌肿瘤最大长径与浸润深度(T分期)的关系*
2017-10-10赵学科陈培楠范宗民胡守佳杜丹凤张向阳鲁建亮周福有王立东
吕 双,宋 昕,赵学科,陈培楠,范宗民,胡守佳,程 让,杜丹凤,张向阳,鲁建亮,王 苒,周福有,王立东#
1)郑州大学第一附属医院河南省食管癌重点开放实验室 郑州 450052 2)新乡医学院基础医学院病理学教研室 河南新乡 453003 3)安阳肿瘤医院胸外科 河南安阳 455000
食管鳞癌肿瘤最大长径与浸润深度(T分期)的关系*
吕 双1,2),宋 昕1),赵学科1),陈培楠1),范宗民1),胡守佳1),程 让1),杜丹凤1),张向阳1),鲁建亮1,2),王 苒1),周福有3),王立东1)#
1)郑州大学第一附属医院河南省食管癌重点开放实验室 郑州 450052 2)新乡医学院基础医学院病理学教研室 河南新乡 453003 3)安阳肿瘤医院胸外科 河南安阳 455000
食管鳞癌;肿瘤最大长径;浸润深度;T分期
目的:探讨食管鳞癌患者肿瘤最大长径(MTL)与浸润深度(T分期)的关系,为准确判断临床T分期及临床治疗方式选择提供依据。方法21 712例食管鳞癌患者中男性13 009例,女性8 703例。通过对根治术后食管大标本形态测量和镜下观察,记录每例患者MTL和肿瘤浸润程度(T分期)。分析食管鳞癌患者一般临床特征及MTL与T分期的关系,运用SPPS软件的决策树模型决定截点值,采用Spearman秩相关和logistic回归分析MTL和T分期的关系。结果21 712例食管鳞癌患者MTL为0.2~16.5(4.1±1.7) cm。Spearman秩相关显示MTL与T分期呈正相关(rS=0.355,P<0.001)。取3.9 cm为MTL的截点值,logistic回归分析显示,MTL>3.9 cm的患者,T2+T3期的发生风险比≤3.9 cm组明显上升7.146倍(95%CI=6.449~7.918,P<0.001)。男性患者MTL高于女性患者[(4.2±1.8) cmvs(3.9±1.6) cm,P<0.001]。 Spearman秩相关分析显示男性和女性患者MTL均与T分期呈正相关(男:rS=0.341,P<0.001;女:rS=0.369,P<0.001)。Logistic回归分析显示:MTL>3.9 cm时,男性和女性T2+T3期的风险均明显升高(男:7.251倍,95%CI=6.343~8.288,P<0.001;女:7.315倍,95%CI=6.234~8.584,P<0.001)。结论食管鳞癌MTL与T分期呈正相关,MTL>3.9 cm是灵敏反映T分期严重程度的截点值。
食管癌临床TNM分期对治疗方式选择具有非常重要的意义,特别是浸润深度(T分期)的准确评估对食管癌预后的判断非常重要,T分期越高的食管癌患者预后越差[1]。尽管目前临床上使用超声内镜对食管癌临床T分期具有较高的准确性,但是受技术和肿瘤体积的限制,超声内镜对不能通过的中晚期患者临床肿瘤浸润程度和淋巴结转移的判断仍有较大的局限性。一项有关超声内镜对早期食管癌术前分期准确性的meta分析[2]发现:受超声内镜检查者的经验、超声内镜选择及频率的种类、病变周围炎症和病变面积过大等诸多因素的影响,其检查的准确性仍然有待提高。然而,肿瘤最大长径(maximum tumor length,MTL)却极易通过临床影像学方法检测到。近年研究[3-4]提示,利用食管造影、内窥镜和PET-CT等方法可以评估食管癌临床T分期,但是,目前尚缺乏大样本循证医学对MTL和食管癌临床T分期关系研究的报道。因此,该研究旨在通过对21 712例食管鳞癌(esophageal squamous cell carcinoma,ESCC)患者的MTL和临床T分期进行相关性分析,为利用MTL准确判断临床T分期及临床治疗方式选择提供科学依据。
1 对象与方法
1.1研究对象21 712例ESCC 患者均来自河南省食管癌重点开放实验室50万例食管及贲门癌临床信息库(1975~2015年),其中男性13 009例,发病年龄29~87(60±8)岁;女性8 725例,发病年龄28~88(61±8)岁;男女比例1.491。
1.2临床信息复核在大范围流行病学调查的基础上,根据患者提供的治疗信息到相应的医院复核每位患者的一般临床信息和病理信息等。该研究主要记录ESCC患者临床病理特征,如性别、年龄、高低发区、肿瘤部位、分化程度、MTL、T分期、N分期和TNM分期等。
1.3病例纳入和病理分期标准病例纳入标准:①所有患者均经术后病理确诊为ESCC。②未合并其他恶性肿瘤,且非双灶或多灶ESCC患者。③所有患者均未行新辅助治疗,以排除放化疗使MTL缩小的情况。④术前及术中均未发现远处转移征象,术后病理中的T分期记录明确。⑤由于食管癌根治术后T4期资料仅有63例,因此T4期不进入分析标准。
病理分期标准:由于该研究病例时间跨度较大,病理分期参照2002年美国癌症联合委员会(AJCC)的TNM分期标准,原发肿瘤(primary tumor,T)定义:Tx为原发肿瘤不能确定,T0为无原发肿瘤证据,Tis为原位癌,T1为肿瘤侵及黏膜固有层或黏膜下层,T2为肿瘤侵及固有肌层,T3为肿瘤侵及纤维膜,T4为肿瘤侵及邻近器官。淋巴结记录阴性和阳性。
1.4病例分组依MTL将21 712例ESCC患者分为6组(MTL≤1 cm,1 cm
1.5统计学处理采用SPSS 21.0进行分析。应用χ2检验分析一般临床特征及MTL与T分期的关系;应用决策树模型决定截点值;应用Spearman秩检验和logistic回归分析ESCC患者MTL和T分期的关系。检验水准α=0.05。
2 结果
2.1ESCC患者一般临床特征及MTL与T分期的关系见表1。21 712例ESCC患者平均MTL为0.2~16.5(4.1±1.7) cm。男性患者平均MTL大于女性患者[(4.2±1.8) cmvs(3.9±1.6) cm,t=14.771,P<0.001]。 MTL为3~4 cm组患者比例最高(26.4%,5 733/21 712),≤1 cm组患者比例最少(2.4%,521/21 712)。不同MTL组年龄分布均以60~69岁为主,且各组间性别、年龄分布、高(低)发区、肿瘤部位、分化程度和N分期等差异均有统计学意义(P<0.001)。
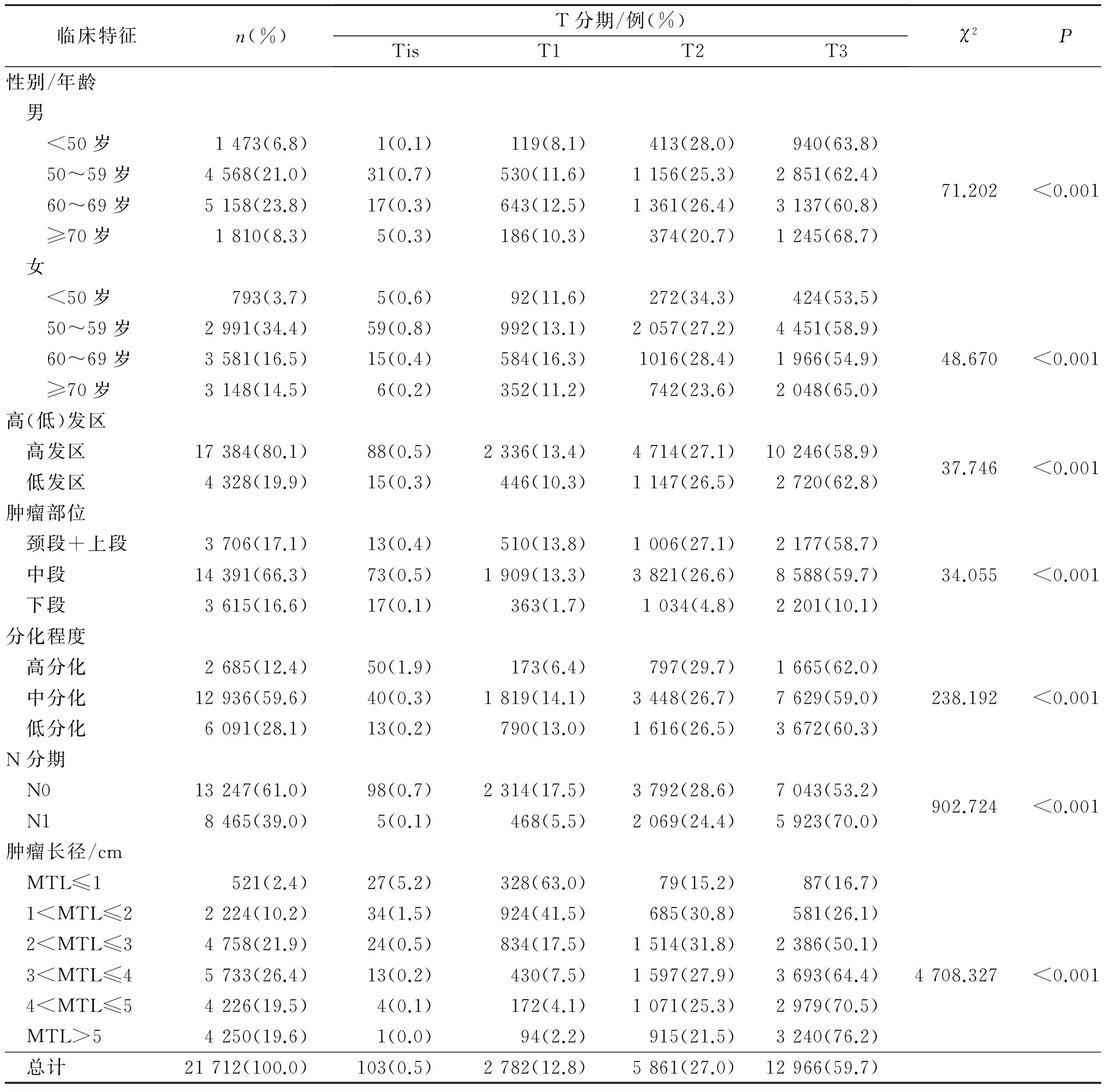
表1 21 712例ESCC患者一般临床特征及MTL与T分期的关系
2.2MTL与T分期关系分析见表2。Spearman秩相关表明,ESCC患者的MTL与T分期呈正相关。随肿瘤长径增长,T分期升高(rS=0.355,P<0.001)。Spearman秩相关分析显示男性和女性患者MTL均与T分期呈正相关(男:rS=0.341,P<0.001;女:rS=0.369,P<0.001)。
2.3决定MTL截点值见图1。运用SPPS软件的决策树模型决定截点值为3.9 cm,调整因素(将性别、年龄、高低发区、肿瘤部位、分化程度、N分期作为调整因素)后的logistic回归分析显示,MTL>3.9 cm的患者,T2+T3期的发生风险比≤3.9 cm组明显上升7.146倍(95%CI=6.449~7.918,P<0.001)。MTL>3.9 cm时,男性和女性T2+T3期的风险均明显升高(男:7.251倍,95%CI=6.343~8.288,P<0.001;女:7.315倍,95%CI=6.234~8.584,P<0.001)。
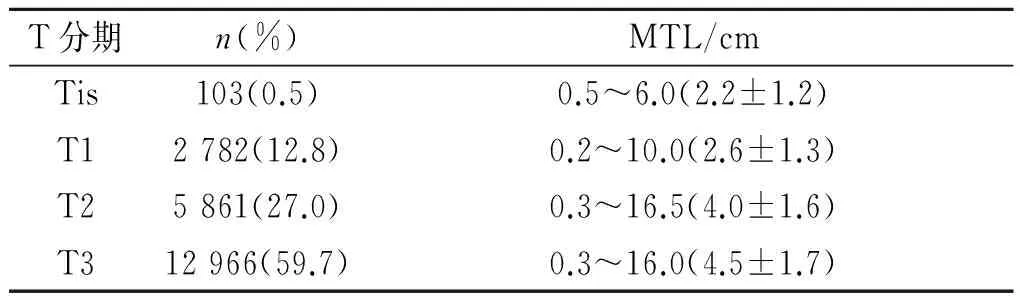
表2 21 712例ESCC患者肿瘤长径和T分期的关系
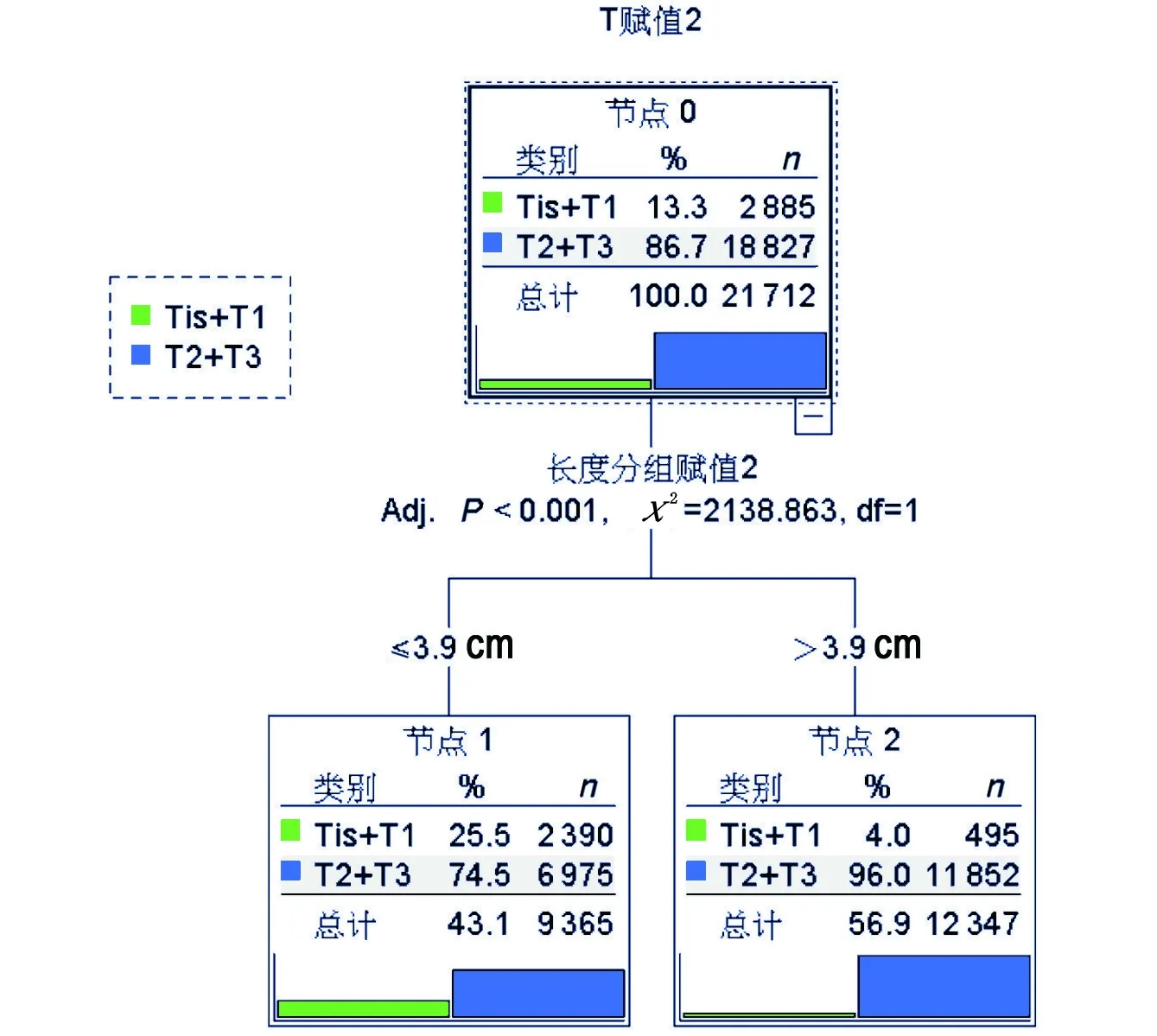
图1 长度分组的决策树
3 讨论
该研究通过回顾性分析21 712例ESCC患者的临床资料,发现T分期随MTL的增长而升高。取3.9 cm为截点值,logistic回归分析显示,MTL>3.9 cm的患者,T2+T3期的发生风险比≤3.9 cm组明显上升7.146倍。结果提示,临床上可通过影像学方法准确测量术前MTL,从而间接地判断T分期。
该研究组前期研究[5]已经发现:和活体食管正常组织段长度相比,食管离体后的新鲜组织和固定后组织的收缩系数分别是为0.42和0.31,食管组织总收缩系数为0.64。因此,在进行食管癌有关MTL方面的研究时,应充分考虑测量长度的标本状态以及不同状态下癌组织的收缩变化对MTL的影响 。作者在该论文中所讨论的MTL全部来自医院术后病理报告,所以病例统一为离体后新鲜组织的MTL。
该研究中病例Tis期的MTL均是通过打开食管癌术后标本测量的。然而,从临床上讲,由于Tis期的病变范围很小,早期食管癌的重要特征是食管的黏膜皱襞中断,术前很难精确测量早期癌的MTL。因此,该研究对于极早期食管癌病变的价值尚待进一步探讨。
目前关于食管癌MTL截点值对T分期影响有较多争议[6-8]。另外,其取截点值的方法也各不相同,有取中位病变长度的[7],还有利用ROC曲线取值的[8]。作者利用SPSS软件的回归树检验,将MTL及T分期设为变量值,结果提示3.9 cm是T2+T3期风险率迅速上升的截点值。因此取3.9 cm为截点值在该研究中对于更高T分期的判断更为有利,此截点值得获取方法与文献[6,9-10]等报道类似。
最初在1983年AJCC的TNM分期中,将MTL作为指导预后的重要因素,T分期根据MTL大小界定,最长径<5 cm为T1期,≥5 cm为T2期[11]。1987年AJCC将浸润深度取代MTL作为T分期新标准一直沿用至今[12]。虽然MTL最终未列入其后的AJCC分期中,但是不断有研究探讨其在评判T分期的情况和食管癌预后中的作用。Wu等[7]提出MTL是影响食管癌患者生存的独立预测因子; Wu等[13]分析了1 435例ESCC根治术后患者MTL的预后和预测意义,提出:MTL是影响食管癌生存的独立预测因子;作为一个预测模型,它可以增加TNM分期系统预测预后的准确性,但是不能增加TNM分期系统的临床实用性。Ma等[14]提出了MTL是影响食管癌生存的独立预测因子,尤其对于淋巴结阴性和低分期患者。邵明雯等[10]分析了686例淋巴结阴性食管癌患者的临床病理资料及生存时间,发现食管癌的MTL与浸润深度关系密切,建议将MTL纳入T分期,且可将≤3 cm归为T1、T2分期,>3 cm归为T3分期。淋巴结阴性食管癌的MTL是一个重要的预后因素,可以据此区分食管癌术后的高风险人群。Yendamuri等[15]建议应该在现行的食管癌分期系统中考虑进病变长度等因素,并为进一步治疗定义出高风险人群。
但与之完全相反,Tachibana等[16]首次回顾性分析129例日本ESCC手术患者临床病理和术后生存的关系,单因素生存分析发现MTL与预后相关,但是多因素分析未能肯定MTL是预后独立影响因子这一观点,可能与治疗方式包含放化疗导致MTL变化有关。Bollschweiler等[17]的研究也提示类似结果。陈砚凝等[18]在ESCC患者预后的多因素分析中发现MTL不是影响预后的独立因素。研究结果不一致的原因可能为样本来源和样本量的不同有关。MTL和食管癌预后的研究文献详见表4。
综上所述,该研究通过大样本量分析,发现ESCC患者MTL与T分期有关,同时也是影响预后的重要因素。因此作者考虑可将MTL纳入TNM分期系统中,尤其作为T分期参考标准,指导患者治疗和预后。课题组后续研究将使用生存分析来精确对比现有TNM分期和MTL联合TNM分期的预后差异,以期对MTL的临床应用有更准确的认识。
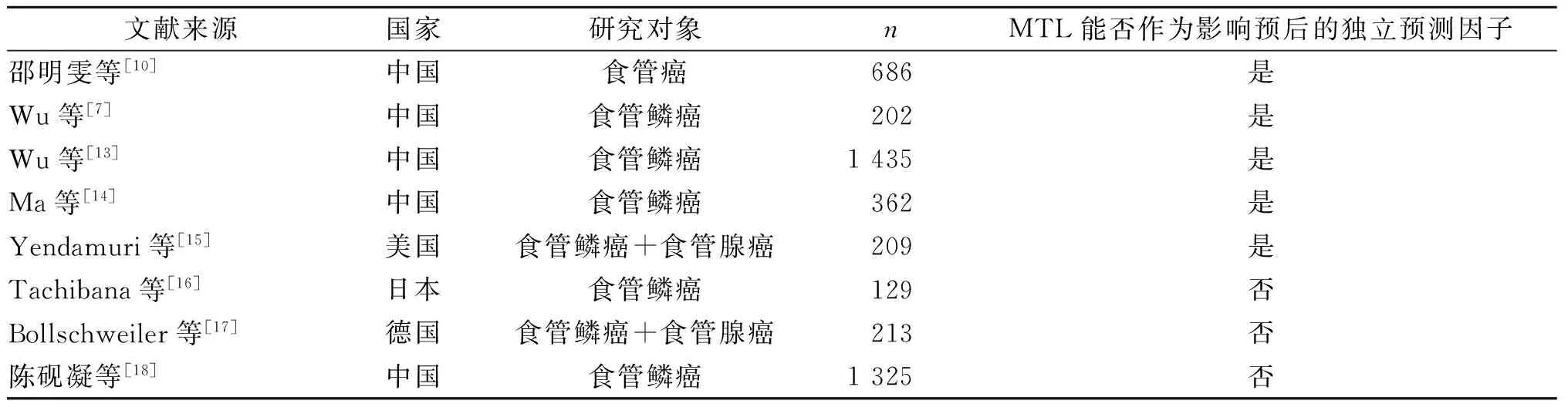
表4 MTL和食管癌预后的研究文献
[1] 何健,王杰军,钱建新,等.第6版和第7版UICC-AJCC TNM分期预测食管癌根治性切除术后生存情况的比较:基于400例食管癌患者的临床分析[J].肿瘤,2013,33(2):164
[2] 周思思,严苏,陈卫昌,等.超声内镜对早期食管癌术前分期准确性的Meta分析[J].世界华人消化杂志,2014,22(7):988
[3] 王军,祝淑钗,韩春,等.CT扫描食管造影和内窥镜测量食管癌病变长度的价值[J].中国肿瘤临床,2008,35(17):967
[4] JEGANATHAN R,MCGUIGAN J,CAMPBELL F,et al.Does pre-operative estimation of oesophageal tumour metabolic length using 18F-fluorodeoxyglucose PET/CT images compare with surgical pathology length?[J].Eur J Nucl Med Mol Imaging,2011,38(4):656
[5] 申秋,王立东,常扶保,等.食管癌和贲门癌手术切除标本离体前后及固定后的收缩变化[J].郑州大学学报(医学版),2009,44(1):37
[6] GAUR P,SEPESI B,HOFSTETTER WL,et al.Endoscopic esophageal tumor length[J].Cancer,2011,117(1):63
[7] WU N,PANG LW,CHEN ZM,et al.Tumour length is an independent prognostic factor of esophageal squamous cell carcinomas[J].Chin Med J,2012,125(24):4445
[8] FENG JF,HUANG Y,ZHAO Q.Tumor length in elderly patients with esophageal squamous cell carcinoma: is it a prognostic factor?[J].Ups J Med Sci,2013,118(3):145
[9] WANG BY,LIU CY,LIN CH,et al.Endoscopic tumor length is an Independent prognostic factor in esophageal squamous cell carcinoma[J].Ann Surg Oncol,2012,19(7):2149
[10]邵明雯,陈亮,李红霞,等.病变长度对淋巴结阴性食管癌患者的临床病理及预后影响[J].中国癌症杂志,2014,24(11):846
[11]THOMPSON WM.Esophageal cancer[J].Int J Radiat Oncol Biol Phys,1983,9(10):1533
[12]SOBIN LH,HERMANEK P,HUTTER RV.TNM classification of malignant tumors:a comparison between the new (1987) and the old editions[J].Cancer,1988,61(11):2310
[13]WU J,CHEN QX.Prognostic and predictive significance of tumor length in patients with esophageal squamous cell carcinoma undergoing radical resection[J].BMC Cancer,2016,16(394):394
[14]MA MQ,YU ZT,TANG P,et al.Is tumor length a prognostic indicator for esophageal squamous cell carcinoma? A single larger study among Chinese patients[J].Int J Clin Exp Pathol,2015,8(5):5008
[15]YENDAMURI S,SWISHER SG,CORREA AM,et al.Esophageal tumor length is independently associated with long-term survival[J].Cancer,2009,115(3):508
[16]TACHIBANA M,KINUGASA S,DHAR DK,et al.Prognostic factors after extended esophagectomy for squamous cell carcinoma of the thoracic esophagus[J].J Surg Oncol,1999,72(2):88
[17]BOLLSCHWEILER E,BALDUS SE,SCHRÖDER W,et al.Staging of esophageal carcinoma:length of tumor and number of involved regional lymph nodes. Are these independent prognostic factors?[J].J Surg Oncol,2006,94(5):355
[18]陈砚凝,刘月平,张玲玲,等.食管鳞状细胞癌预后的多因素分析[J].中华肿瘤防治杂志,2013,20(14):1094
(2017-03-19收稿 责任编辑赵秋民)
Relationship between the maximum tumor length and invasion depth(T Stage) in esophageal squamous cell carcinoma
LYUShuang1,2),SONGXin1),ZHAOXueke1),CHENPeinan1),FANZongmin1),HUShoujia1),CHENGRang1),DUDanfeng1),ZHANGXiangyang1),LUJianliang1,2),WANGRan1),ZHOUFuyou3),WANGLidong1)
1)HenanKeyLaboratoryforEsophagealCancerResearch,theFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052 2)DepartmentofPathology,SchoolofBasicMedicalSciences,Xinxiang,HenanMedicalUniversity,Xinxiang,Henan453003 3)DepartmentofThoracicSurgery,AnyangTumorHospital,Anyang,Henan455000
esophageal squamous cell carcinoma;maximum tumor length;depth of infiltration;T stage
Aim: To characterize the relationship between the maximum tumor length(MTL) and invasion depth(T stage) of esophageal squamous cell carcinoma(ESCC) for clinical T stage classification and precision treatment. Methods: A total of 21 712 cases of ESCC consisted of 13 009 males and 8 703 females. MTL and depth of infiltration(T stage) for each patient were recorded based on surgical specimen measurement and light microscopy observation. The decision tree model based on SPSS software was applied to determine the cut-off point of MTL. Spearman rank correlation and logistic regression were used to analyze the relationship between MTL and T stage. Results: The average MTL for 21 712 ESCC patients was 0.2-16.5(4.1±1.7) cm. Spearman rank correlation analysis indicated a positive correlation between MTL and T stage (rS=0.355,P<0.001). Logistic regression analysis showed that the risk of T2 and T3 increased 7.146 times in the patients with a cut-off value of MTL>3.9 cm(95%CI=6.449-7.918,P<0.001). The average MTL in male patients was higher than that in females[(4.2±1.8) cmvs(3.9±1.6) cm,P<0.001]. An apparent positive correlation of MTL and T stage was observed both in males(rS=0.341,P<0.001) and females(rS=0.369,P<0.001). Logistic regression analysis indicated that the risk of T2 and T3 increased at the cut-off value of MTL>3.9 cm both in males and females(male:7.251 times, 95%CI=6.343-8.288,P<0.001;female:7.315 times, 95%CI=6.234-8.584,P<0.001). Conclusion: The present study demonstrates a positive correlation between MTL and T stage in ESCC. MTL>3.9 cm is a sensitive cut-off point to reflect the severity of T stage.
10.13705/j.issn.1671-6825.2017.05.002
R735.1
*国家自然科学基金委员会和广东省联合重大项目资助 U1301227;河南省科技重大专项资助 161100311300
#通信作者,男,1958年8月生,博士,教授,研究方向:食管/贲门癌变机制与防治,E-mail:ldwang2007@126.com