柚皮素对ApoE-/-小鼠血脂及主动脉粥样斑块MMP水平的影响
2017-10-09何文凤陈玲杨颖蒲丽君杜倩张敏李卫东朱莉陈芸吕湛
何文凤,陈玲,杨颖,蒲丽君,杜倩,张敏,李卫东,朱莉,陈芸,吕湛
(川北医学院附属医院,四川南充637000)
·基础研究·
柚皮素对ApoE-/-小鼠血脂及主动脉粥样斑块MMP水平的影响
何文凤,陈玲,杨颖,蒲丽君,杜倩,张敏,李卫东,朱莉,陈芸,吕湛
(川北医学院附属医院,四川南充637000)
目的探讨柚皮素对ApoE-/-小鼠血脂及主动脉粥样斑块基质金属蛋白酶(MMP)水平的影响。方法将45只ApoE-/-雄性小鼠随机分为对照组、柚皮素组、阿托伐他汀组各15只。三组均给予高脂饲料喂养,同时柚皮素组加柚皮素100 mg/kg灌胃,阿托伐他汀组加阿托伐他汀10 mg/kg灌胃。喂养12周,测量其体质量;收集颈动脉血液,检测血脂;取部分心脏及主动脉制作石蜡切片,HE染色观察并测量主动脉斑块面积;Masson染色检测主动脉根部粥样硬化斑块胶原含量;免疫组化法检测主动脉根部粥样硬化斑块内MMP-2、MMP-3、MMP-9及基质金属蛋白酶组织抑制因子1(TIMP-1)表达。结果ApoE-/-小鼠饲养12周,三组体质量比较差异均无统计学意义(P均>0.05)。阿托伐他汀组甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)较其他两组降低(P均<0.05),高密度脂蛋白胆固醇(HDL-C)较柚皮素组、对照组升高(P均<0.05);柚皮素组、对照组TG、TC、LDL-C、HDL-C比较差异无统计学意义(P均>0.05)。对照组ApoE-/-小鼠主动脉形成粥样斑块,内膜增厚;柚皮素组与阿托伐他汀组主动脉粥样斑块面积明显减少。与对照组比较,柚皮素组与阿托伐他汀组胶原占比升高(P<0.05)。柚皮素组与阿托伐他汀组比较差异均无统计学意义(P>0.05)。与对照组比较,柚皮素组与阿托伐他汀组主动脉根部粥样硬化斑块MMP-2、MMP-3、MMP-9阳性细胞百分比降低(P均<0.05),TIMP-1阳性细胞百分比升高(P均<0.05);柚皮素组与阿托伐他汀组比较差异均无统计学意义(P均>0.05)。结论柚皮素对ApoE-/-小鼠血脂无影响,但可降低主动脉粥样斑块MMP表达。
主动脉粥样斑块;柚皮素;血脂;基质金属蛋白酶;小鼠
脂质代谢异常是动脉粥样硬化最重要的危险因素。动脉粥样硬化常见于高胆固醇血症[1]。研究显示,在动脉粥样硬化斑块周围基质金属蛋白酶(MMP)-2、MMP-3、MMP-9表达异常;MMP-2、MMP-9可促进平滑肌细胞迁移、增殖,从而促进动脉粥样硬化斑块的形成、破裂;而基质金属蛋白酶组织抑制因子1(TIMP-1)可调节MMP的活性,TIMP-1高表达可以减少动脉内膜增厚,从而延缓动脉粥样硬化斑块的形成[2~4]。柚皮素是柚皮甙的甙元,属于二氢黄酮类化合物,具有抗炎、抗癌、解痉和利胆作用,临床应用于治疗细菌感染,镇静、抗癌;其具有抗氧化、抗肿瘤形成与生长等活性。但其在天然植物中的含量并不高,需要复杂的提取、分离工艺[5]。研究认为,柚皮素可影响高脂饮食喂养的载脂蛋白E(ApoE)基因缺陷(ApoE-/-)小鼠Hcy代谢的关键酶对甘氨酸N-甲基转移酶(GNMT)的磷酸化[6]。我们前期研究也发现,大剂量(100 mg/kg)柚皮素可抑制ApoE-/-小鼠主动脉粥样硬化斑块的形成[7]。而关于柚皮素对ApoE-/-小鼠基质金属蛋白酶的影响鲜有报道。2015年5月~2016年,本研究对此进行探讨,为柚皮素的临床应用提供参考。
1 材料与方法
1.1 材料 SPF级ApoE-/-雄性小鼠45只(购于北京大学动物中心),6周龄,体质量18~20 g,采用标准的昼夜采光、合适温度、湿度进行饲养,自由饮食。柚皮素,购于陕西慧科植物开发有限公司,含量≥98%。胆固醇购自成都科龙化工试剂厂、猪油购自郑州阳光食品配料有限公司;甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白(HDL-C)检测试剂盒购自浙江东瓯生物工程有限公司;戊巴比妥钠购自北京普博斯生物,阿托伐他汀购自辉瑞制药有限公司;兔抗鼠MMP-2、MMP-3、MMP-9及TIMP-1抗体购自博士德生物工程有限公司,苏木素染液、伊红染液购自北京中杉生物技术公司;兔抗鼠MMP-2、MMP-3、MMP-9及TIMP-1多克隆抗体购自英国Abcam;辣根过氧化物酶标记羊抗兔IgG购自北京中科晨宇科技有限公司;全蛋白提取试剂盒、BCA蛋白含量检测试剂盒购自南京凯基生物科技发展有限公司;PBS缓冲液购自博士德生物工程有限公司。离心机购自美国Thermo Scientific,显微镜购自上海安信光学仪器制造有限公司,化学发光成像系统购自美国UVP。
1.2 动物分组及模型构建 将ApoE-/-小鼠随机分为对照组、柚皮素组、阿托伐他汀组,每组15只。小鼠均适应性饲养1周后进行实验。对照组给予高脂饲料(普通小鼠饲料+1.25%胆固醇+15%猪油);柚皮素组给予高脂饲料的同时加柚皮素100 mg/kg灌胃;阿托伐他汀组给予高脂饮食的同时加阿托伐他汀10 mg/kg灌胃。以上均1次/d,三组小鼠均自由饮食,喂养12周。
1.3 血脂检测 最后1次喂养后禁饮食12 h,用0.3%戊巴比妥钠腹腔注射,麻醉成功后将小鼠仰卧固定于手术台上,消毒,于颈中线偏右侧行纵形切口,分层剪开组织,暴露手术视野,分离右侧颈动脉,用血管夹夹住其近心端,在远心端处剪破部分右侧颈动脉,将装有1%肝素生理盐水的动脉导管经破口处插入,松开血管夹。用多通道生理信号采集系统监测血压。拔出动脉导管,剪开右颈动脉,收集颈动脉血液,静置30 min,以3 000 r/min离心15 min,取血清,于-80 ℃保存。取三组血清样本,检测TG、TC、LDL-C、HDL-C。
1.4 主动脉斑块观察及面积测量 收集颈动脉血液后用眼科剪逐层分开胸腹腔,分离心脏、主动脉,剪断腹主动脉,用注射器吸取加入肝素的PBS溶液,从左心室靠心尖处刺入反复冲洗心脏及主动脉,取下心脏及全段主动脉,分离周围脂肪及组织,取部分心脏及主动脉经甲醛固定、脱水、石蜡包埋,于-80 ℃保存。切片、脱蜡至水后HE染色,苏木素染色20 min,自来水冲洗1 min,1%盐酸乙醇分化1~3 s,自来水冲洗10 s,碳酸锂水溶液复蓝15 s,自来水冲洗1 min,1%伊红染色30 s,自来水冲洗1 min,于80%乙醇2~3 s,95%乙醇2~3 s/次,入无水乙醇2次,2~3 s/次;入二甲苯2次,5 min/次,晾干封片。用显微镜观察采集图像,用Image pro-Plus6.0分析动脉粥样硬化的面积。
1.5 主动脉根部粥样硬化斑块胶原含量检测 取石蜡切片,脱蜡至水后Masson染色。用R1核染液染色2次,60 s弃染液,用冲洗液冲洗30 s;用R2浆染液染色,30~60 s弃染液,用冲洗液冲洗30 s;R3黄色分色液分色,6~8 min至胶原纤维部分呈粉红色,弃分色液;R4蓝色复染液染色,5 min后弃复染液,以无水乙醇反复冲洗、吹干、封片。用显微镜观察采集图像,蓝色为阳性染色。用Image pro-Plus6.0软件计算粥样硬化斑块内的胶原含量,胶原含量=阳性染色面积/斑块总面积×100%。
1.6 主动脉根部粥样硬化斑块内MMP-2、MMP-3、MMP-9及TIMP-1表达检测 采用免疫组化法。取石蜡切片,脱蜡至水后用免疫组化法检测。PBS冲洗,3% H2O2室温下孵育,蒸馏水冲洗,抗原修复,5%羊血清封闭,室温孵育20 min去血清,滴加兔抗小鼠一抗,于4 ℃冰箱过夜,PBS洗涤3次,5 min/次,滴加山羊抗兔二抗,于37 ℃孵育20 min;PBS洗涤3次,5 min/次;滴加DAB显色,光镜下观察,适时终止反应;自来水清洗,滴加苏木素复染,自来水清洗终止反应。切片脱水、透明、晾干、封片。采集图像,用Image pro-Plus6.0对主动脉根部粥样硬化斑块内MMP-2、MMP-3、MMP-9及TIMP-1阳性表达进行定量分析,计算阳性细胞百分比。

2 结果
2.1 柚皮素对ApoE-/-小鼠血脂及体质量的影响 ApoE-/-小鼠饲养12周,三组体质量比较差异均无统计学意义(P均>0.05)。阿托伐他汀组TG、TC、LDL-C较柚皮素组、对照组降低(P均<0.05),HDL-C较柚皮素组、对照组升高(P均<0.05);柚皮素组、对照组TG、TC、LDL-C、HDL-C比较差异无统计学意义(P均>0.05)。见表1。

表1 三组ApoE-/-小鼠血脂及体质量比较
2.2 柚皮素对ApoE-/-小鼠主动脉斑块形成的影响 对照组ApoE-/-小鼠主动脉形成粥样斑块,内膜增厚;柚皮素组与阿托伐他汀组主动脉粥样斑块面积明显减少。
2.3 柚皮素对ApoE-/-小鼠主动脉根部粥样硬化斑块胶原含量的影响 经Masson染色显示,对照组蓝色减少,可见其胶原含量减少。柚皮素组与阿托伐他汀组蓝色增多,其胶原含量增多。经定量分析,对照组胶原占比为23.74%±6.93%,柚皮素组胶原占比为33.06%±7.14%,阿托伐他汀组胶原占比为34.17%±7.14%。与对照组比较柚皮素组与阿托伐他汀组胶原占比升高(P均<0.05),柚皮素组与阿托伐他汀组比较差异均无统计学意义(P>0.05)。
2.4 柚皮素对ApoE-/-小鼠主动脉根部粥样硬化斑块MMP-2、MMP-3、MMP-9及TIMP-1表达的影响 免疫组化法检测结果:与对照组比较,柚皮素组与阿托伐他汀组主动脉根部粥样硬化斑块MMP-2、MMP-3、MMP-9阳性细胞百分比降低(P均<0.05),TIMP-1阳性细胞百分比升高(P均<0.05)。柚皮素组与阿托伐他汀组比较差异均无统计学意义(P均>0.05)。见表2。
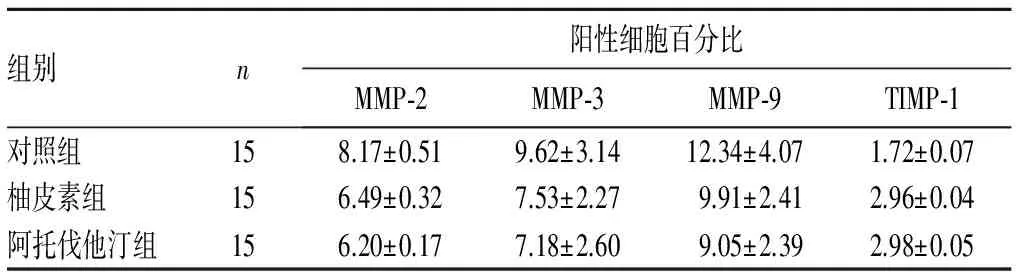
表2 三组主动脉根部粥样硬化斑块MMP-2、MMP-3、MMP-9及TIMP-1阳性细胞百分比比较(%)
3 讨论
动脉粥样硬化是动脉硬化血管病中最常见、最重要的一种[8]。高脂饮食是其危险因素之一[9]。在动脉粥样硬化形成过程中可在多个环节进行干预,其重要的分子靶标之一是ApoE。ApoE是一种富含精氨酸的碱性蛋白,也是一种多态性蛋白,参与脂蛋白的转化与代谢过程,其基因可以调节许多生物学功能。ApoE是LDL受体的配体,也是肝细胞CM残粒受体的配体,它与脂蛋白代谢有密切相关性;ApoE具有多态性,多态性是决定个体血脂水平与动脉粥样硬化发生发展密切相关。ApoE可调节TC水平,通过低密度脂蛋白受体及非低密度脂蛋白受体清除血脂,调控TG[10]。ApoE-/-小鼠,导致其血浆内含TC丰富的残粒清除受阻,是动脉粥样硬化动物实验中常用的模型。ApoE-/-小鼠在非高脂喂养20周其主动脉即存在严重动脉粥样硬化,而高脂喂养条件下,形成动脉粥样硬化斑块的时间明显缩短[11]。本研究造模12周即在其主动脉根部明显形成粥样硬化斑块。我们前期研究发现,100 mg/kg柚皮素可抑制ApoE-/-小鼠主动脉粥样硬化斑块的形成,因此本研究继续使用该剂量的柚皮素,并将使用阿托伐他汀干预的小鼠作为对照。饲养12周,三组体质量比较差异无统计学意义,说明柚皮素、阿托伐他汀均对小鼠的体质量无不良影响。
血脂升高在动脉粥样硬化与冠心病的形成过程中起重要作用。但我们前期研究认为柚皮素可以降低ApoE-/-小鼠血浆Hcy 浓度,但对血脂水平无影响[7]。本研究也再次证明了柚皮素对ApoE-/-小鼠血脂水平无影响。对照组ApoE-/-小鼠经高脂饲料喂养12周其主动脉形成粥样斑块,内膜增厚;而柚皮素组与阿托伐他汀组主动脉粥样斑块面积明显减少。研究认为柚皮素较柚皮苷具有更强的松弛血管和抗氧化作用。分析原因可能为柚皮素为柚皮苷7 位羟基被一分子新橙皮糖取代所生成的黄酮苷,当黄酮上的羟基被大面积的二糖取代后会减弱黄酮与生物大分子之间的结合能力[12~14]。阿托伐他汀可通过降低LDL-C、改善内皮功能、抗氧化、稳定易损斑块等机制有效降低冠心病发病率和病死率,是目前公认的一线降脂药。本研究结果证明柚皮素与阿托伐他汀均可有效减少主动脉粥样斑块形成,但却没有阿托伐他汀的降脂作用。与有关研究结果不一致,可能与柚皮素的浓度、给药时间有关。
胶原在动脉粥样硬化发生发展过程中扮演重要角色。在动脉粥样硬化斑块尤其是不稳定斑块中,胶原含量少,且胶原越少的部位斑块越容易发生破裂。本研究经Masson染色显示,与对照组比较柚皮素组与阿托伐他汀组胶原占比升高,柚皮素组与阿托伐他汀组比较差异均无统计学意义。可见柚皮素可有效预防胶原减少。MMP及TIMP-1是影响动脉粥样斑块中胶原含量的主要酶系。MMP及TIMP-1主要来源于平滑肌细胞、内皮细胞及成纤维细胞,其主要功能是降解细胞外基质成分。MMP-2、MMP-9均能降解细胞外基质,MMP-2、MMP-3、MMP-9在动脉粥样斑块中的表达升高,促使易损斑块形成。而TIMP-1是MMP的抑制剂,二者形成共价性MMP- TIMP-1复合体,从而抑制MMP活化,阻止其对细胞外基质的降解。本研究中免疫组化法检测结果,与对照组比较,柚皮素组与阿托伐他汀组主动脉根部粥样硬化斑块MMP-2、MMP-3、MMP-9阳性细胞百分比降低,TIMP-1阳性细胞百分比高,柚皮素组与阿托伐他汀组比较差异均无统计学意义。因此可以认为,柚皮素通过抑制主动脉粥样硬化斑块MMP-2、MMP-3、MMP-9表达,促进TIMP-1表达来抑制动脉粥样硬化斑块的形成。
综上所述,柚皮素对ApoE-/-小鼠血脂无影响,但可抑制主动脉粥样斑块MMP表达。柚皮素可以抑制ApoE-/-小鼠动脉粥样硬化斑块的形成,但该作用不是通过调节血脂水平实现的,可能通过抑制主动脉粥样硬化斑块MMP-2、MMP-3、MMP-9表达,促进TIMP-1表达实现的。
[1] 部攀,卢婷,赵坤,等.老年患者血甘油三酯水平与外周动脉粥样硬化发病关系的研究[J].中华老年心脑血管病杂志,2016,18(6):604-607.
[2] Rath T, Roderfeld M, Graf J, et al. Matrix metalloproteinases in inflammatory bowel disease - from basic research to clinical significance[J]. Z Gastroenterol, 2009,47(8):758-769.
[3] Johnson JL, Dwivedi A, Somerville M, et al. Matrix metalloproteinase (MMP)-3 activates MMP-9 mediated vascular smooth muscle cell migration and neointima formation in mice[J]. Arterioscler Thromb Vasc Biol, 2011,31(9):e35-e44.
[4] 朱鹏立,蒋娜,尚秀玲,等.白藜芦醇对兔动脉粥样硬化血脂及反映斑块稳定性的MMP-9/TIMP-1比值的影响[J].心血管康复医学杂志,2010,19(5):464-469.
[5] 梅繁勃,王文妍,李冬梅,等.柚皮素对缺血再灌注损伤心肌保护作用的机制研究[J]. 实用药物与临床,2016,19(5):541-544.
[6] Moller MT, Samari HR, Fengsrud M, et al. Okadaic acid-induced,naringin-sensitive phosphorylation of glycine N-methyltransferase in isolated rat hepatocytes[J].Biochem J, 2003,373(2):505-513.
[7] 杨颖,罗晖,吕湛.柚皮苷与柚皮素对ApoE-/-小鼠主动脉粥样硬化斑块形成的作用[J].医药导报,2016,35(11):1181-1185.
[8] 刘悦,毕齐,刘向荣.高血压、糖尿病、高脂血症对老年脑梗死患者颈动脉粥样硬化的作用[J]. 实用老年医学,2016,31(1):58-60.
[9] 杨文,薛希福,刘宝平.糖代谢异常和糖尿病患者颈动脉粥样硬化的观察[J].临床心血管病杂志,2006,22(1):50-51.
[10] 刘燕,张军,蒲强红,等.瑞舒伐他汀减轻ApoE-/-小鼠动脉硬化形成与ST6Gal-Ⅰ表达相关性研究[J].中国药理学通报,2016,32(4):525-530.
[11] 王庆航,陈越峰,陶琳琳,等.白细胞介素35对ApoE-/-小鼠炎症及动脉粥样硬化的影响[J].中国动脉硬化杂志,2016,24(4):334-338.
[12] Machha A, Anwarul HG, Mohd RM. Effects of flavonoids on vascular smooth muscle of the isolated rat thoracic aorta[J]. Life Sci, 2003,74(5):603-612.
[13] Chan T, Galat I, Brien PJ. Oxygen activation during peroxidase catalysed metabolism of flavones or flavanones[J]. Interact, 1999, 122(1):15-25.
[14] Moraa A, Pay M, Rios JL. Structure-activity relationships of polymethoxy flavones and other flavonoids asinhibitors of non-enzymic lipid peroxidation[J]. Biochem Pharm, 1990,40(4):793-797.
10.3969/j.issn.1002-266X.2017.33.008
R543.1
A
1002-266X(2017)33-0026-04
四川省教育厅重点项目(14ZA0199)。
吕湛(E-mail: 2567045248@qq.com)
2017-03-01)
