先天性心脏病患儿CPB后低氧血症发生的危险因素分析
2017-10-09周春龙张利兵郭浪涛徐晓燕
周春龙, 张利兵, 郭浪涛, 徐晓燕, 付 强
(1.四川省成都市妇女儿童中心医院小儿外科, 四川 成都 610091 2.成都医学院第一附属医院心胸外科, 四川 成都 610000)
先天性心脏病患儿CPB后低氧血症发生的危险因素分析
周春龙1, 张利兵1, 郭浪涛1, 徐晓燕1, 付 强2
(1.四川省成都市妇女儿童中心医院小儿外科, 四川 成都6100912.成都医学院第一附属医院心胸外科, 四川 成都610000)
目的探究先天性先脏病患者CPB(体外循环)后低氧血症发生的危险因素。方法选取本院2016年1月至2017年1月期间接收的98例先天性心脏病患儿病例资料,所有患儿均行手术治疗,CPB后有45例出现低氧血症,其余53例未出现低氧血症,经单因素及Logistic多因素回归分析CPB后低氧血症危险因素。结果低氧血症组患儿术后2h、6h以及12h和24hPaO2/FiO2水平均显著低于非低氧血症组,组间差异存在统计学意义(P<0.05)。进行单因素分析可见,低氧血症组和非低氧血症组患儿的年龄、体重、术前存在右向左分流、术前肺动脉高压、术中机械通气模式差异存在统计学意义(P<0.01);经Logistic多因素回归分析发现,年龄小、肥胖以及术前合并右向左分流及肺动脉高压是诱发先天性心脏病CPB后低氧血症的高危因素。结论先天性心脏病患儿CPB后低氧血症的发生和患儿的低龄、肥胖以及术前合并右向左分流及肺动脉高压密切相关。
先天性心脏病; CPB; 低氧血症; 危险因素
先天性心脏病体外循环心脏手术后并发症较多,虽大多数未见典型临床表现,但一旦发生将延长患儿住院时间,继而增加医疗费用,加重家庭经济负担,所以,应得到临床医生广泛重视[1]。回顾近几年相关文献[2,3]发现,CPB术后低氧血症发生率仍居高不下,相关文献统计,先天性心脏病患儿CPB后低氧血症发生率高达30.6%,并进一步分析提出,患儿年龄、CPB时间、既往手术史等是低氧血症发生的高危因素。但也有研究者[4]持不同观点,表示低体重先天性心脏病患儿CPB后更易并发低氧血症。目前临床有关先天性心脏病患儿CPB后低氧血症发生的危险因素尚未统一标准,鉴于此,本文特通过单因素和多因素Logistic回归分析,统计先天性心脏病患儿CPB后低氧血症发生的危险因素,详细内容如下:
1 资料与方法
1.1一般资料:选取本院2016年1月至2017年1月期间接收的98例先天性心脏病患儿病例资料,纳入标准:家属知情、同意,并签订知情同意书;病例资料完整;排除主动脉缩窄治疗等根治手术治疗、姑息手术治疗、术前合并呼吸功能不全者、术中TEE或术后经胸超声心动图检查显示残留右向左分流;排除其他重要脏器功能障碍者;所有患儿均行手术治疗,CPB后有45例出现低氧血症(男性患儿26例,女性患儿19例,年龄在0~26个月,平均5.05±0.25个月,体重在4~24kg),其余53例未出现低氧血症(男性患儿29例,女性患儿24例,年龄在1~25个月,平均5.98±1.05个月,体重在3~32kg)。两组患儿一般资料比较差异未见统计学意义,P>0.05,有可比性。
1.2方法:所有患儿入院后均行手术治疗,进入手术后开放外周静脉压,予以0.1mg/kg咪唑安定+10μg/kg芬太尼+0.6mg/kg罗库溴铵诱导麻醉,然后行气管插管。连接Drager Fabious麻醉剂机械通气(60%空气-氧气混合),参数设置:潮气量10~15mL/kg,呼吸比1:1.5~2.0,通气频率为16~28次/min,呼气CO2分压保持35~45mmHg。检测桡动脉(或股动脉)血压及血气分析。体外循环采用德国进口的Maquel Jostra HL20心肺机。脱机前常规进行手动通气3~5次,手动复张通气峰压应维持在20~30cmH2O。低氧血症判定标准:PaO2/FiO2<300,氧合指数在200~300为中度,<100为重度[5]。

2 结 果
2.1两组患儿术后不同时间点PaO2/FiO2比较:观察患者术后PaO2/FiO2发现,低氧血症组患者术后2h、6h以及12h和24hPaO2/FiO2水平均低于非低氧血症组,组间差异存在统计学意义(P<0.05),详见表1。

表1 两组患儿术后不同时间点PaO2/FiO2比较
2.2先天性心脏病CPB后低氧血症发生单因素分析:CPB后发生低氧血症患儿和未发生低氧血症的患者年龄、体重、术前存在右向左分流、术前肺动脉高压、机械通气模式选取资料经统计学分析,差异具有统计学意义(P<0.05)。组间数据详细统计分析见表2。
2.3先天性心脏病CPB后低氧血症发生的Logistic多因素回归分析:CPB后低氧血症为因变量,年龄(≤6岁为0,6~12岁为1,≥12岁为2)、BMI、术前存在右向左分流(存在=0,不存在=1)、术前肺动脉高压(存在=0,不存在=1)、术中PCV通气模式(VCV=0,PCV=1)为自变量,经Logistic多因素回归分析发现,年龄下、低体重以及术前合并右向左分流及肺动脉高压是先天性心脏病CPB后低氧血症发生的高危因素,详细分析见表3。
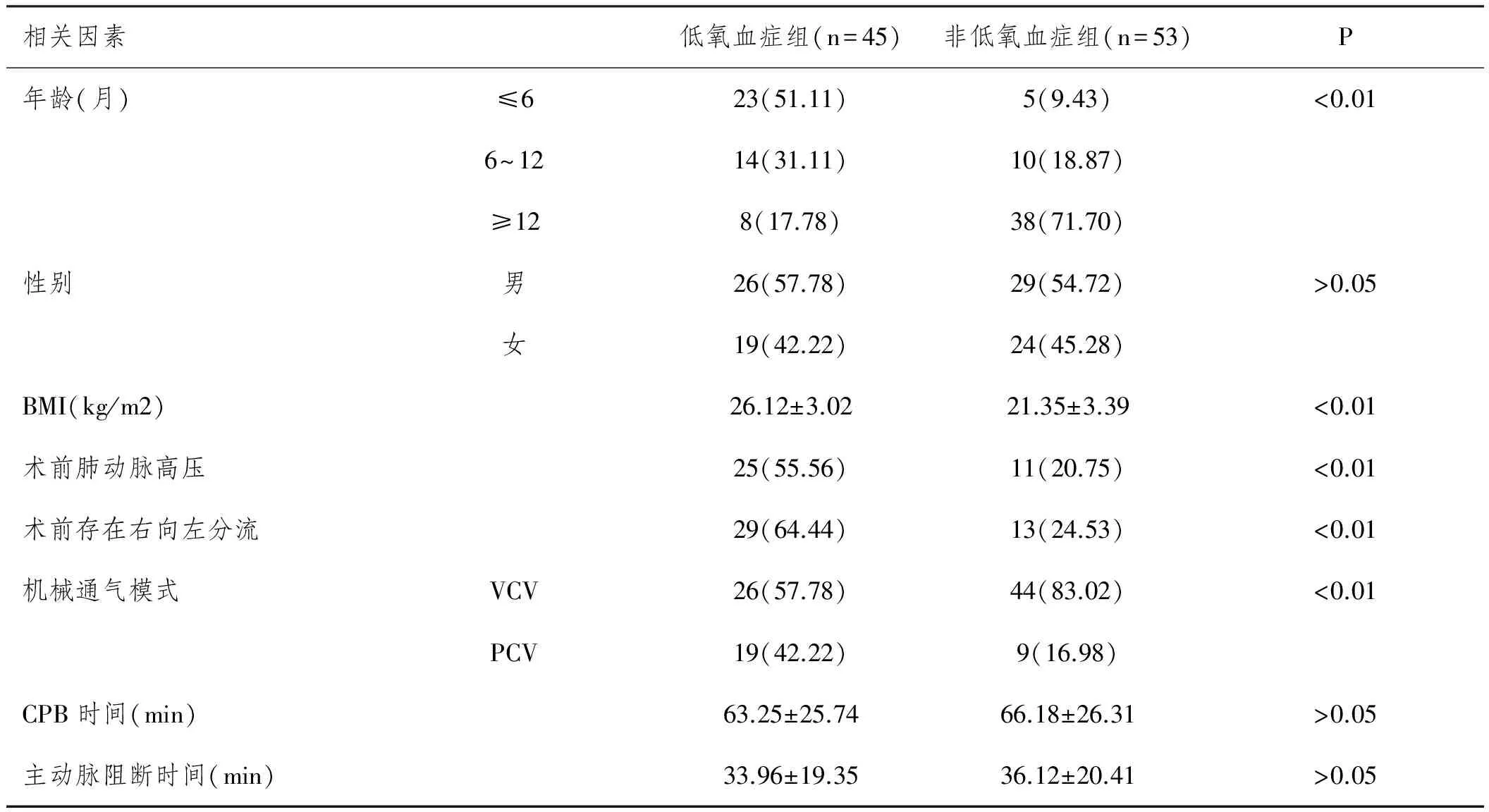
表2 先天性心脏病CPB后低氧血症发生单因素分析n(%)
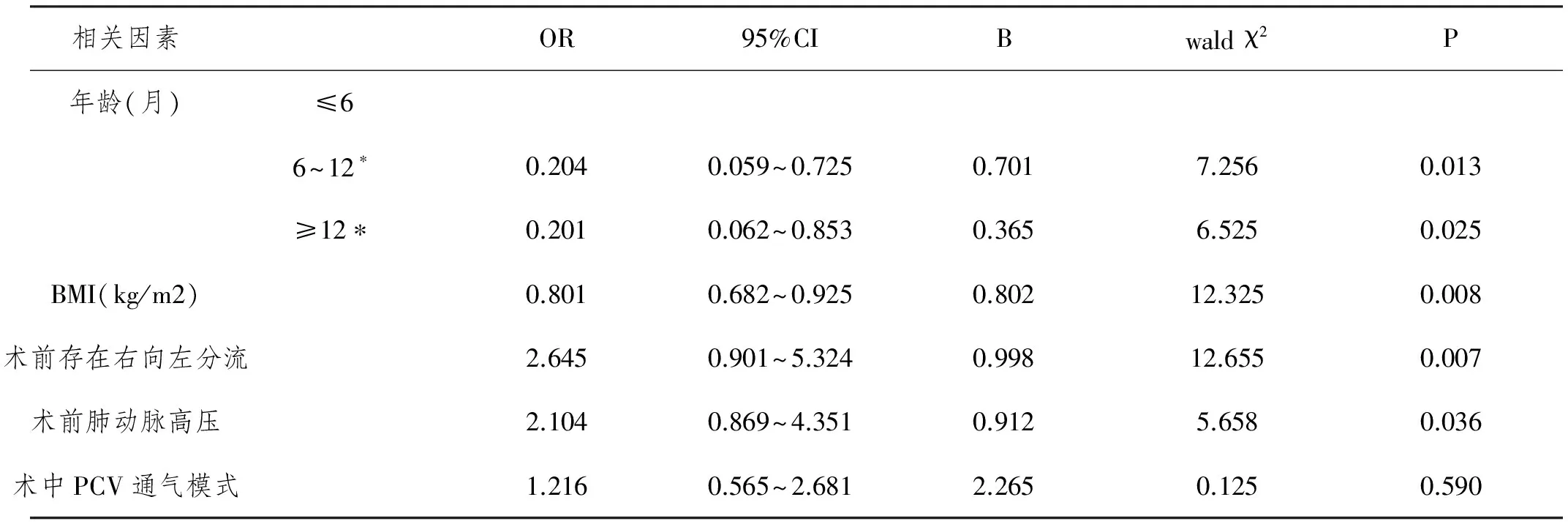
表3 先天性心脏病CPB后低氧血症发生的Logistic多因素回归分析
注:*表示和年龄≤6岁相比较
3 讨 论
先天性心脏病是小儿常见先天性畸形的一种,约占全部先天性疾病的28%。其是指在胚胎发育时由于心脏大血管形成障碍,或发育异常等造成的心脏解剖结构异常[6]。少部分患儿可在5岁之前自愈,一部分患儿病变轻微或对循环功能未造成严重的影响,所以临床不予治疗,但绝大多数患儿需要手术矫正畸形[7]。并且随着我国医学技术的迅猛发展,术后效果得到很大进步,术后大多数可恢复至和常人无异[8]。但术后低氧血症至今难以避免,加之患儿年龄较小,呼吸中枢发育上不成熟,尤其是一些新生儿和婴儿,体外循环后更加容易发生气体交换异常以及呼吸阻力改变,如肺内分流增加、肺血管阻力增加等。因此,明确先天性心脏病患儿体外循环后低氧血症诱导因素,可提高预后[9]。相关文献表示[10],先天性心脏病患者的年龄是唯一既影响肺顺应性又影响总呼吸阻力的因素。而术前合并肺动脉高压的患儿,在体外循环后往往出现肺顺应性降低、气道阻力增加,相关机制可能为:阻力增加,肺血管增粗,压迫气道,阻碍气体的交换;肺血管及支气管平滑肌肥大、收缩均可造成支气管收缩,加之存在肺动脉高压的患儿术前的容量超负荷,极易造成术后左房压力升高,持续发挥在那继而导致肺间质水肿。健康的肺组织是保证呼吸功能正常的基础和前提,若患儿在术前便合并肺组织损伤,则术后发生低氧血症的风险明显增加[11,12]。并且在本次研究中也可见,体外循环后低氧血症组术前存在肺动脉高压的患儿比例明显高于非低氧血症组。某项[13]先天性心脏病患儿体外循环后低氧血症发生独立危险因素分析研究显示,术前存在右向左分流患儿,术后低氧血症发生的风险显著较高。在本次调查统计中,低氧血症组中高达64.44%患儿术前合并右向左分流,而未发生低氧血症的患儿中仅24.53%患儿术前存在右向左分流。本研究和冯靖[14]等的一项相关研究结果相符,在该项研究中表示,术前合并症对心脏手术术后并发症的影响较大,研究者表示,在行心脏手术前应控制相关危险因素,避免术后并发症。
本结果显示,低氧血症患儿在术后1d内不同时间点氧合指数均显著较非低氧血症组患儿低。单因素分析发现,低氧血症患儿大多为超重或肥胖儿、年龄较小、术前合并肺动脉高压、术前残留右向左分流以及术中选用PCV通气者,由此可初步判定先天性心脏病CPB后低氧血症的发生与否可能受患儿年龄、体重术前肺功能以及书中通气模式选取的影响。而经Logistic多因素回归分析发现,患儿的年龄越小、超重或肥胖、术前残留右向左分流以及术前肺动脉高压均是诱发术后低氧血症发生的独立危险因素。既往已经有研究[15]证实,BMI≥25kg/m2(肥胖)是先天性心脏病儿童低氧血症发生独立危险因素。结合本次研究结果,CPB后发生低氧血症患者BMI为(26.12±3.02),明显较未发生低氧血症组(21.35±3.39)高,该结果进一步证实了上述观点。也进一步说明先天性心脏病患儿的基础代谢状态在心血管及肺部疾病发生发展中起着重要的作用,肥胖患儿通常胸壁较肥厚,胸廓顺应性则明显比正常同龄儿童小,继而在呼吸世家需要克服的阻力明显增强,继而消耗氧气较多,加重肺的负担,因此,控制体重也是预防先天性心脏病患儿CPB后低氧血症的重要手段。目前,有关小儿先天性心脏病CPB后低氧血症发生危险因素分析的研究还较少,还有待进一步选取更大的样本证实本文观点。
综上所述,患儿的低龄、肥胖以及术前合并右向左分流及肺动脉高压均是先天性心脏病CPB后低氧血症发生的独立危险因素,因此,临床在手术前应尽量排除诱因,术后积极纠正低氧血症。
[1] 许卫江,陈祖君,肖红艳,等.体外循环冠状动脉旁路移植术后低氧血症的危险因素分析[J].中国综合临床,2011,27(3):249~252.
[2] 沈亮,陆晨希,仲崇俊,等.非体外循环下冠状动脉旁路移植术后低氧血症的危险因素分析[J].解放军医学院学报,2014,35(1):49~51,91.
[3] El Guerrab A,Cayre A,Kwiatkowski F,et al.Quantification of hypoxia-related gene expression as a potential approach for clinical outcome prediction in breast cancer[J].PLoS One.2017,21;12(4):e0175960.
[4] 肖燕燕,姚勇,郑建勇,等.婴幼儿先天性心脏病体外循环术后急性肾损伤的相关临床危险因素[J].实用儿科临床杂志,2012,27(7):519~521.
[5] Hua K,Sheng JJ,Dong R.Short-term clinical outcomes and risk factors associated with in-hospital mortality in patients undergoing off-pump coronary artery bypass grafting[J].Zhonghua Yi Xue Za Zhi.2017;97(16):1218~1221.
[6] 王红,贾明,李呈龙,等.头罩持续气道内正压治疗体外循环心脏手术拔除气管插管后低氧血症初探[J].中国体外循环杂志,2014,12(2):92~95.
[7] 余艳.小儿先天性心脏病术后低氧血症的早期观察及护理[J].护理实践与研究,2012,9(9):72~73.
[8] 沈立,薛松,汪永义,等.冠状动脉旁路移植术后低氧血症危险因素研究[J].中国心血管病研究,2014,12(2):102~106.
[9] 周琦.心脏体外循环手术围手术期并发症的护理[J].护理实践与研究,2015,12(9):47~48.
[10] Sabzi F,Faraji R.Effect of body mass index on postoperative complications in beating coronary artery surgery[J].Ethiop Health Sci.2016;26(6):509~516.
[11] 黄悦,张马忠,宋艳艳,等.小儿先天性心脏病快通道手术后早拔管的体外循环影响因素分析[J].上海交通大学学报(医学版),2011,31(9):1320~1324.
[12] 孙广龙,曹向戎,张健群,等.非体外循环冠状动脉旁路移植术后低氧血症相关因素分析[J].心肺血管病杂志,2011,30(5):411~413.
[13] Takayama T,Akutsu N,Hiro T,et al.A case of giant saphenous vein graft aneurysm followed serially after coronary artery bypass surgery[J].Open Med(Wars).2016,11(1):155~157.
[14] 冯靖,季强,梅运清,等.冠状动脉旁路移植术后低氧血症的相关因素分析[J].同济大学学报(医学版),2012,33(5):53~56.
[15] Howard LS,Santhirapla V,Murphy K,et al.Cardiopulmonary exercise testing demonstrates maintenance of exercise capanity in patient with hpoxemiia and pilmonary arteriovenous malformations[J].Chest,2014,146(3):709~718.
欢迎投稿欢迎指正
AnalysisofRiskFactorsofHypoxemiaafterCPBinChildrenwithCongenitalHeartDisease
ZHOUChunlong,ZHANGLibing,GUOLangtao,etal
(ChengduWomenandChildren'sHospital,SichuanChengdu610091,China)
Objective:To investigate the risk factors of hypoxemia after CPB in congenital patients with congenital heart disease.MethodsA total of 98 children with congenital heart disease received from January 2016 to January 2017 were selected, all children underwent surgical treatment, CPB after 45 cases of hypoxemia, the remaining 53 cases did not appear hypoxemia, risk factors for hypoxemia after CPB were analyzed by single factor and Logistic multivariate regression.ResultsThe PaO2/FiO2levels of 2h, 6h, 12h and 24h in children with hypoxemia were lower than those in non hypoxic group, and there was significant difference between the two groups (P < 0.05). Univariate analysis showed that there were significant differences in age, body weight, preoperative right-to-left shunt, preoperative pulmonary hypertension, and intraoperative ventilation patterns (P <0.01);Logistic multivariate regression analysis showed that low age, obesity, preoperative combined right to left shunt, pulmonary hypertension was congenital heart disease in children after CPB hypoxemia occurred in high risk factors.ConclusionThe incidence of hypoxemia in children with congenital heart disease is closely related to the low age, obesity and preoperative right - to - left shunt and pulmonary hypertension.
Congenital heart disease; CPB; Hypoxemia; Risk factors
1006-6233(2017)09-1470-04
A
10.3969/j.issn.1006-6233.2017.09.018
四川省卫生厅课题,(编号:16PJ073)
