乳腺超声弹性成像联合血清MCP-1含量测定在乳腺良恶性肿瘤鉴别诊断中的作用
2017-09-30吕明丽牛建梅
吕明丽,杨 钰,曾 敏,牛建梅
上海交通大学医学院附属国际和平妇幼保健院超声科,上海 200030
乳腺超声弹性成像联合血清MCP-1含量测定在乳腺良恶性肿瘤鉴别诊断中的作用
吕明丽,杨 钰,曾 敏,牛建梅
上海交通大学医学院附属国际和平妇幼保健院超声科,上海 200030
目的:探讨乳腺超声弹性成像联合血清人单核细胞趋化因子1(monocyte chemoattractant protein 1,MCP-1)含量测定在乳腺良恶性肿瘤鉴别诊断中的作用。方法:选取2015年1—6月就诊于上海交通大学医学院附属国际和平妇幼保健院乳腺科的患者60例,行常规二维超声和压迫式声弹性成像,计算弹性应变率 (strain ratio,SR)。Luminex液相芯片测定患者术前血清MCP-1水平。以病理结果为金标准,评价上述两种方法单独及联用的诊断效能。结果:乳腺超声弹性在截断点为4.87时,灵敏度为83.33%,特异度为70.81%。血清MCP-1测定截断点为45.6 pg/mL时,灵敏度为100.0%,特异度为91.7%。两种方法联用后其受试者工作特征(receiver operating characteristic,ROC)曲线的曲线下面积为0.99,与单独使用乳腺弹性成像相比,差异有统计学意义(P=0.002 5)。乳腺恶性肿瘤弹性成像SR值与血清MCP-1水平呈正相关(r=0.732,P<0.01)。结论:乳腺超声弹性与血清MCP-1联用可大大提高对乳腺良恶性肿瘤的鉴别诊断效能,具有一定的临床应用价值。
乳腺肿瘤;压迫式弹性成像;单核细胞趋化因子1
中国每年有超过160万人被诊断为癌症,120万人因癌症而死亡。中国乳腺癌每年新发病例数和死亡病例数分别占全世界的12.2%和9.6%。目前,中国乳腺癌发病率居女性恶性肿瘤第1位,病死率居第6位,且呈持续增长趋势。Fan等[1]对中国国家癌症登记系统数据进行分析,结果显示,至2021年,55~69岁的中国女性乳腺癌发病率将由<60例/10万增至>100例/10万。早发现、早诊断可明显提高乳腺癌患者的生存率及无病生存期,提高生活质量。
乳腺超声检查及钼靶摄片是最常用的乳腺检查及筛查手段。随着技术的不断创新与发展,国内外学者提出了很多提高乳腺良恶性肿瘤的鉴别诊断方法,如弹性成像、肿瘤造影、三维血管成像等。目前应用最多最广、争议也最多的莫过于弹性成像。肿瘤相关成纤维细胞(cancerassociated fibroblast,CAF)是导致肿瘤局部组织纤维组织增生、组织弹性硬度增加的主要原因。CAF被肿瘤细胞及肿瘤组织中的炎性细胞激活后,可通过分泌细胞因子、生长因子和肿瘤细胞外基质成分,促进胶原蛋白Ⅰ的生成与重塑,最终使肿瘤局部硬度增高,并促进肿瘤的侵袭与转移[2-3]。因此,有学者认为肿瘤微环境中炎性细胞的浸润尤其是巨噬细胞的浸润与肿瘤的硬度密切相关[4]。
人单核细胞趋化因子1(monocyte chemoattractant protein 1,MCP-1)是由乳腺肿瘤细胞及肿瘤微环境中基质细胞分泌的一种炎性介质,是体内主要的趋化血液中巨噬细胞进入组织的物质之一。本课题组在前期研究中发现,乳腺癌患者血液及肿瘤组织中局部MCP-1水平与肿瘤细胞的恶性程度及预后密切相关,进一步的研究表明MCP-1本身即可促进肿瘤细胞的增殖与转移[5],并不需借助肿瘤微环境中的其他因素[6]。
作为极少数可在患者血清中测定的因子,可通过测定血清MCP-1水平来提高乳腺弹性诊断的灵敏度及特异度。本研究通过前瞻性测定手术前乳腺肿瘤患者血液中MCP-1水平和分析乳腺肿瘤超声弹性,综合评价术前乳腺肿瘤的良恶性及其恶性程度,讨论此方法在乳腺筛查中的应用价值。
1 资料和方法
1.1 研究对象
选取2015年1—6月因乳腺肿块首次就诊于上海交通大学医学院附属国际和平妇幼保健院乳腺科的女性患者60例。病例入选标准:患者超声检查前未接受过细针穿刺及放化疗等治疗,且超声检查肿块后评定分级为乳腺影像报告和数据系统(Breast Imaging Reporting and Data System,BIRADS) 4A及4B。排除标准:腋窝淋巴结已接受活检,原发肿瘤破溃、红肿、皮肤侵犯、胸壁侵犯等表现,多中心肿瘤,患有乳腺以外的其他组织器官的肿瘤,隆胸或假体植入术后,以及既往接受过化疗、放疗、内分泌治疗的患者。
患者均为女性,年龄32~75岁,平均(45.36±7.21)岁。肿瘤最长径5~41 mm,平均(15.91±7.45) mm。
1.2 仪器和方法
乳腺超声弹性成像:所有病例采用意大利百胜公司的MyLab Class C彩色超声诊断仪进行二维超声及超声弹性成像。探头型号为LA523,发射频率5~13 MHz。仪器自带弹性组织弥散定量分析软件。对所有肿块先行常规二维超声检测,获得乳腺肿瘤的二维及彩色多普勒声像图,观察病灶位置、数目、大小、形态、内部回声和血流情况等。对二维超声诊断为BI-RADS 4A级以上的病灶行压迫式超声弹性成像。根据病灶位置调整患者体位,尽可能使病灶保持水平,切换为弹性成像模式。弹性成像范围包括病灶及其周边组织,总面积为可疑病灶的3倍左右。采用实时显示功能,同时观察灰阶超声图与弹性图,采用手动平稳微小抖动施压,直至获得稳定的动态弹性图。以连续色谱实时显示施压程度,当色谱显示为绿色时表示结果稳定有效,可进行病灶区与感兴趣区的勾画和计算。手动勾画肿块边界作为感兴趣区,选取周围同水平的正常乳腺组织作为对照区,计算弹性应变率(strain ratio,SR)。对照区应为与感兴趣区处于同一深度的乳腺组织,且尽量避开脂肪组织。所有病灶进行不同切面弹性成像3次。
Luminex液相芯片法检测血清MCP-1水平:采用患者入院后术前检查剩余血液,3 000 r/min,离心10 min后吸取血清,分装于150 μL Eppendorf管中并放入-80 ℃冰箱中冻存。待所有样本收集完成后,采用Luminex液相芯片检查血清MCP-1水平。每个样本设3个复孔。
联合诊断法:患者术前行乳腺超声弹性成像,然后抽取静脉血,行Luminex液相芯片检测血清MCP-1含量。
1.3 统计学处理
采用SPSS 17.0和MedCalc统计软件进行分析。对计量资料采用独立样本t检验,P<0.05为差异有统计学意义。以病理结果为金标准,绘制受试者工作特征(receiver operating characteristic,ROC)曲线,获得3种方法(乳腺超声弹性成像、血清MCP-1测定及两者联合诊断)的最佳诊断界点,并计算其曲线下面积(area under curve,AUC)、灵敏度、特异度和准确率。
2 结 果
2.1 乳腺肿块临床病理诊断情况
本组60个乳腺病灶中,恶性病例35例,占58.3% (35/60),包括导管内癌8例、浸润性导管癌27例、囊内乳头状癌1例;良性病例25例,占41.7% (25/60),包括导管内乳头状瘤伴导管上皮高度增生5例、乳腺病及乳腺病伴纤维腺瘤20例。
2.2 乳腺超声弹性成像对乳腺肿瘤的诊断
按上述方法,对每个乳腺肿瘤取3个不同切面进行弹性成像,取3次SR的平均值。根据病理学结果,将病例分成良性及恶性两组。良性肿块组SR值为5.87±9.36,恶性肿瘤组SR值为20.73±23.46,两组之间有统计学差异(P<0.001)。根据病理结果绘制ROC曲线。统计学结果显示,AUC为0.868,约登指数为0.583,截断点为4.87,所对应的灵敏度为83.33%,特异度为70.81% (图1)。
2.3 血清MCP-1含量对乳腺肿瘤的诊断
取3个复孔测得的MCP-1平均值。根据病理学结果,将病例分成良性及恶性两组。良性肿块组患者血清MCP-1水平为(28.15±12.91) pg/mL,恶性肿瘤组患者血清MCP-1水平为(84.69±15.54)pg/mL,两组之间有统计学差异(P<0.01)。根据病理结果绘制ROC曲线。统计学结果显示,AUC为0.99,约登指数为0.92,截断点为45.6 pg/mL,所对应的灵敏度为100.0%,特异度为91.7%(图2)。
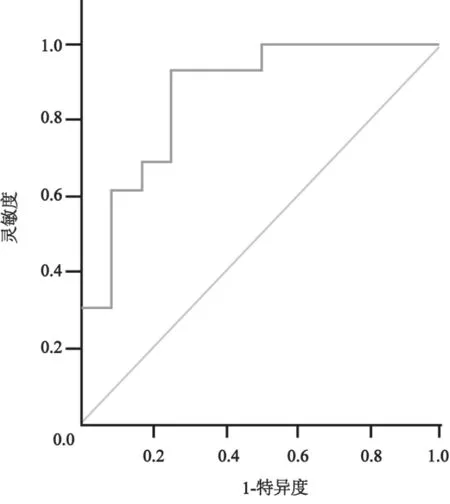
图1 乳腺超声弹性成像对乳腺肿瘤诊断的ROC曲线分析
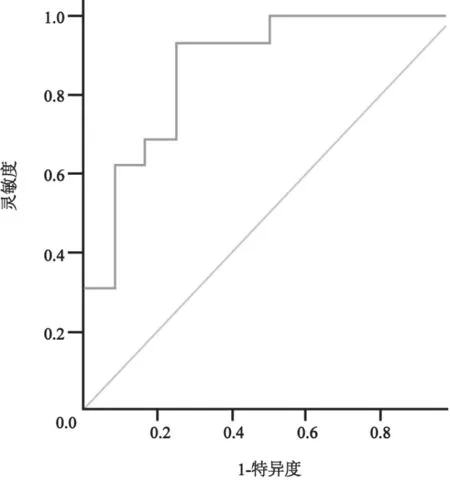
图2 血清MCP-1含量对乳腺肿瘤诊断的ROC曲线分析
2.4 乳腺超声弹性成像联合血清MCP-1含量测定对乳腺肿瘤的诊断
根据病理学结果,将病例分成良性及恶性两组,比较乳腺弹性成像、血清MCP-1含量测定及弹性成像联合MCP-1含量测定这3种方法对乳腺肿瘤的诊断价值。统计学结果显示,乳腺弹性成像与血清MCP-1含量测定联用诊断乳腺肿瘤的AUC为0.99,与单独使用乳腺弹性成像相比,AUC有统计学差异(P=0.002 5)(图3)。联合诊断的约登指数为0.94,乳腺弹性成像的截断点为4.16,血清MCP-1含量的截断点为45.1 pg/mL。联合诊断的灵敏度和特异度与单独使用MCP-1相同,均为100.0%和91.7%,但明显高于单独使用乳腺弹性成像(P<0.01)。
2.5 乳腺超声弹性成像与患者血清MCP-1水平的相关性
对60例患者的乳腺超声弹性成像SR值和血清MCP-1水平进行相关性分析,结果显示两者呈正相关(r=0.344,P=0.007)。将35例恶性肿瘤患者的乳腺超声弹性成像SR值与血清MCP-1水平进行相关性分析,结果显示两者亦呈正相关(r=0.732,P<0.01)(图4)。
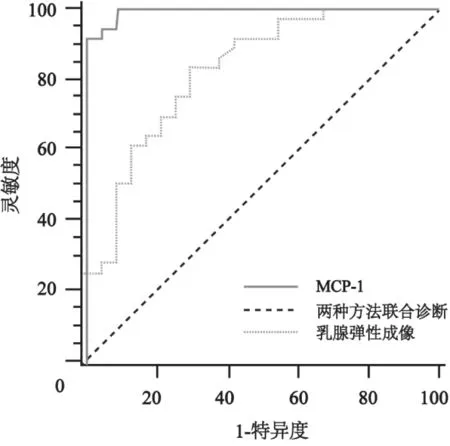
图3 乳腺超声弹性成像、血清MCP-1含量测定及两者联用对乳腺肿瘤诊断的ROC曲线分析
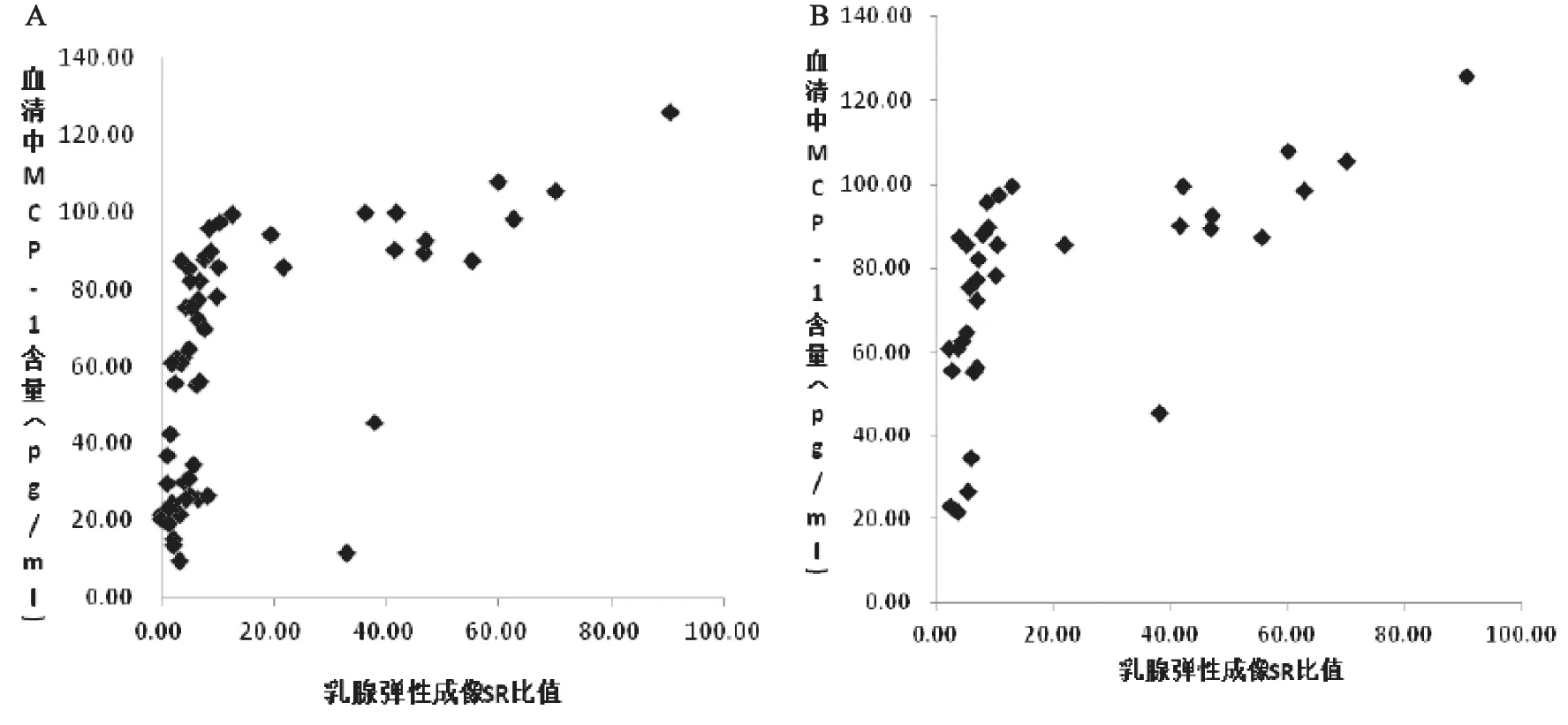
图4 乳腺超声弹性成像与患者血清MCP-1水平的相关性分析
3 讨 论
人类恶性肿瘤的组织硬度通常大于正常组织,因此肿瘤硬度可用于肿瘤的诊断及分期[7]。大多数实体肿瘤的最主要特点是其细胞外基质中含有大量胶原纤维,这也是导致肿瘤力学结构改变的主要原因[8-9]。有学者认为,实体肿瘤硬度的增加意味着肿瘤恶性程度增加[10-11]。Conklin等提出,在乳腺原位癌中,如果有粗的线性胶原纤维出现并与肿瘤的边界垂直相交,那么这种乳腺导管内原位癌很易进展为浸润性乳腺癌[12]。乳腺癌组织中胶原蛋白交联赖氨酰化氧化酶(collagen cross-linker lysyl oxidase,LOX)含量越高,发生远处转移的概率越大[13-14]。
人乳腺癌组织中通常有包括巨噬细胞在内的大量免疫细胞浸润,大量实验也证实乳腺癌的浸润与转移和炎症密切相关,而人为破坏巨噬细胞功能后可阻断肿瘤转移[15-16]。其原因可能是巨噬细胞分泌大量细胞趋化因子、生长因子及金属蛋白等,而这些因子与肿瘤细胞外基质的重塑、CAF的激活及胶原纤维的产生密切相关。MCP-1是由乳腺肿瘤细胞及肿瘤基质细胞分泌的一种可趋化血液中巨噬细胞进入肿瘤局部的细胞因子,也是趋化血液中巨噬细胞进入肿瘤组织的最主要、最重要的趋化因子[17]。本课题组前期研究及其他研究均证实,乳腺肿瘤组织局部和乳腺癌患者血液MCP-1含量均与乳腺肿瘤细胞的恶性程度及患者预后密切相关[5,18]。
本研究发现,弹性成像用于鉴别诊断乳腺良恶性肿瘤时,感兴趣区与对照区域SR的AUC为0.868,截断点为4.87,所对应的灵敏度为83.33%,特异度为70.81%。目前国内学者对乳腺弹性成像SR值的认定并无同一标准,但大多数研究结果通常为3~4[19]。本研究结果的截断点略高于目前相关报道,特异度较低,只有70.81%,这可能与操作时施压力度不同、对照区域选择不同及病例数较少有关。此外,乳腺弹性成像结果与肿瘤大小和对照区域的选择密切相关。
采用患者血清MCP-1含量评价乳腺良恶性肿瘤时,AUC为0.99,约登指数为0.92,截断点为45.6 pg/mL,对应的灵敏度为100.0%,特异度为91.7%。将肿瘤最长径限制在2 cm之内后,其截断点为3.32,灵敏度为95.5%,特异度为70%。因此,采用患者血清MCP-1含量评价乳腺良恶性具有较高的灵敏度和特异度,尤其在肿瘤体积较小时更是如此。目前,国内尚无此类相关报道。Lebrecht等的研究表明,乳腺癌患者血清MCP-1水平高于乳腺良性肿瘤患者或正常志愿者,且与患者预后及淋巴结状态相关[20]。Dehqanzada等研究发现,血清中高浓度MCP-1是患者预后不良的指标,但也意味着很可能从a/neu E75免疫治疗中获益[21]。本课题组前期研究及本次研究均认为,患者血清MCP-1与乳腺癌良恶性密切相关,可作为乳腺恶性肿瘤筛选的辅助诊断指标[5]。但血清MCP-1水平易受患者局部炎症的影响,且很多肿瘤也可分泌MCP-1,因此单独使用MCP-1作为评价乳腺肿瘤的指标易出现假阳性,特异度较低。
在乳腺弹性成像与血清MCP-1的相关性分析中,发现两者在一定程度上呈正相关(r=0.344,P=0.007),特别是将肿瘤限定为病理学诊断为恶性时,相关性大大提高(r=0.732,P<0.01),提示乳腺恶性肿瘤局部MCP-1水平可能与肿瘤组织局部硬度密切相关。推测这可能与MCP-1可促进血液中巨噬细胞进入肿瘤组织局部,进而促进局部炎性细胞增殖及CAF激活有关。
本研究还尝试将乳腺弹性成像与血清MCP-1水平测定联用,观察其评估乳腺良恶性肿瘤的效能。结果显示,两者联合诊断的AUC为0.99,与单独使用乳腺弹性成像相比,AUC有统计学差异(P=0.002 5),而与单独应用血清MCP-1之间无统计学差异,提示血清MCP-1测定可提高乳腺弹性成像的灵敏度及特异度。但血清MCP-1水平的影响因素较多,单独使用MCP-1作为评价乳腺肿瘤的指标易出现假阳性,特异度较低。两者结合则可排除部分假阳性病例。
本研究存在以下不足。首先,样本量较小,且对入选病例的要求较严格,因此统计学结果可能存在一定程度上的选择性偏移。其次,本研究所涉及的乳腺肿瘤类型较少,良性者主要集中在乳腺纤维瘤及乳腺病,恶性以浸润性导管癌为主。当良性病变合并钙化或机化,恶性病例合并出血坏死、囊性变等情况时,无论乳腺弹性成像还是血清MCP-1水平测定均会出现一定的假阳性与假阴性,此时两者联用是否可避免误诊及漏诊,需进一步扩大样本量来证实。此外,乳腺肿瘤局部MCP-1如何导致肿瘤局部细胞外基质中胶原纤维增加及乳腺肿瘤硬度增加,也需进一步研究证实。
综上所述,乳腺肿瘤超声弹性成像与血清MCP-1测定评估乳腺良恶性肿瘤具有较高的灵敏度、特异度和准确率。乳腺肿瘤SR值越高,患者血清MCP-1水平越高,其恶性的可能性越大,反之,则良性的可能性越大。两者联用可弥补不足,避免单独使用时假阳性及假阴性病例的误诊及漏诊,从而大大提高诊断准确率。
[1] FAN L, STRASSER-WEIPPL K, LI J J, et al. Breast cancer in China [J]. Lancet Oncol, 2014, 15(7): e279-e289.
[2] CIRRI P, CHIARUGI P. Cancer associated fibroblasts: the dark side of the coin [J]. Am J Cancer Res, 2011, 1(4):482-497.
[3] MADSEN C D, PEDERSEN J T, VENNING F A, et al. Hypoxia and loss of PHD2 inactivate stromal fibroblasts to decrease tumour stiffness and metastasis [J]. EMBO Rep, 2015, 16(10): 1394-1408.
[4] ACERBI I, CASSEREAU L, DEAN I, et al. human breast cancer invasion and aggression correlates with ECM stiffening and immune cell infiltration [J]. Integr Biol (Camb), 2015, 7(10): 1120-1134.
[5] LV M, XIAOPING X, CAI H, et al. Cytokines as prognstic tool in breast carcinoma [J]. Front Biosci, 2011, 16(3): 2515-2526.
[6] NAM J S, KANG M J, SUCHAR A M, et al. Chemokine (C-C motif) ligand-2 mediates the prometastatic effect of dysadherin in human breast cancer cells [J]. Cancer Res, 2007, 66(14): 7176-7184.
[7] YOUK J H, SON E J, GWEON H M, et al. Comparison of strain and shear wave elastography for the differentiation of benign from malignant breast lesions, combined with B mode ultrasonography: qualitative and quantitative assessments [J]. Ultrasound Med Biol, 2014, 40(10): 2336-2344.
[8] KEELY P J. Mechanisms by which the extracellular matrix and integrin signaling act to regulate the switch between tumor suppression and tumor promotion [J]. J Mammary Gland Biol Neoplasia, 2011, 16(3): 205-219.
[9] HASEBE T. Tumor-stromal interactions in breast tumor progression—significance of histological heterogeneity of tumor-stromal fibroblasts [J]. Expert Opin Ther Targets, 2013, 17(4): 449-460.
[10] SAMANI A, BISHOP J, LUGINBUHL C, et al. Measuring the elastic modulus of ex vivo small tissue samples [J]. Phys Med Biol, 2003, 48(14): 2183-2198.
[11] SAMANI A, ZUBOVITS J, PLEWES D. Elastic moduli of normal and pathological human breast tissues: an inversion-technique-based investigation of 169 samples [J]. Phys Med Biol, 2007, 52(6): 1565-1576.
[12] CONKLIN M W, EICKHOFF J C, RICHING K M, et al. Aligned collagen is a prognostic signature for survival in human breast carcinoma [J]. Am J Pathol, 2011, 178(3): 1221-1232.
[13] PICKUP M W, LAKLAI H, ACERBI I, et al. Stromally derived lysyl oxidase promotes metastasis of transforming growth factor-β-deficient mouse mammary carcinomas [J]. Cancer Res, 2013, 73(17): 5336-5346.
[14] SEMENZA G L. Cancer-stromal cell interactions mediated by hypoxia-inducible factors promote angiogenesis, lymphangiogenesis, and metastasis [J]. Oncogene, 2013, 32(35): 4057-4063.
[15] RUFFELL B, AU A, RUGO H S, et al. Leukocyte composition of human breast cancer [J]. Proc Natl Acad Sci USA, 2012, 109(8): 2796-2801.
[16] RUFFELL B, CHANG-STRACHAN D, CHAN V, et al. Macrophage IL-10 blocks CD8+T cell-dependent responses to chemotherapy by suppressing IL-12 expression in intratumoral dendritic cells [J]. Cancer Cell, 2014, 26(5): 623-637.
[17] UENO T, TOI M, SAJI H, et al. Significance of macrophage chemoattractant protein-1 in macrophage recruitment, angiogenesis, and survival in human breast cancer [J]. Clin Cancer Res, 2000, 6(8): 3282-329.
[18] CHAVEY C, BIBEAU F, GOURGOU-BOURGADE S, et al. Oestrogen receptor negative breast cancers exhibit high cytokine content [J]. Breast Cancer Res, 2007, 9(1): R15.
[19] 张露, 周平, 邓金, 等. 常规超声、压迫式弹性成像及声脉冲辐射力成像鉴别诊断良恶性乳腺肿瘤的对比研究 [J]. 中南大学学报(医学版), 2014, 39(12): 1246-1252.
[20] LEBRECHT A, GRIMM C, LANTZSCH T, et al. Monocyte chemoattractant protein-1 serum levels in patients with breast cancer [J]. Tumour Biol, 2004, 25(1-2): 14-20.
[21] DEHQANZADA Z A, STORRER C E, HUEMAN M T, et al. Correlation between serum monocyte chemotactic protein-1 level, clinical prognostic factors, and HER-2/neu vaccine-related immunity in breast cancer patients [J]. Clin Cancer Res, 2006, 12(2): 478-486.
Compression elastography and serum MCP-1 level in differential diagnosis of benign and malignant breast tumors
LV Mingli, YANG Yu, ZENG Min, NIU Jianmei
(Department of Ultrasonography, International Peace Maternity & Child Health Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai 200030, China)
NIU Jianmei E-mail: niujm5@126.com
Objective:To evaluate the roles of compression elastography and serum monocyte chemoattractant protein 1 (MCP-1) level in the differential diagnosis of begin and malignant breast tumors.Methods:A total of 60 patients with liver lesions were selected from International Peace Maternity & Child Health Hospital, Shanghai Jiao Tong University School of Medicine from January to June 2o16. They underwent the conventional ultrasound and compression elastography examinations and strain ratio (SR) was obtained. Luminex liquid chip technology was used to analyze the level of MCP-1 in serum. The two methods alone and in combination were applied in this study. The pathological results were set as the gold standard and used to evaluate the diagnosis efficiency in differential diagnosing benign and malignant breast tumors.Results:With the cutoffvalue of SR at 4.87, the sensitivity and speci ficity of compression elastography in the diagnosis of malignant breast tumor were 83.33% and 70.81%. With the cutoffvalue of serum MCP-1 level at 45.6 pg/mL, the sensitivity and speci ficity of compression elastography in the diagnosis of malignant breast tumor were 100.0% and 91.7%. When the two methods were combined, the area under receiver operating characteristic (ROC) curve was 0.99, with statistical difference in comparison with compression elastography alone(P=0.002 5). Further correlation analysis showed that there was apositively correlation between SR value and MCP-1 level in serum(r=0.732, P<0.000).Conclusion:The combination of compression elastography and serum MCP-1 level is useful for the differential diagnosis of benign and malignant breast tumors.
Breast tumor; Compression elastography; Monocyte chemoattractant protein 1
R445.1
A
1008-617X(2017)04-0289-06
2017-04-15
2017-06-10)
中国福利会国际和平妇幼保健院优秀青年培育计划;国家自然科学基金项目(No:81402386)
牛建梅 E-mail:niujm5@126.com
