直肠癌不同表观扩散系数测量方法的一致性研究
2017-09-30王秀平
王 勇,王秀平
江苏省泰州市人民医院影像科,江苏 泰州 225300
直肠癌不同表观扩散系数测量方法的一致性研究
王 勇,王秀平
江苏省泰州市人民医院影像科,江苏 泰州 225300
目的:比较直肠癌不同表观扩散系数(apparent diffusion coefficient,ADC)的测量方法,评价其对直肠癌ADC的影响。方法:回顾性收集37例直肠癌患者,术前行MRI包括扩散加权成像(diffusion weighted imaging,DWI)(b值为0、1 000s/mm2)检查。由2名阅片者采用3种方法独立测量肿瘤ADC:全肿瘤测量、最大层面测量、肿瘤实性成分测量。计算不同测量方法所得ADC的一致性。结果:2名阅片者之间全肿瘤测量ADC的一致性极好(组内相关系数为0.87),而最大层面和实性成分测量ADC的一致性一般(组内相关系数分别为0.56、0.58)。实性成分测量所得ADC低于全肿瘤测量(P<0.001)和最大层面测量(P<0.001),而全肿瘤测量和最大层面测量所得SD值高于实性成分测量(P<0.001、P=0.02)。结论:测量方法影响直肠癌ADC的大小和测量一致性,全肿瘤测量ADC的可重复性最优。
直肠肿瘤;扩散加权成像;表观扩散系数
直肠癌是常见恶性肿瘤,手术切除是其主要治疗方法。但对于局部进展期肿瘤包括T3-4期肿瘤或局部淋巴结转移(≥N1)肿瘤,在术前需进行新辅助放化疗,而T、N分期主要依靠高分辨率MRI T2WI进行评价[1-2]。近年来扩散加权成像(diffusion weighted imaging,DWI)开始应用于直肠癌的术前评估,尤其是表观扩散系数(apparent diffusion coefficient,ADC)对直肠癌的生物学行为[3]、预测新辅助放化疗疗效[4]和术后复发[5]等有重要价值。然而,不同研究采用的测量方法不同,包括全肿瘤测量[6]、最大层面测量[7]或部分肿瘤实性成分测量[8]。本研究通过不同方法测量直肠癌的ADC值,并进行比较,以评价测量方法对直肠癌ADC值的影响。
1 资料和方法
1.1 临床资料
回顾性收集江苏省泰州市人民医院直肠癌患者37例,均经肠镜检查后发现肿块,行活检组织病理证实为直肠癌,术前行MRI检查。患者一般在MRI检查后2周内进行手术切除肿块。患者中男性19例、女性18例;年龄52~82岁,平均68.78岁。
1.2 MRI检查
采用SIEMENS 1.5T MRI扫描仪(Magnetom Avanto,Siemens AG,Erlangen,Germany),梯度场强45 mT/m,切换率每毫秒200 mT/m。信号采集联用1个6通道表面线圈和2个脊柱相控阵线圈单元。MR扫描定位片后行快速自旋回波(turbo spin-echo,TSE) T2WI矢状位成像,然后矢状位行T2WI斜横断位扫描,扫描方位垂直于肿瘤所在直肠段的长轴。T2WI参数如下:重复时间(repetitive time,TR)/回波时间(echo time,TE) 3000/95 ms,层厚3 mm,层间距0 mm,矩阵272×320,视野(field of view,FOV) 180~240 mm,激励次数(number of excitation,NEX)为2。DWI扫描采用单次激发自旋回波-平面回波序列(spin-echo echo planar imaging,SE-EPI)。扫描参数如下:TR/TE 3200/74 ms,层厚7mm,层间距2.1 mm,矩阵128×128,FOV 300~360 mm,NEX为2,b值为0和1000 s/mm2,一次屏气中完成,常规加抑脂以减少化学位移伪影。应用全面自动校准部分并行采集(generalized autocalibrating partially parallel acquisitions,GRAPPA)技术,加速因子为2,同时由工作站自动重建ADC图。
1.3 ADC值测量
由2名放射科医师分别评价,阅片者采用盲法读片,测量ADC值并记录平均ADC值及其SD值。ADC测量采用下列3种方法(图1)。① 全肿瘤ADC值:阅片者在DWI (b=1 000 s/mm2)图像上沿高信号肿瘤边缘勾画感兴趣区(region of interest,ROI),每层覆盖整个肿瘤,并复制ROI至相应ADC图,记录每层肿瘤ADC和SD值,取平均值;② 最大层面ADC值:选择肿瘤最大层面测量肿瘤ADC和SD值;③ 肿瘤实性成分测量:同一层面上3个ROI放置于肿瘤的实性成分(参照T2WI图像),计算ADC和SD平均值。
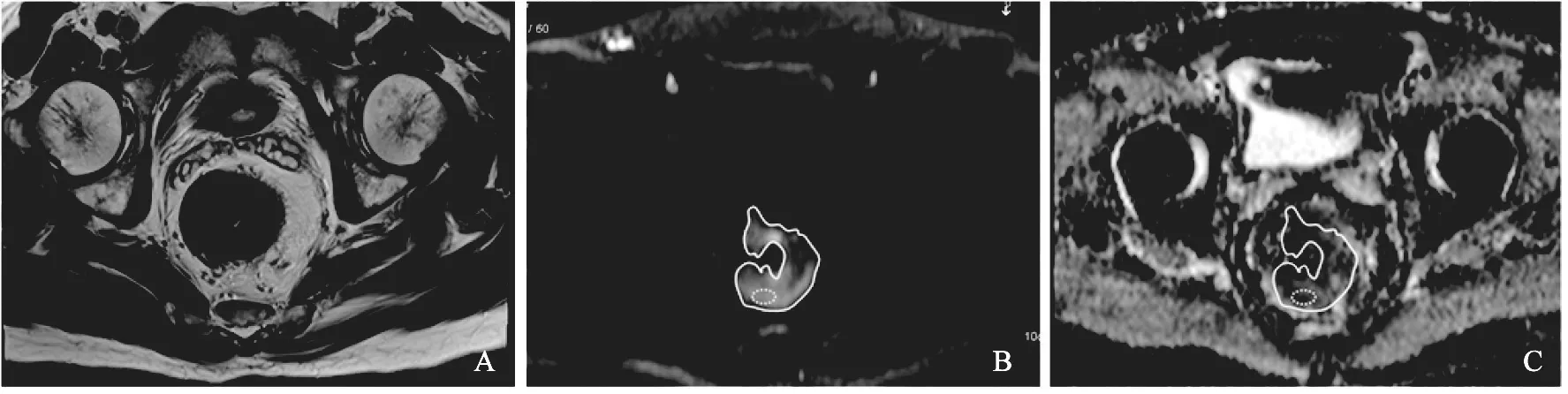
图1 不同ROI测量方法
1.4 统计学处理
两名阅片者之间结果的一致性采用组内相关系数(intraclass correlation coefficient,ICC)。ICC值>0.75时认为一致性极好,0.60~0.74认为一致性好,0.40~0.59认为一致性一般,<0.40认为一致性较差。不同测量方法之间ADC和SD值(平均值)的比较采用配对t检验。采用SPSS 16统计分析软件,P<0.05为有统计学差异。
2 结 果
直肠中段17例,直肠下段7例。手术方式:直肠低位前切除术(Dixon手术) 22例,腹会阴联合直肠癌根治术(Miles手术) 15例。术后病理结果T分期:T11例,T29例,T321例,T46例;N分期:N019例,N113例,N25例。
2.1 观察者之间ADC测量的一致性
两名阅片者的ADC测量值及ICC值见表1。两名阅片者之间全肿瘤ADC测量的ICC为0.87,一致性极好;最大层面和实性成分ADC测量的ICC分别为0.56、0.58,一致性一般。
37例直肠癌患者中,位于直肠上段13例,
表1 观察者之间不同测量方法所得ADC值(×10-3mm2/s)的一致性
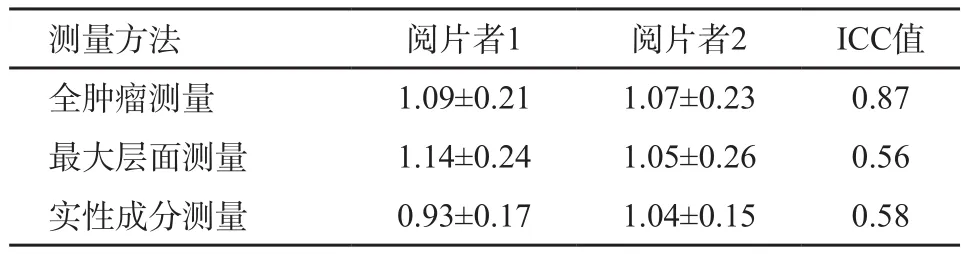
表1 观察者之间不同测量方法所得ADC值(×10-3mm2/s)的一致性
测量方法 阅片者1 阅片者2 ICC值全肿瘤测量 1.09±0.21 1.07±0.23 0.87最大层面测量 1.14±0.24 1.05±0.26 0.56实性成分测量 0.93±0.17 1.04±0.15 0.58
2.2 不同测量方法所得ADC值
全肿瘤测量、最大层面测量、实性成分测量所得平均ADC值分别为1.08×10-3、1.10×10-3、0.99×10-3mm2/s。实性成分测量所得ADC值低于全肿瘤测量(P<0.001)和最大层面测量(P<0.001);而全肿瘤测量与最大层面测量所得ADC值差异无统计学意义(P=0.31)。全肿瘤测量、最大层面测量所得SD值高于实性成分测量(P<0.001,P=0.02);而全肿瘤测量与最大层面测量所得SD差异无统计学意义(P=0.42)。
3 讨 论
人体组织内水分子扩散程度与细胞内外间隙大小密切相关。DWI能无创检测人体组织内水分子扩散运动情况,ADC可定量描述组织内水分子扩散程度,肿瘤恶性程度越高,水分子扩散衰减慢,ADC越小,在高b值DWI上表现为明显高信号。因此,DWI不仅对直肠癌检出有价值[9],对肿瘤治疗反应也有预测价值[4,7-8]。但Curvo-Semedo[10]等研究表明,ADC预测直肠癌术前放化疗疗效的价值有限,推测可能原因是ADC的测量易出现误差,尤其是ADC图上肿瘤的边界显示不清,ROI的大小和位置的微小变化即可导致ADC的明显变化。本研究亦表明,ROI的大小和位置影响ADC测量的一致性。比较3种不同ADC测量方法,发现全肿瘤测量所得ADC的一致性(ICC=0.87)优于最大层面测量(ICC=0.56)和实性成分测量(ICC=0.58),表明分析ADC图的体素越多,越能代表肿瘤真实的ADC,可重复性越高。
本研究结果还显示,不同的ROI选择对直肠癌ADC有一定影响。直肠癌实性成分测量所得ADC低于全肿瘤和最大层面测量。直肠癌实性成分中水分子扩散的限制程度明显高于肿瘤纤维化和肿瘤坏死,因此实性成分少,ROI测量所得ADC明显低,但其并不能反映肿瘤的整体情况。有研究证明,全肿瘤测量所得ADC值对肿瘤治疗反应的预测价值明显优于肿瘤局部测量[11]。另有研究针对结直肠癌CT灌注扫描,发现灌注扫描参数与ROI大小和位置密切相关,全肿瘤测量中肿瘤血流状态最可靠[12]。这也解释了全肿瘤测量所得ADC的变异度(即SD值)高于实性成分测量的原因,因为全肿瘤测量所得ADC包括肿瘤的全部,如肿瘤实质部分、纤维化、黏液变及肿瘤坏死,能更好地代表肿瘤的异质性,更适合评价肿瘤治疗反应。另一方面,全肿瘤测量所得ADC与最大层面测量之间无显著差异,这在临床工作中有重要意义。目前,全肿瘤测量还没有商业化的自动或半自动测量软件,需花费大量时间;而最大层面测量花费时间相对较短,临床较易推广。此外,观察者之间最大层面测量差异明显,可重复性相对较差。
本研究存在一定的局限性:首先,本研究是回顾性分析,病例数相对较少;其次,本科室在临床常规检查中只采用了2个b值(0和1 000 s/mm2),而ADC可能受微循环灌注的影响。近年来多b值DWI技术如体素内不相干运动成像(intravoxel incoherent motion,IVIM)[13]、扩散峰度成像(diffusion kurtosis imaging,DKI)[14]开始用于直肠癌定量研究,但目前尚未常规用于临床。综上所述,直肠癌的ADC测量受ROI大小和位置的影响,全肿瘤测量方法的可重复性优于最大层面和小ROI实性成分测量。
[1] BEETS-TAN R G, BEETS G L. Rectal cancer: review with emphasis on MR imaging [J]. Radiology, 2004, 232(2): 335-346.
[2] 饶圣祥,曾蒙苏,陈财忠,等. 直肠癌T分期高分辨MRI技术应用及其病理对照研究 [J]. 放射学实践, 2007, 22(2): 124-127.
[3] AKASHI M, NAKAHUSA Y, YAKABE T, et al. Assessment of aggressiveness of rectal cancer using 3-T MRI: correlation between the apparent diffusion coefficient as a potential imaging biomarker and histologic prognostic factors [J]. Acta Radiol, 2014, 55(5): 524-531.
[4] JUNG S H, HEO S H, KIM J W, et al. Predicting response to neoadjuvant chemoradiation therapy in locallyadvanced rectal cancer: diffusion-weighted 3 Tesla MR imaging [J]. J Magn Reson Imaging, 2012, 35(1): 110-116.
[5] MOON S J, CHO S H, KIM G C, et al. Complementary value of pre-treatment apparent diffusion coefficient in rectal cancer for predicting tumor recurrence [J].Abdom Radiol (NY), 2016, 41(7): 1237-1244.
[6] SUN Y S, ZHANG X P, TANG L, et al. Locally advanced rectal carcinoma treated with preoperative chemotherapy and radiation therapy: preliminary analysis of diffusion-weighted MR imaging for early detection of tumor histopathologicdownstaging [J]. Radiology, 2010, 254(1): 170-178.
[7] DZIK-JURASZ A, DOMENIG C, GEORGE M, et al.Diffusion MRI for prediction of response of rectal cancer to chemoradiation [J]. Lancet, 2002, 360(9329): 307-308.
[8] KIM S H, LEE J M, HONG S H, etal. Locally advanced rectal cancer: added value of diffusion-weighted MR imaging in the evaluation of tumor response to neoadjuvant chemo- and radiation therapy [J]. Radiology, 2009, 253(1): 116-125.
[9] RAO S X, ZENG M S, CHEN CZ, et al.The value of diffusion-weighted imaging in combination with T2-weighted imaging for rectal cancer detection [J]. Eur J Radiol, 2008, 65(2): 299-303.
[10] CURVO-SEMEDO L, LAMBREGTS D M, MAAS M, et al. Rectal cancer: assessment of complete response to preoperative combined radiation therapy with chemotherapy—conventional MR volumetry versus diffusion-weighted MR imaging [J]. Radiology, 2011, 260(3): 734-743.
[11] ROTH Y, TICHLER T, KOSTENICH G, et al. Highb-value diffusion-weighted MR imaging for pretreatment prediction and early monitoring of tumor response to therapy in mice [J]. Radiology, 2004, 232(3): 685-692.
[12] GOH V, HALLIGAN S, GHARPURAY A,etal.Quantitative assessment of colorectal cancer tumor vascular parameters by using perfusion CT: influence of tumor region of interest [J]. Radiology, 2008, 247(3): 726-732.
[13] YU X P, WEN L, HOU J, et al. Discrimination between metastatic and nonmetastatic mesorectal lymph nodes in rectal cancer using intravoxel incoherent motion diffusion-weighted magnetic resonance imaging [J].Acad Radiol, 2016, 23(4): 479-485.
[14] YU J, HUANG DY, LI Y, et al. Correlation of standard diffusion-weighted imaging and diffusion kurtosis imaging with distant metastases of rectal carcinoma [J]. J Magn Reson Imaging, 2016, 44(1): 221-229.
Interobserver variability for different methods of tumor apparent diffusion coefficient measurement in rectal cancer
WANG Yong, WANG Xiuping
(Department of Radiology, Jiangsu Taizhou People’s Hospital, Taizhou 225300,Jiangsu Province, China)
WANG Xiuping E-mail: wangxiuping126@126.com
Objective:To evaluate the interobserver variability for different methods of tumor apparent diffusion coefficient(ADC) measurement in rectal cancer.Methods:A total of 37 patients with rectal cancer were analyzed retrospectively. They underwent MRI including diffusion weighted imaging (DWI) (b values: 0 and 1 000 s/mm2). The mean ADC values were measured by two readers using three region of interest (ROI) protocols: whole-volume, single slice and small solid samples. The values of ADC and standard deviation (SD) and interobserver variability were compared.Results:Intraclass correlation coefficient (ICC) for whole-volume measurement was excellent (0.87), while for single slice and small solid sample measurements were moderate (ICC:0.56 for single slice, 0.58 for small solid sample). ADC values measured by small solid sample method were signi ficantly lower than those by whole-volume (P<0.001) and single slice (P<0.001). The SDs calculated by whole-volume and single slice methods were signi ficantly larger than that by small solid sample method (P<0.001 and P=0.02, respectively).Conclusion:ADC values and interobserver variability are in fluenced by different measurement methods. There peatability of whole-volume method is the best.
Rectal neoplasm; Diffusion weighted imaging; Apparent diffusion coefficient
R445.2
A
1008-617X(2017)04-0285-04
2017-03-23
2017-04-22)
王秀平 E-mail:wangxiuping126@126.com
