磁共振波谱成像技术对评价早期肝性脑病严重程度的可行性分析
2017-09-29黄天宇梁英良王嵩姚晔
黄天宇,梁英良,王嵩,姚晔
磁共振波谱成像技术对评价早期肝性脑病严重程度的可行性分析
黄天宇,梁英良,王嵩,姚晔*

目的运用3.0 T磁共振波谱成像技术评估早期肝性脑病(minimal hepatic encephalopathy,MHE)患者的局部脑代谢改变。材料与方法收集30例伴有轻微肝性脑病的肝硬化患者,29例不伴有轻微肝性脑病的肝硬化患者及30名健康志愿者。在3.0 T场强下对大脑前扣带回及基底节区进行扫描得到其单体素质子波谱成像的数据。利用LC-model软件计算出N-乙酰天门冬氨酸(N-acetylaspartate,NAA)、肌醇(myo-inositol,MI)、谷氨酸(glutamic,Glu)、谷氨酰胺(glutamate,Gln)以及肌酸(creatine,Cr)的浓度,并对其进行分析比较3组患者之间的差异。结果肝硬化患者的Glu浓度显著升高,在合并MHE的肝硬化患者中尤其明显。在所有肝硬化患者及对照组中,仅有部分肝硬化患者的Gln浓度升高。肝硬化患者的MI浓度明显降低,但两组肝硬化患者降低的程度差异无统计学意义。3组患者的NAA浓度差异无统计学意义。结论3.0 T场强下的磁共振波谱成像(magnetic resonance spectroscopy,MRS)扫描可以检测出合并MHE肝硬化患者的脑代谢改变。合并轻微肝性脑病的肝硬化患者的Glu浓度增高。Glu浓度可以作为评价合并轻微肝性脑病的肝硬化患者病情严重程度的敏感指标。
磁共振波谱成像;肝性脑病;肝硬化;磁共振成像
早期肝性脑病(minimal hepatic encephalopathy,MHE)的典型特点是心理测试中认知功能的损害和/或脑电图平均周期频率的降低,而没有明显的临床症状[1]。传统肝性脑病的诊断主要依靠神经心理学检查,但是这种检查方法既不具有特异性,也不能反映患者当前的病理状态。有研究对肝硬化患者进行3年随访后发现,在合并MHE的肝硬化患者中约有50%的患者会进展为显性肝性脑病[2],而没有MHE的肝硬化患者中仅有8%会发展为显性肝性脑病,因此MHE的早期诊断至关重要,这一方面会影响MHE患者的预后,另一方面也会影响患者的生活质量[3]。与肝硬化相关神经精神损害的机制包括病理生理学、演变和预后尚未完全了解,这个问题的相关结果也是有争议的[4]。目前的研究表明这些神经精神损害和脑代谢模式的改变有关,这些症状可以通过降低血氨来逆转[5]。
对这些患者进行充分的神经精神评估目前仍旧很困难,因为低级别脑病相关的神经精神症状表现多样且轻微。这个问题在MHE患者中更加突出,因为这些患者仅表现出神经心理学测试的改变。这些测试结果会受多种混杂因素的影响,比如年龄、情绪障碍和受教育程度等。因此,运用无创性影像学检查,比如磁共振波谱成像(magnetic resonance spectroscopy,MRS)技术来辅助评估MHE成为目前研究的热点。以前的研究仅报告了谷氨酰胺-谷氨酸复合物(glutamine and glutamate complex,Glx)的变化,而非谷氨酸(glutamic,Glu)和谷氨酰胺(glutamate,Gln)的变化[6]。在本研究中,笔者使用高磁场MR (3.0 T)进行MRS序列扫描区分Gln、Glu,并进行分析数据,以确定N-乙酰天门冬氨酸(N-acetylaspartate,NAA)、肌酸(creatine,Cr)、肌醇(myo-inositol,MI)、Gln和Glu水平与MHE的病理生理学之间的相关性。
1 材料与方法
1.1 临床资料
收集2016年1月至2016年12月上海中医药大学附属龙华医院消化内科门诊患者的资料,将受试者分为3组。组Ⅰ:33例合并MHE的肝硬化患者;组Ⅱ:30例不合并MHE的肝硬化患者;组Ⅲ:30名健康志愿者作为对照组。
在初步评估期间先对患者进行临床评估。认知评估包括精神病史和简易精神状态检查(minimental state examinatlon,MMSE)。MMSE评分小于24分的患者被认定为认知受损,并将其排除研究。笔者运用综合评价方法,例如影像学检查(腹部超声,计算机断层扫描)、组织学检查和血液生化数据诊断肝硬化。患者的排除标准包括:MR检查期间发生幽闭恐怖症;年龄小于18岁或75岁以上;研究前3个月内有活动性酒精中毒;Ⅱ~Ⅳ级肝性脑病;Child-Pugh评分(评估肝脏疾病的严重性) C级;神经或精神疾病;接受用精神药物或已知改变神经心理功能的其他药物治疗;研究前1 w内有胃肠道出血或感染;检查前已进行分流手术。所有对照组中的受试者没有任何神经或精神疾病、代谢紊乱、酒精或药物滥用、头部损伤或肝脏疾病的病史。所有受试者均接受详细的临床评估,包括神经系统检查。
本研究由当地机构审查伦理委员会批准,受试者均签署知情同意书,且该研究方案符合1975年赫尔辛基宣言的伦理准则。
1.2 临床神经心理学测试
根据1998年维也纳第11届世界胃肠病学大会国际肝性脑病工作组的建议[7],笔者对患者进行了数字连接实验A (number connection test,NCT-A)和数字符号实验(digit symbol test,DST)两项检查。当测试分数高于或低于相应的年龄和教育对照组2个标准差时,该结果被视为异常。NCT-A和/或DST结果异常,但没有明显肝性脑病症状的患者诊断为合并MHE。
1.3 实验室检查
所有患者在进行MR扫描的前1 w内进行血液生物化学测试,包括凝血酶原时间、蛋白质代谢测试(例如总蛋白、球蛋白、白蛋白、白球比)、胆红素代谢测试(例如总胆红素、直接胆红素、间接胆红素)、谷氨酸丙酮酸转氨酶和谷氨酸草酰乙酸转氨酶。上述检测结果用于计算Child-Pugh评分以评估肝脏疾病的严重程度,同时对患者进行静脉血氨测试。
1.4 MR检查
使用配备有8通道相位线圈的Philips 3.0 T MRI系统(Ingenia 3.0 T,Philips Medical System,The Netherlands)进行体内单体素MRS成像。磁共振T1加权图像扫描参数如下:TR=550 ms;TE=10 ms;FOV=21 cm×21 cm;层厚=3 mm;间隔=0.1 mm。H1-MRS用于大脑中代谢物浓度的定量分析。运用2D-T1WI的冠、矢状位成像数据对感兴趣区体素进行图像引导定位来进行数据采集。本研究对大脑前扣带回和双侧基底神经节区进行了MRS评估(图1)。单体素MRS激励回波采集序列(stimulated-echo acquisition mode,STEAM)的扫描参数如下:TR=2000 ms;TE=72 ms;TM=6 ms;体素=20 mm×20 mm×20 mm;总点数=2048;平均值=256。总扫描时间为25 min。结果显示各代谢产物的浓度分别为Glu 2.35 ppm、Gln 2.45 ppm、MI 3.55 ppm、Cr 3.02 ppm、NAA 2.01 ppm。其中双侧基底节区代谢物数值取平均值。代谢产物利用LC模型算法在频域拟合实验数据来实现定量测量。
1.5 数据分析
数据分析运用SPSS 11.5软件,定量变量用均值±标准差表示,分类变量表示为频率或百分比。使用双尾t检验测试患者和健康对照组之间的差异。每组间的差异用配对t检验测试。独立样本t检验用于比较健康对照组和肝硬化患者之间的大脑前扣带回和基底神经节区代谢物浓度差异。P<0.05认为差异有统计学意义。
2 结果
由于扫描时间过长,4名患者(组Ⅰ中3名,组Ⅱ中1名)没有完成MR检查。剩余的患者分为以下几组:组Ⅰ:30例(14例女性和16例男性)合并MHE的肝硬化患者组;组Ⅱ:29例(14例女性和15例男性)不合并MHE的肝硬化患者组;组Ⅲ:30名健康受试者(17名女性和13名男性)作为健康对照组。3组研究对象的临床检查和实验室参数见表1。
大脑前扣带回和双侧基底节区的MRS特点如表2所示。大脑前扣带回的代谢改变如图2所示。肝硬化患者的Glu水平显著增加(P<0.001)。在合并与不合并MHE的患者之间其Glu浓度差异具有统计学意义(P<0.001),在合并MHE组明显高于不合并MHE组。Gln在肝硬化患者中显著增加(P1= 0.041,P2=0.034),但并不能在所有肝硬化患者和健康对照组中都检测到。肝硬化患者的MI降低(P1=0.013,P2=0.006),但在合并与不合并MHE的患者之间差异无统计学意义(P=0.701)。3组间NAA差异无统计学意义。研究结果表明MHE患者的Glu升高,肝硬化患者大脑前扣带回的MI/Cr减少。基底节区的测量结果与前扣带回(ACC区域)类似。

表1 3组研究对象的临床和实验室参数Tab.1 Clinical and laboratory parameters of the three groups of subjects
表2 根据2D MRS峰面积计算出的代谢产物浓度Tab.2 The concentration of metabolites calculated (MRS±SD) according to the peak area of 2D MRS
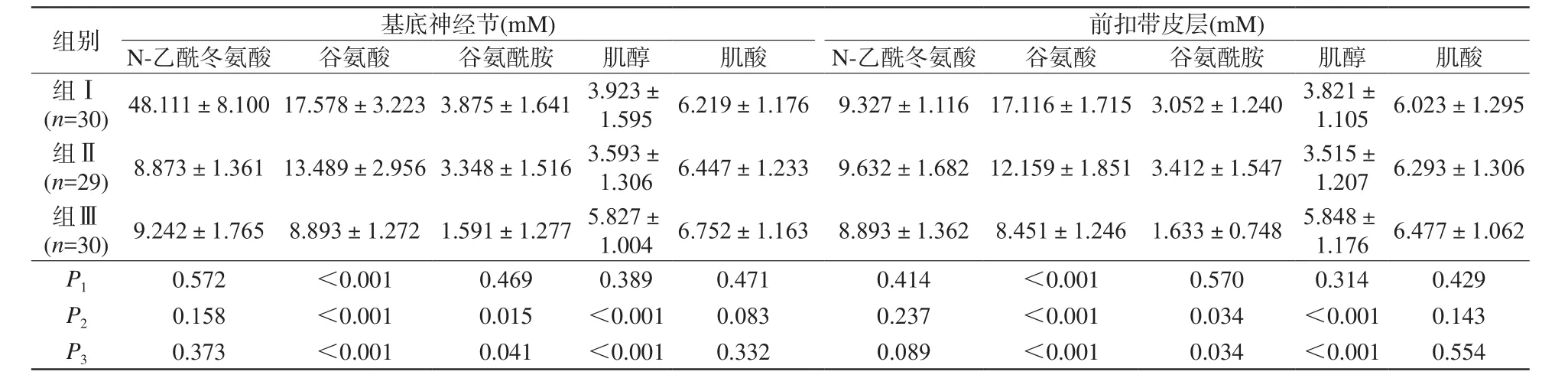
表2 根据2D MRS峰面积计算出的代谢产物浓度Tab.2 The concentration of metabolites calculated (MRS±SD) according to the peak area of 2D MRS
注:P1:组Ⅰ和组Ⅱ之间的P值;P2:组Ⅰ和组Ⅲ之间的P值;P3:组Ⅱ和组Ⅲ之间的P值;组Ⅰ中的11例患者、组Ⅱ中的9例患者及组Ⅲ中的5名健康受试者可以检测到谷氨酰胺。
组别基底神经节(mM)(n=30)48.111±8.10017.578±3.2233.875±1.6413.923±1.5956.219±1.1769.327±1.11617.116±1.7153.052±1.2403.821±1.1056.023±1.295组Ⅱ前扣带皮层(mM)N-乙酰冬氨酸谷氨酸谷氨酰胺肌醇肌酸N-乙酰冬氨酸谷氨酸谷氨酰胺肌醇肌酸组Ⅰ(n=29)8.873±1.36113.489±2.9563.348±1.5163.593±1.3066.447±1.2339.632±1.68212.159±1.8513.412±1.5473.515±1.2076.293±1.306(n=30)9.242±1.7658.893±1.2721.591±1.2775.827±1.0046.752±1.1638.893±1.3628.451±1.2461.633±0.7485.848±1.1766.477±1.062P10.572<0.0010.4690.3890.4710.414<0.0010.5700.3140.429P20.158<0.0010.015<0.0010.0830.237<0.0010.034<0.0010.143P30.373<0.0010.041<0.0010.3320.089<0.0010.034<0.0010.554组Ⅲ

图1 男,49岁,合并MHE的肝硬化患者前扣带回MRS检查。Glu:2.35 ppm,Gln:2.45 ppm,MI:3.55 ppm,Cr:3.02 ppm,NAA:2.01 ppm 图2 合并MHE的肝硬化患者(组Ⅰ),不合并MHE的肝硬化患者(组Ⅱ)和健康受试者(组Ⅲ)的ACC代谢物变化,*P<0.05。肝硬化患者的Glu显著增高,在合并及不合并MHE的患者中差异存在统计学意义;肝硬化患者的Gln增加,但并不能在所有肝硬化和健康者中检测到。肝硬化MI显著减低,在合并与不合并MHE患者之间差异无统计学意义Fig. 1 Male, 49-year-old, metabolite changes in the ACC for the cirrhotic patients with MHE. It revealed that Glu at 2.35 ppm, Gln at 2.45 ppm, MI at 3.55 ppm, Cr at 3.02 ppm, and NAA at 2.01 ppm. Fig. 2 Metabolite changes in the ACC for the cirrhotic patients with MHE (group Ⅰ), the cirrhotic patients without MHE (group Ⅱ) and the healthy volunteers (group Ⅲ).*P<0.05. Glu significantly increased in the cirrhotic patients, and the difference in Glu was statistically significant in patients with and without MHE. Gln significantly increased in the cirrhotic patients, but it could not be detected in all cirrhotic patients or healthy controls. MI significantly decreased in the cirrhotic patients; However, there was no significant difference between the patients with and without MHE.
3 讨论
之前的相关研究主要关注于出现肝性脑病症状的肝硬化患者的脑代谢改变[7]。本项研究的主要目的是定量研究合并以及不合并MHE的肝硬化患者的脑代谢改变,并和健康对照组进行对比。同时测量了各代谢产物的浓度(Glu、Gln、MI、NAA和Cr),而不仅仅是各代谢产物之间的比例。在本研究中,使用3.0 T MR扫描仪进行MRS序列扫描,发现并不是所有的患者和对照组都可以检测出Gln,但所有的肝硬化患者都可以检测出Glu浓度的增加。肝硬化患者会出现Glu的增加,而且在合并以及不合并MHE的患者间其Glu浓度差异有统计学意义,这表明在肝硬化情况下观察到的脑中Glx信号强度的增加主要归因于Glu浓度的增加。
国际肝性脑病和氮代谢协会建议根据认知功能的损害程度来诊断肝性脑病,即认知功能未受损(无任何临床、神经生理学或神经心理学变化)、隐蔽损害(轻微肝性脑病和West-Haven定义的I级肝性脑病)和明显损害(West-Haven定义的Ⅱ级肝性脑病)[8]。MHE患者常常焦虑、激动,甚至有惊厥和睡眠困难,因为Glu是一种兴奋性神经递质。如何解释本研究中的代谢物变化,笔者认为,在疾病的早期阶段,发生高氨血症的情况下,大脑会参与氨的转化,星形胶质细胞中的Gln合成酶将大量的Glu转化为Gln,从而导致细胞渗透压失衡[9]。结合本研究的结果,笔者认为 Glu差异可以为临床提供客观的评价依据。MHE的早期阶段Gln水平会增加,但星形胶质细胞同时代偿性地将Gln转移出大脑。随着病情的发展,Gln水平会迅速增加[10-12]。研究还发现,肝硬化患者的MI水平下降,但在合并以及不合并MHE的肝硬化患者之间差异没有统计学意义。MI是一种有机渗透压调节剂,可以代偿性地缓冲星形胶质细胞中氨诱导产生的过量Gln。然而,星形胶质细胞内达到稳定状态需要一定时间,轻微肝性脑病常由于发病过急而不能及时进行代偿性转移。这可能解释了为什么合并以及不合并MHE患者之间的MI差异无统计学意义,同时说明MI可能与MHE的严重性不相关。
在本研究中,笔者测量了代谢物的具体浓度,而不仅仅是代谢比值,这样就不会受到内参变异的影响。在脑波谱学中,一般认为Cr信号可以作为对照较好的内参使用,但是Cr的浓度在许多疾病中都会发生改变,如肝性脑病[13-15]。本研究结果表明,健康对照组的Cr浓度高于其他两个肝硬化组,但这些差异没有统计学意义。肝硬化患者可能出现脑代谢改变,这些患者的Cr浓度也可能改变,所以使用Cr比值会产生一些偏差。
目前认为大脑氨代谢在急慢性肝衰竭患者发生MHE的病理生理学中发挥了关键作用。但是“氨中毒假说”并不能完全解释为什么在肝硬化程度相同的患者中,只有部分患者继续发展为MHE[16]。氨水平与MHE的严重程度不相关。在本研究中,肝硬化患者的静脉血氨异常,同时合并以及不合并MHE的肝硬化患者的血氨水平差异无统计学意义。Child-Pugh C级的肝硬化患者可能发展为严重的MHE,因此本研究排除了这些患者,只选择Child-Pugh A级和B级的患者。
本研究可能存在以下缺点:(1)由于扫描时间的限制,部分患者可能不一定耐受,尤其对合并MHE的患者;同时扫描的部位也受到限制不能选取更多的部位扫描,进而获得更加丰富的脑代谢变化;(2)没有进行长期随访,连续的跟踪患者MRS代谢值的变化将会更加有意义地说明肝性脑病的代谢规律,这也是下一步研究的方向。
总而言之,本研究发现利用3.0 T MR进行MRS序列扫描可以用于检测合并MHE的肝硬化患者的脑代谢改变,这些患者脑部MRS的典型特征是Glu水平升高,Glu水平升高可以作为评价肝硬化患者MHE严重程度的敏感指标。
[References]
[1] Zhan T, Stremmel W. The diagnosis and treatment of minimal hepaticencephalopathy, Dtsch. Arztebl Int, 2012, 109(10): 180-187.
[2] Stinton LM, Jayakumar S. Minimal hepatic encephalopathy. Can J Gastroenterol, 2013, 27(10): 572-574.
[3] Kappus MR, Bajaj JS. Covert hepatic encephalopathy: not as minimal as youmight think. Clin Gastroenterol Hepatol, 2012,10(11): 1208-1219.
[4] Mullen KD. Review of the final report of the 1998 working party on definition, nomenclature and diagnosis of hepatic encephalopathy.Aliment Pharmacol Ther, 2007, 25(Suppl): 11-16.
[5] Stewart CA, Smith GE. Minimal hepatic encephalopathy. Nat Clin Pract Gastroenterol Hepatol, 2007, 4(12): 677-685.
[6] Singhal A, Nagarajan R, Hinkin CH, et al. Two-dimensional MR spectroscopy of minimal hepatic encephalopathy and neuropsychological correlates in vivo. J Magn Reson Imaging, 2010,32(1): 35-43.
[7] Amodio P, Montagnese S, Gatta A, et al. Characteristics of minimalhepatic encephalopathy. Metab Brain Dis, 2004, 19(3):253-267.
[8] Foerster BR, Conklin LS, Petrou M, et al. Minimal hepatic encephalopathy in children: evaluation with proton MR spectroscopy.Am J Neuroradiol, 2009, 30(8): 1610-1613.
[9] Baja JS, Cordoba J, Mullen KD, et al. Review article: the design of clinicaltrials in hepaticencephalopathy-aninternational society for hepatic encephalopathy and nitrogen metabolism(ISHEN) consensus statement. Aliment Pharmacol Ther, 2011, 33 (7): 739-747.
[10] Savlan I, Liakina V, Valantinas J. Concise review of current concepts onnomenclature and pathophysiology of hepatic encephalopathy.Medicina (Kaunas), 2014, 50(2): 75-81.
[11] Sturgeon JP, Shawcross DL. Recent insights into the pathogenesis of hepaticencephalopathy and treatments. Expert Rev Gastroenterol Hepatol, 2014, 8(1): 83-100.
[12] Sturgeon JP, Shawcross DL. Recent insights into the pathogenesis of hepaticencephalopathy and treatments. Expert Rev Gastroenterol Hepatol, 2014, 8(1): 83-100.
[13] Amodio P, Montagnese S, Gatta A, et al. Characteristics of minimalhepatic encephalopathy. Metab Brain Dis, 2004, 19(3):253-267.
[14] Weissenborn K, Ahl B, Fischer-Wasels D, et al. Correlations between magnetic resonance spectroscopyalterations and cerebral ammonia and glucose metabolism in cirrhoticpatients with and without hepatic encephalopathy. Gut, 2007, 56(12): 1736-1742.
[15] Patidar KR, Bajaj JS. Covert and overt hepatic encephalopathy:diagnosis and management. Clin Gastroenterol Hepatol, 2015,13(12): 2048-2061.
[16] Suraweera D, Sundaram V, Saab S. Evaluation and management of hepatic encephalopathy: current status and future directions. Gut Liver, 2016, 10(4): 509-519.
[17] Keiding S, Pavese N. Brain metabolism in patients with hepaticencephalopathy studied by PET and MR. Arch Biochem Biophys, 2013, 536(2): 131-142.
Viability assessment of magnetic resonance spectroscopy for the detection of minimal hepatic encephalopathy severity
HUANG Tian-yu, LIANG Ying-liang, WANG Song, YAO Ye*
LongHua Hospital Shanghai University of Traditional Chinese Medicine, Shanghai 200032, China
Objective:To evaluate regional cerebral metabolic changes in minimal hepatic encephalopathy (MHE) patients using magnetic resonance spectroscopy (MRS)in 3.0 T scanner.Materials and Methods:This study comprised 30 cirrhotic patients with MHE, 29 cirrhotic patients without MHE and 30 healthy volunteers. Single-voxel proton MRS data in the anterior cingulate cortex (ACC) and basal ganglia were acquired using a 3.0 T scanner. The concentrations of N-acetylaspartate (NAA), myo-inositol(MI), glutamate (Glu), glutamine (Gln) and creatine (Cr) were obtained by LC-model software. Statistical analysis was performed to evaluate the differences between the three groups.Results:There was a significant increase in Glu for the cirrhotic patients,particularly the MHE patients. There was an elevation of Gln in the cirrhotic patients,but not in all cirrhotic patients or controls. There was a significant decrease in MI for the cirrhotic patients, but no significant difference between the two cirrhosis groups. There was no significant difference in NAA between the three groups.Conclusion:MRS using a 3.0 T MR scanner could detect cerebral metabolic changes in cirrhotic patients with MHE. Glu levels were elevated in cirrhotic patients with MHE; Glu levels could be used as a sensitive indicator to evaluate the severity of MHE in patients with cirrhosis.
Magnetic resonance spectroscopy; Hepatic encephalopathy; Liver cirrhosis; Magnetic resonance imaging
28 Feb 2017, Accepted 9 May 2017
作者单位:
上海中医药大学附属龙华医院,上海200032
上海市卫生和计划生育委员会科研课题(编号:201540198)
姚晔,E-mail:122186836@qq.com
2017-02-28
接受日期:2017-05-09
R445.2;R742
A
10.12015/issn.1674-8034.2017.06.003
黄天宇, 梁英良, 王嵩, 等. 磁共振波谱成像技术对评价早期肝性脑病严重程度的可行性分析. 磁共振成像, 2017,8(6): 413-417.
*Correspondence to: Yao Y, E-mail: 122186836@qq.com
ACKNOWLEDGMENTSThis work was part of Scientific Research Project of Shanghai Municipal Commission of Health and Family Planning (No.201540198).
