CAR T细胞治疗在血液肿瘤中的临床研究
2017-09-29李军陈雄波董坚
李军,陈雄波,董坚
1.湖北省肿瘤疾病细胞治疗临床医学研究中心,武汉 430022 2. 武汉思安医疗技术有限公司,武汉 430207
CAR T细胞治疗在血液肿瘤中的临床研究
李军1,2,陈雄波1,2,董坚1,2
1.湖北省肿瘤疾病细胞治疗临床医学研究中心,武汉 430022 2. 武汉思安医疗技术有限公司,武汉 430207

董坚,教授,现任武汉思安医疗技术有限公司首席科学家。长期从事基因治疗、免疫治疗及肿瘤转移的研究和产品开发。曾任诺华制药(日本)研究开发部技术总监,美国国立卫生研究院(NIH)助理研究员,北卡罗莱纳大学教堂山分校医学院研究员。E-mail:dongjian@sianmed.com
2017年7月12日,首个用于复发或难治性儿童/成人急性淋巴细胞白血病的嵌合抗原受体T细胞(CAR-T)疗法CTL-019获美国FDA专家咨询委员会全票通过,标志着CAR-T疗法在血液肿瘤临床试验中取得了巨大的突破。CAR-T疗法在血液肿瘤方面开展了大量临床试验,也积累了很多的临床经验。主要对全球CAR-T细胞治疗在血液肿瘤中的临床试验进行了分析,对治疗过程中出现的细胞因子释放综合征(CRS)、神经毒性、出凝血功能异常、B细胞发育不良等不良反应以及应对措施进行了总结,最后对CAR-T细胞治疗的发展趋势进行了探讨。
嵌合抗原受体T细胞;免疫治疗;血液肿瘤
1 CAR-T细胞治疗的发展
Zelig Eshhar于1989年构建了第一个功能性嵌合抗原受体(CAR)T细胞。CAR由T 细胞受体的胞外抗原结合区、铰链区、中间的跨膜区及胞内信号区4个部分组成。胞外抗原结合区通常是单克隆抗体的单链可变区片段(single chain variable fragment,scFv),由抗体可变区的轻链和重链共同组成,中间由多肽链接,能够特异性识别特定肿瘤抗原,将其转染至T 细胞即可制备出CAR-T细胞,使其具有抗体的特异性和效应T 细胞的细胞毒作用。胞外区也可以是特异性结合癌抗原的配体。scFv可以来源于鼠源、人源和全人源,人源和全人源抗体具有免疫原性低的优点,可以有效避免鼠源scFv引起的人抗鼠抗原(human anti mouse antigen,HAMA)反应。利用胞外区单链的可变性,可以制备出与不同肿瘤抗原结合的CAR-T细胞,因此胞外区决定了CAR的特异性。目前,已有多种肿瘤抗原可用于胞外区识别,包括CD19、CD20、表皮生长因子受体(EGFR)和人类表皮生长因子受体2(HER-2)等[1]。铰链区有CD8 Hinge、CD28 Hinge和较长的IgG1 Fc或IgG4 Fc等。中间的跨膜区有CD4、CD8和CD28等[2],将CAR结构锚定于T细胞膜。细胞内区为免疫受体酪氨酸活化基序(immuno receptor tyrosine-based activation motifs,ITAMs),通常为T细胞受体TCR/CD3 ζ链或免疫球蛋白Fc受体FcεRIγ链,可发挥信号转导功能。第一代CAR胞内仅含一个活化结构域,因此其在特异性识别肿瘤细胞相关抗原后的杀伤作用十分有限[3]。
近几年来通过对胞内信号区设计的改造,CAR经历了从第一代到第四代的变迁。早期设计的第一代CAR受到特异性抗原识别并激发后,可为T细胞提供活化信号,并通过胞内结构域传导该信号,引起细胞的活化,表现为CAR依赖的细胞活化及细胞杀伤作用,分泌穿孔蛋白、颗粒酶及细胞因子,协同作用杀死肿瘤细胞[4-5]。为了增强CAR-T细胞的杀伤作用,通过在胞内结构域引入共刺激分子结构来达到信号传递作用的扩增,使其杀伤力得到成倍的扩大[6]。第二代CAR含有一个活化结构域和一个共刺激区域,如CD28或4-1BB[7-8]。第三代CAR胞内部分则由活化结构域和多重共刺激区域组成,如CD27、CD28、4-1BB和OX40等,这些结构域的增加不仅能够加强CAR-T细胞特异性识别肿瘤抗原及结合等能力,更能够显著扩大由胞外区传递的细胞信号,引起下级细胞杀伤作用的级联放大[9]。此外,Pegram等[10]对CD19的CAR-T细胞进行了进一步的改造,使其可以自分泌IL-12,耐受调节性T细胞造成的免疫抑制作用,减少或避免可能有害的预处理化疗,使患者获得更好的疗效。
2 CAR-T细胞治疗用于血液肿瘤
CAR-T细胞治疗目前已成功运用于多种肿瘤疾病的临床试验中,包括多数血液肿瘤以及肾脏肿瘤、肝脏肿瘤、神经肿瘤等实体瘤。由于血液肿瘤的特殊性质以及靶点特异性,CAR-T细胞治疗在其中取得了显著的效果及安全性。由表1总结的已发表的CAR-T细胞治疗血液肿瘤的临床试验可见,目前已应用于ALL、CLL、AML、NHL、MM等,主要集中在恶性B细胞肿瘤。CAR-T细胞多数为以CD19、CD20为特异性靶点,以CD28或4-1BB为共刺激结构域的第二代产品,少数为同时含有两个共刺激结构域的第三代产品,尽管CAR-T产品具有不同结构,但均显示出良好的治疗效果。CAR-T细胞输注剂量多在1×106/kg~1×107/kg,未发生与细胞输注直接相关的急性的严重毒副作用,可以基本作为安全剂量范围。超过70%的患者可获得不同程度缓解,缓解期较长者可维持1年多。主要不良反应包括CRS及神经毒性,多可自行缓解,严重患者可由托珠单抗或糖皮质激素治疗。
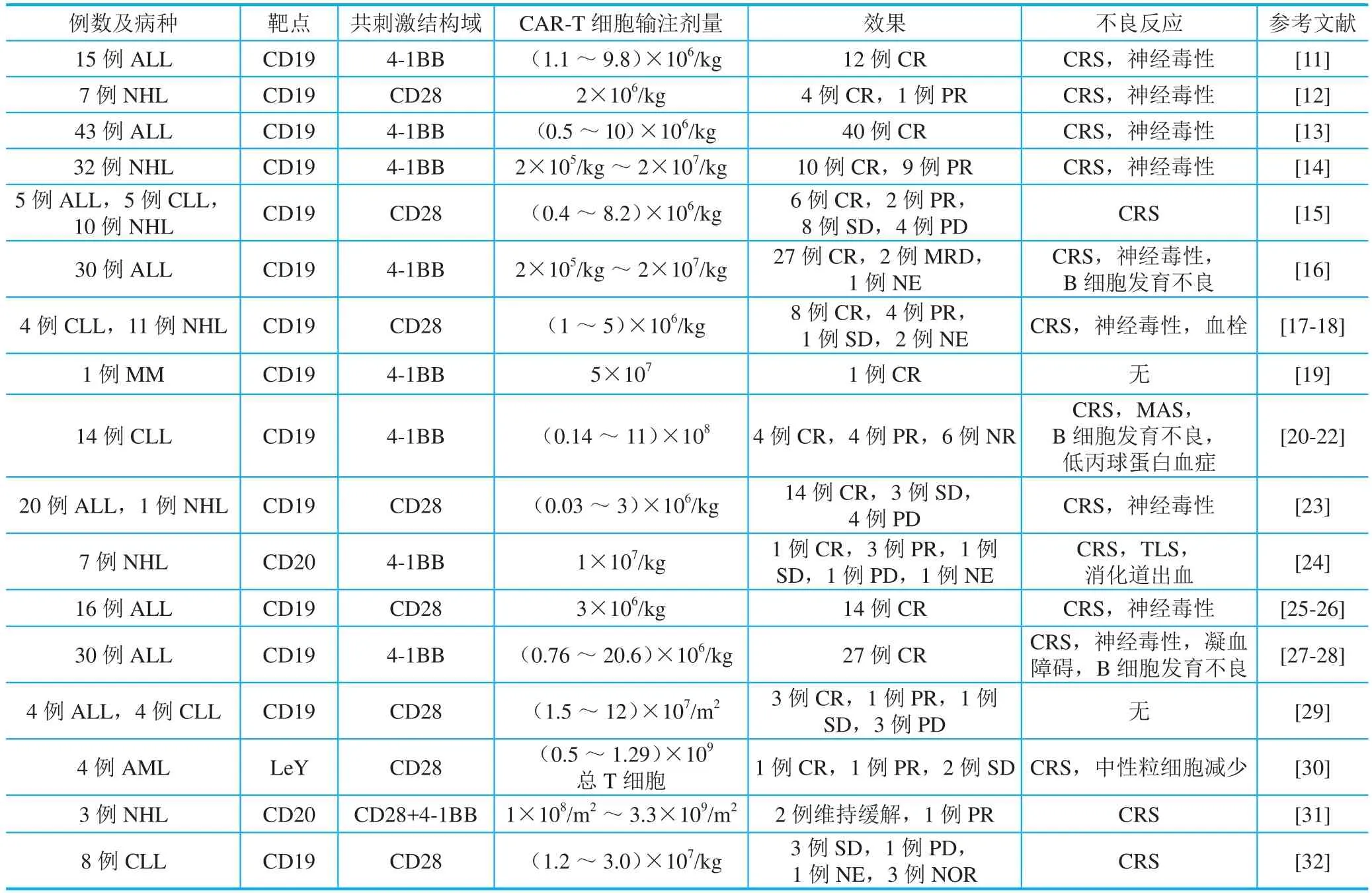
表1 CAR-T细胞治疗血液肿瘤临床试验总结
3 CAR-T细胞治疗的不良反应
CAR-T细胞治疗是一种新兴的肿瘤治疗方法,此前从未有过任何生产标准,尽管已经在临床上证明了它的有效性,但其往往伴随着多种毒副反应,如CRS、神经毒性、出凝血功能障碍、B细胞发育不良等。
3.1 CRS
CAR-T细胞治疗过程中体内释放的大量细胞因子,会引发机体多种免疫炎症反应,称之为CRS,发生于超过半数的受试者,是最常见的不良反应之一。
CRS可发生于CAR-T细胞输注后2~3周内,常见的临床症状包括发热、寒战、疲劳、低血压、呼吸困难,以及心、肝、肾功能异常等[18,21-22,26,28,31-32]。临床医生除了通过患者症状判断其是否发生CRS,还可定期检测其体内细胞因子水平,多项临床试验发现,发生CRS患者血清的TNF-α、IFN-γ、IL-6、IL-10等细胞因子往往处于高水平,其变化趋势也与症状严重程度呈正相关。
在探索CAR-T细胞疗法的早期阶段,曾发生过两例CRS致死的案例[33-34],随着治疗经验的积累,CAR-T细胞疗法的安全性也得以提高。通常情况下,CRS症状可由解热、升压、吸氧等对症支持治疗所控制;对于严重的CRS,可使用免疫抑制剂糖皮质激素[20,23-25,27]或IL-6受体拮抗剂托珠单抗[17,20,23,25,27]进行治疗。值得注意的是,有研究发现,糖皮质激素在迅速控制CRS症状的同时,会影响CAR-T细胞增殖,降低其抗肿瘤效率,而托珠单抗则不会影响治疗效果,故将托珠单抗作为一线治疗剂。Lee等[35]推荐成人使用4mg/kg、儿童使用8mg/kg的托珠单抗进行治疗,合并严重神经系统异常者以甲强龙2mg/(kg·d)作为初始治疗剂量。
3.2 神经毒性
除CRS外,另一常见且具有生命危险的不良反应为神经毒性。多项临床试验曾报道包括脑梗死、谵妄、意识不清、抽搐、神经麻痹、视野缺损、共济失调、言语障碍在内的多种神经系统异常症状 [17-18,23,26,28,31,36-37]。
在成功利用托珠单抗治疗CRS之后,神经毒性已成为CAR-T治疗过程中的主要生命威胁事件,其发生机制仍有待探索。美国CAR-T治疗领域领军企业Juno Therapeutics公司由于在其临床试验中出现5例不可预期的脑水肿死亡[38],宣布停止该项号称“火箭计划”的临床试验;公司分析,神经毒性可能由于预处理化疗药物氟达拉滨或CAR-T产品结构中的CD28共刺激结构域引起。Hu等[37]检测出现神经毒性的患者的脑脊液,发现其中含有大量持续存在的CAR-T细胞,且脑脊液细胞因子水平远远高于血清水平,故推测CAR-T细胞能够穿透血脑屏障,引发颅内CRS,从而造成神经毒性。Mei等[36]治疗1例10岁白血病患儿期间,出现不明原因抽搐、意识丧失,且同样在脑脊液中发现大量可持续存在的CAR-T细胞,该结果警示,在治疗血脑屏障能力较弱的儿童患者时,更应该警惕神经毒性的发生。
定期监测脑脊液中CAR-T细胞数量及细胞因子水平,并借助头颅CT排除其他可能造成神经系统异常的因素,有助于分辨神经毒性是否由于颅内CRS引起,从而进行适当的治疗。对于确切发生颅内CRS的患者,为控制其症状,应使用能够穿透血脑屏障的药物,如地塞米松[26,39]或甲强龙[36-37],而不宜使用不可穿透血脑屏障的大分子药物托珠单抗;同时,可根据患者具体症状使用脱水药物或抗癫痫药物等。
3.3 出凝血功能障碍
部分临床试验中,受试者出现出凝血功能障碍,主要表现为散在瘀斑瘀点、血栓形成及实验室指标异常,如血小板减少、D-二聚体升高、纤维蛋白原降低、纤维蛋白降解产物升高、活化部分凝血活酶时间延长等[17,22,28,31,36]。定期监测血常规及出凝血指标有助于及时发现出凝血功能异常,早期正确的处理可预防弥散性血管内凝血(DIC)的发生,主要治疗措施包括补充血小板及凝血因子、抗凝或抗纤溶药物的适当应用等。
3.4 B细胞发育不良
在B细胞恶性血液肿瘤中,由于针对肿瘤细胞的靶点如CD19,同样表达于正常B细胞表面,故CAR-T细胞在清除肿瘤细胞的同时也会杀灭正常B细胞,造成B细胞发育不良[16,20,27]。且由于CAR-T细胞可在体内长期存续,并发挥作用,故体内可长期缺乏正常B细胞[20],造成丙种球蛋白低下,易形成感染。对于此类患者,应做好预防感染措施,并适当补充丙种球蛋白。
4 CAR-T细胞治疗的优势、局限与展望
CAR-T细胞治疗结合了生物合成技术和细胞工程技术,代表了临床医学和基础科学的有机整合,综合运用了识别和靶向疾病的抗体技术,是一类全新疗法,技术上与传统药物有很大区别,它是一种活体药物,不仅不会像传统药物被代谢掉,还会在病人体内复制,或者形成记忆细胞,一次给药可以延续很长时间[20,21,27]。与单抗治疗相比,CAR-T细胞治疗具有许多优势,如强大的体外扩增能力、体内存续时间久、针对低表达量的靶分子仍然有效等。
在看到CAR-T疗法优势的同时,仍应注意到CAR-T细胞在体内大量扩增带来的副反应,如CRS、神经毒性、出凝血功能异常、B细胞发育不良等,以及CAR-T细胞的有限持续性所带来的肿瘤抗原阳性复发。在提高CAR-T细胞在体内的增殖和持续性、加强肿瘤识别和杀伤、克服免疫抑制性微环境以及调控机制等方面,CAR-T细胞治疗技术还需要持续完善。该技术所面临的另一个问题为长期安全性,包括导致复制型逆转录病毒(RCR)的可能,以及插入诱变引起新的恶性肿瘤(遗传病毒)的可能,仍需找到解决方法。
2017年7月,美国FDA专家组从生产、疗效、安全性3个方面讨论诺华的CAR-T疗法CTL-019用于治疗儿童/成人急性B淋巴细胞白血病(r/rALL),最终全票通过,其在关键临床试验中3个月应答率为82%,6个月生存率为89%,12个月生存率为79%,显示出CAR-T细胞疗法的显著效果,虽然生产和安全性方面仍极具挑战,但也不足以成为上市障碍。可以预测,针对B淋巴细胞血液恶性肿瘤的CAR-T细胞疗法将受到全球医疗及科研机构的更多关注,更多临床试验的开展将加速CAR-T细胞免疫治疗在临床中的应用和推广。
[1] TURTLE C J,RIDDELL S R. Genetically retargeting CD8+lymphocyte subsets for cancer immunotherapy[J]. Curr Opin Immunol,2011,23(2):299-305.
[2] SHI H,LIU L,WANG Z. Improving the efficacy and safety of engineered T cell therapy for cancer[J]. Cancer Lett,2013,328(2):191-197.
[3] JENSEN M C,POPPLEWELL L,COOPER L J,et al. Antitransgene rejection responses contribute to attenuated persistence of adoptively transferred CD20/CD19-speci fi c chimeric antigen receptor redirected T cells in humans[J]. Biol Blood Marrow Transplant,2010,16(9):1245-1256.
[4] DENIGER D C,SWITZER K,MI T,et al. Bispecific T-cells expressing polyclonal repertoire of endogenous gamma delta T-cell receptors and introduced CD19-speci fi c chimeric antigen receptor[J].Mol Ther,2013,21(3):638-647.
[5] JENA B,DOTTI G,COOPER L J N. Redirecting T-cell specificity by introducing a tumor-speci fi c chimeric antigen receptor[J]. Blood,2010,116(7):1035-1044.
[6] WANG J,JENSEN M,LIN Y,et al. Optimizing adoptive polyclonal T cell immunotherapy of lymphomas,using a chimeric T cell receptor possessing CD28 and CD137 costimulatory domains[J]. Hum Gene Ther,2007,18(8):712-725.
[7] KOWOLIK C M,TOPP M S,GONZALEZ S,et al. CD28 costimulation provided through a CD19-specific chimeric antigen receptor enhancesin vivopersistence and antitumor efficacy of adoptively transferred T cells[J]. Cancer Res,2006,66(22):10995-11004.
[8] SANCHEZ-PAULETE A R,LABIANO S,RODRIGUEZ-RUIZ M E,et al. Deciphering CD137(4-1BB) signaling in T-cell costimulationfor translation into successful cancer immunotherapy[J]. Eur J Immunol,2016,46(3):513-522.
[9] PULE M A,STRAATHOF K C,DOTTI G,et al. A chimeric T cell antigen receptor that augments cytokine release and supports clonal expansion of primary human T cells[J]. Mol Ther,2005,12(5):933-941.
[10] PEGRAM H J,LEE J C,HAYMAN E G,et al. Tumor-targeted T cells modified to secrete IL-12 eradicate systemic tumors without need for prior conditioning[J]. Blood,2012,119(18):4133-4141.
[11] HU Y,WU Z,LUO Y,et al. Potent anti-leukemia activities of chimeric antigen receptor-modi fi ed T cells against CD19 in chinese patients with relapsed/refractory acute lymphocytic leukemia[J].Clinical Cancer Research,2017,23(13):3297-3306.
[12] LOCKE F L,NEELAPU S S,BARTLETT N L,et al. Phase 1 results of ZUMA-1:a multicenter study of KTE-C19 anti-CD19 CAR T cell therapy in refractory aggressive lymphoma[J]. Mol Ther,2017,25(1):285-295.
[13] GARDNER R A,FINNEY O,ANNESLEY C,et al. Intent-to-treat leukemia remission by CD19 CAR T cells of de fi ned formulation and dose in children and young adults[J]. Blood,2017,129(25):3322-3331.
[14] TURTLE C J,HANAFI L A,BERGER C,et al. Immunotherapy of non-Hodgkin’s lymphoma with a defined ratio of CD8+and CD4+CD19-specific chimeric antigen receptor-modified T cells[J]. Sci Transl Med,2016,8(355):355ra116.
[15] BRUDNO J N,SOMERVILLE R P T,SHI V,et al. Allogeneic T cells that express an anti-CD19 chimeric antigen receptor induce remissions of B-cell malignancies that progress after allogeneic hematopoietic stem-cell transplantation without causing graft-versushost disease[J]. J Clin Oncol,2016,34(10):1112-1121.
[16] TURTLE C J,HANAFI L A,BERGER C,et al. CD19 CAR-T cells of de fi ned CD4+:CD8+composition in adult B cell ALL patients[J]. J Clin Invest,2016,126(6):2123-2138.
[17] KOCHENDERFER J N,DUDLEY M E,KASSIM S H,et al.Chemotherapy-refractory diffuse large B-cell lymphoma and indolent B-cell malignancies can be effectively treated with autologous T cells expressing an anti-CD19 chimeric antigen receptor[J]. J Clin Oncol,2015,33(6):540-549.
[18] KOCHENDERFER J N,DUDLEY M E,FELDMAN S A,et al.B-cell depletion and remissions of malignancy along with cytokineassociated toxicity in a clinical trial of anti-CD19 chimeric-antigenreceptor-transduced T cells[J]. Blood,2012,119(12):2709-2720.
[19] GARFALL A L,MAUS M V,HWANG W T,et al. Chimeric antigen receptor T cells against CD19 for multiple myeloma[J]. N Engl J Med,2015,373(11):1040-1047.
[20] PORTER D L,HWANG W T,FREY N V,et al. Chimeric antigen receptor T cells persist and induce sustained remissions in relapsed refractory chronic lymphocytic leukemia[J]. Sci Transl Med,2015,7(303):303ra139.
[21] KALOS M,LEVINE B L,PORTER D L,et al. T cells with chimeric antigen receptors have potent antitumor effects and can establish memory in patients with advanced leukemia[J]. Sci Transl Med,2011,3(95):95ra73.
[22] PORTER D L,LEVINE B L,KALOS M,et al. Chimeric antigen receptor-modi fi ed T cells in chronic lymphoid leukemia[J]. N Engl J Med,2011,365(8):725-733.
[23] LEE D W,KOCHENDERFER J N,STETLER-STEVENSON M,et al. T cells expressing CD19 chimeric antigen receptors for acute lymphoblastic leukaemia in children and young adults:a phase 1 dose-escalation trial[J]. Lancet,2015,385(9967):517-528.
[24] WANG Y,ZHANG W Y,HAN Q W,et al. Effective response and delayed toxicities of refractory advanced diffuse large B-cell lymphoma treated by CD20-directed chimeric antigen receptormodi fi ed T cells[J]. Clin Immunol,2014,155(2):160-175.
[25] DAVILA M L,RIVIERE I,WANG X,et al. Efficacy and toxicity management of 19-28z CAR T cell therapy in B cell acute lymphoblastic leukemia[J]. Sci Transl Med,2014,6(224):224ra25.
[26] BRENTJENS R J,DAVILA M L,RIVIERE I,et al. CD19-targeted T cells rapidly induce molecular remissions in adults with chemotherapy-refractory acute lymphoblastic leukemia[J]. Sci Transl Med,2013,5(177):177ra38.
[27] MAUDE S L,FREY N,SHAW P A,et al. Chimeric antigen receptor T cells for sustained remissions in leukemia[J]. N Engl J Med,2014,371(16):1507-1517.
[28] GRUPP S A,KALOS M,BARRETT D,et al. Chimeric antigen receptor-modi fi ed T cells for acute lymphoid leukemia[J]. N Engl J Med,2013,368(16):1509-1518.
[29] CRUZ C R Y,MICKLETHWAITE K P,SAVOLDO B,et al.Infusion of donor-derived CD19-redirected virus-speci fi c T cells for B-cell malignancies relapsed after allogeneic stem cell transplant:a phase 1 study[J]. Blood,2013,122(17):2965-2973.
[30] RITCHIE D S,NEESON P J,KHOT A,et al. Persistence and ef fi cacy of second generation CAR T cell against the LeY antigen in acute myeloid leukemia[J]. Mol Ther,2013,21(11):2122-2129.
[31] TILL B G,JENSEN M C,WANG J,et al. CD20-specific adoptiveimmunotherapy for lymphoma using a chimeric antigen receptor with both CD28 and 4-1BB domains:pilot clinical trial results[J]. Blood,2012,119(17):3940-3950.
[32] BRENTJENS R J,RIVIERE I,PARK J H,et al. Safety and persistence of adoptively transferred autologous CD19-targeted T cells in patients with relapsed or chemotherapy refractory B-cell leukemias[J]. Blood,2011,118(18):4817-4828.
[33] BRENTJENS R,YEH R,BERNAL Y,et al. Treatment of chronic lymphocytic leukemia with genetically targeted autologous T cells:case report of an unforeseen adverse event in a phaseⅠclinical trial[J]. Mol Ther,2010,18(4):666-668.
[34] MORGAN R A,YANG J C,KITANO M,et al. Case report of a serious adverse event following the administration of T cells transduced with a chimeric antigen receptor recognizing ERBB2[J].Mol Ther,2010,18(4):843-851.
[35] LEE D W,GARDNER R,PORTER D L,et al. Current concepts in the diagnosis and management of cytokine release syndrome[J].Blood,2014,124(2):188-195.
[36] MEI H,JIANG H,WU Y,et al. Neurological toxicities and coagulation disorders in the cytokine release syndrome during CAR-T therapy[J]. Br J Haematol,2017. DOI:10.1111/bjh.14680.
[37] HU Y,SUN J,WU Z,et al. Predominant cerebral cytokine release syndrome in CD19-directed chimeric antigen receptor-modified T cell therapy[J]. J Hematol Oncol,2016,9(1):70.
[38] HAWKES N. Trial of novel leukaemia drug is stopped for second time after two more deaths[J]. British Medical Journal,2016,355:i6376.
[39] TANG X Y,SUN Y,ZHANG A,et al. Third-generation CD28/4-1BB chimeric antigen receptor T cells for chemotherapy relapsed or refractory acute lymphoblastic leukaemia:a non-randomised,open-label phaseⅠ trial protocol[J]. Bmj Open,2016,6(12):e013904.
The clinical research of chimeric antigen receptor T cell therapy for hematological malignancies
LI Jun1,2,CHEN Xiongbo1,2,DONG Jian1,2
1. Center for Tumor Disease Cell Therapy and Clinical Medical Research, Hubei Province, Wuhan 430022, China 2. Wuhan Sian Medical Technology Co., Ltd., Wuhan 430207, China
On July 12, 2017, the first chimeric antigen receptor T cell(CAR-T)therapy CTL-019 for relapsed or refractory child/adult acute lymphoblastic leukemia got approved by FDA expert advisory committee unanimously, marking a great breakthrough of the CAR-T therapy in clinical trials of blood tumor. CAR-T therapy has carried out a large number of clinical trials for blood tumors, and has accumulated a lot of clinical experience. This paper mainly analyzed the clinical trials of CAR-T in the treatment of hematological malignancies worldwide, summarized the adverse reactions, such as cytokine release syndrome(CRS), neurotoxicity, coagulation abnormalities, B cell dysplasia and coping measures, and discussed the development trend of the CAR-T treatment.
chimeric antigen receptor T cells; immunotherapy; hematological malignancies
10.3969/j.issn.1674-0319.2017.05.005
