胎儿右位主动脉弓相关异常、遗传物质异常及预后
2017-09-29彭软谢红宁周祎郑菊林美芳
彭软 谢红宁* 周祎 郑菊 林美芳
(1.中山大学附属第一医院 超声科,广东 广州 510080;2.中山大学附属第一医院 妇产科,广东 广州 510080)
胎儿右位主动脉弓相关异常、遗传物质异常及预后
彭软1谢红宁1*周祎2郑菊1林美芳1
(1.中山大学附属第一医院 超声科,广东 广州 510080;2.中山大学附属第一医院 妇产科,广东 广州 510080)
目的分析胎儿右位主动脉弓产前超声的相关异常、遗传物质改变及其预后。方法回顾性分析2013~2016年在本院产前超声诊断的右位主动脉弓并采用AffymetrixCytoScan HD行染色体微阵列分析(chromosomal microarray analysis, CMA)病例。结果研究期间产前超声共诊断右位主动脉弓病例92例,6例失访,26例未行染色体微阵列分析。最常合并的产前超声异常是法洛四联症。60例染色体核型已知病例中,1例46, X, Yqh+, der(13)t(8;13)(q22.3;q33.2),1例47, XYY,余58例染色体核型正常。本研究中,临床意义未明拷贝数变异和致病性拷贝数变异在胎儿右位主动脉弓的检出率分别是5.2%和5.2%。所有的致病性拷贝数变异均是22q11.2微缺失。右位主动脉弓合并异常组和单纯性右位主动脉弓组其合并染色体异常、分娩孕周和出生后存活率差异均无统计学意义。1例合并左锁骨下动脉迷走因出现呼吸系统症状需行手术治疗。结论胎儿右位主动脉弓合并22q11.2微缺失风险约是5%,产前超声检测发现右位主动脉弓,建议CMA检测排除染色体异常。
右位主动脉弓;22q11.2微缺失;染色体微阵列分析;拷贝数变异;超声
产前超声应用三血管-气管切面可检测右位主动脉弓(right aortic arch, RAA),其在低危胎儿中的检出率是1%[1]。右位主动脉弓是主动脉弓发育过程中第四对弓发育异常所致[2]。右位主动脉弓合并左位动脉导管、左锁骨下动脉迷走或双主动脉弓可形成血管环。Meta分析显示胎儿右位主动脉弓合并血管环出生后25.2%因呼吸系统症状需手术治疗[3]。此外,胎儿右位主动脉弓常合并遗传综合征,包括微缺失和微重复综合征。右位主动脉弓与心内异常、22q11.2微缺失综合征的关系已有研究报道[4-6]。染色体微阵列分析(chromosomal microarray analysis, CMA)可检测基因组内的拷贝数变异(copy number variations, CNVs)。研究报道染色体微阵列分析技术可检测与胎儿先心病相关的染色体异常[7-9],但是,关于胎儿右位主动脉弓的拷贝数变异尚未见文献报道。本研究旨在分析胎儿右位主动脉弓产前超声的相关异常、遗传物质改变及其预后。
1 对象与方法
1.1 研究对象 回顾性分析2013~2016年在本院产前超声诊断为右位主动脉弓病例。所有病例行详细胎儿结构筛查和超声心动图检查。仔细观察右位主动脉弓其头颈部血管分支,排除有无左锁骨下动脉迷走(aberrant left subclavian artery, ALSA)和双主动脉弓(double aortic arch, DAA)。合并双主动脉弓病例未纳入本研究。记录入组病例的产前超声结果、染色体微阵列分析结果和临床结局。产前超声诊断右位主动脉弓病例建议行染色体核型分析和染色体微阵列分析。所有病例签署知情同意书,并在获得染色体微阵列分析结果后对其进行遗传咨询。入组病例按照有无合并心内异常分为合并心内异常组和不合并心内异常组。
1.2 CMA检测方法和结果 解读染色体微阵列分析采用Affymetrix CytoScan HD基因芯片,其分辨率高达100 Kb。检测到的拷贝数变异参考公共数据库对比分析,包括DGV、DECIPHER数据库、OMIM、UCSC和CAG等数据库。拷贝数变异按其致病性分为3种类型:致病性、良性和临床意义未明。
1.3 临床结局 追踪存活婴幼儿由儿科专科医师进行随访。
1.4 统计学分析 统计分析采用SPSS22.0统计软件。连续性变量采用中位数(范围)表示,其组间比较Mann-Whitney U检验。分类资料采用百分率表示,其组间比较采用Mann-Whitney U检验或Fisher确切概率法。P<0.05认为差异有统计学意义。
2 结果
2.1 产前超声结果 研究期间产前超声检查诊断右位主动脉弓92例,其诊断孕周中位数24+2周。6例失访,余86例胎儿右位主动脉弓病例纳入本研究。39例未合并心内异常,47例合并心内异常。63例合并左位动脉导管,7例合并右位动脉导管,16例动脉导管显示不清。16例动脉导管显示不清病例均合并动脉锥干异常。6例合并左锁骨下动脉迷走(7.0%,6/86)。22例合并动脉锥干异常,其中2例合并左锁骨下动脉迷走。法洛四联症是最常见的合并异常(31.9%,15/47)。86例右位主动脉弓病例的产前超声合并心内异常情况详见表1和表2。
2.2 染色体核型和CMA结果 26例病例未行染色体核型和CMA检测。60例染色体核型已知病例中,1例46, X, Yqh+, der(13)t(8;13)(q22.3;q33.2)、1例47, XYY、余58例染色体核型正常。58例染色体核型正常胎儿中,7例(12.1%,7/58)检出拷贝数变异。1例良性拷贝数变异是14q11.2的562kb微缺失。3例(5.2%,3/58)检出致病性拷贝数变异,2例合并心内异常,1例不合并心内异常。此外,胎儿右位主动脉弓且染色体核型正常病例中,3例(5.2%,3/58)检出临床意义未明拷贝数变异。7例胎儿右位主动脉弓染色体核型正常但检出拷贝数变异病详见表3。病例15其染色体核型是46, X, Yqh+, der(13)t(8;13)(q22.3;q33.2),CMA可精确检测出该病例13q拷贝数的减少和8q拷贝数的增加。本组病例中胎儿右位主动脉弓合并染色体异常比例是8.3%(5/60),包括染色体核型异常和22q11.2微缺失。
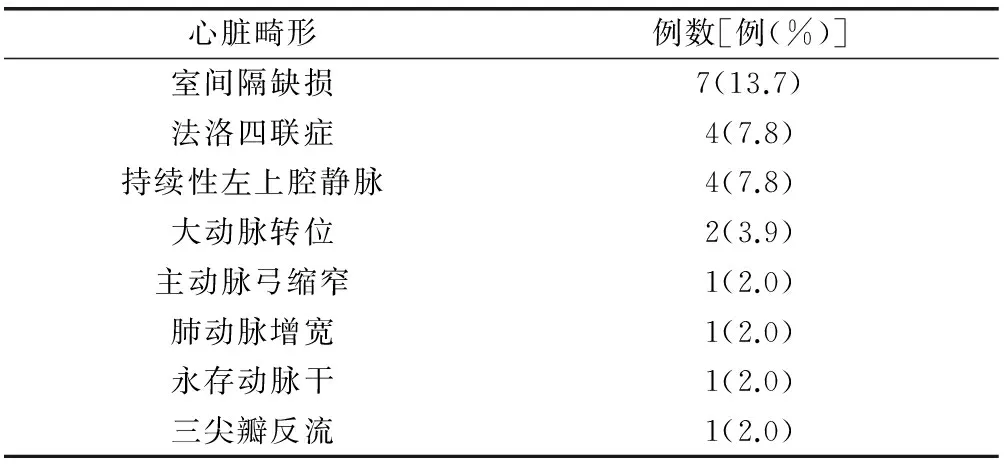
表1 胎儿右位主动脉弓合并一种类型心内异常(n=51)

表2 胎儿右位主动脉弓合并两种或两种以上类型心内异常(n=51)
病例11检测到5q23.2q23.3片段1.051Mb的微重复,该区域包含MEGF10基因。MEGF10突变可引起早发的肌肉病变、反射消失、呼吸窘迫和吞咽困难(EMARDD)。父母因担心该微重复的潜在风险选择终止妊娠。未能对该病例行进一步追踪,故我们认为5q23.2q23.3的微重复为临床意义未明。病例17合并复杂心脏畸形和右侧异构综合征,该检测出16p11.2片段微重复,该重复片段可能与其临床表型无关,但该病例因严重的超声异常表现选择终止妊娠。染色体微阵列分析在病例35检测出4q34.1片段619Kb微重复,该病例合并心脏扩大和三尖瓣反流。已发表文章未见关于该片段微重复的病例报道,目前该病例临床表型正常,分析后我们认为该重复片段临床意义未明。
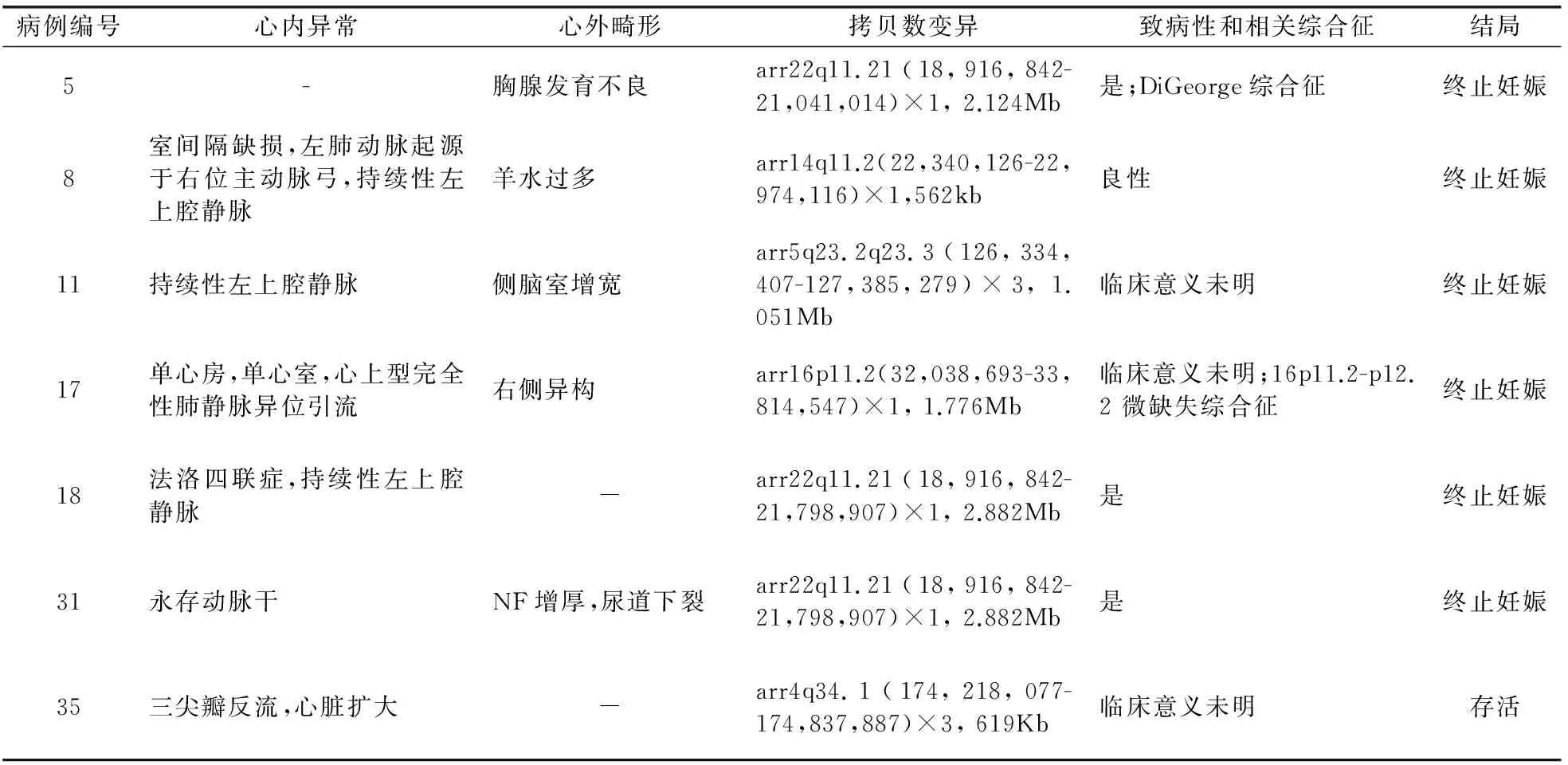
表3 7例胎儿右位主动脉弓染色体核型正常但检出拷贝数变异病例其特征及临床结局
2.3 合并异常与染色体结果分析 所有右位主动脉弓病例存活率是58.1%(50/86)。排除终止妊娠、选择性减胎和自然流产病例,总体存活率是90.9%(50/55)。右位主动脉弓合并心内异常组和未合并心内异常组其产前诊断右位主动脉弓的超声孕周及分娩孕周差异无统计学意义。染色体异常,包括染色体核型异常和致病性拷贝数变异在两组分别是8.0%和8.6%,P=1.000。两组间比较的详细结果见表4。86例胎儿右位主动脉弓病例中,40.6%(35/86)伴有心外异常。合并心外异常组和未合并心外异常组其染色体异常比例差异无统计学意义(16.0%,4/25和2.9%,1/35;P=0.150)。染色体异常在右位主动脉弓合并左位动脉导管(7.0%,3/43)、右位动脉导管(0,0/3)和动脉导管显示不清(14.3%,2/14)间差异无统计学意义(P=0.599)。本研究入组病例中,7.0%(6/86)合并左锁骨下动脉迷走,其中4例未合并心内异常,2例合并心内异常。合并心内异常组和未合并心内异常组两组左锁骨下动脉迷走检出率差异无统计学意义(P=0.404),而合并左锁骨下动脉迷走和未合并左锁骨下动脉迷走其染色体异常发生比例差异无统计学意义(P=1.000)。
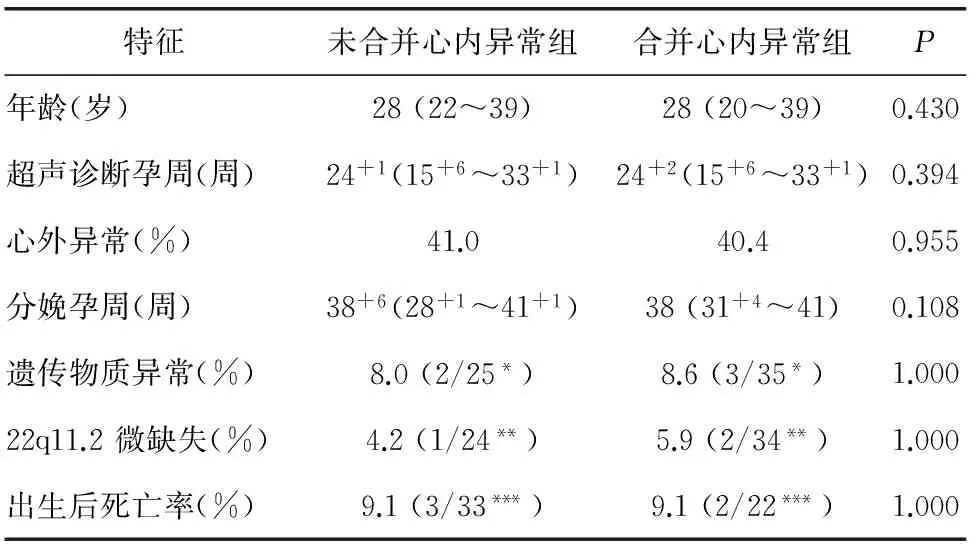
表4 右位主动脉弓合并心内异常组和未合并心内异常组产前超声特征、染色体异常和临床结局比较
注:*行染色体核型和微阵列分析病例数;**染色体核型正常且行染色体微阵列分析病例数;***排除终止妊娠、自然流产和选择性减胎病例。
2.4 出生后临床表现 所有出生病例出生后均随访,随访时间中位数22个月(3~42个月)。目前为止,排除合并心内畸形病例,1例右位主动脉弓因合并左锁骨下动脉迷走出现呼吸系统症状行手术治疗。此外,1例单纯性右位主动脉弓病例38+4周行子宫下段剖宫产分娩,新生儿Apgar评分正常,染色体微阵列分析未检出微缺失和微重复。但该病例现2岁多,语言、认知和表达能力发育迟缓,诊断为自闭症。
3 讨论
据我们所知,目前尚未见关于胎儿右位主动脉弓与拷贝数变异的研究报道。与文献报道相似,本研究中右位主动脉弓合并左位动脉导管是最常见类型(73.2%),若排除合并心内异常病例,则左位动脉导管检出率约是95%[10,11]。胎儿右位主动脉弓合并左位动脉导管,两者位置关系产前超声三血管-气管表现为“U”型。但右位主动脉弓合并右位动脉导管其超声表现较隐匿。三血管-气管切面需仔细观察主动脉弓与气管、降主动脉和脊柱的相互位置关系。法洛四联症是最常见合并异常,与文献报道相符。特别的是,本研究中右位主动脉弓合并法洛四联症,近45%其动脉导管显示不清,Craatz等[12]对出生后病例报道过此现象。胚胎发育早期,神经脊细胞向心脏迁移形成流出道,同时形成第四、五、六对咽弓,此机制可解释为何右位主动脉弓常伴发法洛四联症。
本研究中,胎儿右位主动脉弓染色体核型正常病例中,检测到的致病性拷贝数变异均为22q11.2微缺失综合征。文献报道出生后右位主动脉弓病例其合并22q11.2微缺失比例是9%~12%[13,14],产前单纯性右位动脉弓病例合并22q11.2微缺失风险5.1%(95% CI, 2.4%~8.6%)[3]。本研究中22q11.2微缺失综合征在单纯性右位主动脉弓和所有右位主动弓病例中其检出率和文献报道相似。Miranda等[4]报道右位主动脉弓合并心内异常病例染色体异常风险较未合并心内异常风险高(19.4%和3.7%),但是本研究中合并心内异常并未增加其染色体异常发生风险。之前研究采用FISH或aCGH检测22q11.2微缺失,本研究中行染色体基因芯片微阵列分析,故尚检测到其他类型CNVs如16p11.2微缺失等。
本研究中40%胎儿右位主动脉弓合并心外异常,合并心外异常虽可增加染色体异常风险,但其差异不具有统计学意义。Miranda等[4]的研究中,31.6%胎儿右位主动脉弓合并心外异常,且50%染色体异常。故是否合并心外异常可明显影响右位主动脉弓预后,但是仍需注意,部分心外异常如肛门闭锁等产前超声难以作出诊断。即使如此,若产前超声诊断右位主动脉弓,则需对心外结构包括胸腺等仔细扫查。
综上所述,法洛四联症是胎儿右位主动脉弓最常见合并的心内异常类型。我们研究数据显示5%胎儿右位主动脉弓合并22q11.2微缺失综合征,因此,若产前超声检测到右位主动脉弓,则建议行CMA检测排除染色体异常。是否合并心内异常和心外异常可影响胎儿右位主动脉弓病例预后。
[1] Achiron R, Rotstein Z, Heggesh J, et al.Anomalies of the fetal aortic arch:a novel sonographic approach to in-utero diagnosis[J].Ultrasound Obstet Gynecol,2002,20:553-557.
[2] Kau T, Sinzig M, Gasser J, et al.Aortic development and anomalies[J].Semin Intervent Radiol,2007,24:141-152.
[3] D’antonio F, Khalil A, Zidere V, et al.Fetuses with right aortic arch:a multicenter cohort study and meta-analysis[J].Ultrasound Obstet Gynecol,2016,47:423-432.
[4] Miranda JO, Callaghan N, Miller O, et al.Right aortic arch diagnosed antenatally:associations and outcome in 98 fetuses[J].Heart,2014,100:54-59.
[5] Berg C, Bender F, Soukup M, et al.Right aortic arch detected in fetal life[J].Ultrasound Obstet Gynecol,2006,28:882-889.
[6] Zidere V, Tsapakis EG, Huggon IC, et al.Right aortic arch in the fetus[J].Ultrasound Obstet Gynecol,2006,28:876-881.
[7] Schmid M, Stary S, Blaicher W, et al.Prenatal genetic diagnosis using microarray analysis in fetuses with congenital heart defects[J].Prenat Diagn,2012,32:376-382.
[8] Yan Y, Wu Q, Zhang L, et al.Detection of submicroscopic chromosomal aberrations by array-based comparative genomic hybridization in fetuses with congenital heart disease[J].Ultrasound Obstet Gynecol,2014,43:404-412.
[9] Liao C, Li R, Fu F, et al.Prenatal diagnosis of congenital heart defect by genome-wide high-resolution SNP array[J].Prenat Diagn,2014,34:858-863.
[10] Perolo A, De Robertis V, Cataneo I, et al.Risk of 22q11.2 deletion in fetuses with right aortic arch and without intracardiacanomalies[J].Ultrasound Obstet Gynecol,2016, 48:200-203.
[11] Mogra R, Kesby G, Sholler G, et al.Identification and management of fetal isolated right-sided aortic arch in an unselected population[J].Ultrasound Obstet Gynecol, 2016, 48(6):739-743.
[12] Craatz S, Künzel E, Spanel-Borowski K.Right-sided aortic arch and tetralogy of Fallot in humans-a morphological study of 10 cases[J].Cardiovascular Pathology,2003, 12:226-232.
[13] Lindsay EA, Goldberg R, Jurecic V, et al.Velo-cardio-facial syndrome:frequency and extent of 22q11 deletions[J].Am J Med Genet,1995,57:514-522.
[14] Lindsay EA, Greenberg F, Shaffer LG, et al.Submicroscopic deletions at 22q11.2:variability of the clinical picture and delineation of a commonly deleted region[J].Am J Med Genet,1995,56:191-197.
ObjectiveTo assess the associated prenatal findings, genetic anomalies by using chromosomal microarray analysis (CMA) and clinical outcomes of fetal right aortic arch (RAA).MethodThis retrospective study reviewed 92 cases diagnosed with RAA and the findings of CMA using AffymetrixCytoScan HD array in our institution between 2013 and 2016.ResultsSix cases were lost to follow up and genetic data could not be obtained in 26 cases.Tetralogy of the Fallot was the most common associated anomaly.Among the 60 fetuses with known karyotype, one was 46, X, Yqh+, der(13)t(8;13)(q22.3;q33.2), one was 47, XYY and the remaining were normal.Our study showed that CMA could detect uncertain significant copy number variants (CNVs) in 5.2% of fetal RAA and pathogenic CNVs in 5.2%, all of which were microdeletion in chromosome 22q11.21.The incidence of genetic anomalies, gestational age at diagnosis, gestational age at delivery and postnatal death rate were not significantly different between RAA-no intracardiac anomalies (ICA) and RAA-ICA group.One infant with aberrant left subclavian artery was performed a surgery for respiratory symptom.ConclusionsPrenatal right aortic arch is associated with 22q11.2 deletion syndrome in approximately 5% and, therefore, prenatal testing, preferably using CMA, should be offered in these cases.
right aortic arch; 22q11.2 deletion; chromosomal microarray analysis; copy number variations; ultrasound
R714.53
A
2017-04-30)
编辑:刘邓浩
10.13470/j.cnki.cjpd.2017.02.003
*通讯作者:谢红宁,E-mail:hongning_x@126.com
