P-15肽促进间充质干细胞向软骨细胞分化的分子机制及体内成骨作用研究
2017-09-27杨利丽刘钦毅孟宪荣王瑞强田海清
张 郡,杨利丽,刘钦毅,孟宪荣,刘 睿,王瑞强,田海清,万 腾
(吉林大学第二医院,吉林 长春130041)
P-15肽促进间充质干细胞向软骨细胞分化的分子机制及体内成骨作用研究
张 郡,杨利丽,刘钦毅,孟宪荣*,刘 睿,王瑞强,田海清,万 腾
(吉林大学第二医院,吉林 长春130041)
目的通过细胞实验研究发现P-15肽能有效激活、促进间充质干细胞增殖和向软骨细胞分化,但是否在体内仍有类似作用尚不明确。因此,本研究旨在探讨P-15肽可能如何激活、促进干细胞向软骨细胞增殖分化,同时在体内功能状态。方法培养鼠间充质干细胞在含有和不含有P-15肽的培养基中,培养6小时后,两组细胞均用α5整合素抗体和pFAK抗体染色,进行免疫荧光染色,同时进行蛋白免疫印迹分析;在维斯塔小白鼠腹部皮下注射250 μl含有P-15+rhBMP-2或单纯rhBMP-2的基质胶建立小鼠皮下异位骨化模型,术后12天处死小鼠,分离取下腹部基质胶行Micro CT及组织学检查。结果①与对照组相比,P-15肽培养组pFAK和α5整联蛋白的表达较对照组均有显著性增高(P<0.05);②Micro CT扫描、组织切片染色及免疫组织化学均提示P-15肽组基质胶周边软骨沉积,发现肥大软骨细胞沉积在外围区域。结论①P-15肽可能通过激活pFAK通路并上调α5整联蛋白的表达促进MSCs向软骨细胞分化;②P-15肽能促进局部组织软骨沉积,进而出现组织骨化。
P-15肽;软骨细胞;软骨内骨化;分化;α5整合蛋白/pFAK信号通路
(ChinJLabDiagn,2017,21:1429)
脊柱融合手术是当前治疗胸腰椎骨折最广泛接受的手术方式[1]。在骨折愈合过程中,骨细胞形成是骨折愈合的关键因素,促进骨细胞形成能提高骨折愈合率、缩短愈合进程[2-4]。在骨细胞形成过程中,细胞外基质有重要作用,因此影响成骨率的一个关键因素是相互作用间质细胞的表面细胞外基质[5,6]。研究显示P-15肽能促进纤维母细胞和骨母细胞增殖、粘附以及细胞外基质的分泌[7,8],也能促进骨组织的形成[8,9]。体外实验证实了P-15肽能有效激活、促进间充质干细胞增殖和向软骨细胞分化。本研究旨在研究P-15肽促进间充质干细胞向软骨细胞分化的分子机制及体内成骨作用。
1 材料和方法
1.1 细胞培养及免疫荧光染色
实验选用鼠间充质干细胞(mesenchymal stem cells,MSCs)在DMEM培养基(Dulbecco`s Modified Eagle`s Medium)中,37℃,5%CO2的孵箱内培养。将第6代细胞分为两组:P-15肽组和空白对照组分别接种于均匀铺有P-15肽的培养皿和空白培养皿中。培养6小时后,两组细胞均用α5整合素抗体和pFAK抗体进行免疫荧光染色。
1.2 大鼠皮下异位骨化模型建立
所有关于大鼠手术操作过程均提交托马斯杰弗森大学伦理委员会审议并通过。实验动物为8-12周雄性维斯塔小白鼠,由查尔斯实验室提供。小鼠在饲养室预适应2天后被分为两组:P-15肽组和rhBMP-2组,P-15肽组注射含有P-15+ rhBMP-2的BD基质胶;rhBMP-2组注射含有rhBMP-2的BD基质胶。
将小鼠用异氟醚麻醉后,腹部区域备皮,术区消毒,将250 μl混合后基质注射进小鼠腹部形成皮丘,左侧为P-15肽组,右侧为rhBMP-2组。术后观察小鼠生活状态,有无并发症。于术后12天用CO2处死小鼠,将腹部皮丘组织分离取下,进行下一步分析研究。
1.3 Micro CT分析
组织标本使用4%多聚甲醛固定,按照既往文献说明方法放入Micro CT中扫描[10]。根据图像数据进行具体骨量分析。
1.4 组织学分析
动物组织标本切片,进行苏木精-伊红染色。使用鼠抗人基质金属蛋白酶-13(MMP-13),血管内皮生长因子(VEGF),抗酒石酸酸性磷酸酶(TRAP)单抗来进行免疫组织化学染色。染色切片进行定量数字拍摄。
1.5 统计方法
2 结果
2.1 P-15肽可以激活p FAK,促进α5表达
与对照组相对比:培养基含有P-15肽的MSCs绿色荧光的为α5,红色荧光的为pFAK,二者共同表达的区域为黄色荧光(如图1所示),表明P-15肽与α5整合蛋白表达存在相关性,α5与pFAK的表达也有明显相关性,同时随着细胞数的增加而荧光强度增加。

图1 细胞免疫荧光
2.2 Micro CT检查
组织固定后行扫描骨定量分析,P-15肽组骨化和软骨沉积更明显。
2.3 组织切片染色
组织切片行苏木精-伊红染色,如图2所示P-15肽组整个基质胶周围细胞染色较明显,皮丘周围软骨组织沉积已经完成,肥大软骨细胞沉积于皮丘周围边缘。

图2 苏木精-伊红染色
2.4免疫组织化学染色
免疫组化荧光反应如图3所示:P-15肽复合物周边抗酒石酸酸性磷酸酶染色更明显,发现更多肥大软骨细胞。同时P-15肽组与对照组相比在MMP-13和VEGF水平上也有显著性增加。
3 讨论
脊柱骨折后的骨形成过程是一个骨细胞和细胞外基质形成的三维组合的复杂过程,包括以下两种机制:膜内成骨和软骨内成骨。软骨内成骨由骨折端周围的间充质形成与成骨类似的软骨雏形,继而出现原发性骨化位点,由此向两端延伸进而出现骨髓腔。软骨内成骨过程中细胞外基质的早期沉积对组织修复非常关键,有大量细胞因子参与,需要通过上调特定基因编码的蛋白质表达进行基质重构。软骨细胞分化成为肥大型软骨细胞可以促进这样的过程,而软骨细胞的分化受到细胞外基质信号的调控。
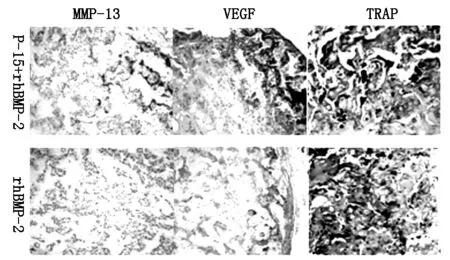
图3 免疫组织化学染色
既往实验证明P-15肽通过α2β1整合素对骨分化和骨形成发挥作用,通过激活细胞基质中的整合素,诱导骨细胞和成骨细胞发生粘附,迁移,增殖和分化[8,11]。然而研究发现,在软骨细胞形成和分化过程中,P-15肽并不直接与α2β1整合素蛋白结合,但却可以通过上调该信号通路达到促进软骨内骨形成[12]。
有研究证实α5β1整联蛋白介导的细胞外细胞基质信号参与软骨骨化[13,14]。本研究提示α5整联蛋白可能在P-15肽作用于MSC细胞软骨化进程中有举足轻重的作用。蛋白免疫印迹实验结果也提示P-15肽的作用下α5整联蛋白的表达水平升高。FAK在细胞外基质整合素信号转导中起重要作用,并调节Ⅱ型胶原表达和细胞增殖。Park等认为FAK可以调节软骨细胞中的软骨糖胺多糖分泌[15]。本研究中pFAK蛋白的表达水平也有明显升高,与α5整联蛋白呈明显相关性。因此,P-15可能通过上调α5整联蛋白的表达并激活pFAK通路促进MSC细胞向软骨细胞分化。
体内实验中实验组皮丘周边MSCs大量聚集,出现组织软骨化和骨沉积。软骨内成骨的特点为软骨细胞肥大,软骨基质钙化,骨原细胞和血管长入肥大性软骨细胞陷窝,骨组织在钙化软骨组织中心形成[16]。与对照组相比较,实验组周边肥大软骨细胞聚集,从组织学角度证明了整个过程受软骨内成骨机制的调控。
[1]RA Deyo,DT Gray,W Kreuter,et al.United States trends in lumbar fusion surgery for degenerative conditions[J].Spine,2005,30(12):1441.
[2]RK Siu,SS Lu,W Li,et al.Nell-1 protein promotes bone formation in a sheep spinal fusion model[J].Tissue Eng,Part A,2011,17 (7-8):1123.
[3]Reid JJ,Johnson JS,Wang JC.Challenges to bone formation in spinal fusion[J].J Biomech,2011,44(2):213.
[4]J Nerubay,B Marganit,JJ Bubis,et al.Stimulation of bone formation by electrical current on spinal fusion[J].Spine,1986,11(2):167.
[5]Ching-Fang Chang,Ming-Wei Lee,PY Kuo,et al.Three-dimensional collagen fiber remodeling by mesenchymal stem cells requires the integrin-matrix interaction[J].J Biomed Mater ResA,2007,80(2):466.
[6]RT Franceschi,C Ge,G Xiao,etal.Transcriptional regulation of osteoblasts[J].Cells Tissues Organs,2009,189(1-4):144.
[7]JY Lee,YS Choi,SJ Lee,et al.Bioactive peptide-modified biomaterials for bone regeneration[J].Curr Pharm Des,2011,17(25):2663.
[8]Qinyi Liu,Worawat Limthongkul,G Sidhu,et al.Covalent attachment of P15 peptide to titanium surfaces enhances cell attachment,spreading,and osteogenic gene expression [J].J Orthop Res,2012,30(10):1623.
[9]M Thorwarth,S Schultzemosgau,F Wehrhan,et al.Bioactivation of an anorganic bone matrix by P-15 peptide for the promotion of early bone formation[J].Biomaterials,2005,26(28):5648.
[10]Eaton GJ,Zhang QS,Diallo C,et al.Freeman TA Inhibition of apoptosis signal-regulatingkinase 1 enhances endochondral bone formation by increasingchondrocyte survival[J].Cell Death Dis,2014,5:e1522.
[11]Bhatnagar RS,Qian JJ,Gough CA.The role in cell binding of a beta-bendwithin the triple helical region in collagen alpha 1 (I) chain:structural and biological evidence for conformational tautomeric on fiber surface[J].J Biomol Struct Dyn,1997,(14):547.
[12]Zhang J,Eisenhauer P,Kaya O,et al.P15 peptide stimulates chondrogenic commitment and endochondral ossification[J].Int Orthop,2017,10.1007.
[13]Inoue T,Hashimoto R,Matsumoto A,et al.In vivo analysis of Arg-Gly-Asp sequence/integrin α5β1-mediated signal involvement in embryonic enchondral ossification by exo utero development system[J].J Bone Miner Res,2014,29(7):1554.
[14]Loeser R F.Integrins and chondrocyte-matrix interactions in articular cartilage[J].Matrix Biol,2014,39:11.
[15]Park MS,Kim YH,Lee JW.FAK mediates signal crosstalk between type II collagen and TGF-beta 1 cascades in chondrocytic cells[J].Matrix Biol,2010,29(2):135.
[16]M Okumura,A Ishikawa,T Aoyama,et al.Cartilage formation in the pelvic skeleton during the embryonic and early-fetal period[J].PLoS One,2017,12(4):e0173852.
MolecularmechanismofP-15peptidepromotingthedifferentiationofmesenchymalstemcellsintochondrocytesanditsfunctionofosteogenesisinvivo
ZHANGJun,YANGLi-li,LIUQin-yi,etal.
(TheSecondHospitalofJilinUniversity,Changchun130041,China)
ObjectiveP15 peptide enhances chondrocyte differentiation and formation in vitro.However,the mechanism is unclear,and whether this is effective in vivo is not clear.In this study,we assessed the mechanism of chondrogenic differentiation in vitro.Further investigationto determine whether P15 could independently direct chondrogenesis or mineralization in vivo.MethodsTo determine if P15 enhances chondrogenic differentiation through integrin α5/pFAK signaling,we stained MSCs that had been maintained on either uncoated or P15-coated dishes using antibodies specific for α5 integrin or pFAK.Six hours after plating,the expression of integrin was determined by Western blot and fluorescent immunohistochemistry.Male Wistar mices
two injections ofMatrigel with bone morphogenetic protein2(BMP2) in the right abdominal region and two injections of Matrigel with P15 in the left abdominal region,respectively.12 days after injections,thetransplanted masses were excised and analyzed by micro CT and histology.ResultsCompare to the control group,cells grown in vitroon surfaces coated with the P15 peptide have increased α5integrin expression and show activation of FAK(P<0.05).When P15 was combined with BMP2,it was observed that an increased number of MSCs transformed into chondrocytes at D12.ConclusionP15 may interact indirectly with integrin α5/pFAK signaling to enhance chondrocyte differentiation.P15 has the ability to increase bone formation through endochondral formation.
P-15peptide;chondrocyte;Cartilage ossification;differentiation;integrin α5/pFAK signaling
*通讯作者
1007-4287(2017)09-1429-03
Q813
:A
2016-11-16)
