抗hCD20单抗所致B细胞减少可以提高CD20特异cTCR+T细胞存活
2017-09-27任振波侯毅锐
任振波,侯毅锐,郑 伟
(1.长春市解放军第208医院,吉林 长春130062;2.长春市中心医院 检验科)
抗hCD20单抗所致B细胞减少可以提高CD20特异cTCR+T细胞存活
任振波1,侯毅锐2*,郑 伟1
(1.长春市解放军第208医院,吉林 长春130062;2.长春市中心医院 检验科)
B细胞淋巴瘤/白血病是一种常见的血液系统恶性肿瘤,化疗及造血干细胞移植的治疗方法存在许多问题。尤其是难治与复发B细胞淋巴瘤/白血病往往治疗的成功率很低。数年前开展的嵌合抗原受体T细胞(CAR-T)过继免疫治疗B细胞淋巴瘤/白血病技术,成功例数不断增加,但有很多方面仍有待完善。本研究意在观察输注CAR-T细胞前给予抗CD20抗体进行预处理B淋巴细胞是否减少及对CAR-T细胞活性是否有影响。
1 材料与方法
1.1 动物、细胞系
Thy1.2+野生型(WT)鼠、Thy1.1+和Thy1.2+Bbalb/c鼠及CL4细胞TCR转基因鼠购自美国The Jackson Laboratory。hCD20特异cTCR+T细胞通过BD Bioscience FACS(fluorescence activitied cell sorter)获得。
1.2 试剂和仪器
CD20-CAR-T细胞购自ATCC(American type culture collection)。流式细胞仪为BD Bioscience的FACS(荧光激活细胞分离仪);抗mCD20和抗hCD20单抗、ELISA试剂盒均为美国eBioscience公司产品。
1.3 鼠骨髓和脾细胞的制备
用二氧化碳窒息鼠后摘取淋巴结和脾脏,用40 μm滤网过滤生成单细胞悬液;骨髓用RPMI1640冲洗鼠股骨骨髓腔取得。
1.4 体外T细胞分析
用流式细胞仪测定T细胞的数量。
1.5 生物发光成像
将荧光素钾注射鼠腹膜内,然后用X线摄像,用软件分析发光资料,单位为光子/s/cm2/sr。
1.6 统计学处理
统计学分析软件应用SPSS 16.0,用t检验比较两样本均数,P<0.05为差异有显著性。
1.7 实验方法
(1)将抗hCD20单抗200 μg通过鼠尾静脉注射Thy1.1+和Thy1.2+Bbalb/c鼠及CL4细胞TCR转基因鼠后获得B细胞减少的白血病鼠,取鼠血、淋巴结、骨髓和脾细胞用低渗液体溶解后用流式细胞仪分析B细胞。用Thy1.2+野生型(WT)鼠做对照。
(2)4天后将2×107荧光素酶+MB20-18+Thy1.1+CD8+T细胞和荧光素酶+MB20-18:CD3ζΔ+T细胞注入B细胞减少的鼠中,将荧光素酶+MB20-18+T细胞注入未经抗体处理的(B细胞未减少的)鼠中,检测cTCR+T细胞的发光信号数据。
2 结果
2.1 用流式细胞仪分析抗hCD20单抗处理hCD20鼠血液、淋巴结、脾及骨髓B细胞。24 h后淋巴结及骨髓成熟B细胞减少90%,脾脏B细胞减少80%,血B细胞减少89%,7天后淋巴结、骨髓及脾脏成熟B细胞减少超过90%。
2.2 MB20-18+T细胞在B细胞减少的白血病鼠中生物发光信号明显增加(2倍,P>0.05),骨髓中的峰值为3天(8倍增加;P<0.01),颈部淋巴结6倍增加(P<0.01)图1。T细胞注射后5天MB20-18+Thy1.1+CD8+T细胞的活性在B细胞减少的鼠骨髓、淋巴结和脾脏中比B细胞未减少的鼠中增强。
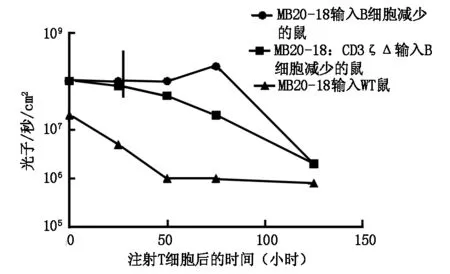
图1 注射T细胞后时间与生物发光信号的关系
3 讨论
已证实在过继T细胞转入之前淋巴细胞减少及造血干细胞移植可以提高抗原特异性T细胞群的存活和功能[1,2-4]。然而,会出现与全淋巴细胞减少及自体干细胞移植有关的明显的毒性反应[5-8],单纯B细胞减少很少产生毒副作用[9],却促进了可能导致抗白血病反应的特异性抗原的增殖。在有微小残留病灶(MRD)的情况下,将B细胞肿瘤相关抗原特异T细胞注入B细胞减少的病人体内可能足以清除抗CD20单抗抵抗的疾病而不需要全淋巴细胞减少。
以前有报道用抗hCD20单抗处理hCD20鼠证明其血液、淋巴结脾及骨髓B细胞减少[10-12]。
为了提高CAR-T细胞疗效及减少其副作用,各研究中心进行了大量的实验,效果不一。我们设计了在输注CAR-T细胞前给予抗CD20抗体进行预处理以减少B淋巴细胞,结果MB20-18+T细胞在B细胞减少的鼠中生物发光信号明显增加。
为确定单克隆抗体介导的B细胞减少对mCD20特异cTCR+T细胞存活及功能的作用,给用CD20单抗处理的WT或hCD20鼠注射2×107MB20-18+荧光素酶+T细胞,给WT鼠注射无关Leu16+T细胞作为对照。hCD20鼠血中hCD20+mCD20+B细胞的减少可以使MB20-18+细胞从肺中排出,此与用无关的Leu16+细胞所观察到的相一致[14]。
MB20-18+T细胞在B细胞减少的鼠中生物发光信号增加,其扩增依靠cTCR,因为MB20-18:CD3ζΔ+T细胞在B细胞减少的鼠中未见扩增。T细胞注射后5天Thy1.1+MB20-18+T细胞的活性在B细胞减少的鼠骨髓、淋巴结和脾脏中比B细胞未减少的鼠中增强。
MB20-18+T细胞与MB20-18:CD3ζΔ+T细胞相比在脾和B细胞减少的鼠中显示CD62L表达减少,但并没有消失,可能反映了在与少量留存的B细胞反应当中cTCR引发的有限性[13,14]。在B细胞不缺乏的鼠中,MB20-18+T细胞不能在淋巴结中聚集可能反映了在与多B细胞反应时的多cTCR触发事件,导致存活降低,CD62L表达减少,移动改变。这些结果表明在过继输入之前的B细胞减少可以促进CD20特异cTCR+T细胞存活并且提高这些细胞移动进入白血病和淋巴瘤聚集的淋巴结和骨髓。
为确定B细胞减少是否能增加MB20-18+T细胞的抗B细胞活性,在注射T细胞5天后计数鼠脾细胞中的残存的B细胞。用抗hCD20单抗预处理的鼠,MB20-18+T细胞使85%的脾残存B细胞减少(P<0.001),与未减少的鼠相比导致95.8%的脾B细胞减少(P<0.001)。既往曾报道边缘区B细胞对抗hCD20抗体介导的B细胞减少相对抵抗[10,12],滤泡区和边缘区B细胞比例在未减少的鼠中从10.5降至抗体致减少鼠的2.5。对比之下,MB20-18+T细胞能有效减少抗体抵抗边缘区残存B细胞,与MB20-18:CD3ζΔ+T/抗hCD20抗体处理的鼠相比边缘区B细胞减少200倍。这些结果表明由抗体介导正常B细胞的减少揭示了CD20特异T细胞的抗B细胞活性,CD20特异T细胞可以使抗体抵抗的细胞清除。
注入的T细胞能否在肿瘤患者体内持续存在为肿瘤过继免疫治疗成败的关键。临床实验证明过继输入的cTCR+T细胞仅能在有大量能产生抗原的患者体内短暂存在[15,16]。有临床研究结果显示表达CD20的正常B细胞能降低CD20特异cTCR+T细胞的寿命和功能,抗体介导的B细胞减少可能提高CD20特异T细胞治疗效果[17]。
我们的研究表明,在实验鼠体内抗CD20单抗诱发的B细胞减少明显提高了CAR-T细胞在白血病体内的活性,可以预测其抗白血病效果亦会有所提高。下一步可以在人体内进行类似实验,以检验在进行CAR-T细胞治疗B细胞淋巴瘤/白血病时用此预处理方法对治疗效果的影响。
[1]Rosenberg SA,Dudley ME.Adoptive cell therapy for the Treatment of patients with metastatic melanoma[J].Curr Opin Immunol,2009,21(2):233.
[2]Gattinoni L,Finkelstein SE,Klebanoff CA,et al.Removal of homeostatic cytokine sinks by lymphodepletion enhances the efficacy of adoptively transferred tumors-specific CD8+T cells[J].J Exp Med,2005,202(7):907.
[3]Wrzesinski C,Paulos CM,Gattinoni L,et al.Hematopoietic stem cells promote the expansion and function of adoptively transferred antitumor CD8 T cells[J].J Clin invest,2007,117(2):492.
[4]Dudley ME,Yang JC,Sherry R,et al.Adoptive cell therapy for patients with metastatic melanoma:evaluation of intensive myeloablative chemoradiation preparative regimens[J].J Clin Oncol,2008,26(32):5233.
[5]Thomas O,Mahe M,Campion L,et al.Long-term complications of total body irradiation in adults[J].Int J Radiat Oncol Biol Phys,2001,49(1):125.
[6]Hake CR,Graubert TA,Fenske TS.Does autologous transplantation directly increase the risk of secondary leukemia in lymphoma patients?[J].Bone Marrow Transplant,2007,39(2):59.
[7]Montoto S,Canals C,Rohatiner AZ,et al.Long-term follow-up of high-dose treatment with autologous haematopoietic progenitor in 693 patients with follicular lymphoma:an EBMT registry study[J].Leukemia,2007,21(11):2324.
[8]Brown JR,Feng Y,Gribben JG,et al.Long-term survival after autologous bone marrow transplantation for follicular lymphoma in first remission[J].Biol Blood Marrow Transplant,2007,13(9):1057.
[9]Fleischmann RM.Safety of biologic therapy in rheumatoid arthritis and other autoimmune diseaseas:focus on rituximab[J].Semin Arthritis Rheum,2009,38(4):265.
[10]Ahuja A,Shupe J,Dunn R,et al.Depletion of B cells in murine lupus:efficacy and resistance[J].J Immunol,2007,197(5):3351.
[11]Beers SA,Chan CH,James S,et al.Type ll(tositumomab) anti-CD20 monoclonal antibody out performs type l (rituximab-like) reagents in B-cell depletion regardless of complement activation[J].Blood,2008,112(10):4170.
[12]Gong Q,Ou Q,Ye S,et al.Importance of cellular microenvironment and circulatory dynamics in B cell immunotherapy[J].J Immunol,2005,174(2):817.
[13]Jung TM,Gallatin WM,Weissman IL,et al.Down-regulations of homing receptors after T cell activation[J].J Immunol,1998,141(12):4110.
[14]Gattinoni L,Klebanoff CA,Palmer DC,et al.Acquisition of full effector function in vitro paradoxically impairs the in vivo antitumor efficacy of adoptively transferred CD8+T cells[J].J Clin Invest,2005,115(6):1616.
[15]Till BG,Jensen MC,Wang J,et al.Adoptive immunotherapy for indolent non-Hodgkin lymphoma and mantle cell lymphoma using genetically modified autologous CD20-specific T cells[J].Blood,2008,112(6):2261.
[16]Park JR,Digiusto DL,Slovak M,et al.Adoptive transfer of chimeric antigen receptor re-directed cytolytic T lymphocyte clones in patients with neuroblastoma[J].Mol Ther,2007,15(4):825.
[17]任振波,侯毅锐,郑 伟,等.表达CD20的正常B细胞对CD20特异cTCR+T细胞抗白血病活性的影响[J].中国实验诊断学杂志,2017,21(2):326.
吉林省科技厅项目资助(20160101165JC)
*通讯作者
1007-4287(2017)09-1426-03
2016-12-29)
