桔梗皂苷D对肝癌干细胞活力和细胞凋亡的干预作用及其机制研究
2017-09-25宣丽杨
宣丽杨
桔梗皂苷D对肝癌干细胞活力和细胞凋亡的干预作用及其机制研究
宣丽杨
目的探讨桔梗皂苷D对肝癌干细胞活力和细胞凋亡的干预作用及其机制。方法MTT法和Annexin V染色流式细胞术检测桔梗皂苷D和5-氟尿嘧啶对HepG2肝癌干细胞细胞活力和细胞凋亡的影响;采用Western blot检测HepG2肿瘤干细胞HAX1表达;运用JC-1染色流式细胞术、Annexin V染色流式细胞术及Western blot方法研究桔梗皂苷D联合5-氟尿嘧啶对肝癌干细胞凋亡通路的影响。结果5μmol/L 5-氟尿嘧啶处理下HepG2肿瘤干细胞活力抑制率为(29.1± 2.4)%,显著低于常规HepG2细胞活力抑制率(72.7±5.2)%(P<0.05)。5-氟尿嘧啶联合桔梗皂苷D对HepG2肿瘤干细胞的细胞活力抑制率为(66.7±3.4)%,凋亡诱导率为(33.9±2.1)%,显著高于5-氟尿嘧啶单独处理的细胞活力抑制率[(28.7±1.8)%,P<0.05]和凋亡诱导率[(8.9±0.6)%,P<0.05]。桔梗皂苷D处理后HepG2肿瘤干细胞HAX1相对表达水平比对照组显著下降[(0.24±0.02)比(0.78± 0.05),P<0.05];5-氟尿嘧啶+桔梗皂苷D+HAX1质粒组HepG2肿瘤干细胞凋亡率显著低于5-氟尿嘧啶+桔梗皂苷D组[(10.1±0.7)%比(34.8±2.2)%,P<0.05];5-氟尿嘧啶+桔梗皂苷D组HepG2肿瘤干细胞相对线粒体膜电位显著低于5-氟尿嘧啶组[(0.21±0.02)比(0.84±0.04),P<0.05]。结论桔梗皂苷D可能通过下调HAX1表达抑制肝癌干细胞对5-氟尿嘧啶的抵抗性。
肝癌干细胞;HAX1;线粒体;凋亡;桔梗皂苷D;5-氟尿嘧啶
文献[1-2]报道,肿瘤干细胞(tumor stem cells,TSCs)对化疗存在抵抗性,是导致肿瘤复发的重要因素。肝癌是常见的消化系统肿瘤之一,恶性程度高,患者预后往往不良,五年存活率较低[3]。5-氟尿嘧啶是治疗肝癌的重要化疗药物,然而5-氟尿嘧啶的长期治疗往往造成肿瘤细胞对其发生抵抗[4],因此抑制肿瘤细胞尤其是肿瘤干细胞对5-氟尿嘧啶的耐药性具有十分重要的意义。本文旨在研究桔梗皂苷D对肝癌干细胞细胞活力和细胞凋亡的干预作用及其机制研究。
1 材料与方法
1.1 材料DMEM培养基购于美国Gibco。噻唑蓝(MTT)、桔梗皂苷D和5-氟尿嘧啶购于美国Sigma-Aldrich。Annexin V/PI凋亡检测试剂盒(货号:88-8005-72)购于美国ebioscience。造血细胞特异性蛋白相关蛋白1(HAX1)抗体、活化型半胱天冬酶-3(cleaved Caspase-3)抗体和β-肌动蛋白(β-actin)抗体购于美国CellSignaling。JC-1(5,5′,6,6′-Tetrachloro-1,1′,3,3′-tetraethyl imidacarbo cyanine iodide)染料购于美国Molecular Probes。CD133-FITC荧光抗体购于美国BD公司。增强型化学发光底物(ECL)试剂盒(货号:32106)购于美国Pierce。脂质体2000(Lipofectamine 2000)购于美国Invitrogen。
1.2 细胞培养人肝癌细胞系HepG2购于中国科学院典型培养物保藏委员会细胞库。HepG2肿瘤干细胞用流式细胞仪进行分选,CD133阳性的HepG2细胞即为HepG2肿瘤干细胞[5]。常规HepG2细胞及HepG2肿瘤干细胞培养在含10%胎牛血清的DMEM培养基中,培养环境为37°C恒温培养箱中培养并通入5%CO2。
1.3 质粒构建和转染将HAX1基因(Gene ID:NM_001018837.1)的开放阅读框架序列经PCR扩增后以分子克隆的方法与pcDNA3.1连接后构建成HAX1重组真核表达质粒。HAX1表达质粒用Lipofectamine2000按试剂操作说明书步骤进行转染,将2μg/mL HAX1表达质粒转染入HepG2肿瘤干细胞中。
1.4 细胞活力检测将HepG2肿瘤细胞按5×103/孔接种在96孔板上,分为对照组、桔梗皂苷D组、5-氟尿嘧啶组、5-氟尿嘧啶+桔梗皂苷D组和5-氟尿嘧啶+桔梗皂苷D+HAX1质粒组。对照组为肿瘤细胞不加药物培养48h,5-氟尿嘧啶组为在肿瘤细胞中加入5μmol/L的5-氟尿嘧啶培养48h,桔梗皂苷D组为在肿瘤细胞中加入2μmol/L的桔梗皂苷D培养48h,5-氟尿嘧啶+桔梗皂苷D组为在肿瘤细胞中加入5μmol/L的5-氟尿嘧啶和2μmol/L的桔梗皂苷D培养48h,5-氟尿嘧啶+桔梗皂苷D+HAX1质粒组为先将2μg/mL的HAX1表达质粒转染入肿瘤细胞中培养24h,之后更换培养基再加入5μmol/L的5-氟尿嘧啶和2μmol/L的桔梗皂苷D继续培养48h。药物处理完毕后在培养体系中加入20μL 5g/L MTT再培养4h,弃去上清,往孔中加入150μL二甲亚砜,在570nm波长下用酶标仪检测OD值,细胞活力抑制率计算公式:抑制率=(OD对照组-OD治疗组)/ OD对照组×100%。
1.5 细胞凋亡实验将细胞按2×106/孔接种在6孔板上,按上述进行分组处理。处理完毕后按照凋亡试剂盒说明书步骤将PI(碘化丙啶)和Annexin-V加入细胞中暗室孵育20min,采用流式细胞术检测肿瘤细胞的凋亡,凋亡率用Annexin-V阳性细胞数占总细胞数的百分比表示。
1.6 Western blot实验将细胞按2×106/孔接种在6孔板上,按上述进行分组处理。药物处理完毕后将细胞用蛋白提取液提取总蛋白质。之后将提取的总蛋白质用12%SDS-PAGE进行电泳分离。分离完毕后通过电转方法将蛋白质从分离胶上转到PVDF膜上,用HAX1抗体,cleaved Caspase-3抗体或βactin抗体孵育过夜,之后再用带辣根过氧化物酶的二抗孵育2h,蛋白条带用ECL试剂盒显色发光。蛋白灰度值分析用Image J软件处理。目标蛋白的相对表达水平用它们的蛋白灰度值与β-actin灰度值的比值表示。
1.7 线粒体膜电位测定将细胞按2×106/孔接种在6孔板上,按上述进行分组处理。处理完毕后按试剂操作说明书步骤将细胞用JC-1染料进行孵育。20min后,将细胞用生理盐水洗涤3遍,之后用流式细胞仪检测JC-1发出的红色荧光,红色荧光强度越强,线粒体膜电位越高[6]。治疗组的相对线粒体膜电位为各治疗组的JC-1荧光强度与对照组荧光强度的比值。
2 结果
2.1 各组HepG2肿瘤干细胞细胞活力抑制率与凋亡率比较MTT实验结果显示,不同浓度5-氟尿嘧啶对HepG2肿瘤干细胞的杀伤活性显著低于常规HepG2细胞(P均<0.05),表明HepG2肿瘤干细胞对5-氟尿嘧啶有明显的抵抗性(见图1)。联用桔梗皂苷D后,5-氟尿嘧啶对HepG2肿瘤干细胞的杀伤活性和凋亡诱导活性显著增强(P均<0.05),表明桔梗皂苷D能明显抑制HepG2肿瘤干细胞对5-氟尿嘧啶的抵抗性。见表1。
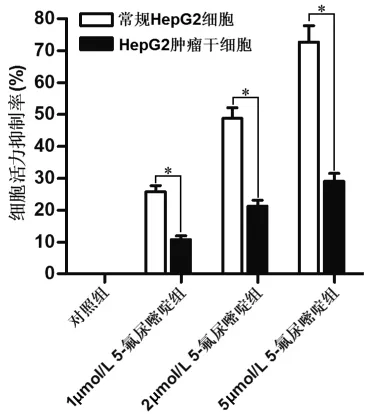
图1 不同浓度5-氟尿嘧啶对常规HepG2细胞及HepG2肿瘤干细胞细胞活力的影响
2.2 各组HAX1表达水平和HepG2肿瘤干细胞凋亡率比较Western blot结果显示,桔梗皂苷D处理能显著抑制HepG2肿瘤干细胞抗凋亡蛋白HAX1表达水平(P<0.05),而5-氟尿嘧啶对HAX1表达无影响(P>0.05),表明HAX1可能是桔梗皂苷D作用靶点。当转染HAX1质粒后,桔梗皂苷D不能协同5-氟尿嘧啶诱导HepG2肿瘤干细胞发生凋亡(P<0.05),表明桔梗皂苷D可能通过下调HAX1表达水平增强5-氟尿嘧啶对HepG2肿瘤干细胞的凋亡诱导活性,见表2。
2.3 各组HepG2肿瘤干细胞线粒体膜电位和Caspase-3表达水平比较流式细胞实验结果显示,联用桔梗皂苷D后,5-氟尿嘧啶对HepG2肿瘤干细胞线粒体膜电位的损伤作用明显增强(P<0.05),Western blot结果显示,联用桔梗皂苷D能显著增强5-氟尿嘧啶对HepG2肿瘤干细胞Caspase-3活化(P<0.05)。然而,转染HAX1质粒后,桔梗皂苷D对线粒体膜电位和Caspase-3干预作用受到明显抑制(P<0.05)。表明桔梗皂苷D可能通过下调HAX1表达促进5-氟尿嘧啶诱导的线粒体途径的凋亡,见表3。
3 讨论
新近研究发现,肿瘤组织中的肿瘤干细胞往往对化疗不敏感,它们能通过改变自身的基因表达产生对化疗药物的抵抗性,肿瘤干细胞还有很高的自我更新能力,化疗后存活的肿瘤干细胞常导致肿瘤的复发[7-8]。桔梗皂苷D是桔梗科植物桔梗干燥根中提取的有效活性成分,具有抗炎、镇痛和免疫调节的作用。文献报道,桔梗皂苷D对多种肿瘤有一定的抑制作用,在体外能促进肿瘤细胞的凋亡和周期阻滞[9-11],然而其对肿瘤干细胞的生物活性至今却仍很少报道。本研究发现桔梗皂苷D能显著逆转肝癌干细胞对5-氟尿嘧啶的抵抗性,表明桔梗皂苷D能作为一种辅助治疗药物增强5-氟尿嘧啶对肝癌干细胞的杀伤活性,提高化疗有效率。
表1 各组HepG2肿瘤干细胞细胞活力抑制率与凋亡率比较(%,)

表1 各组HepG2肿瘤干细胞细胞活力抑制率与凋亡率比较(%,)
注:与对照组比较,*P<0.05;与桔梗皂苷D组比较,△P<0.05;与5-氟尿嘧啶组比较,▲P<0.05
组别对照组桔梗皂苷D组5-氟尿嘧啶组5-氟尿嘧啶+桔梗皂苷D组孔数5-氟尿嘧啶(μmol/L)桔梗皂苷D(μmol/L)3 3 3 3 0 0 5 5 0 2 0 2细胞活力抑制率0 5.8±0.5 28.7±1.8* 66.7±3.4△▲凋亡率1.8±0.2 2.6±0.3 8.9±0.6* 33.9±2.1△▲
表2 各组HAX1表达水平和HepG2肿瘤干细胞凋亡()

表2 各组HAX1表达水平和HepG2肿瘤干细胞凋亡()
注:与对照组比较,*P<0.05;与5-氟尿嘧啶组比较,▲P<0.05;与5-氟尿嘧啶+桔梗皂苷D组比较,#P<0.05
组别对照组桔梗皂苷D组5-氟尿嘧啶组5-氟尿嘧啶+桔梗皂苷D组5-氟尿嘧啶+桔梗皂苷D+HAX1质粒组孔数5-氟尿嘧啶(μmol/L)桔梗皂苷D(μmol/L)HAX1质粒(μg/mL)3 3 3 3 3 0 0 5 5 5 0 2 0 2 2 0 0 0 0 2 HAX1相对表达水平0.78±0.05 0.24±0.02* 0.80±0.05 0.25±0.02▲0.92±0.06#凋亡率(%)1.9±0.2 2.6±0.3 8.8±0.6* 34.8±2.2▲10.1±0.7#
表3 各组HepG2肿瘤干细胞线粒体膜电位和Caspase-3表达水平比较()
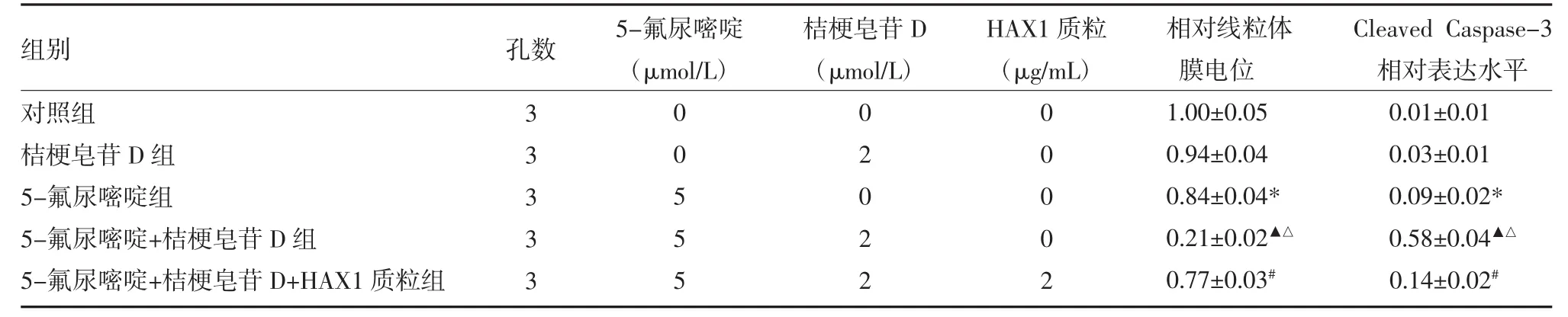
表3 各组HepG2肿瘤干细胞线粒体膜电位和Caspase-3表达水平比较()
注:与对照组比较,*P<0.05;与5-氟尿嘧啶组比较,▲P<0.05;与桔梗皂苷D组比较,△P<0.05;与5-氟尿嘧啶+桔梗皂苷D组比较,#P<0.05
组别对照组桔梗皂苷D组5-氟尿嘧啶组5-氟尿嘧啶+桔梗皂苷D组5-氟尿嘧啶+桔梗皂苷D+HAX1质粒组孔数5-氟尿嘧啶(μmol/L)桔梗皂苷D(μmol/L)HAX1质粒(μg/mL)3 3 3 3 3 0 0 5 5 5 0 2 0 2 2 0 0 0 0 2相对线粒体膜电位1.00±0.05 0.94±0.04 0.84±0.04* 0.21±0.02▲△0.77±0.03#Cleaved Caspase-3相对表达水平0.01±0.01 0.03±0.01 0.09±0.02* 0.58±0.04▲△0.14±0.02#
HAX1是一种定位在线粒体外膜上的抗凋亡蛋白[12]。研究表明,HAX1过表达能阻碍肿瘤细胞的凋亡途径,抑制由药物或其他环境因素引起的肿瘤细胞线粒体的损伤,因此,包括肿瘤细胞的HAX1往往过度表达,且HAX1的过表达程度与肿瘤细胞对化疗药物的敏感性呈负相关[13]。在本研究中,笔者发现桔梗皂苷D在HepG2肿瘤干细胞中的直接靶点是HAX1蛋白,桔梗皂苷D辅助治疗能显著降低HepG2肿瘤干细胞HAX1表达水平。当在肝癌干细胞中转染HAX1质粒强制增加它的表达水平后,桔梗皂苷D联合5-氟尿嘧啶对肝癌干细胞线粒体的损伤作用受到显著抑制,同时Caspase-3的活化也受到明显抑制,表明桔梗皂苷D通过抑制HAX1的表达抑制肝癌干细胞对线粒体途径凋亡的抵抗性,提高5-氟尿嘧啶对肝癌干细胞的杀伤活性。
本研究结果显示,桔梗皂苷D能显著抑制肝癌干细胞对5-氟尿嘧啶的抵抗性。其机制为桔梗皂苷D可能通过下调HAX1表达促进5-氟尿嘧啶对肝癌干细胞线粒体的损伤进而诱导肿瘤细胞发生Caspase-3依赖的凋亡。这些研究结果为逆转肿瘤细胞对5-氟尿嘧啶的抵抗性,提高其疗效提供新的思路和理论依据。
[1]Rybicka A,Król M.Identification and characterization of cancer stem cells in canine mammary tumors[J].Acta Vet Scand,2016,58(1):86.
[2]Chuthapisith S,Eremin J,Eremin O,et al.Breast cancer chemoresistance:emerging importance of cancer stem cells[J]. Surgical Oncology,2010,19(1):27-32.
[3]Siegel R,Naishadham D,Jemal A.Cancer statistics,2013[J].CA Cancer J Clin,2013,63(1):11-30.
[4]Wu R,Nie Q,Diasio RB,et al.Histone H3K27 Trimethylation Modulates 5-Fluorouracil Resistance by Inhibiting PU. 1 Binding to the DPYD Promoter[J].Cancer Res,2016,76(21):6362-6373.
[5]Feng X,Jiang J,Zheng S,et al.Knockdown of miR-25 increases the sensitivity of liver cancer stem cells to TRAIL-induced apoptosis via PTEN/PI3K/Akt/Bad signaling pathway[J].Int J Oncol,2016,49(6):2600-2610.
[6]Prathapan A,Vineetha VP,Raghu KG.Protective effect of Boerhaavia diffusa L.against mitochondrial dysfunction in angiotensin II induced hypertrophy in H9c2 cardiomyoblast cells[J].PLoS One,2014,9(4):e96220.
[7]Zhang HL,Wang P,Zhang SD,et al.c-Myc regulation of ATP-binding cassette transporter reverses chemoresistance in CD133(+)colon cancer stem cells[J].Sheng Li Xue Bao,2016,68(2):171-178.
[8]Mohammed MK,Shao C,Lee MJ,et al.Wnt/β-catenin signaling plays an ever-expanding role in stem cell self-renewal,tumorigenesis and cancer chemoresistance[J].Genes Dis,2016,3(1):11-40.
[9]Li T,Xu WS,Lu JJ,et al.Platycodin D induces apoptosis,and inhibits adhesion,migration and invasion in HepG2 hepatocellular carcinoma cells[J].Asian Pac J Cancer Prev,2014,15(4):1745-1749.
[10]Qin H,Du X,Wang R,et al.Platycodin D,a triterpenoid saponin from Platycodon grandiflorum,induces G2/M arrest and apoptosis in human hepatoma HepG2 cells by modulating the PI3K/Akt pathway[J].Tumour Biol,2014,35(2):1267-1274.
[11]Dai Q,Chen Z,Wu BH,et al.Mechanism of platycodin D-induced apoptosis in A549 human lung cancer cells[J]. Zhongguo Zhong Yao Za Zhi,2012,37(17):2626-2629.
[12]Trebinska A,Hogstrand K,Fadeel B,et al.Exploring the anti-apoptotic role of HAX-1 versus BCL-XL in cytokine-dependent bone marrow-derived cells from mice[J].FEBS Lett,2014,(588):2921-2927.
[13]Li X,Jiang J,Luo X,et al.Expression of HAX-1 in colorectal cancer and its role in cancer cell growth[J].Mol Med Rep,2015,12(3):4071-4078.
(收稿:2017-02-05 修回:2017-05-20)
Intervention of Platycodin D on Viability and Apoptosis of Liver Cancer Stem Cells and Its Related Mechanism
XUAN Liyang.Department of Clinical Laboratory,Tongde Hospital of Zhejiang Province,Hangzhou(310012),China
ObjectiveTo investigate the role of platycodin D in inhibiting the resistance of liver cancer stem cells to 5-fluorouracil.MethodsMTT assay and Annexin V staining were performed to investigate the effect of platycodin D and 5-fluorouracil on cell viability and apoptosis in HepG2 cancer stem cells.Western blot analysis was performed to investigate the effect of platycodin D on regulating the expression of HAX1 in HepG2 cancer stem cells.JC-1 staining,Annexin V staining and western blot analysis was performed to investigate the apoptotic pathway in HepG2 cancer stem cells treated with platycodin D and 5-fluorouracil.ResultsCell viability inhibitory rate of HepG2 cancer stem cells treated with 5mol/L 5-fluorouracil was(29.1±2.4)%,which was significantly lower than the routine HepG2 cells[(72.7±5.2)%,P<0.05].Cell viability inhibitory rate and apoptotic rate of HepG2 cancer stem cells co-treated with 5-fluorouracil plus platycodin D were(66.7±3.4)%and(33.9±2.1)%,respectively, which were significantly higher than the cell viability inhibitory rate[(28.7±1.8)%,P<0.05]and apoptotic rate[(8.9± 0.6)%,P<0.05]of HepG2 cancer stem cells treated with 5-fluorouracil alone.Relative expression of HAX1 in platycodin D treatment group was significantly lower than that in control group(0.24±0.02 vs 0.78±0.05,P<0.05). Apoptotic rate in 5-fluorouracil+platycodin D+HAX1 plasmid treatment group was significantly lower than that in the 5-fluorouracil+platycodin D group[(10.1±0.7)%vs(34.8±2.2)%,P<0.05];relative mitochondrial membrane potential in 5-fluorouracil+platycodin D treatment groupis significantly lower than that in 5-fluorouracil alone group(0.21±0.02 vs 0.84±0.04,P<0.05).ConclusionPlatycodin D may inhibit the resistance of liver cancer stem cells to 5-fluorouracil via down-regulating the expression of HAX1.
liver cancer stem cells;HAX1;mitochondria;apoptosis;platycodin D;5-fluorouracil
book=756,ebook=25
浙江省立同德医院检验科(杭州310012)
