雷珠单抗竞争结合血管内皮生长因子A抑制裸鼠皮下血管瘤细胞生长的实验研究
2017-09-25黄崇青虞冠锋黄景勇麻朋艳万丽范良好
黄崇青 虞冠锋 黄景勇 麻朋艳 万丽 范良好
雷珠单抗竞争结合血管内皮生长因子A抑制裸鼠皮下血管瘤细胞生长的实验研究
黄崇青 虞冠锋 黄景勇 麻朋艳 万丽 范良好
目的探索观察雷珠单抗(Ranibizumab)竞争结合血管内皮生长因子A(VEGF-A)抑制裸鼠皮下血管瘤的相对疗效及副作用。方法BALB/c裸鼠30只,采用密度为1×107个/mL血管瘤内皮细胞(EOMA)200μL单侧腋下皮下注射法建立血管瘤裸鼠模型,在接种EOMA细胞9天后给予相应药物治疗。具体分组为:对照组只接种EOMA细胞,无药物治疗;雷珠单抗低、中、高剂量组接种EOMA细胞并给予0.25、0.5和0.75mg/cm3雷珠单抗治疗;平阳霉素组接种EOMA细胞并给予1mg/cm3平阳霉素治疗,每组6只。观察各组裸鼠成瘤情况并测量肿瘤体积,免疫组织化学(IHC)法检测各组裸鼠肿瘤组织CD34、Ki67表达,HE染色后观察各组裸鼠肺、心、肝、肾组织病理变化。结果第9~12天各组裸鼠血管瘤体积增长最快,第12~24天雷珠单抗低、中、高剂量组、平阳霉素组裸鼠血管瘤体积增长减缓,与对照组比较,差异有统计学意义[第12天:(44.44±13.11)mm3、(45.71± 7.69)mm3、(35.37±11.96)mm3、(41.44±3.75)mm3比(61.91±17.09)mm3,P均<0.05;第15天:(52.16± 13.28)mm3、(48.18±14.46)mm3、(33.52±9.97)mm3、(47.22±10.86)mm3比(72.98±14.85)mm3,P均<0.05;第18天:(56.50±6.96)mm3、(51.56±11.10)mm3、(36.57±18.79)mm3、(51.36±5.21)mm3比(95.58±19.10)mm3,P均<0.01;第21天:(62.88±9.76)mm3、(60.34±12.80)mm3、(39.45±18.47)mm3、(54.95±4.37)mm3比(123.46±18.03)mm3,P均<0.01;第24天:(70.85±8.73)mm3、(69.84±16.33)mm3、(41.83±18.65)mm3、(61.52±8.12)mm3比(171.76±52.46)mm3,P均<0.01);与平阳霉素组比较,雷珠单抗高剂量组裸鼠血管瘤体积显著缩小[第12天:(35.37±11.96)mm3比(41.44±3.75)mm3,P<0.05;第15天:(33.52±9.97)mm3比(47.22±10.86)mm3,P<0.05;第18天:(36.57±18.79)mm3比(51.36± 5.21)mm3,P<0.05;第21天:(39.45±18.47)mm3比(54.95±4.37)mm3,P<0.05;第24天:(41.83±18.65)mm3比(61.52±8.12)mm3,P<0.05);雷珠单抗低、中、高剂量组和平阳霉素组裸鼠血管瘤组织CD34和Ki67蛋白表达明显降低(P<0.01),且雷珠单抗浓度越高,降低越明显。各组裸鼠肺组织受到不同程度的损伤,但雷珠单抗高剂量组裸鼠肺组织损伤程度较平阳霉素轻;各组裸鼠心、肝、肾组织无明显变化。结论雷珠单抗抑制裸鼠皮下血管瘤细胞生长作用显著,其作用可能与下调血管瘤组织CD34、Ki67表达有关,对裸鼠肺组织损伤要较平阳霉素轻。
裸鼠;血管瘤;血管内皮生长因子A;雷珠单抗;平阳霉素
血管瘤是先天性良性肿瘤或血管畸形,因其复发率高、手术风险及难度大,治疗后残留疤痕。因此寻找创伤小、疗效佳、复发率低的治疗方法成为当前医学的一大难题。药物治疗是血管瘤病的治疗首选[1],其中我国最具代表性的是平阳霉素(pingyangmycin),但其疗效不甚理想[2]。雷珠单抗(ranibizumab)能更紧密结合到血管内皮生长因子A(vascular endothelial growth factor A,VEGF-A)上[3]。被认为是一种强效的血管生成抑制剂(angiogenesis inhibitor),其导致血管凋亡的治疗效果明确,已被批准用于治疗与皮下组织血管瘤发病相似的老年性黄斑变性(age-related macular degeneration,AMD)[4]。但是对于治疗皮下结缔组织血管瘤病变,目前国内外尚缺少研究。本研究旨在探讨建立动物实验模型下观察雷珠单抗竞争结合VEGF-A抑制裸鼠皮下结缔组织血管瘤的相对疗效及副作用。通过HE染色观察不同处理组裸鼠心、肺、肝、肾及血管瘤区域组织的病理变化。应用免疫组织化学检测不同处理组裸鼠血管瘤组织CD34和Ki67的蛋白表达情况。
1 实验材料
1.1 实验动物SPF级BALB/c裸鼠共30只,购自南京医科大学,许可证号:SCXK(苏)2016-0002,雌雄不拘,3~4周龄,体质量18.0~20.0g。所有动物均在温州医科大学实验动物中心SPF级动物实验室饲养,喂养饲料由北京科澳协力饲料有限公司提供。未进行任何治疗的小鼠血管瘤内皮细胞(EOMA细胞)购自南京科佰生物科技有限公司。
1.2 试剂及药物雷珠单抗注射液(批号p2013080 2142430969)(Novartis公司,瑞士),平阳霉素(批号YB01156)(上海钰博),血管性血友病因子(vWF)抗体(批号00049557)(Proteintech),CD34抗体(批号J1119)(Santa cruz),Ki67抗体(批号23DB17)(Affinity),台盼蓝(批号mkbp3291v)(Sigma),Triton-X100(批号BLBD4155V),青链霉素混合液(批号20160317),胰蛋白酶-乙二胺四乙酸(EDTA)消化液(批号20160224),4%多聚甲醛(批号20160311),磷酸盐缓冲液(PBS)(批号20160314),中性树脂(批号20160515)(Solarbio),广谱二抗(批号LD010024),3,3-二氨基联苯胺(DAB)浓缩型试剂盒(批号LDD10118)(上海长岛生物技术有限公司),荧光二抗(批号B20160122),4',6-二脒基-2-苯基吲哚(DAPI)溶液(批号20160207),抗荧光淬灭封片剂(批号20160207)(碧云天),苏木素(批号16B01S22)(BASO),苏木素-伊红染色试剂盒(批号16L03A14)(博士德);牛血清白蛋白(BSA)(批号SG16HZ0322)(生工生物),胎牛血清(FBS)(批号AB216694)(Hyclone),EBM2培养基(批号8112655)(LONZA),细胞培养皿/瓶(批号03316010)(Corning),石蜡(批号20160205),二甲苯(批号20160111),无水乙醇(批号20160207),氨水(批号20160118),3%H2O2(批号20160107),3%甲醛溶液(批号20160107)(上海国药集团)等。
2 实验方法
2.1 台盼蓝染色取完全内皮细胞培养基上(成分为EBM2培养基+2%FBS+1%双抗)对数生长期的EOMA细胞,传代前24h换培养液。用0.25%的胰蛋白酶于37℃消化细胞1~2min,待大部分细胞收缩变圆、即将脱壁时弃去胰蛋白酶,加入含10%胎牛血清的培养液终止消化,并以无菌吸管轻轻吹打混匀,使细胞从培养皿底脱落成为细胞悬液。收集细胞悬液,离心(1000rpm,5min),弃上清,加入1mL培养液于2mL离心管内,以无菌吸管轻轻吹打将细胞吹打成单细胞悬液(不能用力过猛,以不出现泡沫为宜)。吸取出10μL于血球计数板上,于显微镜下计数。计数后将细胞悬液的浓度调整为106个/mL。取适当细胞悬液与0.4%台盼蓝染色液以9∶1的比例混合均匀。在3min内分别计数活细胞和死细胞。镜下观察,死细胞被染成淡蓝色,而活细胞拒染。
2.2 免疫荧光鉴定血管瘤内皮细胞细胞爬片:盖玻片灭菌烘干,放入12孔细胞培养板,EOMA细胞进行单层细胞爬片。固定细胞:待细胞密度约70%时,去培养基先用PBS洗涤1次,再用3%甲醛溶液固定,室温固定10~15min,后用PBS洗涤3次。穿透:标本放置于12孔板,用1%Triton-X100进行打孔穿透,室温孵育5~10min,用PBS洗涤3次。封闭:在封口膜划分操作区域,每个样本位点加适量3% BSA封闭液,室温封闭30min。一抗孵育:1∶200稀释一抗,置于湿盒4°℃封闭过夜,PBS洗涤3次。二抗及DAPI核染:1∶500稀释荧光二抗和DAPI混合液,避光室温孵育30~60min,后用PBS洗涤3次。封片固定:用荧光淬灭封片剂在载玻片上进行封片,指甲油描边固定玻片。荧光显微镜拍片,放大倍数为200倍。
2.3 裸鼠成瘤动物模型建立及分组治疗30只裸鼠随机分成五组,每组6只,对照组为接种EOMA细胞的BALB/c裸鼠,无药物治疗;雷株单抗低剂量组为接种EOMA细胞的BALB/c裸鼠+0.25mg/cm3雷珠单抗;雷株单抗中剂量组为接种EOMA细胞的BALB/c裸鼠+0.5mg/cm3雷珠单抗;雷株单抗高剂量组为接种EOMA细胞的BALB/c裸鼠+0.75mg/cm3的雷珠单抗;平阳霉素组为接种EOMA细胞的BALB/c裸鼠+1mg/cm3平阳霉素。取EOMA细胞接种培养至70%~80%,胰酶消化后浓集制成细胞悬浮液,使其密度为1×107个/mL,200μL皮下注射于BALB/c裸鼠单侧腋下,建立血管瘤模型,此过程注意无菌操作,每隔3天测定肿瘤体积,造模9天后加药治疗,继续每隔3天测定肿瘤体积。
2.4 苏木素-伊红染色(HE)染色各组接受处理后裸鼠的肿瘤组织及肺、心、肝、肾组织HE染色并进行图像采集和分析。
2.5 免疫组织化学(IHC)检测分别在药物注射后15天取肿瘤组织,石蜡切片制备,免疫组化染色CD34和Ki67。具体操作如下:切片:切片前将蜡块在-20℃冰箱至少放置30min,以增加硬度。将切片刀装在刀片机的刀架上并固定紧,固定蜡块底座或蜡块,调整蜡块与刀至合适位置,刀刃与蜡块表面呈5度角。调整切片机上的切片厚度为4~7μm,然后切片。烤片和脱蜡。将玻片置于65℃恒温烘箱中烤片30min;置于二甲苯Ⅰ中浸泡15min,再置于二甲苯Ⅱ中浸泡15min。水化。将脱蜡后的切片经100、95、85、75%酒精分别浸泡5min,自来水冲洗10min。抗原修复。本研究采用0.01M柠檬酸钠缓冲溶液中高压修复15min,自然冷却后,0.02M PBS洗3次,每次3min,将玻片置于3%过氧化氢(H2O2)中,湿盒孵育10min,以消除内源性过氧化物酶的活性。0.02M PBS冲洗3次,每次3min。一抗孵育。滴加一抗((阴性对照可用PBS代替一抗)),湿盒孵育,室温下放置1h(或者4℃孵育过夜)。0.02M PBS冲洗3次,每次3min。二抗孵育,滴加辣根过氧化物酶(HRP)标记广谱二抗,湿盒孵育,室温下放置20~30min。0.02M PBS冲洗3次,每次3min。显色,DAB染色,观察到切片有颜色改变时,立即用自来水洗去染色液。苏木素染色,苏木素复染3min,1%盐酸酒精分化,显微镜下观察,控制染色程度。自来水冲洗10min,放入65℃烘箱中烘干水分。透明和封片将玻片置于二甲苯中透明2次,每次3min,中性树胶封片,放入65℃烘箱中15min。最后行图像采集和分析。
2.6 统计学方法初步数据录入EXCEL(2007版)进行逻辑校对与分析,应用SPSS22.0软件对上述数据进行统计分析。一般资料以() 表示,单因素方差分析加post-hoc LSD检验。P<0.05为差异有统计学意义。
3 实验结果
3.1 血管瘤内皮细胞原代分离及鉴定EOMA细胞培养过程中状态较好,死细胞很少(见插页图1)。免疫荧光检测显示,在原代分离的EOMA细胞中检测到vWF蛋白表达阳性率为93%左右。在原代分离的EOMA细胞中检测到CD34蛋白表达阳性率为97%左右(见插页图2~3)。
3.2 EOMA细胞裸鼠成瘤及药物治疗第9~12天肿瘤体积增长最快,因此后续各组裸鼠在接种EOMA细胞9天后进行治疗(见插页图4)。
与对照组比较,雷株低、中、高剂量组、平阳霉素组裸鼠肿瘤体积在未加药治疗之前(0~9天)差异无统计学意义(P>0.05),加药治疗之后(12~21天)肿瘤体积明显减小。至第24天,对照组裸鼠肿瘤体积显著增大,各实验组裸鼠肿瘤体积均显著缩小,与对照组比较,差异有统计学意义(P均<0.01);与平阳霉素组比较,雷株低、中剂量组裸鼠肿瘤体积变化基本接近(P>0.05),雷株高剂量组裸鼠肿瘤体积小于平阳霉素组(P<0.05)。见表1。
3.3 HE染色肿瘤组织及肺、心、肝、肾的病理变化与对照组比较,雷株低、中、高剂量组、平阳霉素组裸鼠肺组织损伤(肺水肿、肺泡壁增厚)程度明显加重,且浓度雷珠单抗浓度越高,损伤越明显,其中平阳霉素组损伤程度最为明显,雷株高剂量组损伤程度次之。与对照组比较,雷株低、中、高剂量组、平阳霉素组裸鼠心、肝、肾组织无明显变化(见插页图5)。对照组裸鼠血管瘤内皮细胞增殖并聚集成团,界限清晰,组织内可见明显的微细血管瘤;雷株低、中、高剂量组、平阳霉素组裸鼠血管瘤内皮细胞明显减少,彼此界限不清,血管瘤组织有不同程度的消退。且雷珠单抗浓度越高,消退效果越明显(见插页图6)。
3.4 各组裸鼠肿瘤组织CD34和Ki67表达量比较与对照组比较,雷株低、中、高剂量组、平阳霉素组裸鼠肿瘤组织CD34和Ki67蛋白表达明显下降(P<0.01),且浓度雷珠单抗浓度越高,下降越明显,其中雷珠单抗高剂量组和平阳霉素组效果最明显。与平阳霉素组比较,雷株低、中、高剂量组裸鼠肿瘤组织CD34和Ki67蛋白表达差异无统计学意义(P>0.05)。见插页图7。
4 讨论
4.1 雷珠单抗治疗血管瘤病变的机制分析雷珠单抗(商品名Lucentis)是一种重组人源化单克隆抗体(FAB),最初用于抑制肿瘤血管生成[5]。其受体结合部位是血管内皮生长因子中最重要的血管内皮生长因子A(VEGF-A),VEGF-A与VEGF受体(vascular endothelial growth factor re-ceptor,VEGFR)结合后可激活血管内皮细胞中的信号转导,产生促血管生成作用和渗漏,是新生血管形成中的关键因素[6]。这种单克隆抗体与VEGF-A结合防止并阻碍了血管内皮生长因子受体在血管内皮细胞表面的相互作用。导致血管瘤的发生发展及消退的标志细胞-增殖期血管瘤细胞(HemECs)的凋亡[7]。从而阻止血管内皮增生,减少血管的渗漏和新血管的生成。其导致血管凋亡的治疗效果已被批准用于治疗湿性(新生血管性)老年性黄斑变性,此病系眼底色素上皮层下活跃的新生血管引起,与皮下组织血管瘤发病相似,雷珠单抗对其有效作用率可达89%[4]。此外对于其余眼科血管性疾病如:息肉样脉络膜视网膜病变(polypoidal choroidal vasculopathy,PCV)[8],视网膜静脉阻塞(retinal vein occlusion,RVO)引起的黄斑水肿[9],糖尿病性黄斑水肿(diabetic macular edema,DME)[10],脉络膜新生血管(choroidalneovascularization,CNV)[11-12],新生血管性青光眼(neovascular glaucoma,NVG)[13],均有肯定的报道。基于此,本研究在建立动物模型的基础上,探讨其对于皮下结缔组织血管瘤病变的治疗作用。
4.2 细胞注射法血管瘤动物实验模型的分析本研究采用的台盼蓝染色检测原代血管瘤内皮细胞状态表明,EOMA细胞培养过程中状态较好,死细胞很少。免疫荧光检测原代分离的EOMA细胞中vWF和CD34蛋白表达均在90%以上。我们采用提取的EOMA细胞,注射法建立BALB/c裸鼠皮下血管瘤模型[14]。其成瘤曲线表明9~12天肿瘤体积增长最快,因此这段时间是药物治疗肿瘤最好的窗口期。
表1 各组裸鼠肿瘤体积比较(mm3,)
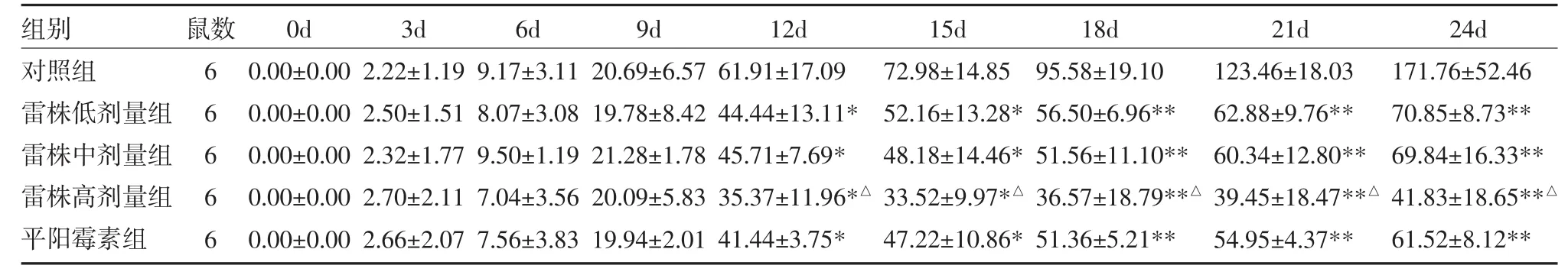
表1 各组裸鼠肿瘤体积比较(mm3,)
注:与对照组比较,*P<0.05,**P<0.01;与平阳霉素药组比较,△P<0.05
组别对照组雷株低剂量组雷株中剂量组雷株高剂量组平阳霉素组鼠数6 6 6 6 6 0d 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 3d 2.22±1.19 2.50±1.51 2.32±1.77 2.70±2.11 2.66±2.07 6d 9.17±3.11 8.07±3.08 9.50±1.19 7.04±3.56 7.56±3.83 9d 20.69±6.57 19.78±8.42 21.28±1.78 20.09±5.83 19.94±2.01 12d 61.91±17.09 44.44±13.11* 45.71±7.69* 35.37±11.96*△41.44±3.75* 15d 72.98±14.85 52.16±13.28* 48.18±14.46* 33.52±9.97*△47.22±10.86* 18d 95.58±19.10 56.50±6.96** 51.56±11.10** 36.57±18.79**△51.36±5.21** 21d 123.46±18.03 62.88±9.76** 60.34±12.80** 39.45±18.47**△54.95±4.37** 24d 171.76±52.46 70.85±8.73** 69.84±16.33** 41.83±18.65**△61.52±8.12**
4.3 药物治疗血管瘤的疗效对比分析各药物治疗后,各个时期的药物治疗组裸鼠血管瘤体积均有明显减小,且以0.75mg/cm3的雷珠单抗治疗组与平阳霉素治疗组的效果最为明显。与平阳霉素治疗组比较,0.75mg/cm3的雷珠单抗治疗组疗效稍优于平阳霉素治疗组,其余各组相当。血管瘤HE染色表明,无药物治疗的基础对照组裸鼠血管瘤内皮细胞增殖并聚集成团,界限清晰,组织内可见明显的微细血管瘤,故细胞注射法建立的皮下结缔组织血管瘤动物模型成瘤效果理想;不同浓度雷珠单抗治疗组及平阳霉素治疗组血管瘤内皮细胞明显减少,彼此界限不清,血管瘤组织有不同程度的消退。且雷珠单抗浓度越高,消退效果越明显。上述结果表明,各药物对裸鼠血管瘤有不同程度的治疗作用。而0.75mg/cm3的雷珠单抗治疗组疗效最为明显。
HE染色观察不同处理组裸鼠肺、心、肝、肾的病理变化表明,不同浓度雷珠单抗治疗组及平阳霉素治疗组裸鼠均出现非致死性肺组织损伤,表现为肺水肿、肺泡壁增厚,其中平阳霉素治疗组损伤程度最为明显,0.75mg/cm3的雷珠单抗治疗组损伤程度次之。与无药物治疗的基础对照组比较,不同浓度雷珠单抗治疗组及平阳霉素治疗组裸鼠心、肝、肾组织无明显变化。上述结果表明,各药物治疗后,裸鼠肺组织受到不同程度的损伤,其他组织无明显变化,但雷珠单抗治疗组对于肺组织的损伤要轻于平阳霉素。
CD34和Ki67是细胞增殖的标志物[15]。免疫组织化学检测不同处理组裸鼠血管瘤组织中CD34和Ki67的蛋白表达情况表明,不同浓度雷珠单抗治疗组及平阳霉素治疗组裸鼠血管瘤组织CD34和Ki67蛋白表达明显下降,且雷珠单抗浓度越高,下降越明显,0.75mg/cm3的雷珠单抗治疗组和平阳霉素治疗组效果最明显。不同浓度雷珠单抗治疗组与平阳霉素治疗组比较,裸鼠血管瘤组织CD34和Ki67蛋白表达基本接近。上述结果表明,雷珠单抗治疗后,血管瘤组织中细胞增殖明确受到抑制,并且其抑制作用基本相当。
总之,本研究表明,利用细胞注射法建立裸鼠皮下血管瘤模型的方法是切实可行与成熟的。对比平阳霉素,雷珠单抗治疗皮下结缔组织血管瘤病变,通过阻碍血管内皮生长因子通路,抑制异常增生血管瘤组织细胞的增生作用是显著的,且均不影响对于生命相关的循环、消化及泌尿系统,而对于肺组织的损伤要轻于平阳霉素。对于改善及预防其严重并发症,类胰岛素生长因子(IGF-1)、丙二醇甲醚醋酸酯(PMA)等细胞生长因子信号通路激活药物是否有效,需要后期进一步研究。
[1]郑家伟,杨秀娟.血管瘤的治疗选择[J].中国实用口腔科杂志,2009,2(5):274-279.
[2]曹程程,张莉,李旭文,等.增生期血管瘤的个性化治疗[J].中华全科医学,2015,13(1):30-32,90.
[3]Papadopoulos N,Martin J,Ruan Q,et al.Binding and neutralization of vascular endothelial growth factor(VEGF)and related ligands by VEGF Trap,ranibizumab and bevacizumab[J].Angiogenesis,2012,15(2):171-185.
[4]Heussen FM,Shao Q,Ouyang Y,et al.Clinical outcomes after switching treatment from intravitreal ranibizumab to aflibercept in neovascular age-related macular degeneration[J].Graefes Arch Clin Exp Ophthalmol,2014,252(6):909-915.
[5]Hutton-Smith LA,Gaffney EA,Byrne HM,et al.A Mechanistic Model of the Intravitreal Pharmacokinetics of Large Molecules and the Pharmacodynamic Suppression of Ocular Vascular Endothelial Growth Factor Levels by Ranibizumab in Patients with Neovascular Age-Related Macular Degeneration[J].Mol Pharm,2016,13(9):2941-2950.
[6]Stewart MW.Pharmacokinetics,pharmacodynamics and preclinical characteristics of ophthalmic drugs that bind VEGF[J].Expert Rev Clin Pharmacol,2014,7(2):167-180.
[7]Phung TL,Hochman M.Pathogenesis of infantile hemangioma[J].Facial Plast Surg,2012,28(6):554-62.
[8]Sakai T,Okano K,Kohno H,et al.Three-year visual outcomes of intravitreal ranibizumab with or without photodynamic therapy for polypoidal choroidal vasculopathy[J]. Acta Ophthalmol,2016,94(8):e765-e771.
[9]Campochiaro PA,Sophie R,Pearlman J.Long-term outcomes in patients with Retinal Vein Occlusion treated with Ranibizumab the RETAIN study[J].Ophthalmology,2014,121(1):209-219.
[10]Patrao NV,Antao S,Egan C,et al.Real-World Outcomes of Ranibizumab Treatment for Diabetic Macular Edema in a United Kingdom National Health Service Setting[J].Am J Ophthalmol,2016,172:51-57.
[11]Parodi MB,Iacono P,Papayannis A,et al.Intravitreal rani-bizumab for pigment epithelium detachment with subfoveal occult choroidal neovascularization:a prospective 24-month case series[J].Am J Ophthalmo,2013,155(1):103-108.
[12]Iacono P,Parodi MB,Papayannis A,et al.A new treatment algorithm for the management of myopic choroidal neovascularization using intravitreal ranibizumab[J].Acta Ophthalmol,2015,93(6):e519-e520.
[13]Luke J,Nassar K,Luke M,et al.Ranibizumab as adjuvant in the treatment of rubeosis iridis and neovascular glaucoma-results from a prospective interventional case series[J].Graefes Arch Clin Exp Ophthalmol,2013,28(7):2403-2413.
[14]刘超,秦中平,魏奉才,等.细胞注射法和组织块移植法在构建血管瘤动物模型中的比较[J].山东大学学报(医学版),2012,50(5):46-50.
[15]徐贤绸,温培楠,王兆洪,等.大黄素治疗裸鼠胰腺癌肝转移瘤的实验研究[J].浙江中西医结合杂志,2014,24(3):207-210.
(收稿:2017-02-22 修回:2017-05-20)
Inhibition of Vascular Endothelial Growth Factor A by Ranibizumab in Subcutaneous Hemangiomas in Nude Mice
HUANG Chongqing1,YU Guanfeng1,HUANG Jingyong1,MA Pengyan1,WAN Li2,FAN Lianghao3.1
Department of Vascular Surgery,2 Department of Pathology,3 Department of Interventional Therapy,the First Affiliated Hospital of Wenzhou Medical University,Wenzhou,325015,China
ObjectiveTo investigate the relative efficacy and side effects of ranibizumab competitive combined with vascular endothelial growth factor A(VEGF-A)in inhibiting subcutaneous hemangioma in nude mice.Methods Thirty animal model was established by injecting hemagioma cells(EOMA,1×107/mL,200μL)to subcutaneous tissue of nude mice.The nude mice were divided into 5 groups,with 6 mice in each.Drugs were given after 9 daysincubation of EOMA.Group A∶control group,without drug therapy.Group B∶group of injection with 0.25mg/cm3ranibizumab.Group C∶group of injection with 0.5mg/cm3ranibizumab.Group D∶injection of 0.75mg/cm3ranibizumab.Group E∶drug control group,injection of 1mg/cm3pingyangmycin.Tumor growth was observed and the body weight of mice was measured after treatment.Immunohistochemistry was used to detect the expression of CD34 and Ki67 in tumor tissue and HE staining was applied to observe the pathology of Lung,heart,liver and renal tissues of mice.ResultsTumor grew the fastest during 9 to 12 days.On day 12,15,18,21 and 24,the tumor volume was reduced in Group B,C,D,E compared with that in Group A(day 12∶44.44±13.11mm3,45.71±7.69mm3, 35.37±11.96mm3,41.44±3.75mm3vs 61.91±17.09mm3,all P<0.05;day 15∶52.16±13.28mm3,48.18±14.46mm3, 33.52±9.97mm3;47.22±10.86mm3vs 72.98±14.85mm3,all P<0.05;day 18∶56.50±6.96mm3,51.56±11.10mm3,36.57± 18.79mm3,51.36±5.21mm3vs 95.58±19.10mm3,all P<0.01;day 21∶62.88±9.76mm3,60.34±12.80mm3,39.45± 18.47mm3,54.95±4.37mm3vs 123.46±18.03mm3,all P<0.01;day 24∶70.85±8.73mm3,69.84±16.33mm3,41.83± 18.65mm3,61.52±8.12mm3vs 171.76±52.46mm3,all P<0.01);compared with Group E,the anti-tumor effect in Group D was more obvious at each time point(all P<0.05).The expression of CD34 and Ki67 protein in tumor tissue of nude mice in Group B~E was significantly decreased as compared to Group A;the decrease appeared to be in a dose-dependent manner in Group B~D.After treatment,the lung tissue of nude mice was damaged in different degrees in every group;however,the damage in Group D was the less;no pathological changes were observed in other tissues in every group.ConclusionRanibizumab can obviously inhibit the growth of hemangioma, which may be related to its downregulation of CD34 and Ki67 in tumor tissue and ranibizumab has less damage to the lung tissue than Pingyangmycin does.
nude mice;hemangioma;VEGF-A;ranibizumab;pingyangmycin
book=747,ebook=16
浙江省温州市公益性社会发展科技项目(No.Y20160407)
温州医科大学附属第一医院血管外科(黄崇青、虞冠锋、黄景勇、麻朋艳)、病理科(万丽)、介入科(范良好)(温州325015)
黄崇青,Tel:0577-55579133;E-mail:christopherhuang@qq.com
