槐杞黄颗粒对MRL/Lpr狼疮肾小鼠Th17细胞的影响及机制研究
2017-09-25汪卫于健宁陶筱娟
汪卫 于健宁 陶筱娟
槐杞黄颗粒对MRL/Lpr狼疮肾小鼠Th17细胞的影响及机制研究
汪卫 于健宁 陶筱娟
目的探讨槐杞黄颗粒对MRL/Lpr狼疮肾小鼠Th17细胞的影响以及相关机制。方法正常饲养C57BL/6小鼠8只为空白对照组,8~10周龄MRL/Lpr狼疮小鼠24只,随机分为模型组、槐杞黄颗粒治疗组和地塞米松治疗组,每组8只。MRL/Lpr狼疮小鼠12周龄左右开始发病,分别给予槐杞黄颗粒或地塞米松治疗,检测各组处理前后24h尿蛋白定量,血清TGF-β、IL-17含量,肾脏RORC mRNA表达水平。结果与模型组比较,地塞米松组和槐杞黄组小鼠治疗后尿蛋白含量明显下降[(245.87±47.25)mg/L、(333.18±22.19)mg/L比(474.69±48.76)mg/L,P<0.05];与空白组比较,地塞米松组、槐杞黄组TGF-β和IL-17均升高[TGF-β:(262.69±23.53)ng/L、(352.05±26.77)ng/L比(166.12±36.44)ng/L,P<0.01;IL-17:(265.25±44.29)pg/mL、(317.33±46.83)pg/mL比(172.03±45.21)pg/mL,P<0.05,P<0.01];与模型组比较,地塞米松组、槐杞黄组TGF-β和IL-17明显降低[TGF-β:(262.69±23.53)ng/L、(352.05±26.77)ng/L比(593.84±35.02)ng/L,P<0.01;IL-17:(265.25±44.29)pg/ mL、(317.33±46.83)pg/mL比(602.13±58.30)pg/mL,P<0.01];与空白组比较,模型组肾脏Th17细胞比例和细胞数、RORC mRNA表达量显著上升[Th17比例:(8.62±0.77)%比(0.05±0.02)%,P<0.01;Th17细胞数:(8.62±0.77)104/mL比(0.05±0.02)104/mL,P<0.01;RORC mRNA:(11.08±0.89)比(1.00±0.05),P<0.01];与模型组比较,地塞米松组、槐杞黄组肾脏Th17细胞比例和细胞数、RORC mRNA表达显著下降[Th17比例:(0.15±0.04)%、(4.06±0.43)%比(8.62±0.77)%,P<0.01;Th17细胞数:(0.15±0.04)104/mL、(4.06±0.43)104/mL比(8.62±0.77)104/mL,P<0.01;RORC mRNA:(3.67± 0.39)、(5.53±0.49)比(11.08±0.89),P<0.01]。结论槐杞黄颗粒能减少狼疮肾小鼠尿蛋白排出,调节Th17细胞分化,其机制可能与下调RORCmRNA表达有关。
MRL/Lpr狼疮小鼠;系统性红斑狼疮;槐杞黄;地塞米松;肾损伤;Th17细胞
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种常见而复杂的自身免疫性疾病,主要是因免疫耐受失衡导致的T细胞应答失调和B淋巴细胞功能亢进,使体内产生和沉积多种自身抗体和免疫复合物,从而引起组织损伤[1]。研究表明,Th17细胞数量和/或功能异常与SLE发生、发展密切相关[2-5]。Th17是一种重要的促炎性细胞,参与自身免疫性疾病,也是其主要致病性细胞[5-6]。TGF-β、IL-6和IL-23可促进Th17细胞的分化发育[7]。槐杞黄颗粒是由槐耳菌丝、枸杞子、黄精制成的颗粒剂,具有益气养阴功效。槐杞黄的主要有效成分槐耳富含PS-T(槐耳菌质多糖),已证实PS-T可明显增强机体细胞免疫应答,具有免疫调节、抗肿瘤及抗病毒等功能[8]。槐耳菌还能诱生免疫调节剂—TH1类细胞因子[9-10]。目前SLE无特异性的治疗方法。槐杞黄颗粒在系统性红斑狼疮的研究尚无文献报道,其机制也不清楚。本文通过MRL/Lpr狼疮小鼠模型,研究槐杞黄颗粒是否是通过其对Th17的调节从而起到改善狼疮小鼠肾损伤的作用。
1 材料与方法
1.1 实验动物SPF级MRL/lpr自发系统性红斑狼疮狼疮样模型小鼠24只,正常C57BL/6小鼠8只,雌性8~10周龄,购自广东省医学实验动物中心,由国家遗传工程小鼠资源库暨南京大学模式动物研究所提供,实验动物许可证号:SYXK(粤)2008—0002。环境温度稳定于20~26℃,湿度40%~70%,采用10h:14h昼夜自动循环交替照明。
1.2 药物及试剂槐杞黄颗粒购自盖天力药业有限公司,地塞米松购自Sigma,TGF-β、IL-17试剂盒购自慧嘉生物科技有限公司,FITC标记山羊抗小鼠lgG(H+L)购自碧云天公司(批号A0568),IgG单抗购自Abcam(批号Ab6785),C3单抗购自Santa cruz(批号Sc-28294),Anti-Mouse CD3 APC购自Biole-gend(批号100235),Anti-Mouse CD8 PE购自Bio-legend(批号100707),Anti-Mouse/Rat IL-17A FITC购自Ebioscience(批号11-7177-80),胎牛血清购自GIBCO(批号16000-044),RMPI-1640购自Hyclone(批号SH30809.01B),PMA购自Sigma(P1585),钙离子霉素购自Solarbio(18800-1mg),Monensin(蛋白转运抑制剂)购自Beyotime(CAS22373-78-0)。
1.3 仪器Thermo公司Multiskan MK3型全自动酶标仪,Leica公司DM6000B型荧光显微镜,BD公司Accuri C6型流式细胞仪(flow cytometry,FCM),IMS图象分析系统,ABI 7300 Real-time PCR仪器。
1.4 方法
1.4.1 分组及给药24只MRL/Lpr狼疮小鼠,按随机数字表法随机分为槐杞黄组、地塞米松组和模型组,各8只。正常C57BL/6小鼠8只为空白对照组。MRL/Lpr狼疮小鼠12周龄左右开始发病,槐杞黄组予槐杞黄颗粒4g/kg灌胃,每天1次;地塞米松组予地塞米松2.5mg/kg灌胃,每天1次;模型组给予生理盐水灌胃,每天1次。各组均连续灌胃15天。
1.4.2 24h尿蛋白检测考马斯亮蓝(CBB法)检测24h尿蛋白,G250具有红色和青色两种色调,在游离状态下,呈红色型,一旦与蛋白质结合即变为青色,色素的最大吸收波长从465nm转移到595nm。测定595nm处光密度值,即可进行定量。按照试剂盒说明书进行操作。

表1 RT-PCR引物
1.4.3 用酶联免疫吸附法(Elisa)测定血清TGF-β、IL-17含量各组小鼠灌胃结束后,摘取眼球法取各组小鼠外周血,室温血液自然凝固10~20min,离心20min左右(2000~3000rpm/min),仔细收集上清,按照试剂盒说明书进行操作。
1.4.4 肾单核细胞悬液制备采用颈椎脱臼法处死小鼠,75%酒精中浸泡10~15min;无菌分离肾脏,放入PBS溶液中清洗2遍;然后加入适量培养基;将剪碎后的组织经200目滤网过滤,得到肾细胞悬液;加入与细胞悬液等量体积的淋巴细胞分离液,之后将细胞悬液轻轻加到离心管的淋巴细胞分离液上层;离心完毕后吸取中间白膜层即为单个核细胞;培养基进行洗涤1次后,用红细胞裂解液去除红细胞;再次用培养基进行洗涤1次,重悬后进行细胞计数;调整细胞浓度为1×106/mL,接种于24孔板中,加入PMA300ng/mL,200μL和离子霉素1μg/mL,加入RMPI-1640至1000μL充分混匀后,置于37℃,5% CO2的培养箱培养1h,取出后加入浓度为2μmol/L的蛋白质转运抑制剂莫能菌素200μL,之后放入37℃,5%CO2的细胞培养箱中培养6h;buffer洗涤之后离心弃上清,沉淀用buffer重悬。
1.4.5 Th17细胞检测单核细胞计数后调整细胞浓度为106/mL。设置14个检测管:阴性对照管;同型对照管;CD3单标管;CD8单标管;IL-17单标管;CD3和CD8双标管;CD3+CD8+IL-17三标管;4℃避光孵育1~2h。IL-17单标管和CD3+CD8+IL-17三标管进行3000rpm,10min离心,弃上清,沉淀用PBS溶液洗涤2次,洗涤后的细胞沉淀用0.5mL FIX buffer重悬,放置4℃固定30min;其他检测管可进行上机检测;固定结束后,IL-17单标管和CD3+CD8+IL-17三标管每管分别用0.5mL Permeabilization and Wash buffer洗涤两次;洗涤结束后,IL-17单标管和CD3+ CD8+IL-17三标管每管分别加入0.5mL Permeabilization and Wash buffer,放置4℃破膜30min;破膜后,IL-17单标管和CD3+CD8+IL-17三标管每管分别加入IL-17抗体5μL;4℃避光孵育1h。流式细胞仪上机检测。
1.4.6 RT-PCR检测细胞总RNA提取后消除总RNA中的DNA,然后进行反转录。反应程序:37℃,60min;85℃,5min;4℃,5min;置于-20℃保存。Realtime PCR扩增反应体系:12.5μL SYBRGreen Mix,0.5μL上游引物F,0.5μL下游引物R,2μL cDNA模板,总体积25μL;反应程序:95℃,10min;(95℃,15s;60℃,45s)×40;95℃,15s;60℃,1min;95℃,15s;60℃,15s;数据结果采用ABI Prism 7300 SDS Software仪器软件分析,结果数据采用2-△△CT法进行分析。引物序列见表1。
1.4.7 统计学方法应用SPSS19.0统计软件进行数据分析,所有数据以均值±标准差() 表示,两组均数比较采用t检验,多组间两两比较采用单因素方差分析(One-way ANOVA)LSD法(最小显著性法),P<0.05为差异有统计学意义,并采用GraphPad Prism 6软件对结果绘制图。
2 结果
2.1 各组小鼠治疗前后24h尿蛋白定量比较空白对照组、模型组治疗前后尿蛋白含量无显著变化(P>0.05);地塞米松组、槐杞黄组小鼠治疗后尿蛋白含量明显下降(P<0.01,P<0.05);地塞米松组、槐杞黄组小鼠治疗后尿蛋白含量明显低于模型组(P<0.05),见表2。
表2 各组小鼠治疗前后24h尿蛋白含量比较(mg/L,)
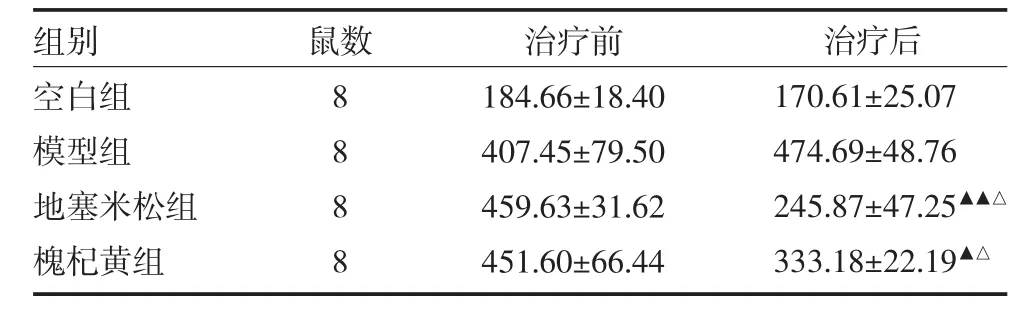
表2 各组小鼠治疗前后24h尿蛋白含量比较(mg/L,)
注:与治疗前比较,▲P<0.05,▲▲P<0.01;与模型组比较,△P<0.05
组别空白组模型组地塞米松组槐杞黄组鼠数8 8 8 8治疗前184.66±18.40 407.45±79.50 459.63±31.62 451.60±66.44治疗后170.61±25.07 474.69±48.76 245.87±47.25▲▲△333.18±22.19▲△
2.2 各组小鼠血清TGF-β、IL-17含量比较与空白组比较,模型组、地塞米松组、槐杞黄组小鼠血清TGF-β、IL-17含量显著升高(P<0.05,P<0.01);与模型组比较,地塞米松组、槐杞黄组小鼠血清TGF-β、IL-17含量显著降低(P<0.01),见表3。
表3 各组小鼠血清TGF-β、IL-17含量比较()

表3 各组小鼠血清TGF-β、IL-17含量比较()
注:与空白组比较,*P<0.05,**P<0.01;与模型组比较,△△P<0.01
组别空白组模型组地塞米松组槐杞黄组鼠数8 8 8 8 TGF-β(ng/L)166.12±36.44 593.84±35.02** 262.69±23.53**△△352.05±26.77**△△IL-17(pg/mL)172.03±45.21 602.13±58.30** 265.25±44.29*△△317.33±46.83**△△
2.3 各组小鼠肾脏Th17细胞比例及细胞数比较与空白组比较,模型组小鼠肾脏Th17细胞比例和细胞数显著上升(P<0.01);经地塞米松和槐杞黄颗粒治疗后,狼疮小鼠肾脏Th17细胞比例和细胞数显著下降(P<0.01)。见图1~2。
2.4 各组小鼠肾脏RORC mRNA表达与空白组比较,模型组狼疮小鼠肾脏单核细胞维甲酸相关孤儿受体(retinoic acid related orphan receptor,RORC)mRNA表达量显著上升(P<0.01);经地塞米松和槐杞黄颗粒治疗后,狼疮小鼠肾脏单核细胞RORC mRNA表达显著下调(P<0.01),见图3。
3 讨论
SLE确切的病因及发病机制尚不十分清楚。研究[11]表明,CD4+T细胞在SLE自身免疫反应以及器官损害方面发挥重要作用。调节性T(regulatory cells,Treg)细胞和Th17细胞作为特殊的T细胞亚群,其失衡在SLE的发病机制中起到重要的作用。实验[12]证明,Treg细胞和Th17细胞失衡与自身免疫性疾病特别是SLE的发生发展密切相关。Treg细胞在体内外都具有免疫抑制功能,能够控制免疫应答的强度,减轻对机体组织损伤。Treg细胞通过抑制效应T细胞的活化增殖达到机体的免疫耐受和预防自身免疫性疾病的作。Th17细胞被认为是一群重要的介导炎症反应的细胞,是一种特定的CD4+T细胞亚群,主要是分泌促炎因子IL-17[12]。同时也可分泌其他细胞因子如IL-17F、IL-21、IL-22、粒细胞-巨噬细胞集落刺激因子(GM-CSF)、肿瘤坏死因子(TNF-α)等。IL-17主要是通过促进中性粒细胞聚集,诱导细胞释放前炎症因子,在宿主抗细菌感染免疫中发挥重要作用。而IL-17的表达异常与慢性炎性疾病、自身免疫性疾病有着密切的关联[13]。

图1 各组小鼠肾脏Th17细胞流式检测结果(CD4+IL-17+标记Th17细胞)
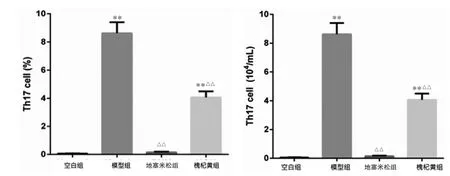
图2 各组肾脏中Th17细胞比例及细胞数

图3 各组小鼠肾脏单核细胞RORC mRNA转录水平
近年研究表明,Th17细胞在SLE的致病过程中发挥重要作用。在狼疮小鼠模型中已证实,Th17细胞与狼疮的发生密切相关。Stanus等[14]在BXD2狼疮小鼠模型中研究发现,脾Th17细胞数目均异常升高,分离的初始CD4+T细胞在体外培养中更易于分化为Th17细胞。2000年Wong等[15]报道,华人SLE患者的外周血Th17细胞明显升高,并和SLE疾病活动性指数(SLEDAI)之间呈正相关。Ambrosi等[16]报道,在狼疮鼠模型和SLE患者中的研究表明Th17细胞通过分泌前炎性因子IL-l7使其在推动疾病的进程中发挥着重要作用。本研究通过对MRL/lpr自发系统性红斑狼疮模型研究发现,模型组小鼠24h尿蛋白定量下降,提示HQH能减少狼疮小鼠蛋白尿的排除;相比空白对照组,模型组小鼠血清TGF-β、IL-17含量都显著上升(P<0.001);经地塞米松及槐杞黄颗粒治疗后,小鼠血清TGF-β、IL-17含量不同程度下调(P<0.01)。说明槐杞黄颗粒能抑制MRL/lpr自发系统性红斑狼疮小鼠TGF-β表达,从而使得初始CD4+T细胞不向Th17细胞分化,转而向调节性T细胞分化成为可能。同时地塞米松及槐杞黄颗粒治疗后,小鼠血清IL-17下降,也证实CD4+T细胞向Th17分化减少。各组肾脏Th17细胞检测结果显示,相比正常组小鼠,未治疗狼疮小鼠肾脏中Th17细胞比例和细胞数显著上升(P<0.01);经地塞米松和槐杞黄颗粒治疗后,狼疮小鼠肾脏Th17细胞比例和细胞数显著下降(P<0.01)。进一步证实,槐杞黄颗粒通过抑制TGF-β的表达,从而减少CD4+T细胞向Th17细胞分化,使得Th17细胞比例减少,降低SLE疾病活动性指数(SLEDAI),减缓SLE的发生。本研究也与武青等[17]的研究结果一致[18]。
维甲酸相关孤儿受体是Th17细胞的特异性转录因子,调控着Th17细胞的分化和发育[18-19],控制Th17细胞效应性细胞因子IL-17的表达。Th17细胞分泌的最主要细胞因子是IL-17A,在初始T细胞内转入编码RORC的逆转录病毒可诱导Th17细胞分泌IL-17。研究表明,当小鼠敲除RORC基因后,IL-17表达下降[19-20],Th17细胞数量也相应减少[19]。另外,Th17与Treg细胞的分化成熟分别受其上游转录因子RORC及Foxp3基因表达水平调控[21]。初始T细胞在IL-6、TGF-β以及转录因子RORC的参与下能够被诱导分化成Th17细胞[22]。本研究结果表明,狼疮小鼠肾脏单核细胞RORC mRNA表达量较空白对照组小鼠显著上升(P<0.01);经地塞米松和槐杞黄颗粒治疗后,狼疮小鼠肾脏单核细胞中RORC mRNA的表达显著下调(P<0.01)。说明槐杞黄颗粒可以通过抑制RORC表达,从而降低其对CD4+T向Th17的分化趋势,使得Th17细胞减少,从而起到对SLE的治疗作用。
综上所述,槐杞黄颗粒可以抑制TGF-β和RORC表达,同时抑制TGF-β和IL-6联合诱导的Th17细胞的分化趋势,降低Th17细胞比例,减少IL-17表达,减缓SLE的发生,减轻MRL/lpr自发系统性红斑狼疮小鼠肾脏损害,对系统性红斑狼起到一定的治疗和缓解作用。
[1]La CA.T-regulatory cells in systemic lupus erythematosus[J].Lupus,2008,17(5):421-425.
[2]Conti G,Coppo R,Amore A.Pathogenesis of systemic lupus erythematosus[J].2012,29 Suppl,54(5):S84-90.
[3]Heo YJ,Joo YB,Oh HJ,et al.IL-10 suppresses Th17 cells and promotes regulatory T cells in the CD4+,T cell population of rheumatoid arthritis patients[J].Immunol Lett,2010,127(2):150-156.
[4]Lin FJ,Jiang GR,Shan JP,et al.Imbalance of regulatory T cells to Th17 cells in IgA nephropathy.Scandinavian[J]. JClin Lab Inv,2012,72(3):221-229.
[5]Cua DJ,Sherlock J,Chen Y,et al.Interleukin-23 rather than interleukin-12 is the critical cytokine for autoimmune inflammation of the brain[J].Nature,2003,421(6924):744-748.
[6]Brembilla NC,Chizzolini C.T cell abnormalities in systemic sclerosis with a focus on Th17 cells[J].Eur Cytokine Netw,2012,23(4):128-139.
[7]Abdulahad WH,Boots AMH,Kallenberg CGM.FoxP3+CD4+ T cells in systemic autoimmune diseases:The delicate balance between true regulatory T cells and effector Th-17 cells[J].Rheumatology,2010,50(4):646-656.
[8]陈慎宝,丁如宁.槐耳菌质成分对小鼠免疫功能的影响[J].食用菌学报,1995,2(1):21-25.
[9]陆慧瑜,张巧玲,蒋小云,等.槐杞黄对IgA肾病大鼠蛋白尿及肾组织nephrin及podocin的影响[J].中华妇幼临床医学杂志(电子版)2009,5(5):458,465.
[10]孙楠.槐杞黄颗粒治疗小儿哮喘60例临床观察[J].中国现代医生,2010,48(2):36-44.
[11]Lewis JE,Fu SM,Gaskin F.Autoimmunity,end organ damage,and the origin of autoantibodies and autoreactive T cells in systemic lupus erythematosus[J].Discov Med,2013,15(81):85-92.
[12]Park H,Li Z,Yang XO,et al.A distinct lineage of CD4 T cells regulates tissue inflammation by producing interleukin 17[J].Nat Immuno,2005,6(11):1133-1141.
[13]Gaffen SL.Recent advances in the IL-17 cytokine family[J].CurrOpin in Immunol,2011,23(5):613-619.
[14]Stanus AL.Interleukin 17-producing T helper cells and interleukin 17 orchestrate autoreactive germinal center development in autoimmune BXD2 mice[J].Nat Immunol,2008,9(2):166-175.
[15]Wong CK,Lit LC,Tam LS,et al.Hyperproduction of IL-23 and IL-17 in patients with systemic lupus erythematosus:implications for Th17-mediated in-flammation in auto-immunity[J].Clin Immunol,2008,127(3):385-393.
[16]Ambrosi A,Espinosa A,Wahren-Herlenius M.IL-17:a new actor in IFN-driven systemic autoimmune diseases[J].Eur J Immunol,2012,42(9):2274-2284.
[17]武青.槐杞黄颗粒对过敏性紫癜性肾炎大鼠蛋白尿及肾组织TGF-β1表达的影响[D].南京中医药大学,2015.
[18]Lee WW,Kang SW,Choi J,et al.Regulating human Th17 cells via differential expression of IL-1 receptor[J].Blood,2010,115(3):530-540.
[19]Ivanov II,Mckenzie BS,Liang Z,et al.The orphan nuclear receptor RORgammat directs the differentiation program of proinflammatory IL-17+T helper cells[J].Cell,2006,126(6):1121-1133.
[20]Manel N,Unutmaz D,Littman DR.The differentiation of human T(H)-17 cells requires transforming growth factorbeta and induction of the nuclear receptor RORgammat[J].Nat Immunol,2008,9(6):641-649.
[21]Chen Z,Lin F,Gao Y,et al.FOXP3 and RORγt:transcriptional regulation of Treg and Th17[J].Int Immunopharmacol,2011,11(5):536-542.
[22]Zhou L,Lopes JE,Chong MM,et al.TGF-beta-induced Foxp3 inhibits T(H)17 cell differentiation by antagonizing RORgammat function[J].Nature,2008,453(7192):236-240.
(收稿:2017-05-06 修回:2017-05-16)
Effect of Huaiqihuang Granule on Th17 Cells of MRL/Lpr Mice with Lupus Nephritis and Its Underlying Mechanisms
WANG Wei,YU jianning,TAO xiaojuan.Department of Rheumatology,Immune&Nephrology,
Hangzhou Red Cross Hospital,Hangzhou(310003),China
ObjectiveTo investigate the effect of Huaiqihuang(HQH)on Th17 cells of MRL/Lpr mice with lupus nephritis.MethodsEight normal 8-10 weeks C57BL/6 mice were fed as blank control group.MRL/Lpr lupus erythematosus mice were randomly arranged to three groups∶model group,HQH treated group,dexamethasone(DXM)treated group.After the appearance of clinical symptoms at 12 weeks age,Mrl/lpr mice were treated with HQH or dexamethasone.The levels of 24h urine protein quantitation,TGF-β,IL-17,and RORC mRNA and the proportion of TH17 in CD4+T cells of each group were detected before and after treatment.ResultsAfter treatment compared with model group,DXM group and HQH group had decreased 24h urinary protein content(245.87± 47.25mg/L and 333.18±22.19mg/L vs 474.69±48.76mg/L,P<0.05);compared with blank group,DXM and HQH groups had increased TGF-β and IL-17(TGF-β∶262.69±23.53ng/L and 352.05±26.77ng/L vs 166.12±36.44ng/L,P<0.01;IL-17∶265.25±44.29pg/mL and 317.33±46.83pg/mL vs 172.03±45.21pg/mL,P<0.05);compared with model group,DXM group and HQH group had decreased TGF-β and IL-17 contents TGF-β∶(262.69±23.53)ng/L and 352.05±26.77ng/L vs 593.84±35.02ng/L,P<0.01;IL-17∶265.25±44.29pg/mL and 317.33±46.83pg/mL vs 602.13± 58.30pg/mL,P<0.01);compared with blank group,the proportion of Th17 cells and the cell number and renal mRNA expression of RORC in model group significantly increased[the proportion of Th17∶(8.62±0.77)%vs(0.05± 0.02)%,P<0.01;Th17 cell number∶(8.62±0.77)×104/mL vs(0.05±0.02)×104/mL,P<0.01;RORC mRNA∶(11.08± 0.89)vs(1.00±0.05),P<0.01];compared with model group,the proportion of Th17 cells and the cell number and the renal mRNA expression of RORC in DXM group and HQH group significantly reduced[the proportion of Th17∶(0.15±0.04)%and(4.06±0.43)%vs(8.62±0.77)%,P<0.01;Th17 cell number∶(0.15±0.04)×104/mL and(4.06± 0.43)×104/mL vs(8.62±0.77)×104/mL,P<0.01;RORC mRNA∶(3.67±0.39)and(5.53±0.49)vs(11.08±0.89),P<0.01].ConclusionHQH can decrease the excretion of proteinuria and regulate the differentiation of Th17 cells, which may be related to the down regulation of RORC mRNA expression.
MRL/lpr lupus mice;systemic lupus erythematosus;huaiqihuang;dexamethasone;renal injury;th17 cells
book=739,ebook=8
杭州市科技计划项目(No.20140733Q25)
杭州市红十字会医院风湿免疫肾内科(杭州310003)
陶筱娟,Tel:13336098114;E-mail:93731496@qq.com
