高脂膳食对超重和肥胖小鼠血清和脂肪组织内源性大麻素系统的影响
2017-09-23田倩倩孙顺利刘向云杨亚兵王秋灵孙向东
杨 钦,田倩倩,孙顺利,刘向云,杨亚兵,王秋灵,孙向东,李 娜,刘 微,王 茹
YANG Qin,TIAN Qian-qian,SUN Shun-li,LIU Xiang-yun,YANG Ya-bing,WANG Qiu-ling,SUN Xiang-dong,LI Na,LIU Wei,WANG Ru
高脂膳食对超重和肥胖小鼠血清和脂肪组织内源性大麻素系统的影响
杨 钦,田倩倩,孙顺利,刘向云,杨亚兵,王秋灵,孙向东,李 娜,刘 微,王 茹
YANG Qin,TIAN Qian-qian,SUN Shun-li,LIU Xiang-yun,YANG Ya-bing,WANG Qiu-ling,SUN Xiang-dong,LI Na,LIU Wei,WANG Ru
目的:探讨高脂膳食诱导下,不同肥胖程度小鼠血清内源性大麻素(endocannabinoids,EC)、脂肪组织大麻素受体、合成酶和降解酶的变化趋势及其机制。方法:6周龄C57BL/6J雄性小鼠随机分为对照组(n=25,喂食普通饲料)和高脂诱导组(n=205,喂食D12492高脂饲料,脂肪提供热量占60%),诱导时间10周。对照组随机挑选10只平均体重记为X(g);高脂诱导组按体重分类标准分4组(每组随机挑选10只):抵抗组(X×0.9<体重≤X×1.1)、超重组(X×1.1<体重≤X×1.2)、肥胖组(X×1.2<体重≤X ×1.5)和严重肥胖组(体重>X×1.5)。采用高效液相色谱法检测血清大麻素含量,荧光定量PCR检测脂肪组织大麻素受体、合成酶和降解酶表达变化。结果:1) 从对照组、超重组、肥胖组到严重肥胖组,血清大麻素平均水平依次升高,但只有严重肥胖组血清2-AG、AEA和OEA与对照组相比显著升高(P<0.01,P<0.05和P<0.05)。2)(超重+肥胖+严重肥胖组)VS对照组,脂肪组织大麻素受体CB1,CB2 mNRA表达下降(P<0.05和P<0.05),2-AG合成酶DAGLβ表达上升(P<0.01)。3)将超重、肥胖和严重肥胖组小鼠综合起来分析发现,血清2-AG与体重(P=0.004,r=0.586)和内脏脂肪量(P=0.001,r=0.647)均呈中度正相关,而血清AEA仅与内脏脂肪量呈正相关(P=0.034,r=0.453)。4)内脏脂肪量与脂肪组织2-AG合成酶ABHD4(P=0.022,r=-0.466)、DAGLβ(P=0.019,r=-0.475)、降解酶ABHD6(P=0.000,r=-0.738)、MAGL(P=0.012,r=-0.505)、AEA和OEA的共同降解酶NAAA(P=0.003,r=-0.586)mRNA表达呈负相关。结论:高脂诱导下,超重、肥胖和严重肥胖组小鼠血清循环大麻素水平依次升高,脂肪组织大麻素受体CB1表达依次下降,大麻素合成酶与降解酶与内脏脂肪量均呈负相关。因此我们推测:对于相同诱导时间下的不同肥胖程度小鼠,大麻素合成酶表达下调的速度低于降解酶和CB1受体的下调速度,使得循环大麻素水平升高,这些因素共同促成了肥胖相关的外周ECS活化。
高脂膳食;内源性大麻素系统;2-AG;AEA;OEA;肥胖
前言
内源性大麻素系统(The Endocannabinoid System,ECS)是一种广泛存在于细胞间的信号传导系统,在中枢神经系统保护、奖赏系统激活、摄食促进、能量平衡调节、体重维持及镇痛方面起重要作用[3,12]。
第一代大麻素受体亚型I(Cannabinoid Receptor 1,CB1)抑制剂利莫那班(Rimonabant)可显著改善超重、肥胖和II型糖尿病患者糖脂代谢紊乱的实验提示[4,17]:抑制CB1对治疗这些疾病有效,但ECS是一个复杂的系统,其与肥胖的因果关系并不清楚。比较一致的研究认为,肥胖者外周血循环大麻素水平是升高的[2,6],但CB1表达尚无定论[2,6,15,23]。大麻素底物合成增加、大麻素受体和合成酶表达上调、降解酶表达下调均可以促成ECS的活化。研究发现,肥胖者ECS活化与脂肪量变化密切相关,其脂肪组织大麻素降解酶脂肪酸酰胺水解酶(Fatty Acid Amide Hydrolase,FAAH)表达下降,并且与外周血循环大麻素水平呈现显著的负相关关系[6]。此外,大麻素合成酶N-酰基磷脂酶D(N-acylphosphatidylethanolamine phospholipase D,NAPE-PLD)对脂肪形成过程有显著影响[9]。这些结果表明,作为重要的能量存储器官,肥胖者脂肪组织与ECS活化密切相关。那么,相同的高脂诱导时间下,处于超重、肥胖和严重肥胖状态的小鼠脂肪组织ECS表达如何变化?目前有关研究甚少。
鉴于此,本研究首先探讨高脂膳食引起的体重增长过程中,主要的3种大麻素2-花生四烯酸甘油酯(2-Arachidonoylglycerol,2-AG)、花生四烯酸乙醇胺(Anandamide,AEA)和油酰乙醇胺(N-Oleylethanolamine,OEA)在外周循环血的变化;然后分析脂肪组织大麻素受体、合成酶和降解酶的表达变化,并探讨ECS与体重、体脂之间的相关性。结合ECS随体重增长所发生的变化来分析其活化机制。
1 材料和方法
1.1 建立高脂诱导的肥胖小鼠模型
首先构建高脂饮食诱导肥胖小鼠模型。6周龄C57BL/6J雄性小鼠(体重20.26±1.38g)由上海第二军医大学实验动物中心提供,普通饲料适应性喂养1周后,随机分为对照组(n=25,喂食普通饲料)和高脂诱导组(n=205,喂食D12492高脂饲料,脂肪提供热量占60%,Research Diet公司),自由饮水饮食,诱导时间10周。对照组随机挑选10只平均体重记为X;高脂诱导组按体重变化分4组(每组随机挑选10只):高脂诱导-抵抗组(n=10,X×0.9<体重≤X×1.1)、高脂诱导-超重组(n=10,X ×1.1<体重≤X×1.2)、高脂诱导-肥胖组(n=10,X×1.2<体重≤X ×1.5)和高脂诱导-严重肥胖组(n=10,体重>X×1.5),体重分组参照人类体重评判标准[20,21]。各组小鼠摘眼球取血后,颈椎脱臼法处死取材,脂肪组织(包括双侧肾周和附睾脂肪)一部分存放于4%多聚甲醛溶液,另一部分-80℃保存。计算体脂率[体脂率=(左右肾周脂肪+左右附睾脂肪)/体重×100%]。
1.2 血清EC测定
血清大麻素送至第二军医大学药学院实验室测定(质谱仪:AB Sciex Triple Quad 6500+,液相:Eksigent microLC 200 plus)。色谱柱:HaLO TM C18(2.7 μm,90A,0.5×50 mm);流动相:A-水溶液,B-乙腈溶液;液相条件:20%A~80%B洗脱10 min,流速为40 μl/min;进样量2 μl,柱温为35℃。质谱条件:CUR 35V, IS +5 500V, CAD 10V,TEM 550℃, Gas1 55V, Gas2 55V;MRM:2-AG 定量离子对为379.3/287.3,CE为20V,DP为 104V;AEA定量离子对为348.3/62.0,CE为35V,DP为130V;OEA定量离子对为300.1/62.0,CE为18,DP为112V。
1.3 血糖血脂测定
采用ELISA试剂盒测定小鼠空腹血糖含量(Fasting Blood-Glucose,FBG,Catalog:CK-E00592M,R&D公司)。采用微孔板分光光度仪(BioTek Instructents公司)测定甘油三酯(Triglycerides,TG,Catalog:K622-100,BioVision公司)、高/低密度脂蛋白胆固醇(High/Low Density Lipoprotein Cholesterol,H/LDL-C,Catalog:MAK045,Sigma公司)含量。
1.4 Real Time PCR
冰上取脂肪组织约50mg,加入1ml Trizol(Lot:117206,invitrogen公司),先用75%酒精处理剪刀,再用DEPC (Diethyl Pyrocarbonate,焦碳酸二乙酯)处理水浸泡后剪碎组织,机械匀浆打碎,按说明书方法提取组织总RNA。采用微孔板分光光度仪(BioTek Instructents)测定RNA浓度和OD260/280的值。按照反转录试剂盒(catalog:K1622,Thermo Scientific公司)和荧光定量试剂盒(Lot:16385700,Roche公司)说明书进行逆转录和PCR上机操作(ABI StepOne Plus,Applied Biosystems公司),引物序列见表1,以GAPDH作为内参引物。

表1 RT-PCR引物序列Table 1 Primer Sequences Used for Real-time PCR
1.5 数据统计
各检测数据录入Excel 2013,结果以平均数±标准差(±SD)表示。组间两两比较采用SPSS19.0软件进行独立样本t检验,多组间比较采用单因素方差分析(ANOVA);采用Pearson积差相关分析探讨变量之间相关性。
2 结果
2.1 高脂诱导下小鼠形态学指标与血糖、血脂变化
从诱导第4周起,高脂膳食小鼠体重与对照组出现显著性差异(P<0.01);到第10周结束时,共有148只小鼠体重大于对照组平均值的20%,诱导肥胖成功率为72.20%(图1A)。图1B显示了不同肥胖程度小鼠的体重变化过程。进一步的分析表明(图1C),高脂诱导下小鼠体重增加主要表现在体脂率的增加。此外,HE染色显示,抵抗组小鼠附睾脂肪组织细胞大小与对照组差别不大,而超重、肥胖、严重肥胖小鼠脂肪细胞则较大(图1D)。表2显示,高脂引起小鼠空腹血糖(P<0.05)、高密度脂蛋白胆固醇(P<0.01)和低密度脂蛋白胆固醇(P<0~0.05)显著升高。这表明,高脂诱导引起的体重增长过程中,小鼠出现肥胖相关的糖、脂代谢紊乱。
由于高脂诱导-抵抗组小鼠体重并未显著增加,其内源性大麻素系统转录表达亦与超重、肥胖和严重肥胖组表达趋势有所不同。因此,本研究在分析高脂诱导的体重增加过程中ECS表达变化时,并未纳入抵抗组小鼠,选取超重、肥胖、严重肥胖组小鼠综合起来作为高脂诱导组,对照组仍不变。
2.2 肥胖小鼠血清EC含量比较
图2显示,高脂诱导组与对照组相比,小鼠血清大麻素平均水平呈现升高趋势,但未达到统计学意义(图2A)。当小鼠处于严重肥胖状态时,3种主要的大麻素2-AG、AEA和OEA水平均比对照组显著升高(图2 B,P<0.01,P<0.05和P<0.05)。ANOVA分析显示,严重肥胖组2-AG水平比超重组和肥胖组都高,差异具有统计学意义(P<0.05)。对于高脂诱导组,小鼠血清2-AG含量与体重和内脏脂肪量均呈正相关(P<0.01);而AEA仅与内脏脂肪量呈正相关(P<0.05)。这种相关关系提示,循环大麻素水平与内脏脂肪量存在密切联系,同时脂肪组织也是ECS活化的重要部位,因此,我们接下来分析了脂肪组织EC相关受体、合成酶及降解酶的表达趋势。
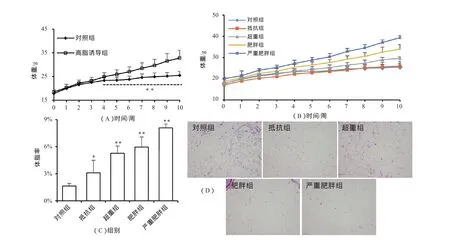
图1 高脂诱导下小鼠形态学指标变化示意图Figure 1. Morphological Changes of Mice Fed on High Fat Diet
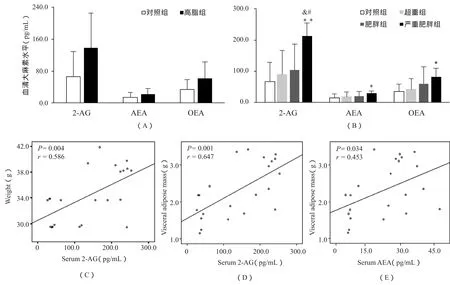
图2 不同肥胖程度小鼠血清大麻素比较及其与体重体脂的相关性分析示意图Figure 2. Comparison of Serum Endocannabinoid Levels and Their Relation with Body Weight and Visceral Adipose Mass among Varying Degrees of Obese Mice
2.3 高脂诱导下小鼠脂肪组织EC受体、合成酶和降解酶转录表达
本研究分析的脂肪组织ECS包括:1)大麻素受体及其类似物:CB1、CB2、GPR18(G Protein-Coupled Receptor 18)、GPR55、GPR119、TRPV1(Transient Receptor Potential Cation Channel Subfamily V Member 1)、PPARδ/β (Peroxisome Proliferator Activated Receptors δ/β);2)大麻素合成酶:DAGLα/β(Diacylglycerol Lipase α/β)、NAPE-PLD和ABHD4(α/ β-Hydrolase 4);3)大麻素降解酶:ABHD6、ABHD12、MAGL(Monoacylglycerol Lipase)、FAAH和NAAA(N-Acylethanolamine Acid Amidase)。这些基因在脂肪组织的表达趋势并不相同,部分表达无变化,或者表达丰度的基因未列出。图3(A)显示,与对照组相比,高脂诱导组CB1、CB2表达显著下调,而2-AG的合成酶DAGLβ显著上调。图3(B)显示,随着体脂含量增加(即从超重到严重肥胖的递增过程中),CB1、PPARδ、ABHD6表达呈下调趋势;DAGLβ、MAGL、NAAA则是先上调后下调;而CB2表达则是先下调后趋于正常;FAAH表达尽管趋势不一,但在超重组和严重肥胖组均表现出显著下调趋势。这提示ECS各成分,在肥胖的不同形成阶段,其表达变化亦各有特点。
2.4 高脂诱导小鼠脂肪组织EC受体、合成酶、降解酶表达与脂肪量的相关性分析

图3 不同肥胖程度小鼠肾周脂肪组织EC受体、合成酶及降解酶表达分析柱状图Figure 3. Expression of Endogenous Cannabinoid Receptors,Synthetic Enzyme and Degrading Enzyme among Varying Degrees of Obese Mice
图4(A)显示,在高脂诱导引起的体重增加过程中,CB2 mRNA相对表达水平与内脏脂肪量呈正相关(P<0.01);而ABHD4、DAGLβ、ABHD6、MAGL、NAAA mRNA相对表达水平分别与内脏脂肪量呈负相关(P<0.05,图4B~F)。结果提示,随肥胖加重,脂肪组织CB2介导的炎症过程可能加重;而EC合成酶,降解酶下调提示,大麻素合成能力与降解能力均下降。
3 分析与讨论
本研究首次观察了高脂诱导下,不同体脂的小鼠内源性大麻素系统在外周血和脂肪组织的表达情况。结果发现,1)随高脂诱导的体重增加,血清大麻素2-AG、AEA和OEA水平均出现升高趋势,且2-AG、AEA与小鼠体脂呈正相关关系,而对照组不存在这种关系;2)对于超重、肥胖和严重肥胖小鼠,脂肪组织大麻素受体CB1、CB2表达下调,2-AG合成酶DAGLβ表达上调;随肥胖程度加重,大麻素受体CB1、PPARδ和降解酶ABHD6表达不断下调; 3)大麻素受体CB2表达与内脏脂肪量呈正相关,而合成酶ABHD4、DAGLβ、降解酶ABHD6、MAGL、NAAA表达与脂肪量均呈负相关。这些结果提示,在肥胖形成过程中,机体ECS各成分变化并不相同,尽管CB1表达不断下调,2-AG合成酶DAGLβ的整体上调和降解酶ABHD6的持续下调,可能是促成肥胖ECS活化的重要原因,而严重肥胖组外周血3种大麻素的显著升高,则是ECS合成酶与降解酶表达紊乱的综合结果。
研究认为,肥胖者体内中枢和外周ECS均处于活化状态,这种活化与循环大麻素水平、大麻素受体、合成酶和降解酶表达变化均有相关[6,12]。尽管肥胖者血清循环大麻素水平升高已被验证,但随肥胖加重,不同种类的血清大麻素如何变化及其原因并无研究。机体肝脏、脂肪组织、骨骼肌、胰腺均存在一套完整的ECS系统[18],这些组织的器官大麻素水平可能对血清循环大麻素含量产生影响,而大麻素合成酶与降解酶表达异常,可能是大麻素升高的直接原因。在高脂膳食引起的肝脏ECS活化过程中,FAAH表达下降,被认为是肝脏AEA增多的重要原因[16]。鉴于循环大麻素含量与内脏脂肪量存在的显著相关关系,我们推测,脂肪组织可能是循环大麻素的来源之一,脂肪组织大麻素合成酶与降解酶的表达变化,同样可能与脂肪量存在相关关系。
肥胖者外周循环2-AG和AEA均有升高[6,14],这两者是研究最为广泛的大麻素,2-AG与CB1亲和力不如AEA,但2-AG含量比AEA高很多,因此,被认为是ECS发挥正常生理功能的主要大麻素。AEA可促进脂肪细胞分化,引起PPARγ和CB1表达上调[11],并促进脂形成;OEA与PPARα和CB2的结合,一方面促进白色脂肪棕色化和产热,另一方面,可减弱TNF-α诱导的炎症[10.19.22]。由此可见,OEA的生理功能与2-AG和AEA是相反的。尽管高脂诱导下,3种主要的大麻素均有升高趋势,这可能是外周ECS活化的重要表现。但仅有2-AG在不同组别间有显著性差异,这提示,随肥胖加重,2-AG的变化趋势更为明显,其合成酶DAGLβ在整个高脂诱导过程中的上调,则与循环2-AG上升对应。2-AG与体重和体脂的正相关关系与前人研究一致,同一份研究还发现,2-AG与肥胖者胰岛素水平呈正相关,与葡萄糖输注率呈负相关[2],这些结果暗示,在肥胖不断加重的过程中,2-AG与脂肪量增加和胰岛素抵抗的形成有着密切关系。
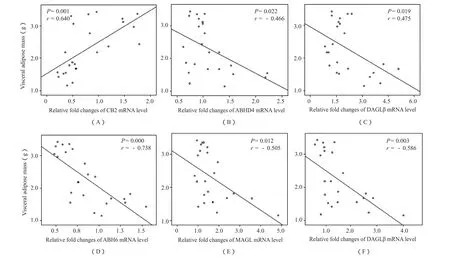
图4 EC相关酶与内脏脂肪量的相关性分析示意图Figure 4. Correlation Analysis of the Endocannabinoid System Related Enzyme and Visceral Adipose Mass
CB1是研究最多的大麻素受体,但CB1在脂肪组织表达却无定论,认为表达升高、不变、降低的结果均存在[2]。尽管CB1受体抑制剂利莫那班可减少肥胖者摄食、增加能量消耗、减轻体重[4],但最新研究提示,CB1受体的持续活化状态并不会引起肥胖或糖尿病[13]。这说明,CB1受体活化不是导致肥胖的主因,同时提示,ECS是伴随着肥胖形成而被激活的。综合血清循环大麻素水平变化,我们推测,在肥胖形成并不断加重的过程中,外周循环大麻素的升高速度强于CB1受体的下调强度,导致了外周ECS的活化。
CB2受体表达在超重组下降最多,随后趋于正常,并且CB2表达与内脏脂肪量呈显著正相关,这提示,CB2介导的炎症和胰岛素抵抗[5],伴随着肥胖进程而不断加重。在高脂诱导肥胖过程中,CB2抑制可改善高脂膳食引起的胰岛素抵抗[1],本研究超重阶段的CB1表达下调,很可能也是机体通过CB2下调来改善胰岛素抵抗的适应性调节,随肥胖加重,这种适应性调节被打破,CB2表达又呈现上调趋势。PPARδ活化可诱导脂肪酸分解代谢和适应性产热所需的基因表达[7],随肥胖进展,PPARδ表达不断下调,但OEA含量却不断增多,因此,OEA-PPARδ信号的促脂肪分解功能是否受到抑制仍需进一步实验证实。
随后,我们分析了脂肪组织大麻素相关合成酶与降解酶表达变化。2-AG的合成酶包括ABHD4和DAGL-α/β,降解酶有ABH6和MAGL;AEA和OEA的合成酶包括NAPEPLD,降解酶包括ABHD12、FAAH和NAAA[8]。DAGLβ表达上升提示,2-AG合成增多;但ABHD4和DAGLβ均与内脏脂肪量呈负相关,这从另一方面提示,随肥胖程度加重,2-AG合成增加的速度减慢。这同样可能是体重增加过程中,机体对DAGLβ表达过高的一种应激性调节。ABHD6、MAGL、FAAH、NAAA均是大麻素降解相关酶[8],但其表达并不一致。MAGL与NAAA表达均是先上升后下降,提示,两者对高脂诱导的敏感性较高,在超重时期即显著上调;ABHD6则是持续下调,并且ABHD6、MAGL和NAAA均与内脏脂肪量呈显著负相关,这些结果提示,高脂诱导对脂肪组织EC合成酶与降解酶的影响并不一致;脂肪量越多,脂肪组织的大麻素降解功能越呈现下降趋势,而这些酶的表达失衡,可能是促成脂肪组织ECS活化的原因之一。
综上所述,本研究认为,在高脂诱导引起的体重增加过程中,ECS系统的活化程度与脂肪量存在密切关联。本研究结果提示,脂肪组织ECS活化是伴随着肥胖而发生的,是肥胖相关代谢紊乱引起的连带效应,而不是先于肥胖发生。根据以上结果,我们认为,肥胖者ECS活化主要表现在循环大麻素水平的升高,而这种异常与脂肪组织大麻素合成酶和降解酶表达失衡相关。尽管两种酶都与脂肪量负相关,大麻素合成酶下调速度低于降解酶的下调速率,促成了大麻素水平的升高。该研究将有助于深层次理解肥胖者脂肪组织ECS活化机制,为寻找以ECS为靶点的减控体重方法提供科学依据。
[1] AGUDO J,MARTIN M,ROCA C,et al. Deficiency of CB2 cannabinoid receptor in mice improves insulin sensitivity but increases food intake and obesity with age [J]. Diabetologia,2010,53(12):2629-2640.
[2] BLUHER M,ENGELI S,KLOTING N,et al. Dysregulation of the peripheral and adipose tissue endocannabinoid system in human abdominal obesity [J]. Diabetes,2006,55(11):3053-3060.
[3] D’ADDARIO C,MICIONI DI BONAVENTURA M V,PUCCI M,et al. Endocannabinoid signaling and food addiction [J]. Neurosci Biobehav Rev,2014,(47):203-224.
[4] DESPRES J P,GOLAY A,SJOSTROM L,et al. Effects of rimonabant on metabolic risk factors in overweight patients with dyslipidemia [J]. N Engl J Med,2005,353(20):2121-2134.
[5] DEVEAUX V,CADOUDAL T,ICHIGOTANI Y,et al. Cannabinoid CB2 receptor potentiates obesity-associated inf l ammation,insulin resistance and hepatic steatosis [J]. PLoS One,2009,4(6):e5844.
[6] ENGELI S,BOHNKE J,FELDPAUSCH M,et al. Activation of the peripheral endocannabinoid system in human obesity [J]. Diabetes,2005,54(10):2838-2843.
[7] EVANS R M,BARISH G D, WANG Y X. PPARs and the complex journey to obesity [J]. Nat Med,2004,10(4):355-361.
[8] GAMELIN F X,AUCOUTURIER J,IANNOTTI F A,et al. Effects of chronic exercise on the endocannabinoid system in Wistar rats with high-fat diet-induced obesity [J]. J Physiol Biochem,2016,72(2):183-199.
[9] GEURTS L,EVERARD A,VAN HUL M,et al. Adipose tissue NAPE-PLD controls fat mass development by altering the browning process and gut microbiota [J]. Nat Commun,2015,6:6495.
[10] GUZMAN M,LO VERME J,FU J,et al. Oleoylethanolamide stimulates lipolysis by activating the nuclear receptor peroxisome proliferator-activated receptor alpha (PPAR-alpha) [J]. J Biol Chem,2004,279(27):27849-27854.
[11] KARALIOTA S,SIAFAKA-KAPADAI A,GONTINOU C,et al. Anandamide increases the differentiation of rat adipocytes and causes PPARgamma and CB1 receptor upregulation [J]. Obesity(Silver Spring),2009,17(10):1830-1838.
[12] LI C,JONES P M,PERSAUD S J. Role of the endocannabinoid system in food intake,energy homeostasis and regulation of the endocrine pancreas [J]. Pharmacol Ther,2011,129(3):307-320.
[13] MARCUS D J,ZEE M L,DAVIS B J,et al. Mice Expressing a“Hyper-Sensitive” Form of the Cannabinoid Receptor 1 (CB1)Are Neither Obese Nor Diabetic [J]. PLoS One,2016,11(8):e0160462.
[14] MARTINS C J,GENELHU V,PIMENTEL M M,et al. Circulating Endocannabinoids and the Polymorphism 385C>A in Fatty Acid Amide Hydrolase (FAAH) Gene May Identify the Obesity Phenotype Related to Cardiometabolic Risk:A Study Conducted in a Brazilian Population of Complex Interethnic Admixture [J]. PLoS One,2015,10(11):e0142728.
[15] MORENO-NAVARRETE J M,CATALAN V,WHYTE L,et al. The L-alpha-lysophosphatidylinositol/ GPR55 system and its potential role in human obesity [J]. Diabetes,2012,61(2):281-291.
[16] OSEI-HYIAMAN D,LIU J,ZHOU L,et al. Hepatic CB1 receptor is required for development of diet-induced steatosis,dyslipidemia,and insulin and leptin resistance in mice [J]. J Clin Invest,2008,118(9):3160-3169.
[17] PI-SUNYER F X,ARONNE L J,HESHMATI H M,et al. Effect of rimonabant,A cannabinoid-1 receptor blocker,on weight and cardiometabolic risk factors in overweight or obese patients:RIO-North America:A randomized controlled trial [J]. JAMA,2006,295(7):761-775.
[18] SPOTO B,FEZZA F,PARLONGO G,et al. Human adipose tissue binds and metabolizes the endocannabinoids anandamide and 2-arachidonoylglycerol [J]. Biochimie,2006,88(12):1889-1897.
[19] SUAREZ J,RIVERA P,ARRABAL S,et al. Oleoylethanolamide enhances beta-adrenergic-mediated thermogenesis and white-tobrown adipocyte phenotype in epididymal white adipose tissue in rat [J]. Dis Model Mech,2014,7(1):129-141.
[20] SUN H,MA Y,HAN D,et al. Prevalence and trends in obesity among China’s children and adolescents,1985-2010 [J]. PLoS One,2014,9(8):e105469.
[21] SVEGER T,LINDBERG T,WEIBULL B,et al. Nutrition,overnutrition,and obesity in the fi rst year of line in Malmo,Sweden [J]. Acta Paediatr Scand,1975,64(4):635-640.
[22] XU X,GUO H,JING Z,et al. N-Oleoylethanolamine reduces in-fl ammatory cytokines and adhesion molecules in TNF-alpha-induced human umbilical vein endothelial cells by activating CB2 and PPAR-alpha[ J]. J Cardiovasc Pharmacol,2016:68(4):280-291.
[23] YAN Z C,LIU D Y,ZHANG L L,et al. Exercise reduces adipose tissue via cannabinoid receptor type 1 which is regulated by peroxisome proliferator-activated receptor-delta [J]. Biochem Biophys Res Commun,2007,354(2):427-433.
Effects of High Fat Diet on Endocannabinoid System in Serum and Adipose Tissue of Overweight and Obese Mice
Objective:To explore the changes of endocannabinoids,related receptor,synthetic enzyme and degrading enzyme in mice of different obese status via high fat diet. Methods:C57BL/6J male mice were randomly divided into control group (n=25,fed normal diet) and high fat diet group(n=205,fed D12492,60% fat). For further experiments,10 mice were randomly selected from control group and recorded average body weight(BW) as X(g);for mice fed on high fat diet,four groups were divided:resistant group (X×0.9<BW≤X×1.1);overweight group (X×1.1<BW≤X×1.2);obese group (X×1.2<BW≤X×1.5);severe obese group (BW>X×1.5). High performance liquid chromatography (HPLC) and RT-PCR were used to detect endocannabinoids levels and expression of related endogenous cannabinoid receptors,synthetic enzyme and degrading enzyme,respectively. Results:1) from control group to severe obese group,serum endocannabinoids increased successively,however,only 2-AG,AEA and OEA in severe group were signif i cantly higher than control group (P<0.01,P<0.05 andP<0.05). 2) for overweight,obese and severe group mice,adipose CB1,CB2 mRNA level were lower than control group(P<0.05 andP<0.05),while 2-AG synthetic enzyme DAGLβ mRNA level were higher than control group (P<0.01). For overweight,obese and severe group mice,3) serum2-AG showed moderate positive correlation with BW (P=0.004,r=0.586) and visceral adipose mass (P=0.001,r=0.647);while serum AEA were positively correlated with visceral adipose mass (P=0.034,r=0.453) only. 4) visceral adipose masswere negatively correlated with synthetic enzyme ABHD4(P=0.022,r=-0.466),DAGLβ(P=0.019,r=-0.475),degrading enzyme ABHD6(P=0.000,r=-0.738),MAGL (P=0.012,r=-0.505) and NAAA (P=0.003,r=-0.586) mRNA level. Conclusion:serum endocannabinoids increased successively as body weight increased during high fat diet induced obesity,while adipose tissue CB1 mRNA level showed a downward trend. Moreover,both endocannabinoid synthase and degrading enzymes showed negatively correlation with visceral adipose mass. Therefore,we conclude that for mice of different obese degrees under the same HFD induction time,descending rate of cannabinoid synthase is lower than descending rate of degrading enzymes and adipose CB1 expression level,which contributes to the rise of circulating endocannabinoids and fi nally activates the peripheral ECS.
high fat diet;endocannabinoid system;2-AG;AEA;OEA;obesity
G804.7
A
1002-9826(2017)05-117-08
10. 16470/j. csst. 201705014
2016-10-17;
2017-05-20
国家自然科学基金面上资助项目(81472148) 。
杨钦,男,在读博士研究生,主要研究方向为低氧、运动营养与健康促进,Email:yangqinsus@163.com。
王茹,女,副教授,博士,博士研究生导师,主要研究方向为运动免疫学、运动营养学、低氧与健康促进,Email:wangru0612@163.com。
上海体育学院,上海 200438 Shanghai University of Sport,Shanghai 200438,China.
