干燥时间对枣多酚得率和抗氧化活性的影响
2017-09-22张泽炎张海生
张泽炎,张海生,2*
1(陕西师范大学 食品工程与营养科学学院,陕西 西安,710119) 2 (陕西省果蔬深加工技术研究中心,陕西 西安,710062)
干燥时间对枣多酚得率和抗氧化活性的影响
张泽炎1,张海生1,2*
1(陕西师范大学 食品工程与营养科学学院,陕西 西安,710119) 2 (陕西省果蔬深加工技术研究中心,陕西 西安,710062)
通过高效液相色谱法和体外抗氧化活性法研究了50 ℃热风干燥对狗头枣和冬枣多酚得率和体外抗氧化活性的影响。检测了粗多酚得率,没食子酸、原儿茶酸、绿原酸、咖啡酸、对香豆酸、阿魏酸、芦丁、肉桂酸和槲皮素含量,以及粗多酚清除DPPH·能力和总还原力的变化情况。结果表明,狗头枣多酚得率从9.205 mg/g(干燥0 h)下降到8.833 mg/g(干燥48 h),对应条件下新鲜冬枣多酚得率从32.188 mg/g下降到26.315 mg/g。干燥处理过程中,狗头枣中的9种单体酚总量随干燥时间延长而减少;冬枣中对应的单体酚总量随干燥时间延长呈先增加后减少趋势。体外抗氧化试验中,狗头枣和冬枣多酚的抗氧化能力分别在干燥24、12 h时高于各自组别中其他处理组,并且冬枣的抗氧化能力强于狗头枣。最终确定市面干制的狗头枣(干物质量为70.19%)直接用于多酚的提取,冬枣经50 ℃热风干燥(干物质量为80.36%)12 h后用于提取多酚。
干燥时间;枣多酚;高效液相色谱;抗氧化活性
枣(Zizyphus jujuba mill)为鼠李科枣属植物的果实。一般认为枣的主要功能性营养成分有环腺苷酸、枣多糖、枣多酚、氨基酸等[1-2]。枣多酚组成丰富,具有较高的抗氧化活性[3]、保肝、增强体内抗氧化酶活性、预防心肌损伤和氧化损伤等[4-6]功效。枣多酚属于热敏性活性成分,原料的预处理方式对枣多酚的提取有重要影响。
烘房干燥是目前鲜枣加工过程中的常用方式之一[7],其可以降低产品重量、减少贮藏和运输成本并延长货架期,同时也是提高枣的商品价值的重要途径。枣需经过长时间的干燥处理以控制产品水分含量在适当范围,因此,选择适宜的干燥时间对于枣中多酚的提取极为重要。本文研究干燥时间对枣多酚得率和活性的影响情况,并在此基础上采用HPLC法分析枣多酚的主要组分,及其体外抗氧化活性。考虑到多酚类物质极易氧化变性的特性和干燥时的能耗等情况,本文以干制的狗头枣、新鲜冬枣为对比原料,采用50℃热风干燥法[8-9],研究干燥时间对枣总酚含量、单体酚含量及其活性的变化规律。
1 材料与方法
1.1试验材料
狗头枣、冬枣,购于西安市朱雀农副产品批发市场。
多酚标准品:没食子酸、原儿茶酸、绿原酸、咖啡酸、对香豆酸、阿魏酸、芦丁、肉桂酸、槲皮素、三氟乙酸、福林酚试剂、TPTZ、DPPH,均购于Sigma公司;其他试剂均为分析纯。
1.2主要试验仪器
BS 224S电子天平,北京赛多利斯仪器系统有限公司;GZX-9146数显鼓风干燥箱,上海博讯实业有限公司医疗设备厂;HR2864型飞利浦三合一搅拌机,珠海经济特区飞利浦家庭电器有限公司;722型紫外可见分光光度计,上海光谱仪器有限公司;高效液相色谱系统:Breeze1525型,美国Waters公司,Diamonsil (2) HPLC C18色谱分析柱(250 mm×4.6 mm,5 μm)。
1.3多酚的提取
参照GB 5009.3—2010中的直接干燥法测量计算枣的干物质含量。
将切碎的枣(4 mm×4 mm×4 mm)若干份铺平置于数显鼓风干燥箱内,调节温度(50±1)℃,干燥时间分别为0、12、24、36、48 h,得到不同干燥时间处理的样品后即进行枣多酚的提取。
称取干燥处理的样品(10.000 0±0.020 0)g,加入预先准备好的4℃乙醇于搅拌机内粉碎5 min,再将粉碎液转移至500 mL平底烧瓶中,热水浴静置浸提。重复提取2次[10]后,抽滤、合并滤液后于40℃旋转蒸发浓缩至原体积的20%,用蒸馏水定容至100 mL,得样品液。取样品液5 mL于10 mL离心管-60 ℃保存备用。
1.4总酚含量的测定
本文采用Folin-Ciocalteu法[11](FC法)测定枣多酚的含量。为了确定枣多酚的最佳测定波长,在400~900 nm内进行光谱扫描。从图1可看出,在波长为770 nm附近,没食子酸和枣多酚的反应液均出现最大吸收峰,且峰的形状和位置几乎一致。这说明以没食子酸作为多酚测定的标准品可行,多酚提取液中的其他非多酚类物质对多酚含量的测定不会产生较大影响。所以,后续总酚含量测定试验均用没食子酸作为多酚标准品,选用770 nm的波长。
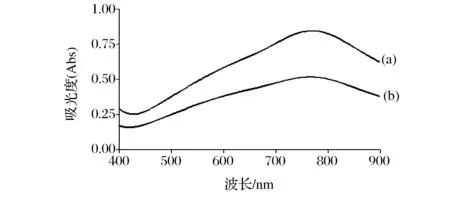
图1 没食子酸反应液(a)和样品提取液(b)反应液波谱扫描Fig.1 Spectrum scanning of distilled liquid of polyphenols and reactive liquid of gallic acid
多酚含量的测定参照文献[11]并稍加修改。精密称取没食子酸25 mg置于25mL棕色容量瓶中定容,得1 mg/mL标准溶液。分别准确吸取该标准溶液0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9 mL于5 mL棕色容量瓶,定容得不同浓度的标准液。取0.2 mL标准液于18 mm×180 mm的试管中,再依次加入2.5 mL稀释10倍的福林酚试剂,2.0 mL 7.5%的Na2CO3溶液。充分摇匀后在室温下避光静置2 h,在770 nm波长处测定吸光度。以没食子酸浓度为横坐标、吸光度为纵坐标绘制标准曲线。试验确定了以没食子酸为标准品的多酚测定标准曲线方程为y=0.005 4x-0.012 9,相关系数R2=0.998 9。式中,y表示样品在770 nm处吸光度值;x表示没食子酸质量浓度(μg/mL)。
将不同处理的样品经提取多酚稀释至适当的浓度后按上述方法测定吸光度值,依据公式(1)计算多酚的含量:
R=(C×V)÷(m×w)
(1)
式中:R为每克枣提取多酚的量,以没食子酸当量计,mg/g;C为根据标准曲线计算出待测液中多酚的质量浓度,mg/mL;V为样品提取液浓缩定容后的体积,mL;m为样品的干重,g;w为样品干物质含量。
1.5单体酚含量的测定
HPLC分析条件如下,流速:0.8 mL/min;进样体积:20 μL;检测波长:280 nm;柱温:20℃;流动相A:体积分数5%甲醇水溶液(含0.1%三氟乙酸);流动相B:色谱甲醇。洗脱条件:0~5 min,0% B;5~30 min,30% B;30~45min,30% B;45~70 min,65% B;70~80 min,100% B。
标准曲线的建立:准确配制2 000 mg/L没食子酸、原儿茶酸、绿原酸、咖啡酸、对香豆酸、阿魏酸、肉桂酸标准溶液和1 000 mg/L芦丁、槲皮素标准溶液。取上述溶液,配制成不同浓度混标,经0.45 μm微孔滤膜过滤,用峰面积(纵坐标)与浓度(横坐标)进行线性回归。结果如表1所示。
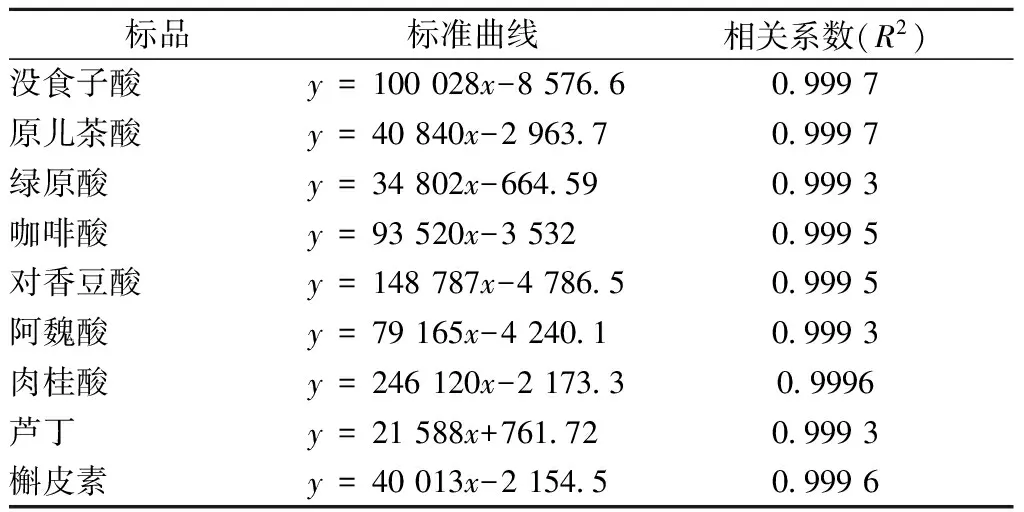
表1 标准品的回归分析
从表1可看出,各组分浓度与峰面积呈良好的线性关系,相关系数r均在0.999 9 以上。因此,采用峰面积定量法对各组分进行定量分析可行。
混标的分离:将样品过0.45 μm微孔滤膜过滤后,采用上述HPLC条件上液相分离混标。
枣经干燥处理后,将提取的样品多酚过0.45 μm微孔滤膜过滤,采用上述HPLC条件上液相分析各样品多酚中的单体酚的含量及其变化情况。
1.6抗氧化活性
1.6.1 枣多酚清除DPPH·能力测定
参照WANG[12]的方法进行。在2.0 mL 100 μmol/L DPPH·溶液(无水乙醇为溶剂)中分别加入1 mL不同浓度枣多酚溶液,用力摇匀后于室温下放置30 min,测定其在517 nm下的吸光度值(AS);以1 mL水代替样品为空白对照(A0); 以1 mL样品与2.0 mL无水乙醇混合液为样品对照(AX),以消除样品本身颜色的影响;以1 mL水与2 mL无水乙醇的混合液调仪器零点。每个样品每个浓度重复3次,取平均值。清除率S按公式(2)计算:
S/% ={[A0-(AS-AX)]/A0}×100
(1)
1.6.2 FRAP法测定枣多酚的还原力
按照BENZIE[13]建立的方法进行。TPTZ工作液的配制参见文献[13]。还原力标准曲线的制作:将2.007 0 mmol/L的FeSO4溶液稀释成不同浓度,取各浓度的FeSO4溶液1 mL,再加入3 mL TPTZ工作液,混匀后于37 ℃反应30 min于593 nm处测定吸光度。得标准曲线方程y=5.263 0x+0.001 4,R2=0.999 6。如图2所示,其中,y为593 nm处吸光度值;x为FeSO4浓度(mmol/L)。
枣多酚还原力的测定:取样品液1 mL,再加入3 mL TPTZ工作液,混匀后于37 ℃反应30 min,于593 nm处测定吸光度。根据吸光度值和还原力标准曲线,计算FeSO4当量浓度。
1.7数据分析
试验中用软件DPS 3.01对相关数据进行统计分析,采用Tukey’s test进行数据的显著性分析方法,p
<0.05为显著。
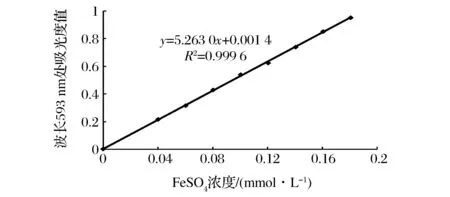
图2 还原力测定标准曲线Fig.2 Standard curve of reductive power
2 结果与分析
2.1干物质含量
干燥处理后的样品枣经常压干燥法测得的干物质含量如表2所示。随着干燥时间延长,样品枣中水分逐渐减少,干物质含量相应增加。
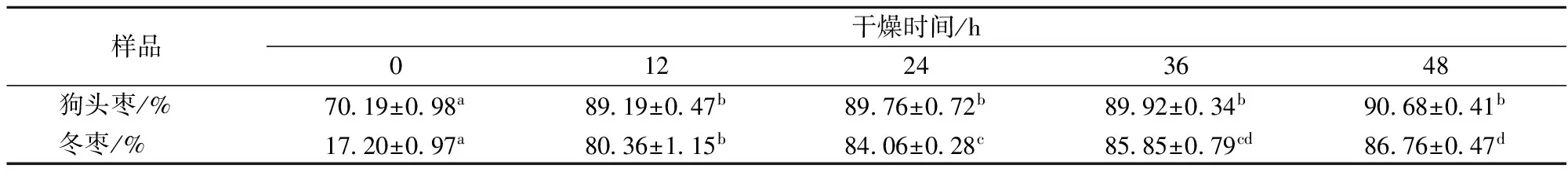
表2 不同干燥时间的样品枣干物质含量
注:标有不同小写字母表示组间差异显著(p<0.05)。
2.2对枣多酚得率的影响
干燥处理后的样品枣,按照方法1.3提取多酚,样品枣多酚得率变化情况如图3所示。
从图3可以看出,随着干燥时间的增加,样品的多酚得率逐渐减少。购买回的狗头枣直接提取时,其多酚得率最高为9.205 mg/g,当干燥48 h后,多酚得率下降到8.833 mg/g,下降了4.04%;新鲜冬枣直接用于提取多酚得率为32.188 mg/g,干燥48h后得率为26.315 mg/g,下降了18.25%。
在前24 h内,狗头枣和冬枣多酚得率随着干燥时间的增加显著下降,在24~48 h,多酚得率缓慢下降。这可能是样品在50℃热风干燥过程中,枣多酚氧化酶催化多酚转化为醌类物质的反应中,前24 h时,多酚迅速向转化为醌类物质的方向进行;在24~48 h,生产的醌类物质已达到一定量,由枣多酚氧化酶催化的可逆反应快接近反应体系的平衡状态,所以催化多酚反应的量减少,因而此时段内多酚得率减少缓慢[14-15]。
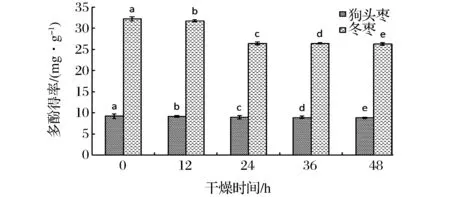
图3 不同干燥时间对多酚得率的影响Fig.3 The effects of yield of jujubepoly phenols from different dried time samples
2.3对枣单体酚得率的影响
枣经干燥处理后,将提取的多酚粗提液上液相色谱检测,所得各组分得率变化结果如图4所示。从图5可知,随着干燥时间的增加,狗头枣总酚中没食子酸、原儿茶酸、绿原酸、咖啡酸得率均呈下降趋势;阿魏酸、槲皮素呈先增加后减少趋势,均在24h时达到峰值;对香豆酸、肉桂酸随干燥时间延长呈增加趋势;但是,芦丁得率却在干燥24 h时达到峰值1.376 5 mg/g,较未干燥处理组提高了28.42%;在24~48 h得率随干燥时间的增加而减少。冬枣总酚中没食子酸、原儿茶酸、绿原酸、咖啡酸、对香豆酸、阿魏酸、芦丁、肉桂酸均呈先增加后减少趋势;槲皮素呈递增趋势。
这可能是在这段干燥时间内原来与其他化合物相结合的部分芦丁转变成了游离态的芦丁,另外部分黄酮类物质转变成了能检测的芦丁,因而芦丁的得率有所增加。而对香豆酸、阿魏酸、肉桂酸、槲皮素这4种单体酚的得率随干燥时间的增加量不显著,这可能是这几种单体酚含量较少,50℃热风干燥对其含量的影响不明显。
同时从图4可以看出,检出的9种单体酚中,狗头枣中芦丁为主要成分,干燥24 h后得率从1.071 9 mg/g上升到1.376 5 mg/g,提高了28.42%;冬枣中咖啡酸、芦丁含量较高,在干燥时间为12、36 h时得率各自达到顶峰10.512 5、9.649 7 mg/g,分别提高了269.8%,273.9%。并且,所检测的9种单体酚中,除了肉桂酸,冬枣中其他单体酚含量均高于狗头枣中的,这可能是从市面上购置的干制狗头枣,在长时间的干制过程中,热敏性多酚已经损失一部分导致[16]。
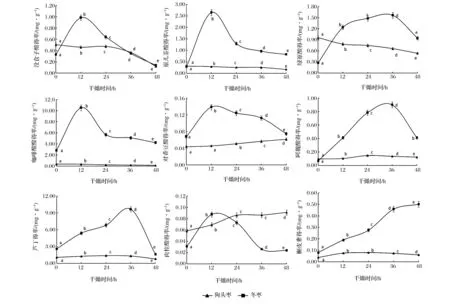
图4 不同干燥时间对枣单体酚含量的影响Fig.4 Free phenolic acids contents from different dried time jujube samples
2.4对枣多酚抗氧化活性的影响
2.4.1 对清除DPPH·能力的影响
DPPH·是一种化学性质较为稳定的以氮为中心的自由基,不易被清除,若受试物能够清除它,则表示受试物具有较强自由基清除能力[17]。从图5可以看出,随着干燥时间的增加,狗头枣多酚与冬枣对DPPH·的清除率呈先增加后降低趋势。在干燥时间为24 h时,狗头枣多酚清除DPPH·的能力较强,IC50为17.012 mg/L,这可能是芦丁的抗氧化活性能力强于其它单体酚的[18],并且在干燥24 h后的枣多酚粗提物中芦丁含量达到最大值,所以在干燥24 h后,狗头枣多酚有较强DPPH·清除能力。而冬枣多酚在干燥时间为12h时,对DPPH·的能力达到最大,而且较狗头枣多酚的强,IC50达到14.97 mg/L,这可能是该处理条件下有较高浓度的咖啡酸(10.513mg/L)和芦丁(5.397 mg/L)。同时从图5可知,冬枣多酚的在较低浓度35.081 mg/L 时对DPPH·的清除能力达到平衡,而狗头枣的为52.635 mg/L,说明冬枣多酚对DPPH·清除能力高于狗头枣的。

表3 不同干燥时间处理多酚的DPPH·清除能力,(IC50) 单位:mg/L
注:标有不同小写字母表示组间差异显著(p<0.05)。
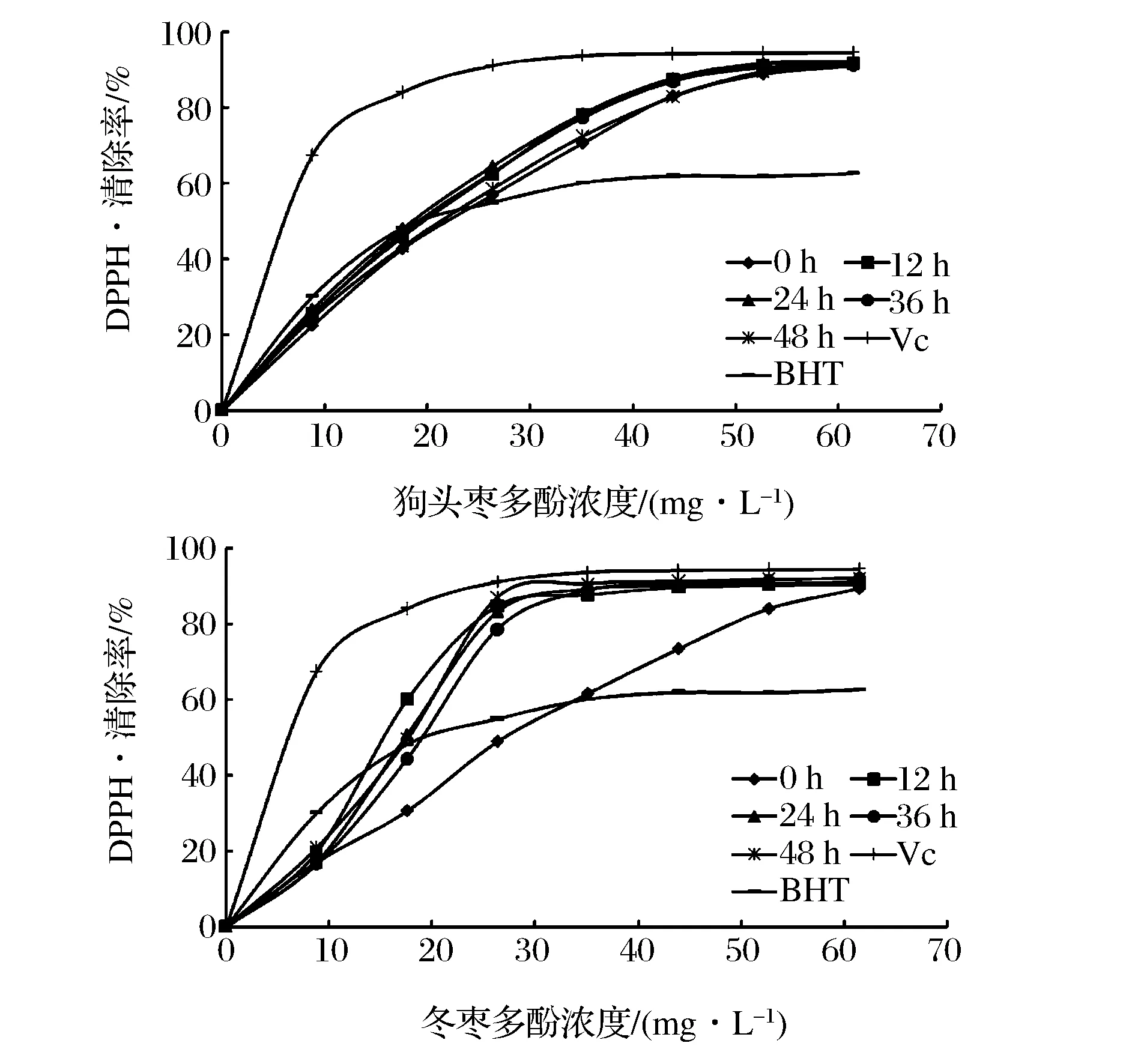
图5 不同干燥时间对枣多酚清除DPPH·能力的影响Fig.5 DPPH· scavenging activity of polyphenols from different dried time jujube samples
2.4.2 对枣多酚的还原力的影响
从图6可知,不同干燥时间的狗头枣和冬枣的多酚粗提液的还原力与其清除DPPH·能力呈现相似的变化情况。随着干燥时间的增加,多酚的还原力均先增加后降低;并且随着多酚浓度的增加,FeSO4当量浓度也在不断增加,即还原力不断增加。狗头枣在干燥时间为24 h时,还原力较强,这可能是芦丁的抗氧化能力强于其他单体酚的[18],并且在干燥24 h后的狗头枣多酚粗提物中芦丁含量达到最大值。干燥时间12h时,冬枣多酚测试浓度为16.5 mg/L对应的FeSO4当量浓度为46.188 mg/L,高于狗头枣(干燥24 h)30.0 mg/L对应的FeSO4当量浓度39.281 mg/L。即干燥12h的冬枣多酚还原力高于干燥24 h狗头枣多酚的还原力。这可能是冬枣中含有较多的咖啡酸、芦丁等单体酚的缘故。
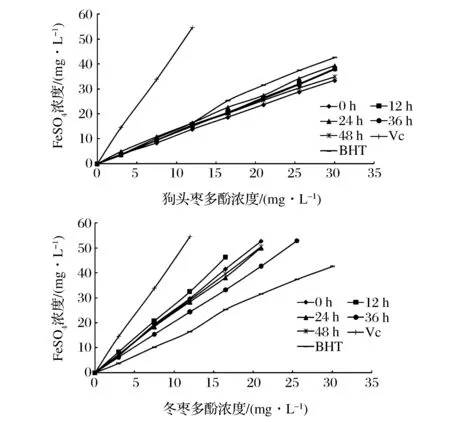
图6 不同干燥时间对枣多酚还原力的影响Fig.6 FRAP values of polyphenols from different dried time jujube samples
3 结论
(1) 在样品的前处理试验中,以狗头枣、冬枣为原料,在50 ℃热风干燥条件下,随着干燥时间的增加,多酚得率均逐渐减小。狗头枣多酚得率从9.205 mg/g(干燥0 h)下降到8.833 mg/g(干燥48 h),下降了4.0%;而对应干燥时间内的新鲜冬枣多酚得率从32.188 mg/g下降到26.315 mg/g,下降了18.3%。
(2) 样品在不同干燥时间处理过程中,狗头枣中芦丁得率呈先增加后减少的趋势,但所测的9种单体酚的总量随干燥时间增加而减少;冬枣中所测的9种单体酚总量随干燥时间的增加呈先增加后减少趋势。
(3) 在不同干燥时间处理样品枣的体外抗氧化试验中,均呈现先增加后减小现象,狗头枣和冬枣多酚的体外抗氧化能力分别在干燥24、12 h时高于各自组别中其他处理组,冬枣的抗氧化能力强于狗头枣。
考虑到干制过程中能源消耗等因素,市面上干制的狗头枣(干物质量为70.19%)直接用于提取多酚,冬枣50 ℃热风干燥12 h作为提取的前处理条件,即可在较高活性的前提下尽可能多地提高多酚得率。
[1] GAO Q H,WU P T,LIU J R,et al. Physico-chemical properties and antioxidant capacity of different jujube (ZiziphusjujubaMill.) cultivars grown in loess plateau of China[J].Scientia Horticulture,2011,130(1): 67-72.
[2] 张艳红,陈兆慧,王德萍,等.枣中氨基酸和矿物质元素含量的测定[J].食品科学,2008,29(1): 263-266.
[3] WANG B N,LIU H F,ZHENG J B,et al.Distribution of phenolic acids in different tissues of jujube and their antioxidant activity[J].Journal of Agricultural Food Chemistry,2011,59(4): 1 288-1 292.
[4] SHEN X C,TANG Y P,YANG R H,et al.The protective effect of Zizyphus jujube fruit on carbon tetrachloride-induced hepatic injury in mice by anti-oxidative activities[J].Journal of Ethnopharmacology,2009,122(3): 555-560.
[5] 郝婕,王艳辉,董金皋.金丝小枣多酚提取物的生理功效研究[J].中国食品学报,2008,8(5): 22-27.
[6] CHENG D,ZHU C Q,CAO J K,et al.The protective effects of polyphenols from jujube peel (Ziziphus Jujube Mill) on isoproterenol-induced myocardial ischemia and aluminum-induced oxidative damage in rats.Food and Chmical Toxicology,2012,50(5): 1 302-1 308.
[7] 陈锦屏.枣烘干技术[M].西安:陕西科技出版社,2000.
[8] 陈锦萍,穆启运,田呈瑞.不同升温方式对烘干枣品质影响的研究[J].农业工程学报,1999,15(3),237-239.
[9] 刘坤.红枣干制过程主要成分变化动力学[D].杨凌:西北农林科技大学,2011
[10] 乔小瑞,烟利亚,刘兴岚,等.荔枝壳多酚提取工艺的响应面法优化及自由基清除活性研究[J].中国食品学报,2010,10(5): 22-30.
[11] VERNON L.SINGLETON,R O,ROSA M. Analysis of total phenols and other oxidation substrates and antioxidants by means of folin-ciocalteu reagent[J].Methods in Enzymology,1999,299: 152-178.
[12] WANG Bi-ni,LIU Hai-feng,ZHENG Jian-bin,et al.Distribution of phenolic acids in different tissues of jujube and their antioxidant activity[J].Journal of Agricultural and Food Chemistry,2011,59(4): 1 288-1 292.
[13] BENZIE I F F,STRAIN J J.The ferric reducing ability of plasma as a measure of “antioxidant power”: the FRAP assay [J].Analytical Biochem,1996,239: 70-76.
[14] 霍瑞贞,刘光东,栗印环.栗子多酚氧化酶催化动力学及抑制机理的研究[J].华南理工大学学报:自然科学版,1999,27(9): 75-80.
[15] 张百刚.红枣多酚氧化酶(PPO)特性及抑制其酶促褐变的研究[M].西安: 陕西师范大学,2006.
[16] WOJDYLOAneta, FIGIEL Adam, LEGUA Pilar,et al.Chemical composition,antioxidant capacity,and sensory quality of dried jujube fruits as affected by cultivar and drying method[J].Food Chemistry,2016,207(15): 170-179.
[17] 李建科,李国秀,赵艳红,等.石榴皮多酚组成分析及其抗氧化活性[J].中国农业科学,2009,42(11): 4 035-4 041.
[18] 金越,吕勇,韩国柱,等.槲皮素及异槲皮素、芦丁抗自由基活性的比较研究[J].中草药,2007,38(3): 408-412.
Dryingtimeontheeffectsofjujubepolyphenolsyieldandit’santioxidantactivity
ZHANG Ze-yan1,ZHANG Hai-sheng1,2*
1 (College of Food Engineering and Nutritional Science,Shaanxi Normal University,Xi′an 710119,China) 2 (Research Center of Fruit and Vegetable Deep-processing Technology,Xi′an 710062,China)
In order to improve the yield of active jujube polyphenol,it’s the yield and antioxidant activity of Goutouzao and Dongzao,dried by different 50℃ hot air drying time,was studied by high performance liquid chromatography method and antioxidant activityinvitro. Test detected the yield of crude polyphenols and it’s ability of scavenging DPPH· and reducing power,as well as the yield of gallic acid,protocatechuic acid,chlorogenic acid,caffeic acid,coumaric acid,ferulic acid,rutin,cinnamic acid and quercetin.The results showed that Goutouzao polyphenol yield fell from 9.205 mg/g (dried 0 h) to 8.833 mg/g (drying 48 h),the yield of fresh Dongzao jujube polyphenol decreased from 32.188 mg/g to 26.315 mg/g under the corresponding conditions.The total amount of nine kinds of free phenolic compound in Goutouzao decreases with drying time.Phenol content decreased first and then increased in Dongzao.The antioxidant capacity in vitro of Goutouzao polyphenols (dried 24h) and Dongzao polyphenols (drying 12 h) were higher than other treatments.Moreover,the latter is stronger than the former.Finally,dried Goutouzao (dry matter content,70.19%) was chosen in polyphenols extraction,polyphenols were extracted after dried by hot air for 12h at 50℃ (dry matter content,80.36%).
drying time; jujube polyphenols; HPLC; antioxidant activity
10.13995/j.cnki.11-1802/ts.012906
硕士研究生(张海生副教授为通讯作者,E-mail:hshzh1965@snnu.edu.cn)。
国家自然科学基金面上项目(31171678)
2016-09-05,改回日期:2016-12-19
