热加工处理对β-乳球蛋白与茶多酚间相互作用的影响
2017-09-22徐洁琼曾茂茂秦昉何志勇陈洁
徐洁琼,曾茂茂,秦昉,何志勇,陈洁
(江南大学 食品科学与技术国家重点实验室,江苏 无锡,214122)
热加工处理对β-乳球蛋白与茶多酚间相互作用的影响
徐洁琼,曾茂茂,秦昉,何志勇*,陈洁
(江南大学 食品科学与技术国家重点实验室,江苏 无锡,214122)
利用荧光光谱技术分析β-乳球蛋白与EGCG、EGC间的相互作用,通过测定其结合常数、结合位点数、热力学常数及β-乳球蛋白的构象变化,探究不同热处理加工条件(80 ℃/20 min、100 ℃/5 min)和加热方式(蛋白与茶多酚混合加热、蛋白单独加热)对β-乳球蛋白与茶多酚间相互作用的影响。结果表明,热加工处理对β-乳球蛋白构象及与EGCG、EGC的结合强度有不同影响。β-乳球蛋白热变性致结构展开,从而表现出与EGCG、EGC的结合能力增强。EGCG、EGC均能与β-乳球蛋白自发形成复合物而发生相互作用,结合强度EGCG明显大于EGC。对比EGCG、EGC与β-乳球蛋白混合加热和β-乳球蛋白单独加热,发现80 ℃混合加热后的结合强度均大于80 ℃蛋白单独加热,分别增加55.56%和42.78%,而100 ℃混合加热后的结合强度均小于100 ℃蛋白单独加热,分别减小14.44%及74.22%。热加工处理能改变EGCG、EGC与β-乳球蛋白的结合力类型。
β-乳球蛋白;儿茶素;相互作用;热处理;荧光光谱
牛乳蛋白中主要含有酪蛋白及乳清蛋白,分别约占80%及20%[1],而β-乳球蛋白是乳清蛋白的主要成分。绿茶中儿茶素占其茶多酚总量的近80%,而表没食子儿茶素没食子酸酯(epigallocatechingallate,EGCG)、表没食子儿茶素(epigallocatechin,EGC)、表儿茶素没食子酸酯(epicatechin gallate,ECG)和表儿茶素(epicatechin,EC)则为主要的绿茶多酚[2],其对许多慢性及退化性疾病具有药理和保健功能,例如癌症、心血管疾病、肥胖、糖尿病和神经退行性过程等[3-7]。奶茶饮料同时富含牛乳蛋白和茶多酚,故近年来深受消费者喜爱。但奶茶加工和贮藏过程中茶多酚与蛋白质的互作,造成奶茶乳液体系不稳定甚至产生浑浊沉淀,对茶多酚的抗氧化性及游离茶多酚含量具有一定影响。KANAKIS[8]研究了天然β-乳球蛋白与茶多酚间的相互作用,结果表明β-乳球蛋白与茶多酚间有不同大小的结合强度。YUKSEL[9]研究了牛乳蛋白与茶多酚间的相互作用,发现茶多酚能使蛋白质表面的疏水性降低且利用等温滴定量热法确定其为非共价键作用。HE[10]利用荧光光谱法研究了β-乳球蛋白与EGCG在不同pH和热处理后的相互作用,发现pH和温度会影响两者间的相互作用强度。蛋白与茶多酚间的相互作用对奶茶产品的抗氧化性、粒径及浑浊程度等健康品质有一定影响。THONGKAEW[11]研究证明乳清分离蛋白与多酚间存在相互作用,并能增强蛋白质的沉淀能力。WANG[12]研究EGCG与乳白蛋白互作形成的复合物的抗氧化性大于乳白蛋白对照组,且在pH 7.0及pH 8.0下,复合物液滴的平均径直小于乳白蛋白对照组。本实验利用荧光光谱方法研究工业热加工处理对奶茶体系中β-乳球蛋白与EGCG和EGC分子相互作用的影响。
1 材料与方法
1.1实验材料
β-乳球蛋白(纯度>98%),美国Sigma公司;EGCG、EGC(纯度>95%),南京春秋生物工程有限公司;其他所用试剂均为分析纯,国药控股化学试剂有限公司。
1.2实验仪器
Fluoromax-4型荧光光谱仪,美国HORIBA公司;HWS-12 水浴锅,上海一恒科技有限公司;超纯水系统,南京易普易达科技发展有限公司。
1.3溶液配制
用三羟甲基氨基甲烷(Tris)和HCl配制pH 6.4的Tris-HCl缓冲液;Tris-HCl缓冲液配制20 mmol/L的β-乳球蛋白储备液,储备液保存于4 ℃冰箱;Tris-HCl缓冲液分别配制1.0 mmol/L的EGCG及EGC溶液(现配现用)。
1.4五组乳球蛋白-多酚复合物溶液制备
常温组:β-乳球蛋白液直接与多酚混合;单80组:β-乳球蛋白液80 ℃水浴加热20 min后,立即冰水浴冷却再与相应多酚混合;单100组:β-乳球蛋白液100 ℃沸水浴加热5 min后,立即冰水浴冷却再与相应多酚混合;混80组:β-乳球蛋白与相应浓度多酚混合后,再置于80 ℃水浴中加热20 min后立即冰水浴冷却;混100组:β-乳球蛋白与相应浓度多酚混合后,再置于100 ℃加热5 min后立即冰水浴冷却。每组样品中均含有7个浓度梯度的蛋白-多酚样品,其中β-乳球蛋白浓度均10 μmol/L,EGCG浓度梯度为0、25、50、100、150、200、250 μmol/L;EGC浓度梯度为0、100、200、400、600、800、1 000 μmol/L。
1.5荧光光谱法
将每组样品分别置于24、31和38 ℃水浴中保温30 min,然后设置激发波长280 nm,狭缝波长5 nm,在300~450 nm内测定相应温度下样品液的荧光发射光谱,并以相应浓度多酚的缓冲溶液作为空白扣除,得到每组样品的荧光强度值。
1.6数据分析
实验均重复做3组,采用Origin 8.5软件进行绘图,Statistix 9.0软件进行数据统计分析,取显著性水平为P<0.05。
2 结果与讨论
2.1荧光光谱
蛋白质自身内源荧光主要来自于色氨酸(Trp)、酪氨酸(Tyr)及苯丙氨酸(Phe)残基,其中Trp荧光的量子产率和发射最大波长对环境的极性和其生物大分子的结构变化非常敏感[13],因而常被用作内源探针研究蛋白质与多酚相互作用。当激发波长为280 nm时,蛋白质的荧光光谱主要由Trp、Tyr共同贡献[14]。β-乳球蛋白中含有Trp19和Trp61,其中Trp19埋藏在乳球蛋白的内部,接近花萼底端且贡献80%的总荧光,而Trp61则在一定程度上暴露于极性环境中,在Cys66-Cys160二硫键附近,贡献一部分的荧光[15-16]。

图1 EGCG和EGC对β-乳球蛋白的荧光猝灭图谱Fig.1 Fluorescence emission spectra of 10 μmol/L β-lactoglobulin at 24 ℃ (λex = 280 nm) in the presence of various concentrations of EGCG 注:A~G: EGCG 0, 25, 50, 100, 150, 200, 250 μmol/L (a~g:EGC 0, 100, 200, 400, 600, 800, 1 000 μmol/L) after thermal processings。
从图1中可看到,EGCG、EGC都对β-乳球蛋白的荧光有猝灭作用,猝灭效果随多酚浓度的增大而增强,且EGCG猝灭能力大于EGC。这可能与EGCG、EGC的分子结构有关,EGCG中酯基相连的苯环上有3个羟基,可能更易发生氢键作用[17]。
β-乳球蛋白在80 ℃和100 ℃加热后最大荧光强度增加,这可能与在中性环境下β-乳球蛋白的变性温度大概在70 ℃左右,80 ℃以上加热的热处理使β-乳球蛋白复合物变性解体,使自消灭的Trp减少有关[18-20]。β-乳球蛋白常温、80 ℃及100 ℃处理后的最大发射波长(λmax)分别为330,331及332 nm。加热处理后出现轻微的红移表明β-乳球蛋白的Trp残基转移到一个更亲水或极性微环境中,主要是由于热处理引起结构的展开[18]。
分析EGCG对β-乳球蛋白的荧光猝灭表明,常温、80 ℃及100 ℃蛋白单独加热下λmax均表现出先红移至335 nm,再蓝移至333 nm;而80 ℃及100 ℃混合加热下λmax则分别缓慢红移至336 nm和338 nm。当EGCG添加浓度为100 μmol/L时,常温、80 ℃及100 ℃蛋白单独加热下其对β-乳球蛋白的猝灭率分别为42.35%、46.72%和46.94%;80 ℃及100 ℃混合加热的样品则为66.60%及65.85%,可见β-乳球蛋白加热后EGCG对β-乳球蛋白的猝灭能力增加,且混合加热比单加热猝灭率高。这可能与加热后β-乳球蛋白变性展开,使有更多的Trp残基能被EGCG猝灭和EGCG可能被氧化后猝灭能力增强有关[10]。5种热加工处理后EGC对β-乳球蛋白荧光的猝灭,使λmax几乎都红移至333 nm,表明EGC对β-乳球蛋白Trp残基的环境并没有多大改变。相同浓度下,常温、80 ℃及100 ℃蛋白单独加热样品的猝灭率分别为10.27%、5.11%和1.29%,可见β-乳球蛋白加热后EGC对其猝灭率降低,这可能与加热后β-乳球蛋白变性展开而暴露更多的Trp残基与EGC猝灭能力弱共同导致有关;但混合加热后的猝灭率增大,80 ℃及100 ℃混合加热样品分别表现为13.19%和14.25%,可能与EGC受热氧化后猝灭能力增强有关。
2.2荧光猝灭机理的判断
小分子猝灭剂对蛋白质荧光体分子的荧光猝灭作用因猝灭机理的不同,一般可分为动态猝灭和静态猝灭[21]。静态猝灭是指猝灭剂与荧光体分子之间通过分子间作用力,在基态时结合形成一定结构的不发光的超分子复合物,因而蛋白质荧光体的荧光强度降低。动态猝灭则与猝灭剂与荧光体分子在激发态时的相互作用,以及分子扩散和碰撞有关,可用Stern-Volmer 方程描述[22],见公式(1):

(1)
式中:F0和F分别代表蛋白质荧光体分子与猝灭剂(茶多酚)结合前后的荧光强度;[Q],猝灭剂浓度;Ksv,动态猝灭常数;Kq,生物大分子猝灭过程中的速率常数;τ0,荧光体分子在无猝灭剂存在下的寿命常数,其值大约为10-8s。根据公式(1),作F0/F与[Q]的Stern-Volmer (S-V)曲线,如图2所示,从斜率可得到Ksv,且不同温度(297,304,311 K)下测得的Kq值列于表1与表2。研究报道,当荧光猝灭为动态猝灭时,Ksv值随温度增加而增大,且各类猝灭剂对荧光体分子的最大Kq值约为2×1010L/(mol·s)[23]。
从图2中可看出EGCG、EGC与β-乳球蛋白的S-V曲线部分呈非直线关系(R2<0.98),表明热加工处理下茶多酚对β-乳球蛋白的猝灭并非主要由动态猝灭,可能是由猝灭剂与荧光体分子间形成不发光的超分子复合物的静态猝灭[24]或者静态和动态猝灭共有的猝灭[2]导致。由表1、表2的结果可看出,EGCG与β-乳球蛋白在不同热处理条件下的Ksv并不是随着温度的升高而增大,有些呈现出随温度升高而降低,且其Kq值在1012L/(mol·s)数量级,远大于最大动态猝灭的Kq值,这些都表明它们的荧光猝灭机制为复杂的静态猝灭[25]。EGC与β-乳球蛋白的Ksv随温度增加而增加,但其Kq值稍大于2×1010L/(mol·s),推测EGC与β-乳球蛋白的猝灭可能是由静态和动态猝灭共同作用的结果。但在线性范围内,以上数据图表事实说明这两种茶多酚与β-乳球蛋白体系的荧光猝灭过程都可以认为是形成新复合物而引起的,即认为其猝灭机理是静态猝灭[17]
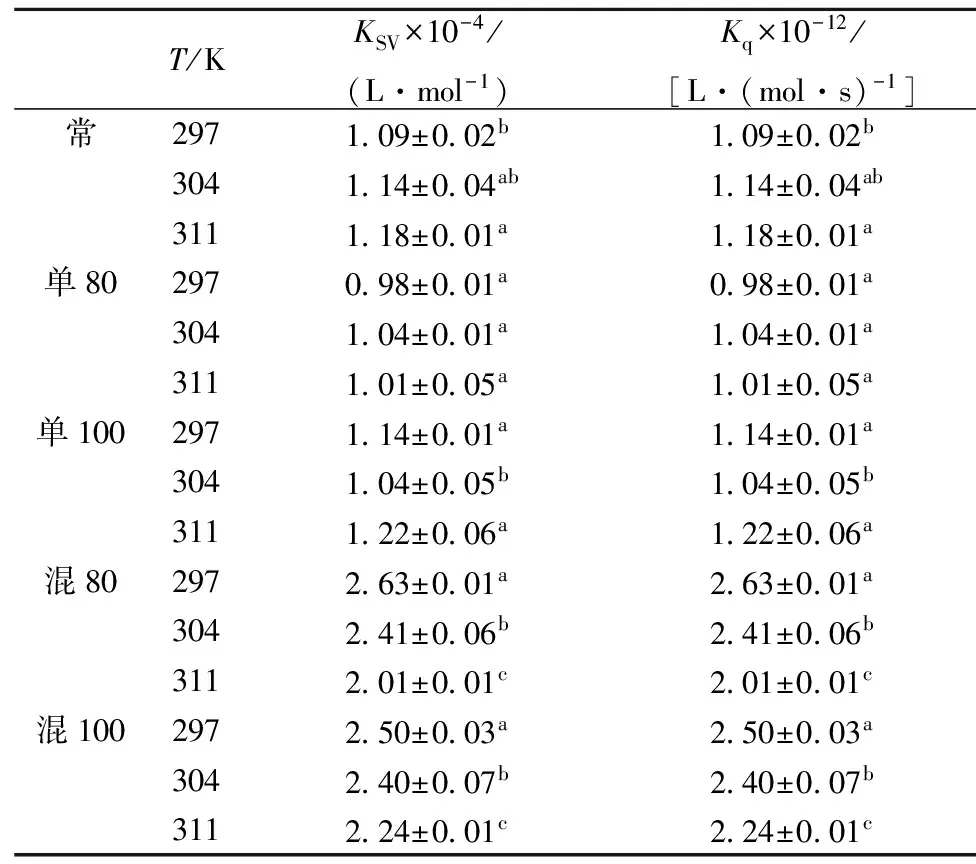
表1 不同热处理下EGCG与β-乳球蛋白的猝灭常数
注:不同小写字母表示每组实验不同温度下KSV及Kq间存在显著性差异(p<0.05)。表2同。

表2 不同热处理下EGC与β-乳球蛋白的猝灭常数
2.3结合常数和结合位点数的计算
由以上判断可知,EGCG、EGC与β-乳球蛋白的结合为静态猝灭过程。因此按照静态猝灭机理,其结合常数KA、结合位点数n与猝灭剂及荧光强度之间的关系可按照公式(2)计算:
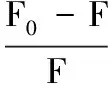
(2)
式中:F0、F及[Q]的意义与公式(1)相同,KA和n分别代表猝灭剂与荧光体分子间的结合常数和结合位点数。根据公式(2),作lg[(F0-F)/F]关于lg[Q]的图线,即得到EGCG、EGC与β-乳球蛋白在五种热加工处理下的双对数曲线图,从图3中可见其双对数都呈现较好的线性关系。由图3中直线的斜率和截距可分别得到n和KA,其计算结果列于表3和表4。分析在297 K下的结合常数和结合位点数,可看到EGCG与β-乳球蛋白的结合常数KA(3×104~7×104L/mol) 明显大于EGC与β-乳球蛋白的KA(3×102~15×102L/mol)。这与WU[2]研究EGC与β-乳球蛋白结合常数13×102L/mol及HE[10]在pH为6.4下研究EGCG与β-乳球蛋白的结合常数7×104L/mol类似。刘欣[17]在研究在儿茶素与牛血清蛋白(BSA)相互作用时同样得到类似结果。结合位点数n均在1左右,表明β-乳球蛋白均提供一个位点与EGCG、EGC结合形成复合物[8,10]。

图3 不同温度下β-乳球蛋白与EGCG、EGC相互作用的双对数回归曲线Fig.3 The double logarithm regression curve of lg [(F0-F)/F] versus lg [Q] of β-lactoglobulin at 297 K, 304 K and 311 K after thermal processings
分析EGCG、EGC与β-乳球蛋白的KA,可得常温下的结合常数最小。当对β-乳球蛋白单独加热处理后,EGCG、EGC与其结合常数增加,并随着加热温度的升高而明显增加,这主要与β-乳球蛋白为热变性蛋白[18-20]有关。本实验中,从加热后β-乳球蛋白的荧光强度增强情况,可判断β-乳球蛋白在100 ℃下加热5 min后变性程度大于80 ℃下加热20 min的变性程度,故导致结构更为舒展,因而为小分子的结合提供更多的平台。当对蛋白多酚混合80 ℃加热20 min后,对比80 ℃蛋白单独加热,EGCG、EGC与β-乳球蛋白混合80 ℃加热后的结合常数均显著增加(p<0.05),这可能是多酚发生氧化且其氧化后产物醌与β-乳球蛋白发生共价结合有关[10,12]。对比表中100 ℃蛋白单独加热与100 ℃混合加热下KA值,发现100 ℃蛋白单独加热均大于100 ℃混合加热,这可能与EGCG、EGC发生剧烈氧化形成聚酯型儿茶素导致分子结构增大,从而与蛋白质结合能力减弱有关[10,26]。
对比蛋白单独加热和混合加热的结合位点数n,发现EGCG、EGC与β-乳球蛋白混合加热后的结合位点数低于相同温度下蛋白单独加热后的结合位点数。分析β-乳球蛋白的单独加热处理,可发现β-乳球蛋白加热后与EGCG、EGC的结合位点数增加,这同样与β-乳球蛋白的热变性有关。
2.4热力学参数与结合力类型
小分子与蛋白质等生物大分子间的相互作用主要有疏水相互作用、静电相互作用、范德华作用和氢键作用等。研究表明,从热力学参数可判断蛋白质—配体间的结合力类型。当ΔH>0、ΔS<0 时,分子间作用力主要是静电相互作用和疏水相互作用;当ΔH>0、ΔS>0 时,分子间作用力主要是疏水相互作用;当ΔH<0、ΔS<0时,分子间作用力主要是范德华作用、氢键作用;而当ΔH<0、ΔS>0时,分子间作用力则主要为静电相互作用[27]。
蛋白质与配体间的热力学参数可根据公式(3)~(5)计算[27]
(3)
ΔG=-RTlnKA
(4)
ΔG=ΔH-TΔS
(5)
式中:KA,对应温度T时的结合常数;ΔG,结合过程的自由能变化;ΔH,结合焓变;ΔS,结合熵变,R为气体常数(8.314 J/(mol·K)) 。根据公式(4),先计算ΔG,然后作lnKA关于1/T的图线,由直线的斜率可计算得到ΔH,最后根据公式(5),计算相应温度下的ΔS。计算结果同样列于表3、表4。

表3 EGCG与β-乳球蛋白的结合常数KA、结合位点数n及热力学参数
注:不同大写字母表示在297 K下KA存在显著性差异(p<0.05)。表4同。
从表3和表4中可看出,EGCG、EGC与β-乳球蛋白结合过程中的自由能变化ΔG都小于0,这表明其与β-乳球蛋白的结合均为自发进行[28]。对于β-乳球蛋白-EGCG体系,常温无处理下其ΔH>0、ΔS>0,表明两者间主要存在疏水相互作用,80 ℃蛋白单独加热、100 ℃蛋白单独加热及80 ℃混合加热后其ΔH<0、ΔS<0,则表现为范德华力及氢键,100 ℃混合加热后热力学常数ΔH<0、ΔS>0,分子间作用力则主要为静电相互作用。对于β-乳球蛋白-EGC体系中,除100 ℃蛋白单独加热其ΔH<0、ΔS>0,表现为静电相互作用外,其余均表现为疏水相互作用。

表4 EGC与β-乳球蛋白的结合常数KA、结合位点数n及热力学参数
3 结论
热加工处理和儿茶素均能使β-乳球蛋白的构象发生一定程度的改变。2种儿茶素单体EGCG、EGC均能与β-乳球蛋白发生相互作用,且为自发进行,根据结合常数判断其作用强弱顺序为:EGCG>EGC。β-乳球蛋白提供一个位点与EGCG、EGC结合。β-乳球蛋白加热后与EGCG、EGC的结合强度增大。EGCG、EGC与β-乳球蛋白80 ℃混合加热后的结合强度大于β-乳球蛋白80 ℃单独加热后的结合常数。但EGCG、EGC与β-乳球蛋白100 ℃混合加热后的结合强度均小于β-乳球蛋白100 ℃单独加热后的结合常数。热加工处理能影响EGCG、EGC与β-乳球蛋白的结合力类型。当前研究证明热加工处理对β-乳球蛋白与茶多酚间相互作用有不同程度的影响,因此可为探究相互作用与茶多酚在人体消化后的生物可及性关系提供指导。
[1] YE Jian-hui, FAN Fang-yuan, XU Xin-qing, et al. Interactions of black and green tea polyphenols with whole milk[J]. Food Research International, 2013, 53(1): 449-455.
[2] WU Xu-li, WU Hui, LIU Mei-xia, et al. Analysis of binding interaction between (-)-epigallocatechin (EGC) and β-lactoglobulin by multi-spectroscopic method[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2011, 82(1): 164-168.
[3] HU Gang, BIDEL S, JOUSILAHTI P, et al. Coffee and tea consumption and the risk of Parkinson's disease[J]. Movement Disorders, 2007, 22(15): 2 242-2 248.
[4] NG T P, FENG L, NITI M, et al. Tea consumption and cognitive impairment and decline in older Chinese adults[J]. The American Journal of Clinical Nutrition, 2008, 88(1): 224-231.
[5] DIEREN S V, UITERWAAL C S P M, SCHOUW Y T V D, et al. Coffee and tea consumption and risk of type 2 diabetes[J]. Diabetologia, 2009, 52(12):2 561-2 569.
[6] YUAN J H, LI Y Q, YANG X Y. Inhibition of epigallocatechin gallate on orthotopic colon cancer by upregulating the Nrf2-UGT1A signal pathway in nude mice[J]. Pharmacology, 2007, 80(4): 269-278.
[7] ZUCHI C, AMBROSIO G, LUSCHER T F, et al. Nutraceuticals in cardiovascular prevention: lessons from studies on endothelial function[J]. Cardiovascular Therapeutics, 2010, 28(4): 187-201.
[8] KANAKIS C D, HASNI I, BOURASSA P, et al. Milk β-lactoglobulin complexes with tea polyphenols[J]. Food Chemistry, 2011, 127(3): 1 046-1 055.
[9] YUKSEL Z, AVCIE, ERDEM Y K. Characterization of binding interactions between green tea flavanoids and milk proteins[J]. Food Chemistry, 2010, 121(2): 450-456.
[10] HE Zhi-yong, CHEN Jie, MOSER S E. Interaction of β-lactoglobulin with (-)-epigallocatechin-3-gallate under different processing conditions of pH and temperature by the fluorescence quenching method[J]. European Food Research and Technology, 2015, 241(3): 357-366.
[11] THONGKAEW C, GIBIS M, HINRICHS J, et al. Polyphenol interactions with whey protein isolate and whey protein isolate-pectin coacervates[J]. Food Hydrocolloids, 2014, 41: 103-112.
[12] WANG Xiao-ya, ZHANG Jiao, LEI Fei, et al. Covalent complexation and functional evaluation of (-)-epigallocatechin gallate and α-lactalbumin[J]. Food Chemistry, 2014, 150: 341-347.
[13] STOJADINOVIC M, RADOSAVLJEVIC J, OGNJENOVIC J, et al. Binding affinity between dietary polyphenols and β-lactoglobulin negatively correlates with the protein susceptibility to digestion and total antioxidant activity of complexes formed[J]. Food Chemistry, 2013, 136(3/4): 1 263-1 271.
[14] SAHU A, KASOJU N, BORA U. Fluorescence study of the curcumin-casein micelle complexation and its application as a drug nanocarrier to cancer cells[J]. Biomacromolecules, 2008, 9(10): 2 905-2 912.
[15] LIANG L, TAJMIR H A, SUBIRADE M. Interaction of β-lactoglobulin with resveratrol and its biological implications[J]. Biomacromolecules, 2007, 9(1): 50-56.
[16] BOHIN M C, VINCKEN J P, VANDERHIJDEN H T, et al. Efficacy of food proteins as carriers for flavonoids[J]. Journal of Agricultural and Food Chemistry, 2012, 60(16): 4 136-4 143.
[17] 刘欣.几种黄酮类药物小分子与牛血清白蛋白相互作用的研究[D].长沙:中南大学,2010.
[18] BUSTI P, GATTI C A, DELORENZI N J. Delorenzi. Thermal unfolding of bovine β-lactoglobulin studied by UV spectroscopy and fluorescence quenching[J]. Food Research International, 2005, 38(5): 543-550.
[19] MANDERSON G A, HARDMAN M J, CREAMER L K. Creamer. Effect of heat treatment on bovine β-lactoglobulin A, B, and C explored using thiol availability and fluorescence[J]. Journal of Agricultural and Food Chemistry, 1999, 47(9): 3 617-3 627.
[20] RENARD D, LEFEBVRE J, GRIFFIN M C A, et al. Effects of pH and salt environment on the association of β-lactoglobulin revealed by intrinsic fluorescence studies[J]. International Journal of Biological Macromolecules, 1998, 22(1): 41-49.
[21] ROSS P D, SUBRAMANIAN S. Thermodynamics of protein association reactions: forces contributing to stability[J]. Biochemistry, 1981, 20(11): 3 096-3 102.
[22] KIM D, PARK J, KIM J, et al. Flavonoids as mushroom tyrosinase inhibitors: a fluorescence quenching study[J]. Journal of Agricultural and Food Chemistry, 2006, 54(3): 935-941.
[23] LAKOWICZ J R, WEBER G. Quenching of protein fluorescence by oxygen. Detection of structural fluctuations in proteins on the nanosecond time scale[J]. Biochemistry, 1973, 12(21): 4 171-4 179.
[24] CHENG Zheng-jun, LIU Rong, JIANG Xiao-hui, et al. The interaction between cepharanthine and two serum albumins: multiple spectroscopic and chemometric investigations[J]. Luminescence, 2014, 29(5): 504-515.
[25] HE Zhi-yong, CHEN Jie, MOSER S E, et al. Interaction of β-casein with (-)-epigallocatechin-3-gallate assayed by fluorescence quenching: effect of thermal processing temperature[J]. International Journal of Food Science & Technology, 2016, 51(2):342-348.
[26] ANDREW P N, AMBER S H, BRUCE R C,et al. Catechin degradation with concurrent formation of homo-and heterocatechin dimers during in vitro digestion[J]. Journal of Agricultural and Food Chemistry, 2007,55(22): 8 941-8 949.
[27] WANG Yan-qiong, ZHANG Hong-mei, ZHANG Gen-cheng, et al. Interaction of the flavonoid hesperidin with bovine serum albumin: A fluorescence quenching study[J]. Journal of Luminescence, 2007. 126(1): 211-218.
[28] 许铭珠.葡萄皮花青素提取物与蛋白质的相互作用及其对色素稳定性的影响[D].无锡:江南大学,2015.
Interactionofβ-lactoglobulinwithteapolyphenolsunderdifferentthermalprocessing
XU Jie-qiong, ZENG Mao-mao, QIN Fang,HE Zhi-yong*, CHEN Jie
(State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122, China)
Tea polyphenols are rich in catechins, and epigallocatechingallate (EGCG), and epigallocatechin (EGC) are typical catechins monomer. The competitive interactions of β-lactoglobulin with EGCG and EGC under the two heat processing conditions (80 ℃/20 min; 100 ℃/5 min) and two heating methods (heating the mixture; protein alone heating) were investigated by fluorescence spectroscopy. The influence of heating process and conditions on the interaction between β-lactoglobulin and tea polyphenols was studied by measuring binding constant, binding sites, thermodynamic parameters and conformational changes of β-lactoglobulin. The results indicated that the thermal processing changed the structure of β-lactoglobulin and the binding ability of EGCG/EGC with β-lactoglobulin. The structure of β-lactoglobulin were more open than its native state due to the heat-induced denaturation and unfolding of protein. Therefore, the strong binding affinity with EGCG and EGC were observed. The β-lactoglobulin can spontaneously interact with EGCG/ EGC to form a complex and its binding strength with EGCG was stronger than that with EGC. Compared with heating mixing EGCG, EGC and β-lactoglobulin and heating with β-lactoglobulin alone, it was found that after 80 ℃ mixed heating, the binding strength were stronger than that of protein alone heating, and binding strength was increased by 55.56% and 42.78% respectively. However, after 100 ℃ mixed heating, the binding strength were weaker than 100 ℃ protein alone heating, decreased by 14.44% and 74.22% respectively. Thermal processing can change binding types of EGCG/EGC with β-lactoglobulin.
β-lactoglobulin; catechin; interaction; thermal processing; fluorescence spectroscopy
10.13995/j.cnki.11-1802/ts.013213
硕士研究生(何志勇教授为通讯作者,E-mail:zyhe@jiangnan.edu.cn)。
江南大学食品科学与技术国家重点实验室自由探索资助课题(No.SKLF-ZZA-201504)
2016-10-19,改回日期:2017-01-04
