乳酸菌生物学特性与其拮抗空肠弯曲杆菌在小鼠肠道定植能力的分析
2017-09-22王刚贺禹丰陈晓华赵建新张灏陈卫
王刚,贺禹丰,陈晓华,赵建新,张灏,陈卫
1(江南大学 食品学院,江苏 无锡,214122) 2(衡阳师范学院 生命科学与环境学院,湖南 衡阳,421008)
乳酸菌生物学特性与其拮抗空肠弯曲杆菌在小鼠肠道定植能力的分析
王刚1*,贺禹丰1,陈晓华2,赵建新1,张灏1,陈卫1
1(江南大学 食品学院,江苏 无锡,214122) 2(衡阳师范学院 生命科学与环境学院,湖南 衡阳,421008)
采用3周龄C57BL/6小鼠建立了空肠弯曲杆菌感染模型,评价了8株在体外具有抑制空肠弯曲杆菌生长能力的乳酸菌在体内拮抗空肠弯曲杆菌定植的能力,同时对该8株菌生长速率、产酸能力、生物膜形成能力、黏附能力等生物学特性进行了测定,通过主成分分析对8株乳酸菌生物学特性的评价以及皮尔森相关性系数对乳酸菌生物学特性及其在体内拮抗空肠弯曲杆菌定植能力相关性的分析,发现8株乳酸菌种间生物学特性差异明显大于种内生物学特性差异,且乳酸菌在小鼠体内拮抗空肠弯曲杆菌定植的能力与其细胞黏附能力呈正相关。具有最高黏附指数的植物乳杆菌N8、N9可有效清除模型小鼠肠道内的空肠弯曲杆菌,对保护人体免受空肠弯曲杆菌感染具有潜在的应用价值,同时也为具有拮抗致病菌能力的益生菌的筛选提供了理论依据。
乳酸菌;空肠弯曲杆菌;拮抗;黏附;小鼠感染模型
空肠弯曲杆菌(Campylobacterjejuni,C.jejuni)是一种革兰氏阴性病原菌。20世纪90年代以来,C.jejuni感染率上升明显,在欧美发达国家,该菌是造成腹泻的主要病原体之一[1]。人体感染C.jejuni可造成腹痛、水样腹泻以及便血,严重时甚至可能引起格林-巴利综合征(Guillain-Barré syndrome,GBS),导致急性神经麻痹[2]。目前,抗生素是治疗C.jejuni感染的常用疗法,然而C.jejuni抗药性的与日俱增促使人们寻找可替代抗生素治疗的新方法[3]。
部分乳酸菌是健康人类肠道中的固有菌群,其对于维持人体肠道健康发挥着十分重要的作用。研究表明,乳酸菌对多种病原菌具有良好的抑制作用,如沙门氏菌[4]、大肠杆菌O157:H7[5]、单增李斯特菌[6]等。同时有研究发现,乳酸菌对于防治C.jejuni感染同样具有良好的效果。CEAN[7]等筛选得到了4株可以阻止C.jejuni入侵鸡原代细胞的乳酸菌,将4株菌混合后喂食给幼年和成年肉鸡,均可显著降低其肠道内C.jejuni定植量。SANTINI[8]等的研究表明,BifidobacteriumlongumPCB 133可以在体外有效抑制C.jejuni生长,同时具有良好的加工性能以及消化道耐受能力。动物实验表明该菌可在鸡体内有效定植6天以上,并能够显著降低C.jejuni定植量。
本研究通过建立C.jejuni在小鼠体内定植模型并利用该模型评价乳酸菌对C.jejuni在体内定植的拮抗能力,同时将拮抗能力与乳酸菌的部分生物学特性进行相关性分析,探索乳酸菌拮抗C.jejuni感染定植的可能机制。
1 材料与方法
1.1实验菌株和细胞株
本研究选用实验室保藏的已知对C.jejuni具有体外抑制作用的8株乳酸菌。8株乳酸菌以及C.jejuniNCTC11168均保藏于实验室菌种库并经过16s rDNA测序确定种属。人结肠癌细胞株HT-29,购自中国科学院典型培养物保藏委员会细胞库。8株乳酸菌的编号、种属见表1。
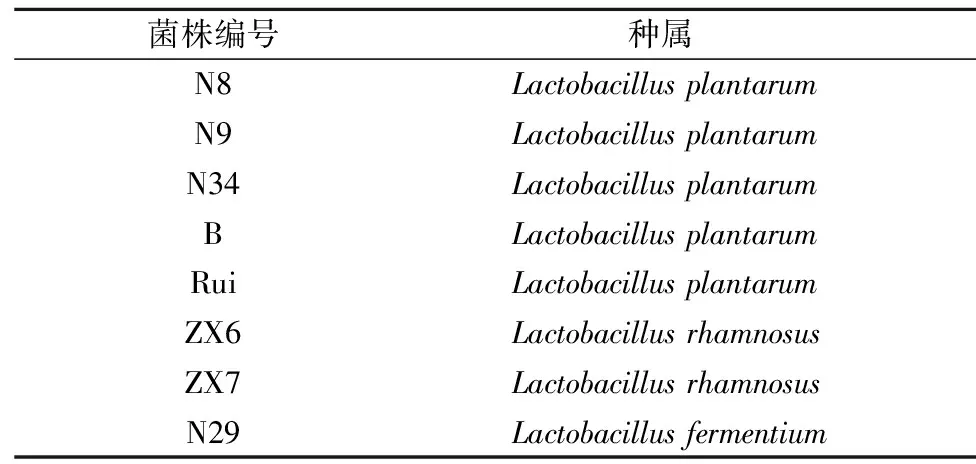
表1 实验用乳酸菌菌株信息
1.2试剂与仪器
脑心浸液肉汤(BHI),哥伦比亚血琼脂培养基,MRS培养基均购自青岛海博生物技术有限公司;无菌绵羊血,购自杭州新锐生物工程有限公司;Skirrow空弯选择性混合抗生素,购自英国OXOID公司;RPMI-1640培养基,购自美国Gibco公司。
BD150L三气培养箱,德国Bingd公司;PYX-DHS隔水式恒温培养箱,上海一恒科技有限公司;MLS-3750高压蒸汽灭菌锅,日本SANYO公司;生物安全柜,美国Labconco公司;气相色谱质谱联用仪 GC-MS-QP2010 Ulra System,日本岛津公司。
1.3菌株的培养
乳酸菌菌株以30%甘油冻存于-80 ℃超低温冰箱中,使用时先于4 ℃下化冻并以体积分数2%接种量接种于MRS培养基中,37 ℃培养20 h,以此条件活化2代备用。
C.jejuni菌株以30%甘油冻存于-80 ℃超低温冰箱中,使用时先于4 ℃下化冻并在哥伦比亚血平板上划线接种,于37 ℃三气培养箱(5% O2, 10% CO2,85% N2)培养48 h后备用。
1.4空肠弯曲杆菌生长曲线的测定
挑取哥伦比亚血平板上的C.jejuni单菌落并接种于BHI培养基中,于37 ℃三气培养箱培养48 h后,以体积分数2%的接种量接种于新鲜BHI培养基中,于37 ℃三气培养箱培养,间隔不同时间点取样进行涂布计数。
1.5牛津杯法测定乳酸菌发酵上清液抑菌效果
实验方法参考张婷婷[9]等的方法并加以改良:将37 ℃培养20 h后的乳酸菌悬液经0.22 μm无菌滤膜过滤后得到乳酸菌发酵上清液。取部分上清液,用NaOH将其pH值调整为6.5。取100 μL 1×106CFU/mL的C.jejuni菌悬液,均匀涂布于哥伦比亚血平板上,将无菌牛津杯插入平板琼脂层并避免插至平板底部。取200 μL乳酸菌发酵上清液沿壁加入牛津杯中,盖上平板盖并将平板正置于三气培养箱培养48 h,观察并测量牛津杯外围抑菌圈直径。每个样本做3个平行实验,以MRS培养基(pH=6.5)作为阴性对照,0.28 mg/mL的诺氟沙星溶液作为阳性对照。
1.6乳酸菌生物学特性的评价
1.6.1 生长速率
取活化后的乳酸菌,调整至相同活菌数,以体积分数2%接种量接种于MRS培养基中,37 ℃下静置培养20 h后进行涂布计数。将此时的乳酸菌活菌数用于评估其生长速率。
1.6.2 产酸能力
取活化后的乳酸菌,调整至相同活菌数,以体积分数2%接种量接种于MRS培养基中,37 ℃下静置培养20 h后用0.22 μm无菌滤膜过滤,得到无菌发酵上清液并用pH计测量,每株菌做3个平行实验。
1.6.3 生物膜形成能力
取活化后的乳酸菌,调整至相同活菌数,以体积分数1∶100的比例稀释于MRS培养基中,混匀。移取200 μL菌悬液至96孔板中,37 ℃培养48 h。吸走孔中悬浮菌液,用200 μL PBS缓冲液轻柔地冲洗2次,恒温干燥箱中烘干剩余水分。用200 μL 0.1%结晶紫染色20 min,继续以200 μL PBS缓冲液轻柔地冲洗3次,烘干。每孔加入200 μL 95%乙醇,震荡3 min后,移取150 μL孔中液体至新的96孔板中,在595 nm处测量吸收值。
1.6.4 黏附HT-29细胞能力
实验方法参考王刚[10]的方法等并稍作修改:以RPMI-1640完全培养基复苏冻存于液氮的HT-29细胞,在37 ℃、5% CO2环境下静置培养,每2天换液1次。待细胞生长至70%密度,用胰酶消化并进行传代,直至细胞生长到足够数量。将贴壁生长的HT-29细胞经胰酶消化后以RPMI-1640完全培养基将细胞密度调整至1×105个/mL。向24孔板中加入1 mL HT-29细胞悬液,待细胞生长至贴壁状态后吸去培养液,并用PBS缓冲液冲洗2次,加入1 mL乳酸菌悬液(以RPMI-1640培养基重悬,1×108CFU/mL),并补加RPMI-1640培养基(不含血清及抗生素)至2 mL,37 ℃、5% CO2条件下孵育2 h。孵育结束后用PBS缓冲液清洗3次,以除去未黏附的细菌,用倒置显微镜对细胞表面黏附的细菌进行计数,通过计算得出乳酸菌的黏附指数(每个细胞表面平均黏附的细菌个数)。
1.7动物实验
1.7.1 动物饲养及分组
动物实验选用3周龄SPF级雌性C57BL/6小鼠,同室分笼喂养,每笼6只。饲养环境温度(20±2) ℃,湿度(60±5)%,12 h光照12 h黑暗,每3~4 d更换垫料。每日灌胃体积为200 μL/只,C.jejuni灌胃菌数为2×109CFU/mL,不同乳酸菌灌胃菌数统一调整为5×109CFU/mL。饲养过程中每周称量小鼠体重。实验分组及处理方案详见表2。
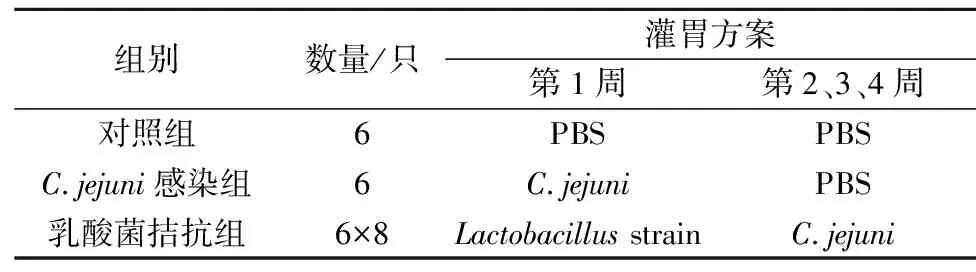
表2 动物实验分组及处理方案
1.7.2 小鼠粪便中C.jejuni的计数
收集动物实验小鼠饲养第28天的粪便,置于4 ℃冰盒中。将0.1 g粪便重悬于PBS缓冲液中,充分混匀后进行梯度稀释并涂布于哥伦比亚血平板,三气条件下培养48 h后对C.jejuni菌落数进行计数。哥伦比亚血平板配制时以体积分数1∶250的比例加入Skirrow混合抗生素,用于抑制杂菌生长。
1.7.3 小鼠粪便中短链脂肪酸的测定
实验方法参考毛丙永[11]等并略作改动:准确称取50 mg粪便置于EP管中,加入500 mL饱和NaCl溶液,浸泡30 min,破碎至无明显颗粒状。加入20 μL硫酸酸化,漩涡振荡30 s,准确加入800 μL乙醚用于萃取短链脂肪酸,漩涡振荡30 s后14 000 r/min离心15 min。吸取全部上清,向上清中加入0.25 g无水硫酸钠,14 000 r/min离心15 min,将液相移入进样瓶中上机分析。
GC-MS采用Rtx-Wax柱,柱长30 m,内径0.25 μm;载气为He,流速2 mL/min;进样体积1 μL,分流比10∶1;进样温度设定为240 ℃,按如下程序进行升温:初始温度为100 ℃,按7.5 ℃/min升温至140 ℃,之后按照60 ℃/min升温至200 ℃,保持3 min,离子化温度为220 ℃;分析采用全扫描模式,用外标法计算乙酸、丙酸、丁酸的浓度(μmol/g)。
1.8数据处理及分析
本研究数据结果以“平均值+标准差”表示,数据使用EXCEL 2010及SPSS 20.0进行处理,利用单因素方差分析(ANOVA)两两比较中的Tukey s-b法进行显著性分析,p<0.05则认为存在显著性差异,利用皮尔森相关系数法 (Pearson correlation coefficient)进行相关性分析,利用主成分分析法(Principal component analysis ,PCA)进行多组数据主成分分析。
2 结果
2.1空肠弯曲杆菌的生长曲线
了解C.jejuni的生长曲线有助于获得更高数量级、更强活力的菌体,从而用于后续的感染研究。由图1可知,C.jejuniNCTC11168可以在BHI培养基中迅速生长,接种后0~18 h为对数生长期,18 h后进入稳定期,42 h后进入衰亡期,菌体量最高可达到2×109CFU/mL。因此选用接种24 h后处于稳定期的C.jejuni用于后续感染实验,以确保足够的菌体量以及菌体活力。
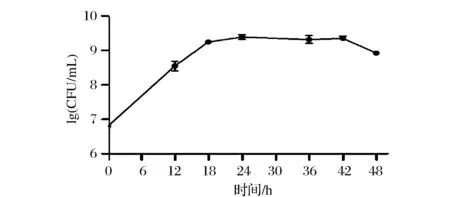
图1 C.jejuni在BHI培养基中的生长曲线Fig.1 Growth curve of C.jejuni in BHI broth
2.2乳酸菌在体外可抑制C.jejuni的生长
本研究利用牛津杯法测定了8株乳酸菌发酵上清液(未经pH调整)体外抑制C.jejuni生长的能力,结果见图2。可以看出,8株乳酸菌的发酵上清液均对C.jejuni生长均具有明显的抑制作用,菌株N29抑菌圈直径超过13 mm,而其他菌株均超过15 mm。诺氟沙星阳性对照组平板上几乎未见C.jejuni生长,故未测量抑菌圈直径。8株乳酸菌的抑菌圈直径与空白对照组MRS相比,均存在显著性差异(p<0.05)。而将8株乳酸菌发酵上清液pH值调为6.5后,抑菌圈直径与空白对照组无明显差异,证明乳酸菌在体外抑制C.jejuni的生长的主要物质是代谢产物中的有机酸或pH依赖的抑菌成分。
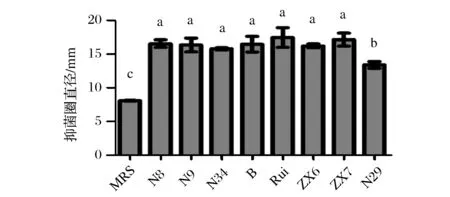
图2 乳酸菌发酵上清液对C.jejuni生长的抑制作用Fig.2 C.jejuni growth was inhibited by cell-free supernatants of Lactobacillus strains
2.3乳酸菌在小鼠体内对C.jejuni感染的拮抗作用
2.3.1 乳酸菌降低C.jejuni在小鼠体内的定植数
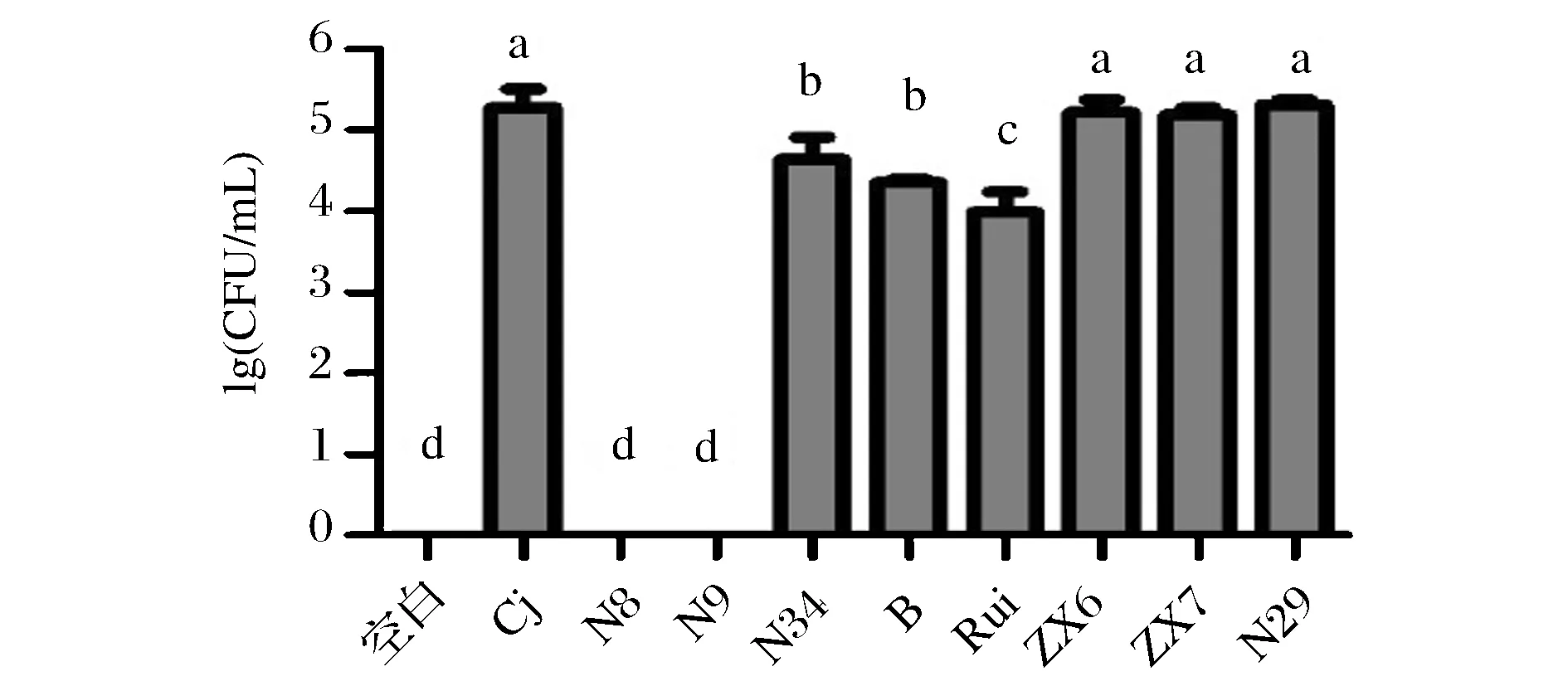
图3 小鼠粪便中C.jejuni活菌数Fig.3 Viable cells of C.jejuniin mice feces
通过对小鼠粪便中C.jejuni活菌进行平板涂布计数,反映C.jejuni在小鼠体内的定植情况。由图3可知,C.jejuni感染组28天粪便中仍能检测到超过1.9×105CFU/g 的C.jejuni活菌,说明C.jejuni在3周龄小鼠肠道内能够有效定植。而L.plantarumN8、N9处理组的小鼠粪便中未能检出C.jejuni活菌,L.plantarumN34、B、Rui处理组小鼠粪便中C.jejuni活菌相比C.jejuni感染组降低了近1个数量级,L.rhamnosusZX6、ZX7、L.fermentiumN29处理组C.jejuni活菌数相比C.jejuni感染组无显著差异(p>0.05)。以上结果表明L.plantarumN8、N9在模型小鼠体内能有效降低C.jejuni的定植率。
2.3.2 小鼠体重变化
从饲养第1天起每周测量各组小鼠体重以观察体重变化。由表3可以看出,用于实验的3周龄小鼠初始体重不足10 g,随实验进程体重逐步增加。C.jejuni感染以及不同乳酸菌处理并未对小鼠体重变化产生显著性影响(p>0.05)。
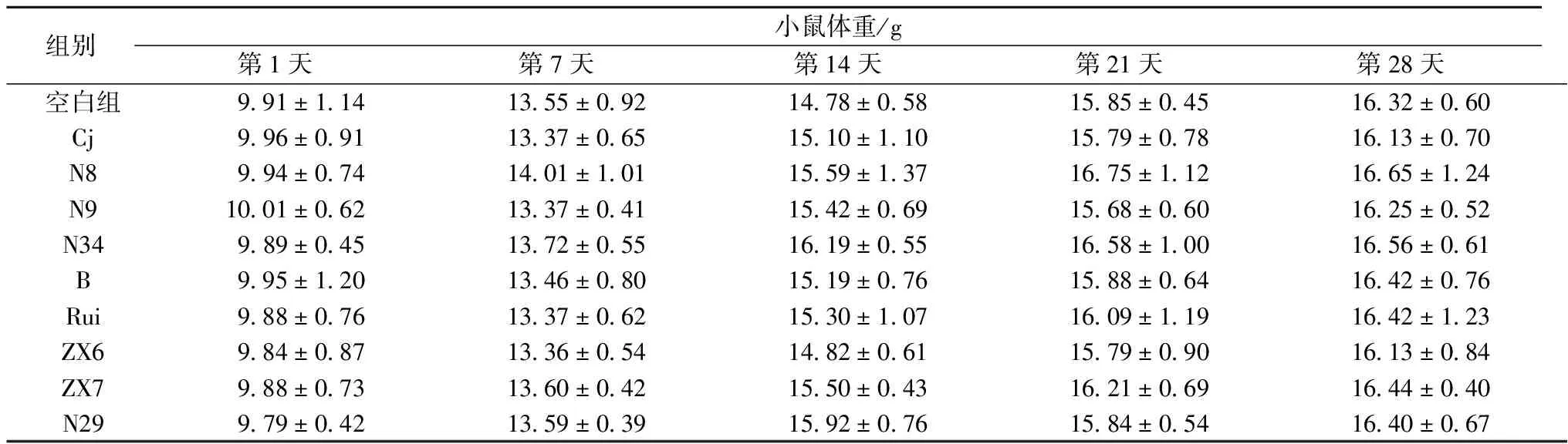
表3 小鼠体重变化
注:各组之间数据均无显著性差异(p>0.05)。
2.4乳酸菌生物学特性与其体内拮抗C.jejuni定植的相关性
不同乳酸菌菌株具有各自的生理学特性,其益生功效与菌株自身生物学特性密切相关。部分研究表明[12-14],乳酸菌的生长速率、对细胞的黏附能力以及生物膜形成能力可能对乳酸菌在体内的定植起到了重要的影响。而乳酸菌的产酸能力则决定了其在肠道内拮抗病原菌的能力[15]。因此本研究进一步探究了以上具有体外拮抗C.jejuni生长能力的乳酸菌在生长速率、产酸能力、生物膜形成能力、黏附能力等方面的差异,并通过主成分分析及相关性分析确定不同乳酸菌在各生物学特性方面的表现以及与其体内拮抗C.jejuni定植的相关性。
2.4.1 乳酸菌的生长速率
按照1.6.1所述方法对8株乳酸菌生长速率进行测定。从图4可以看出,在37 ℃条件下培养24 h后,除N29外其余7株菌的活菌数均可超过1×109CFU/mL,其中Rui、ZX7生长速率最快,可超过3×109CFU/mL,N29生长速率最慢,仅为7×108CFU/mL。不同菌株生长速率的种间、种内差异均比较明显(p<0.05)。
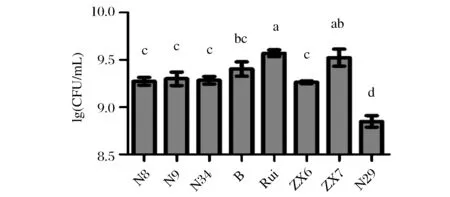
图4 乳酸菌在MRS培养基中的生长速率Fig.4 Growth rate of Lactobacillus strains in MRS broth
2.4.2 乳酸菌产酸能力
对8株乳酸菌在MRS培养基中培养20 h的发酵上清液pH值进行了测定,结果见表4。N8、N9、N34、B、Rui、ZX6、ZX7均具有较强的产酸能力,发酵上清液pH在3.80~3.90之间,菌株之间差异不明显(p>0.05)。而N29产酸能力较弱,发酵上清液pH仅为4.38。

表4 乳酸菌发酵上清液pH值
2.4.3 乳酸菌生物膜形成能力
按照1.6.3所述方法测定了8株乳酸菌自身形成生物膜的能力,OD595数值代表了生物膜形成量。由图5可知,不同菌株生物膜形成能力差异明显,其中N9、N34、Rui、N29自身成膜能力较强,N8、B、ZX6成膜能力一般,ZX7几乎不具备生物膜形成能力。
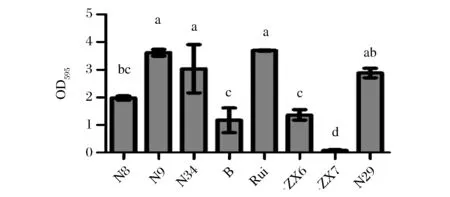
图5 乳酸菌自身生物膜形成能力Fig.5 Biofilm formation of Lactobacillus strains
2.4.4 乳酸菌对HT-29细胞的黏附能力
按照1.6.4所述方法评价了8株乳酸菌体外黏附HT-29细胞的能力,结果如图6所示。其中N8、N9粘附能力最为出色,B、Rui也具备一定黏附能力,而N34、ZX6、ZX7、N29黏附能力较差。从8株菌的种属来看,L.plantarum的黏附能力普遍强于L.rhamnosus与L.fermentium且L.plantarum黏附能力的种内差异也十分明显。
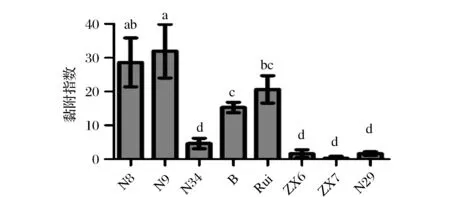
图6 乳酸菌对HT-29细胞的黏附能力Fig.6 Adhesion of Lactobacillus strains to HT-29 cells
2.4.5 主成分分析8株乳酸菌的生物学特性分布规律
本研究采用主成分分析法对8株乳酸菌的生物学特性分布规律进行了分析,得到第一主成分F1和第二主成分F2,分别包含了原来信息的51.34%和36.55%。第一主成分F1综合了产酸、生长2个特性,第二主成分F2综合了生物膜、黏附2个特性,具体见图7。由图7可知,L.plantarumN8、N9、N34、B、Rui集中于第一象限附近,距离4种生物学特性坐标点距离较近。这说明5株L.plantarum在4项生物学特性的评估中均有不错的表现,N8、N9、Rui尤为突出。而L.rhamnosusZX6、ZX7、L.fermentiumN29距离4种生物学特性坐标点较远,说明其在生物学特性的评价中表现较差。此外,同一菌种在图中分布相对集中,这说明8株乳酸菌的生物学特性种间差异大于种内差异。
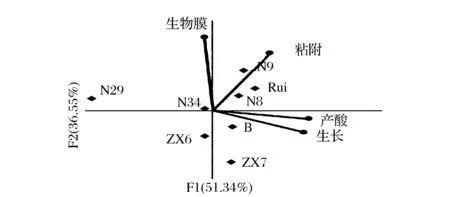
图7 8株乳酸菌生物学特性PCA分布Fig.7 PCA analysis of characteristics of 8 Lactobacillus strains
2.4.6 皮尔森相关性系数法分析
皮尔森相关系数法是一种准确度量2个变量关系之间密切程度的统计学方法,其相关性系数r值位于-1和1之间[16]。本研究分析了乳酸菌降低C.jejuni在小鼠体内定植的能力与8株乳酸菌生长速率、产酸能力、生物膜形成能力、黏附HT-29细胞能力的皮尔森相关系数,结果见表5。可以看出粪便中C.jejuni活菌数与乳酸菌的黏附细胞的能力具有极强的负相关性,这说明8株乳酸菌中,黏附能力越强的菌株对小鼠体内C.jejuni定植的拮抗效果越好。而乳酸菌降低C.jejuni在小鼠体内定植的能力与其生长速率、产酸能力、生物膜形成能力等生物学特性未见有显著的相关性。

表5 皮尔森相关性系数法分析
2.5具有显著拮抗C.jejuni定植能力的乳酸菌对小鼠粪便中短链脂肪酸含量的影响
本研究进一步选取在小鼠体内拮抗C.jejuni定植能力出色的L.plantarumN8,测定了该处理组小鼠粪便中乙酸、丙酸、丁酸的含量,结果如图8。可见C.jejuni的感染本身并不会明显影响小鼠粪便中乙酸、丙酸、丁酸的含量 (p>0.05),而L.plantarumN8摄入则可使小鼠粪便中乙酸含量显著增加(p<0.05)。这说明L.plantarumN8对C.jejuni的清除能力可能与其在肠道内的定植及产酸具有密切的联系。
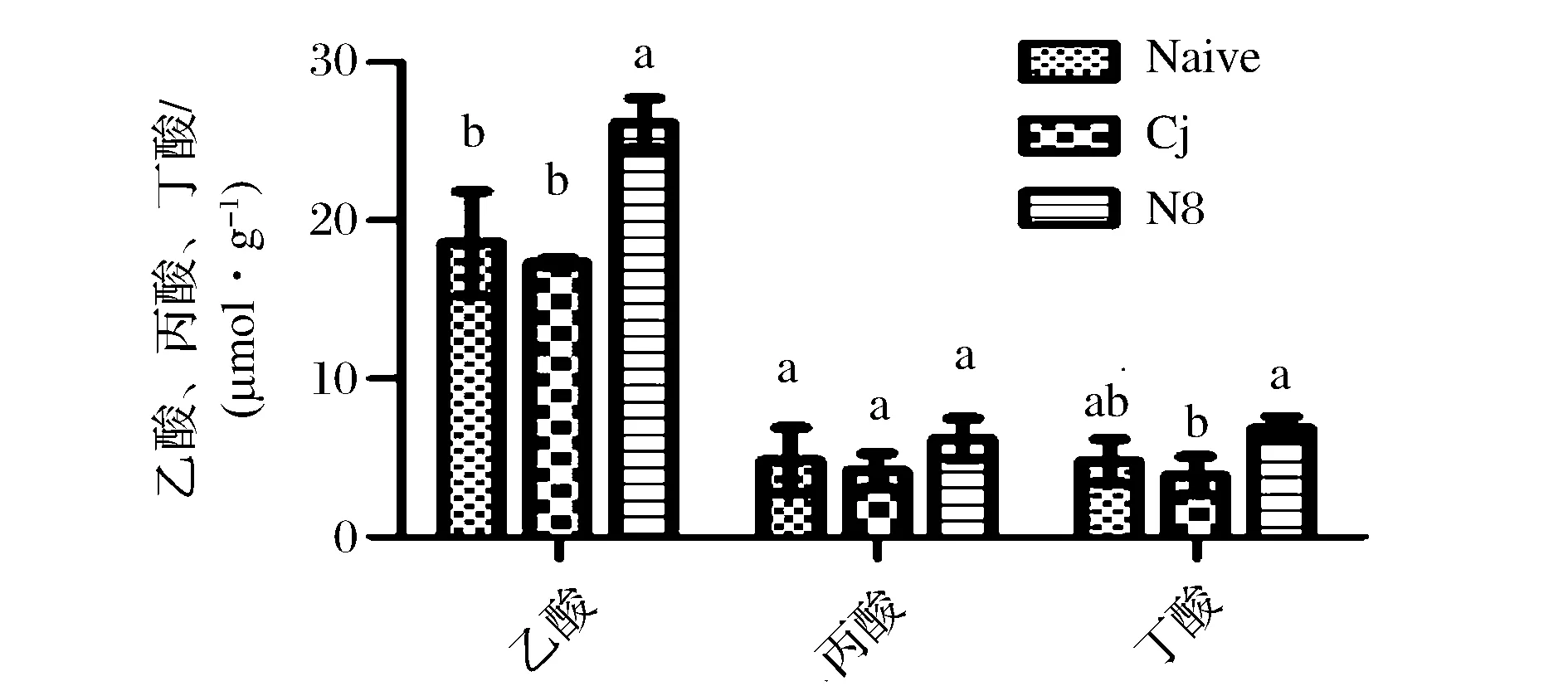
图8 小鼠粪便中乙酸、丙酸、丁酸含量Fig.8 Acetic acid , propionic acid , butyric acid in mice feces
3 讨论
空肠弯曲杆菌依然是威胁人类肠道健康的主要病原菌之一[17]。近年来,利用大环内脂类或喹诺酮药物治疗C.jejuni感染受到了越来越多的质疑[18]。因此,开发可以替代抗生素有效预防和治疗C.jejuni感染的新方法变得十分重要。乳酸菌作为肠道中的常见菌种,其对病原菌感染的保护作用正逐步引起人们的重视。虽然禽类作为模型用于评价乳酸菌拮抗C.jejuni感染已获得较为广泛的应用[19-20],但该模型并不完全适合用于模拟人类感染C.jejuni的病理过程。小鼠感染模型经常被用于模拟多种致病菌的感染过程[21-22],但是成年小鼠由于其成熟的肠道菌群产生“定植抗性”,导致C.jejuni无法有效在小鼠体内定植[23]。有研究表明3周龄的断奶小鼠对C.jejuni更为易感,可使C.jejuni在小鼠体内以一定数量有效定植[24]。本研究中C.jejuni可在3周龄小鼠肠道内以超过105数量级定植且乳酸菌可有效减少肠道中C.jejuni活菌数,说明该小鼠模型可用于评价乳酸菌在体内拮抗C.jejuni定植的能力。然而本研究中C.jejuni的定植尚未对小鼠体重产生明显影响,这在一定程度上说明该模型尚不足以模拟严重的人体感染C.jejuni的病理状态。
本研究使用的8株乳酸菌通过牛津杯抑菌实验证实其发酵上清液均可在体外有效抑制C.jejuni的生长,且8株乳酸菌对C.jejuni的体外拮抗能力受发酵液pH影响显著,这与金星[25]探究乳酸菌体外抑菌成分的结果一致,表明乳酸菌体外拮抗C.jejuni能力主要与其产生的有机酸有关。虽然这些乳酸菌在体外拮抗C.jejuni生长的能力差异并不明显,但在小鼠感染模型中却表现出对C.jejuni定植非常明显的差异。由于体外拮抗实验仅仅反映了发酵上清对C.jejuni生长的抑制作用,而体内拮抗实验则会受到乳酸菌在肠道内的定植及抗菌物质的产生等一系列因素的影响。因此导致乳酸菌在体内具有不同拮抗能力的原因可能与乳酸菌的部分生物学特性有关。例如,研究认为有机酸是乳酸菌用以拮抗病原微生物的主要物质之一[26];而黏附是乳酸菌与宿主作用的第一步,是其在宿主体内发挥益生功能的基础[27];乳酸菌的表面疏水性、自聚集能力和产胞外多糖能力可能影响其自身成膜能力[28],乳酸菌可在特定环境下形成生物膜,形成生物膜的乳酸菌具有更强的稳定性和抗逆性[29],有利于其在肠道内发挥益生功效。因此,乳酸菌的生长速率、对细胞的黏附能力以及生物膜形成能力可能对乳酸菌在体内的定植起到了重要的影响,而乳酸菌的产酸能力则决定了其在肠道内拮抗病原菌的能力。
本研究评估了8株乳酸菌在生长速率、产酸能力、生物膜形成能力、黏附能力等方面的生物学特性差异。8株乳酸菌在MRS培养基中均可以较快生长,除L.fermentiumN29外,其余菌株培养20 h后均超过109CFU/mL;在产酸能力方面,除L.fermentiumN29的7株乳酸菌均有较强的产酸能力;而8株乳酸菌生物膜形成能力各异,无明显种间或种内差异;对HT-29细胞的黏附能力,8株乳酸菌表现出一定的差异,总体来看植物乳杆菌黏附能力较鼠李糖乳杆菌、发酵乳杆菌更强,这与LIN[30]等研究结论一致。此外,乳酸菌的黏附能力往往也表现出明显的种内差异,本研究中5株植物乳杆菌黏附能力差异明显,这在赵煜[31]、MORITA[32]等人的研究中也有充分体现。
不同乳酸菌在部分生物学特性方面表现出一定的差异,主成分分析结果表明,L.plantarumN8、N9、Rui相较之L.plantarumN34、B,L.rhamnosusZX6、ZX7和L.fermentiumN29具有更为出色的生物学特性,这与乳酸菌在小鼠模型中对C.jejuni定植率的影响是吻合的。而进一步的皮尔森相关性分析表明8株乳酸菌在小鼠体内拮抗C.jejuni能力与其黏附HT-29细胞能力呈极强正相关。这说明乳酸菌进入宿主体内后能否黏附于肠道上皮并顺利增殖以完成定植,决定了乳酸菌对致病菌的拮抗效果。而对小鼠粪便中短链脂肪酸的分析表明,具有很好细胞黏附能力的L.plantarumN8会使小鼠肠道中乙酸含量增加,这表明该菌在摄入后的定植及产酸能够显著拮抗C.jejuni在小鼠肠道内的定植。
综上所述,8株乳酸菌中L.plantarumN8、N9能够有效降低小鼠肠道中C.jejuni活菌数,其作为益生菌用于拮抗C.jejuni感染具有潜在的应用价值。相关性分析表明,8株乳酸菌的黏附能力与其在体内拮抗C.jejuni定植能力呈强正相关,该结果为今后具有拮抗致病菌能力的益生菌的筛选提供了理论依据。
[1] DASTI J I, TAREEN A M, LUGERT R, et al.Campylobacterjejuni: a brief overview on pathogenicity-associated factors and disease-mediating mechanisms.[J]. International Journal of Medical Microbiology, 2010, 300(4):205-211.
[2] ALTEKRUSE S F, STERN N J, FIELDS P I, et al.Campylobacterjejuni-an emerging foodborne pathogen.[J]. Emerging Infectious Diseases, 1999, 5(1):28-35.
[3] ALFREDSON D A, KOROLIK V. Antibiotic resistance and resistance mechanisms inCampylobacterjejuniandCampylobactercoli[J]. Fems Microbiology Letters, 2007, 277(2):123-132.
[4] CASTILLO N A, LEBLANC A D M D, GALDEANO C M, et al. Comparative study of the protective capacity againstSalmonella, infection between probiotic and nonprobioticlactobacilli[J]. Journal of Applied Microbiology, 2012, 114(3):861-876.
[5] GAGNON M, KHEADR E E, LE B G, et al.Invitroinhibition ofEscherichiacoliO157:H7 byBifidobacterialstrains of human origin[J]. International Journal of Food Microbiology, 2004, 92(1):69-78.
[6] DE W R, GARSSEN J, BOKKEN G C, et al. Antagonistic activity ofLactobacilluscaseistrain shirota against gastrointestinalListeriamonocytogenesinfection in rats[J]. International Journal of Food Microbiology, 2002, 73(1):93-100.
[7] CEAN A, STEF L, SIMIZ E, et al. Effect of human isolated probiotic bacteria on preventingCampylobacterjejunicolonization of poultry[J]. Foodborne Pathogens & Disease, 2015, 12(2):122-130.
[8] SANTINI C, BAFFONI L, GAGGIA F, et al. Characterization of probiotic strains: an application as feed additives in poultry againstCampylobacterjejuni[J]. International Journal of Food Microbiology, 2010, 141 Suppl 1(8):S98-S108.
[9] 张婷婷, 翟齐啸, 金星,等. 具有拮抗空肠弯曲杆菌能力鸡源乳酸菌的筛选及特性[J]. 微生物学通报, 2017, 44(1):118-125.
[10] 王刚, 金星, 印伯星,等. 1株具有拮抗空肠弯曲杆菌作用的唾液乳杆菌的研究[J]. 中国食品学报, 2014, 14(12):6-12.
[11] 毛丙永. 功能性低聚糖对肠道细菌的影响及机制[D]. 无锡:江南大学, 2015.
[12] 任鹏飞. 乳酸菌益生效应评价体外模型建立及黏附相关机制研究[D]. 北京:中国农业科学院, 2013.
[13] 任真真. 以斑马鱼为模型筛选高黏附性乳酸菌及其免疫调节作用的研究[D]. 杭州:浙江工商大学, 2015.
[14] 任大勇. 益生乳酸杆菌的黏附及免疫调节作用研究[D]. 长春:吉林大学, 2013.
[15] 于卓腾. 鸡肠黏膜乳酸菌的分离鉴定及其益生特性研究[D]. 南京:南京农业大学, 2004.
[16] 杨帆, 冯翔, 阮羚,等. 基于皮尔逊相关系数法的水树枝与超低频介损的相关性研究[J]. 高压电器, 2014,50(6):21-31.
[17] SALAHEEN S, NGUYEN C, HEWES D, et al. Cheap extraction of antibacterial compounds of berry pomace and their mode of action against the pathogenCampylobacterjejuni[J]. Food Control, 2014, 46:174-181.
[18] WANG G, ZHAO Y, TIAN F, et al. Screening of adhesive lactobacilli with antagonistic activity againstCampylobacterjejuni[J]. Food Control, 2014, 44(44):49-57.
[19] STERN N J, SVETOCH E A, ERUSLANOV B V, et al. Isolation of aLactobacillussalivariusstrain and purification of its bacteriocin, which is inhibitory toCampylobacterjejuniin the chicken gastrointestinal system[J]. Antimicrobial Agents & Chemotherapy, 2006, 50(9):3 111-3 116.
[20] COLE K, M B FARNELL, A M DONOGHUE, et al. BacteriocinsreduceCampylobactercolonizationand alter gut morphology in turkey poults[J]. Poultry Science, 2006, 85(9):1 570-1 575.
[21] AIBA Y, NAKANO Y, KOGA Y, et al. A highly acid‐resistant novel strain ofLactobacillusjohnsoniiNo. 1088 has antibacterial activity, including that againstHelicobacterpylori, and inhibits gastrin-mediated acid production in mice[J]. Microbiologyopen, 2015, 4(3):465-474.
[23] HAAG L M, FISCHER A, OTTO B, et al.Campylobacterjejuniinfection of infant mice: acuteenterocolitis is followed by asymptomatic intestinal and extra-intestinal immuneresponses[J]. European Journal of Microbiology & Immunology, 2012, 2(1):2-11.
[24] LEA MH, ANDRÉ F, BETTINA O, et al. Intestinal microbiotashifts towards elevated commensalEscherichiacoliloads abrogate colonization resistance againstCampylobacterjejuniin mice[J]. Plos One, 2012, 7(5):e35988.
[25] 金星. 具有拮抗空肠弯曲杆菌效应的乳酸菌的研究[D]. 无锡:江南大学, 2014.
[26] MAKRAS L, TRIANTAFYLLOU V, FAYOLMESSAOUDI D, et al. Kinetic analysis of the antibacterial activity of probiotic lactobacilli towardsSalmonellaentericaserovarTyphimurium reveals a role for lactic acid and other inhibitory compounds[J]. Research in Microbiology, 2006, 157(3):241-247.
[27] GOPAL P K, PRASAD J, SMART J, et al. In vitro adherence properties ofLactobacillusrhamnosusDR20 andBifidobacteriumlactisDR10 strains and their antagonistic activity against an enterotoxigenicEscherichiacoli[J]. International Journal of Food Microbiology, 2001, 67(3):207-216.
[28] SAMOT J, LEBRETON J, BADET C. Adherence capacities of oral lactobacilli for potential probiotic purposes[J]. Anaerobe, 2011, 17(2):69-72.
[29] 王坤, 闫颖娟, 姜梅,等. 保加利亚乳杆菌和嗜热链球菌生物膜形成研究[J]. 食品科学, 2011, 32(19):184-187.
[30] LIN W H, WU C R, FANG T J, et al. Adherent properties and macrophage activation ability of 3 strains of lactic acid bacteria[J]. Journal of Food Science, 2011, 76(1):M1-M7.
[31] 赵煜. 具有拮抗空肠弯曲杆菌功效的乳酸菌的研究[D]. 无锡:江南大学, 2012.
[32] MORITA H, HE F, FUSE T, et al. Adhesion of lactic acid bacteria to CaCo-2 cells and their effect on cytokine secretion[J]. Microbiology & Immunology, 2002, 46(4):293-297.
AnalysisonbiologicalcharacteristicsoflacticacidbacteriaanditsantagonisticactivityagainstCampylobacterjejunicolonizationinmice
WANG Gang1*, HE Yu-feng1, CHEN Xiao-hua2,ZHAO Jian-xin1, ZHANG Hao1, CHEN Wei1
1(School of Food Science and Technology, Jiangnan University, Wuxi 214122, China) 2(College of Life Science and Environment, Hengyang Normal University, Hengyang 421008, China)
In this study, 3-week-old C57BL / 6 mice were used to establish a infection model byCampylobacterjejuni. 8 strains of lactic acid bacteria capable of inhibiting the growth ofCampylobacterjejuniin vitro were engaged to estimate the antagonistic activity againstCampylobacterjejunicolonizationinvivo. Meanwhile, the biological characteristics such as the growth rate, acid production ability, biofilm formation ability and adhesion ability of the 8 strains were also measured. It was found that the differences of biological characteristics inter-species of 8 strains were greater than that of biological characteristics intra-species.Furthermore, the ability of lactic acid bacteria to antagonizeCampylobacterjejunicolonization in mice was positively correlated with the adhesion ability of bacteria.LactobacillusplantarumN8 and N9 with the highest adhesion index could effectively removeCampylobacterjejuniin the intestine of model mice. These two strains have the potential application value to prevent the human body fromCampylobacterjejuniinfection. This study also provides a theoretical basis for the screening of probiotics with antagonistic ability against pathogens.
lactic acid bacteria;Campylobacterjejuni; antagonistic activity; adhesion ability; mice infection model
10.13995/j.cnki.11-1802/ts.014093
博士,副教授(本文通讯作者,E-mail:wanggang@jiangnan.edu.cn)。
国家自然科学基金-青年科学基金项目(31601444,31301407)
2017-02-20,改回日期:2017-03-09
