低强交变磁场促进灰树花液体发酵及其生物学窗效应研究
2017-09-22李心怡叶晓非马海乐刘伟民孙玲孔娜
李心怡,叶晓非,马海乐,刘伟民,孙玲,孔娜
(江苏大学 食品与生物工程学院,江苏省食品物理加工重点实验室,江苏 镇江,212013)
低强交变磁场促进灰树花液体发酵及其生物学窗效应研究
李心怡,叶晓非*,马海乐,刘伟民,孙玲,孔娜
(江苏大学 食品与生物工程学院,江苏省食品物理加工重点实验室,江苏 镇江,212013)
使用实验室自制磁场摇床,以灰树花为研究对象,通过改变交变磁场作用各参数条件,研究其对灰树花菌丝体生长促进效果的影响,并借助发酵液pH值的变化对窗效应的发生原因进行了初步探讨。通过扫描电镜、红外光谱、一般性化学成分分析等手段,对比常规液态发酵和磁场辅助液态发酵所得菌丝体的差别。研究表明,当磁感应强度为35 Gs、初次磁处理介入时间为接种后1 h、作用时长为3 h时,磁场对灰树花菌丝体的生长促进作用最强,灰树花的菌丝体干质量提高率达11.43%,各营养成分总量均有所上升。在磁场处理时长为3 h和5 h时,出现了磁场促进灰树花生长的“生物学窗效应”。
灰树花;液体发酵;交变磁场;窗效应
灰树花(Grifolafrondosa,G.frondosa) 又名贝叶多孔菌(Polyporusfrondosa)、千佛菌、莲花菌等,是一种担子菌纲、多孔菌目、多孔菌属的高档药、食两用真菌,其子实体脆嫩鲜美,味如鸡丝,干菇具有独特香气[1]。现有研究表明,在诸多生物活性物质中,富含 β-1,6-及 β-1,3-糖苷键的灰树花多糖(特别是灰树花D组分)被认为是其最主要的活性成分,具有降血糖[2]、降血脂[3]、降胆固醇[4],调节机体免疫能力[5],抗肿瘤[6]等效用。此外对灰树花浸膏粉的化学成分分析,其菌丝体亦富含蛋白、氨基酸、微量元素、维生素等营养元素[7]。
灰树花于1965年左右由日本研究人员首次人工栽培成功,因其丰富的营养价值极受推崇,被誉为“食用菌王子”。我国的首次栽培记录于1983年,浙江、河北、福建、四川等地栽培较多,是中国食品药品监督管理总局(CFDA)认可的保健食品原料,是WHO和FAO组织向发展中国家推荐的名贵经济品种,近年来受到极大关注。现已开发多种保健品,如:“灰树花胶囊(麦特消)”(国药准字B20020023)、“维吉尔胶囊”(卫食健字(2003)第0320号)、MAIEXT(日本)以及Grifron系列产品(美国)等[8]。
目前我国灰树花工业化生产技术仍较为原始,基本采用固体菌种直接出菇的方法,灰树花多糖的提取也依赖于子实体,但该方法原料品质及环境条件难以控制,生长周期长,占地面积大,产量不稳定,易受杂菌污染,属于劳动密集型产业。相比固体培养,食用菌液体深层培养具有原料来源广泛,周期短,品质产量稳定,环境条件易于控制,少杂菌污染等优点[9],深层发酵的发酵液还可用于提取多种代谢产物如真菌多糖、氨基酸、多肽等,提高原料利用率。故国内外对灰树花的液态深层发酵研究逐渐增多,主要通过筛选诱变菌种、优化培养条件、添加无机微粒子等方法提高灰树花液体发酵效率,但该类方法只能针对某种特定的菌种,无法普遍适用,研究成本高、耗时长。
物理学方法在食品加工领域的主要应用包括食品分离、食品加工、食品非热加工、农产品品质快速检测等[10],早期应用在微生物发酵中相对较少,低频交变磁场的应用更不常见。生物磁学作为一门新型边缘学科,近年来研究逐渐深入,出现了利用磁场(稳恒磁场、低频交变磁场)促进微生物生长或促进某种微生物代谢产物合成的研究。目前研究者已发现磁场可以促进平菇的生长,在菌体数量、色泽、整齐度方面均能有所提高[11]。高梦祥等[12-13]通过研究发现一定条件下的交变磁场对啤酒酵母、猴头菌等菌种的生长具有促进作用。王蓓等[14]研究发现,静磁场可显著促进樟芝菌丝体液态发酵,同时显著提高发酵产物中三萜的产量。但尚无有关灰树花生物磁效应的相关研究,本项目采用摇瓶试验的方式,对灰树花菌株液态发酵进行研究,探索磁场(低频交变磁场)作用下,磁感应强度、初次磁处理介入时间以及每天作用时长等条件因素对灰树花液体发酵菌丝体产量、营养成分等的影响,旨在提高液体发酵生产灰树花的效率,以期为后一步灰树花液体发酵工业化扩大生产提供一种普遍适用的提高产率的新思路。
1 材料与方法
1.1仪器设备
本试验使用的磁场摇床设备图如图 1 所示,其中1为220V交流电源;2为TDGC2-3k 3000VA单相接触调压器(磁感应强度通过变压器调节);3为绕线圈摇床孔(6个摇床孔大小一致,所绕线圈参数一致,故各磁场发生器中的磁感应强度全部相等);4为试验用250 mL三角烧瓶;5为摇床;6为摇床电源开关;7为转速调节按钮;8为转速显示屏(转速设定为150 r/min)。磁感应强度通过高斯计测定。试验组三角瓶被放置在磁场发生器中,温度通过空调控制在28 ℃左右。
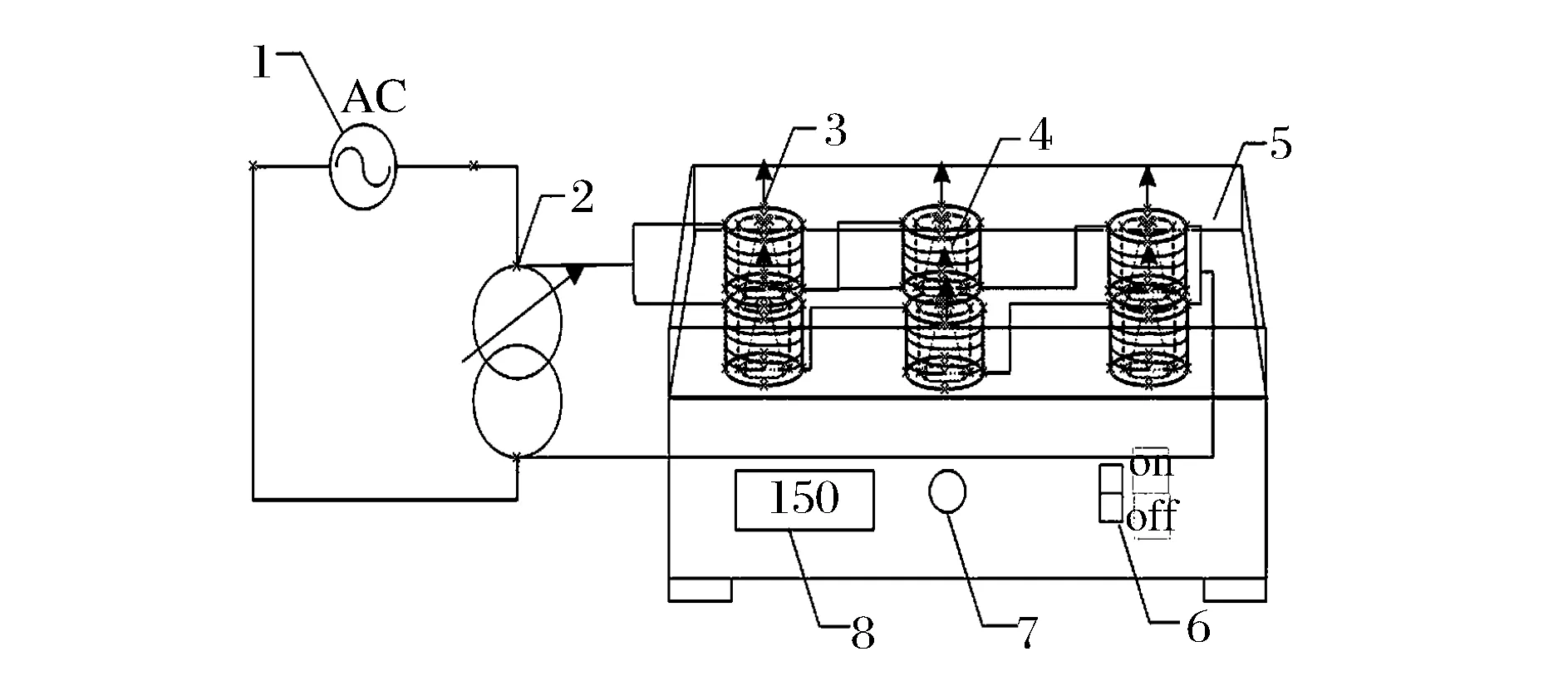
图1 磁场摇床试验装置示意图Fig.1 Schematic diagram of magnetic shaking incubators
JZ5002型电子天平,上海天平仪器厂;G154DWS型立式灭菌锅,南京庚辰科学仪器有限公司;VS-1300L-U型洁净工作台,苏净基团苏州安泰空气技术有限公司;PSX-280H型恒温培养箱,宁波莱福科技有限公司;HYL-C型摇床,太仓市强乐实验设备有限公司;LD5-2A型离心机,北京医用离心机厂;PHS-25酸度计,上海理达仪器厂;HH-S数显恒温水浴锅,江苏省金坛市医疗仪器厂;Nicolet IS50傅里叶变换红外光谱仪,美国尼高力仪器公司。
1.2菌株
灰树花(G.frondosa)菌株由江苏大学食品与生物工程学院刘伟民教授惠赠。保存于中国典型培养物保藏中心(CCTCC),菌种保藏编号M2011113。
1.3主要试剂
葡萄糖、MgSO4、KH2PO4、NaOH、氯仿、正丁醇、浓HCl、浓H2SO4、无水乙醇、无水乙醚等:分析纯;大豆蛋白胨、琼脂粉等:生物试剂,国药集团化学试剂有限公司;马铃薯浸出粉:生物试剂,杭州百思生物技术有限公司。
1.4培养基的配置
1.4.1 斜面培养基
马铃薯浸出粉6 g/L、葡萄糖20 g/L、MgSO40.75 g/L、KH2PO41.50 g/L、大豆蛋白胨5 g/L和琼脂粉20 g/L。分装至20 mm×200 mm的具塞试管中,每支装入10 mL。用2层报纸封口,将封装好的试管置于灭菌锅中,121℃灭菌20 min。
1.4.2 种子液培养基
马铃薯浸出粉6 g/L、葡萄糖20 g/L、MgSO40.75 g/L、KH2PO41.50 g/L和大豆蛋白胨5 g/L。分装至250 mL的三角瓶中,每瓶装入100 mL。用8层纱布和2层报纸封口,将封装好的三角瓶置于灭菌锅中,121 ℃灭菌20 min。
1.4.3 摇瓶发酵培养基
配制方法同1.4.2 种子液培养基液体种子培养基配制。
1.5培养方法
1.5.1 菌种保藏方法
将灰树花(G.frondosa)接种于PDA斜面,28 ℃恒温培养5 d,置于4 ℃冰箱中备用。每3个月转接1次。
1.5.2 种子液培养方法
从活化后的斜面上,用接种铲切取面积0.5 cm×0.5 cm的菌体,转接入装有100 mL种子液培养基的250 mL三角瓶中,28 ℃、180 r/min 条件下振荡培养5 d。
1.5.3 对照组发酵的摇瓶培养
以10%体积分数的接种量,将灰树花种子液接入摇瓶发酵培养基中。发酵对照组放置于恒温培养摇床上培养,培养条件为温度28 ℃、振荡速度150 r/min、发酵5 d。每个处理水平设3个生物重复。
1.5.4 磁场辅助发酵条件的优化试验
以10%体积分数的接种量,将灰树花种子液接入摇瓶发酵培养基中。发酵试验组放置于恒温培养摇床上培养,每天于相同时间段取出转移至自制磁场摇床中,开启磁场摇床,对发酵液施加一定时长、一定强度的弱磁场,在磁辅助处理结束后迅速将样品返回至恒温培养摇床上继续培养。计划通过试验优化的参数为:磁感应强度、接种后初次磁处理介入时间、磁处理时长。其他发酵条件同发酵对照组,每个处理水平设3个生物重复。
1.6灰树花发酵菌丝体干重的测定
将发酵所得的菌丝体离心(5 000 r/min,10 min),用蒸馏水冲洗除去表面所黏附的培养液,放入鼓风干燥箱中,50 ℃条件下干燥至恒质量,电子天平称量即得菌丝干质量。菌丝体干重提高率按公式(1)计算:
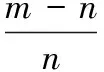
(1)
式(1)中:L为菌丝体干重提高率;m为各磁场辅助发酵条件处理后的灰树花菌丝干质量;n为对照组灰树花菌丝干质量。
1.7灰树花发酵液pH的测定
使用pH计对发酵所得的菌液直接进行测定。
1.8扫描电镜观察菌丝体
对照组和试验组同时取时间点为第4次磁处理结束后的湿菌丝体用,0.1 mol/L PBS缓冲液清洗3次,以除净菌体上的培养基成分。加入2.5%戊二醛固定液,4 ℃冰箱中固定2 h以上。再用0.1 mol/L PBS清洗3次,15 min/次。依次采用50%、70%、80%、90%、95%、100%体积分数的乙醇梯度脱水各1次,15 min/次。再用加入饱和Na2SO4的无水乙醇脱水15 min。CO2临界点干燥。将干燥后的样品固定在干净的铝箔片上,置于样品仓中进行喷金处理。样品取出后,置于扫描电镜观察室中进行观察。
1.9灰树花菌丝体水溶性粗多糖红外光谱的测定
根据1.6菌丝体生物量测定结果确定磁场辅助发酵条件下摇瓶培养的最优条件。
将最优磁处理辅助条件下发酵生产出的菌丝体和对照组菌丝体分别冷冻干燥后研磨粉碎,与蒸馏水按1∶25(v/v)料液比混合,80 ℃水浴6 h。使用布氏漏斗过滤取上清液,减压浓缩至原体积的1/10。加入Sevage试剂[V(浓缩上清液)∶V(氯仿)∶V(正丁醇)=25∶4∶1),充分振摇20 min后,静置萃取,取上层溶液,重复脱蛋白,直到蛋白层消失,即得除去蛋白的粗多糖溶液。将4倍体积的无水乙醇缓慢加入多糖溶液中,于4 ℃冰箱中静置过夜,在3 000 r/min 下离心20 min,收集沉淀。沉淀冷冻干燥至恒重,得最优发酵条件下生产出的菌丝体和对照组菌丝体水溶性粗多糖。
将提取后的粗多糖粉末放入样品槽,按照仪器操作流程对样品进行测试。
对比对照组常规液态发酵培养的灰树花粗多糖的红外谱图和最优磁处理辅助条件下发酵培养的灰树花粗多糖的红外谱图,根据红外光谱特征吸收频率和红外特性吸收谱带的出现与否,研究2种粗多糖样品的成分是否发生变化。
1.10灰树花菌丝体一般性化学成分的测定
根据1.6小节菌丝体生物量测定结果确定磁场辅助发酵条件下摇瓶培养的最优条件。分别对最优磁处理辅助条件下发酵和对照组发酵生产的菌丝体进行化学成分测定试验。
将待测菌丝体冻干后,粉碎过60目筛,水分以冻干的子实体为样品,总糖、粗蛋白、粗脂肪按干物质计算,粗纤维检测样品未粉碎过筛。
各项指标测定方法如下:
水分测定:按照 GB 5009.3—2016“食品中水分的测定”进行测定,选用直接干燥法测定;
总糖测定:按照按照 GB/T 15672—2009“食用菌中总糖含量的测定”进行测定;
粗蛋白测定:按照 GB 5009.5—2016“食品中蛋白质的测定” 进行测定,选用凯氏定氮法测定;
粗脂肪测定:按照 GB 5009.6—2016“食品中脂肪的测定”进行测定,选用索氏抽提法测定;
粗纤维测定:按照 GB/T 5009.10—2003“植物类食品中粗纤维的测定”进行测定。
1.11数据处理
试验数据采用SPSS17.0软件进行处理。图和表中结果为3个生物重复的平均值±标准偏差。采用one way ANOVA 进行试验数据的方差分析,P<0.05表示显著差异。
2 结果与分析
2.1磁感应强度对灰树花发酵菌丝体干重提高率的影响
通过先期预实验结果,预设磁处理初次介入时间为接种后1 h,每天于同一时间段磁场处理时长设为3 h,磁感应强度分别调至:15、25、35、45、55 Gs。磁感应强度对菌丝体干重提高率的影响如图2所示。由图2可知,磁感应强度为35 Gs时,菌丝体干重提高率最高。因此后续试验选择35 Gs为最佳磁处理强度。
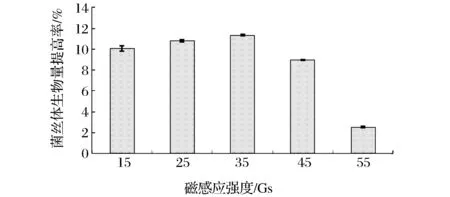
图2 磁感应强度对灰树花发酵菌丝体干重提高率的影响Fig.2 Effect of magnetic field induction on dry weight of G. frondosa
2.2接种后初次磁处理介入时间对灰树花发酵菌丝体干重提高率的影响
将每天同一时间段磁场处理时长设为3 h,磁感应强度调至35 Gs,依次在接种后1、7、13、18、23 h开始进行初次磁处理。初次磁处理介入时间对菌丝体干重提高率的影响如图3所示。由图3可知,在接种后1 h开始进行初次磁场处理,菌丝体干重提高率最高。因此,后续试验选择初次磁处理介入时间为1 h。
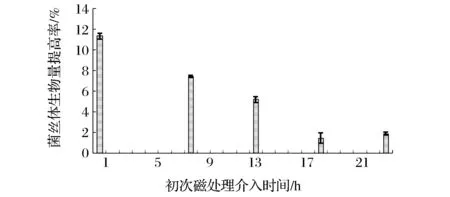
图3 磁场处理开始时间对灰树花发酵菌丝体干重提高率的影响Fig.3 Effect of magnetic treatment start time on dry weight of G. frondosa
2.3磁处理时长对灰树花发酵菌丝体干重提高率的影响
将初次磁处理介入时间定为1 h,磁感应强度调至35 Gs,磁处理时长分别设定为:1、2、3、4、5、6、7 h。磁处理时长对菌丝体干重提高率的影响如图4所示。由图4可知,每天磁处理时长3 h时菌丝体干重提高率最高。
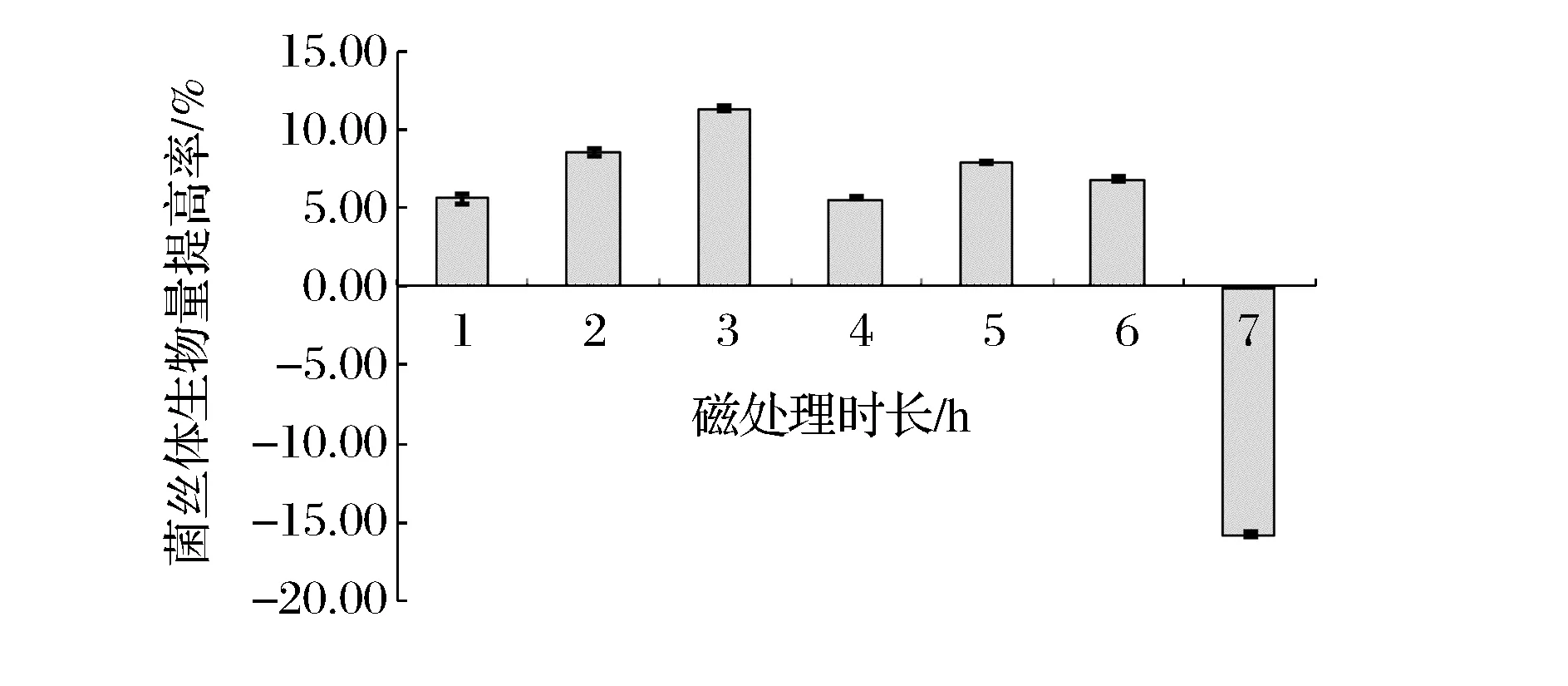
图4 磁处理时长对灰树花发酵菌丝体干重提高率的影响Fig.4 Effect of magnetic treatment exposure time on dry weight of G. frondosa
经过单因素逐级优化,获得灰树花磁场辅助液体发酵最佳的条件为初次磁处理介入时间为接种后1 h、磁感应强度35 Gs、每天于同一时间段磁处理时长3 h。在该条件下,与对照组相比,菌丝体干重提高率达到11.43%。
2.4低强磁场辅助发酵“生物学窗效应”的初步研究
磁处理时长反映了对发酵液施加磁作用剂量的大小,从图4可以看出,在磁处理时长1~7 h之间出现了2个峰值,这个规律应该是低强交变磁场对微生物活性影响表现出的“生物学窗效应”。电磁波的生物学窗效应是指只有某些个离散的、电磁场参数(例如频率、场强、作用时间等)区间极窄的电磁波才能产生的生物学效应[15]。作者在脉冲强磁杀菌时多次发现了生物学窗效应,并通过钙离子的跨膜行为等方法进行了窗效应发生机制的探讨[16-17]。
微生物发酵过程中pH值与微生物的生长状况有密切的关系,因此可以通过测定不同磁处理时长下发酵液pH值的变化,初步探索生物学窗效应发生的原因。图5是不同磁处理时长下5天发酵结束后发酵液的最终pH值。从图5可以看出,发酵液pH值和菌丝体干重提高率的变化趋势基本一致,也大致在相同的位置出现2个峰值,初步说明窗效应的发生与发酵液pH值的变化有关(对照组pH 3.82)。当然,对于低强磁场促进微生物发酵是否有窗效应发生及其发生的机理,尚需进行更深入的研究。
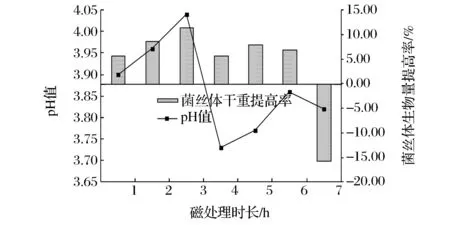
图5 磁场处理时长对发酵液pH的影响Fig.5 Effect of magnetic treatment exposure time on the pH
2.5扫描电镜观察结果
通过扫描电镜对样品表面的超微形貌进行观察,从图6可以看出,普通液态发酵进行到第76 h(第4次处理结束)时获得的灰树花菌丝体(图6 A)表面光滑饱满,菌丝直径一致且弯折较少,结构致密,菌丝体上开始出现小分枝。而磁场辅助发酵获得的菌丝体(图6 B)发酵进行到第76 h时,菌丝体表面粗糙、坑洼、部分细胞壁被破坏,菌丝直径明显不一、旋转弯折严重,结构较对照组疏松,菌丝体上出现大量小的新分枝,部分分支点同时出现多个小分枝。在磁处理后菌丝体分枝明显变多,菌丝体出现应激反应,生长速度加快,从而达到促进发酵的作用,并且磁处理后的菌丝体更为松散,松散的结构有助于发酵液中的营养物质和代谢物等物质的传递运输,也可能导致试验组生长速率相对更快。

图6 普通发酵(A)与磁场辅助发酵(B)所得灰树花菌丝体Fig.6 Mycelia from traditional (A) and magnetic field (B) fermentation of G. frondosa
2.6灰树花菌丝体水溶性粗多糖红外光谱测定结果
灰树花多糖(Grifolafrondosapolysaccharide,GFP)是灰树花中极为重要的生物活性物质。图7是对照组和最优条件下试验组菌丝体水溶性粗多糖的红外图谱。由于多糖结构的相似性,其红外光谱具有一些相同的特征吸收峰。
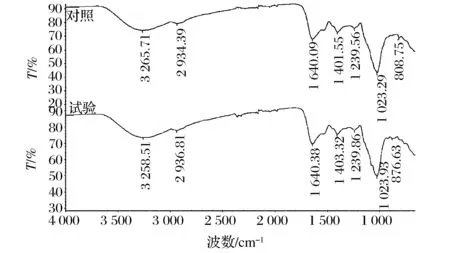
图7 对照组与试验组菌丝体多糖的红外图谱Fig.7 Infrared spectrum of mycelia polysaccharide from control group and experimental group of G. frondosa

2.7灰树花菌丝体一般性化学成分分析
常规发酵对照组和最优磁场辅助发酵试验组菌丝体各一般性化学成分分析结果见表1。通过试验发现,试验组纤维、总糖含量较对照组提高,水分、粗蛋白含量较对照组降低,粗脂肪含量无明显变化。其中粗纤维含量的极显著增高可能是由磁场辅助处理对细胞产生破坏作用后,细胞的应激性反应造成。粗蛋白含量的降低可能是由于磁场辅助处理改变细胞膜通透性后,菌丝体内的营养成分向发酵液中转移造成(由于发酵液营养成分的测定会受到培养基成分的影响,本研究只侧重研究菌丝体营养成分)。
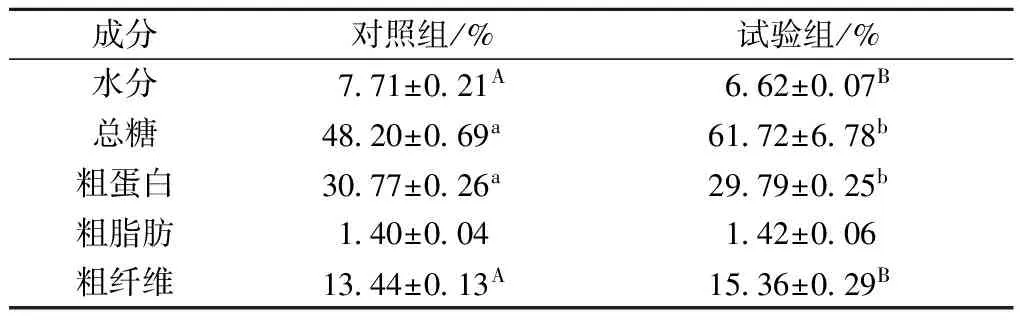
表1 对照组与试验组菌丝体一般性成分分析
注:同一行不同小写字母表示两个数据存在显著差异(p<0.05),同一行不同大写字母表示2个数据存在极显著差异(p<0.01)
3 结论
(1)灰树花磁场辅助液体发酵最佳的条件为:磁感应强度为35 Gs、初次磁处理介入时间为接种后1 h、每天同一时间段磁辅助处理时长为3 h。在该条件下,菌丝体干重提高率达到11.43%。
(2)在磁场处理时长为3 h和5 h时,出现了磁场促进灰树花生长的“生物学窗效应”,借助发酵液pH值的变化对窗效应的发生原因进行了初步探讨。
(3)通过扫描电镜观察,低强交变磁场造成灰树花菌丝体表面皱缩、菌丝旋转,部分菌丝体出现膨大和变细,同时试验组菌丝体较对照组产生更多的分枝,且菌丝体结构更为松散,这可能是其能促进菌丝体生长的原因。
(4)通过对对照组及试验组水溶性粗多糖的红外光谱测定分析可以判断,2种发酵方法获得的菌丝体多糖相同或为相似同系物。
(5)通过一般性化学成分分析,虽然试验组菌丝体中的部分营养成分含量较对照组有所降低,但由于交变磁场辅助处理对菌丝体生物量的提高,营养成分总量仍较对照组均有所提高。同时经过测算,最优条件下每次摇瓶试验总用电量约0.3 kW。由此可见,清洁、安全的磁辅助发酵技术能耗极低,具有较强的实用意义。
[1] 郭家瑞,王卫国,李磊,等.灰树花研究概述[J].食用菌,2010(4):1-2.
[2] PREUSS H G, ECHARD B, BAGCHI D, et al. Enhanced insulin-hypoglycemic activity in rats consuming a specific glycoprotein extracted from maitake mushroom[J].Mol Cell Biochem,2007,306(1):105-113.
[3] PREUSS HG, BOBBY E, DEBASIS B, et al. Maitake mushroom extracts ameliorate progressive hypertension and other chronic metabolic perturbations in aging female rats[J].International Journal of Medical Sciences,2010,7(4):169-180.
[4] FUKUSHIMA M, OHASHI T.Cholesterol-lowering effects of maitake (Grifolafrondosa) fiber shiitake (Lentinusedodes) fiber, and enoditake (Flammulinavelutipes) fiber in rats[J].Exp Biol Med (Maywood),2001,226(8):758-765.
[5] 李小定,吴谋成,曾晓波,等.灰树花多糖 PGF-1 对荷瘤小鼠免疫功能的影响[J].华中农业大学学报,2002,21(3):261-263.
[6] KONNO S. Potential growth inhibitory effect of maitakeD-fraction on canine cancer cells[J].Vet Ther,2004, 5(4):263-271.
[7] 徐洁,陈体强,朱培根,等.灰树花浸膏粉的生产及其化学成分分析[J].江西农业大学学报,2000,22(3):428-430.
[8] 边杉,叶波平,奚涛,等.灰树花多糖的研究进展[J].药物生物技术,2004,11(1):60-63.
[9] 顾顺明,孙 晔,王潞江,等.发酵法生产灰树花菌丝体的研究[J].工业微生物,2003,33(4):1-4.
[10] 马海乐,周存山,曲文娟,等.食品物理加工技术研究进展[J].食品科学,2011,33(1):103-107.
[11] 王式媛,刘松. 平菇磁处理效应研究[J].辽宁农业科学,1997(3):28-29.
[12] 高梦祥,夏帆,胡秋冬. 交变磁场对啤酒酵母的生长促进效应[J].农业机械学报,2007,38 (7):91-93.
[13] 高梦祥,夏帆,朱朋涛. 交变磁场对猴头菌生长作用的研究[J].农业机械学报, 2009,40(2) :139-141.
[14] 王蓓,王薇薇,马海乐,等. 静磁场辅助液态发酵对樟芝菌丝体及三萜产量的影响[J].中国农业科技导报,2015,17(5) :99-105.
[15] 牛中奇,侯建强,王海彬,等. 电磁波的生物学窗效应[J].中国生物医学工程学报, 2003,22(2):126-132.
[16] 许审时,马海乐. 金黄色葡萄球菌脉冲磁场杀菌实验、生物学窗效应及其失活动力学[J],食品科学,2010,31(21):20-23.
[17] HE RONGHAI, MA HAILE, WANG HELI. Inactivation ofE.coliby high-intensity pulsed electromagnetic field with a change in the intracellular Ca2+concentration[J].Journal of Electromagnetic Waves and Applications,2014,28(4):459-469.
StimulationofGriflolafrondosaliquidfermentationthroughlow-intensityalternatingmagneticfieldanditspreliminarystudyofbiologicalwindoweffects
LI Xin-yi, YE Xiao-fei*, MA Hai-le, LIU Wei-min, SUN Lin, KONG Na
(School of Food and Biological Engineering, Jiangsu University, Jiangsu Provincial Key Laboratory for Food Physical Processing, Zhejiang 212013, China)
The stimulation ofGriflolafrondosafermentation through alternating magnetic field was studied by using a self designed generator with adjustable magnetic field intensity, magnetic treatment start time and exposure time. The reason for occurrence of biological window effects was preliminarily discussed by virtue of the pH of fermentation liquor. Scanning electronic microscope (SEM), infrared spectroscopy (IR), and general chemical composition analysis were used to compare and analyze the differences between normal liquid state fermentation and magnetic field liquid state fermentation. Results showed that when the intensity of the magnetic field was 35 Gs, magnetic treatment start time was 1 h after inoculation and exposure time was 3 h, the stimulation forGriflolafrondosaliquid fermentation was the strongest, and the dry weight of theGriflolafrondosaincreased 11.43% and all the nutrients were increased. When the exposure time of the magnetic field was 3 h and 5 h, biological window effects of low-intensity alternating magnetic field onG.frondosawas found.
Griflolafrondosa;liquid fermentation;alternating magnetic field;window effects
10.13995/j.cnki.11-1802/ts.014492
硕士研究生(叶晓非教授为通讯作者,E-mail:yexx0023@yahoo.com)。
国家科技支撑计划(2012BAD36B05)
2017-04-10,改回日期:2017-05-03
