植物花青素通过JNK信号通路抗肿瘤机制研究进展
2017-09-22郅琦
郅 琦
李福香1
杨雅轩1
田 勇1
唐 宇1
石 芳1
明 建1,2
(1. 西南大学食品科学学院,重庆 400715;2. 重庆市特色食品工程技术研究中心,重庆 400715)
植物花青素通过JNK信号通路抗肿瘤机制研究进展
郅 琦1
李福香1
杨雅轩1
田 勇1
唐 宇1
石 芳1
明 建1,2
(1. 西南大学食品科学学院,重庆 400715;2. 重庆市特色食品工程技术研究中心,重庆 400715)
文章综述了JNK信号通路的组成及活化机制,总结了植物花青素通过该信号通路抑制乳腺癌、前列腺癌、肝癌等恶性肿瘤发生、增殖、侵袭和凋亡的能力,以期为植物花青素应用于功能食品和药品的开发提供依据。
植物花青素;JNK;信号通路;抗肿瘤机制
癌症是指细胞不受控制地生长、侵袭、转移形成恶性肿瘤,是全球面临高发病率和死亡率的健康问题。细胞可通过胞内信号转导网络对环境做出反应,肿瘤抑癌基因的抑制是细胞内信号通路的重要机制[1]。JNK信号通路作为胞内一种重要的信号转导网络,可被细胞因子、细胞应激等多种因素刺激活化,在细胞增殖、分化、侵袭、转移、细胞凋亡等生物过程中起着至关重要的调控作用。众多研究[2]证实,JNK信号通路与多种恶性肿瘤的发生和发展密切相关,可作为恶性肿瘤的分子治疗靶点。
植物花青素是水果和蔬菜中最丰富的黄酮类化合物,赋予水果和蔬菜以红色、紫色和蓝色,如葡萄、石榴、紫甘蓝、紫薯等。流行病学研究[3]显示,植物花青素具有抗氧化和抗炎症等活性,日常摄入能够有效降低心血管疾病、糖尿病、关节炎和癌症的风险。植物花青素还可以保护DNA,能有效减缓细胞凋亡和恶性肿瘤的增殖速率[4]。尽管目前国内外对植物花青素抗癌机制的研究并不全面,但可以肯定的是植物花青素通过JNK信号通路调节多重基因的表达和活化,在调控实体肿瘤,如胃癌[5]、乳腺癌[6-7]、前列腺癌[8]、肝癌[9]、结肠癌[10]、食管癌[11]中发挥着重要的作用。
研究[12]表明,植物花青素与肿瘤细胞的增殖、分化、侵袭、转移以及凋亡等生命过程密切相关。本文综述了植物花青素通过JNK信号通路对肿瘤细胞的调控机制,总结了JNK信号通路与肿瘤发生的关系,阐述了植物花青素在抑制不同恶性肿瘤增殖、侵袭和凋亡的作用机制,旨在为研究植物花青素抗肿瘤的作用机制提供参考。
1 JNK信号通路概述
JNK是丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号通路中最为重要的一条信号通路[13],又称应激激活的蛋白激酶(SAPK),是一种c-Jun氨基末端激酶(c-Jun N-terminal kinase)的蛋白激酶,属于“应激诱导”的MAPK[14]。当苏氨酸和酪氨酸的残基发生磷酸化后,JNK信号被激活,主要参与细胞生长、凋亡、增殖、侵袭、代谢和DNA损伤修复等过程,尤其是与恶性肿瘤的发生和发展密切相关,如大肠癌、食道癌、结肠癌等[15]。
1.1 JNK信号通路的组成结构
JNK位于细胞质中,蛋白激酶由3个编码基因组成:JNK1、JNK2、JNK3,其中JNK1、JNK2基因在全身广泛表达,JNK3则主要在神经元和心脏组织中局限性表达,如睾丸、心脏、大脑等。每个编码基因都可以编码4.6×104和5.4×104的蛋白产物。3种基因通过不同的方式磷酸化不同的底物,如c-Jun、ATF2、Elk1、p53等。JNK1是由一个较小结构域的β折叠氨基末端和一个较大结构域的α螺旋羧基末端交叉连接,交叉区域为ATP结合位点,羧基末端结构域决定底物的特异性[16]。
JNK1和JNK2主要在病理学和生理学中发挥其功能,特别是免疫系统;JNK3主要在神经系统方面发挥重大作用,特别是对于神经细胞的死亡[17]。不同的JNKs由大量的信号和磷酸化物质(如c-Jun)活化,作为有效的细胞循环进程的重要过程。研究[18]发现在成纤维细胞中,JNK1在c-Jun激活导致的细胞增殖中发挥着重要的作用,而JNK2则通过促进c-Jun降解抑制细胞增殖。JNK3的活性则跟苏氨酸残基的磷酸化有关[19]。
1.2 JNK信号通路的活化与调节
JNK是丝氨酸/苏氨酸蛋白激酶,可被多种刺激物活化,包括环境应力(如紫外线、电离辐射、热冲击、渗透或氧化还原冲击)、炎症性细胞因子和生长因子[20]。
JNK信号通路的活化遵循细胞内磷酸化级联作用。经典的哺乳动物MAPK蛋白序列磷酸化模式包括3个细胞内蛋白酶激活反应,即MAPKKK-MAPKK-MAPK[21]。在JNK信号通路中,激活剂首先激活MAPKKK(如MEKK1/4、MLKs、ASK、TAK1),然后MAPKKK磷酸化并激活MKK4/7,随后MKK4/7通过对酪氨酸和苏氨酸的双重磷酸化激活JNK,活化后的JNK迅速从细胞质移位到细胞核内,并作用于不同的转录因子(如c-Jun、ATF2、Elk1、DPC4、p53、NFAT4等),进而调控细胞的生长、增殖、分化和凋亡等多种细胞生命过程[17]。
在哺乳动物细胞中,JNK的活性主要由蛋白磷酸酶——支架蛋白调节,主要的支架蛋白有:JIP家族蛋白、细丝蛋白、CrkI1Crk和β-抑制蛋白质[22]。其参与的活化机制是蛋白质和蛋白质相互作用,形成蛋白复合体,这些复合体参与激酶与蛋白质的相互作用或激酶间的相互作用,介导JNK的活化[23]。
这2种活化机制(见图1)保证了JNK信号通路能够高效且特异性地传递胞外各种刺激信号进而调控细胞的生命过程。
2 JNK信号通路与肿瘤的发生
目前,国内外对于JNK信号通路与肿瘤的关系尚存在争议,有人认为JNK通路能够促进肿瘤细胞的增殖,促进肿瘤的发生;也有人认为JNK的激活可促进肿瘤细胞的凋亡,抑制肿瘤的发生。
2.1 JNK激活促进肿瘤形成
研究[27]发现,JNK通过激活c-Jun调节细胞活动,JNK调控乳腺癌细胞中c-Jun的活化,使得c-Jun在乳腺癌细胞中表达水平较高,证明了JNK/c-Jun信号通路对肿瘤发生起着促进作用。在患有腺瘤性结肠息肉病的小鼠中,JNK的活性被激活,通过直接磷酸化丝氨酸863刺激mTORC1激酶的活性,促进结肠癌细胞的形成[28]。JNK1作为肿瘤坏死因子(TNF-α)诱导c-Jun磷酸化、细胞增殖的重要激酶,JNK1的激活上调了组蛋白第3亚基4号赖氨酸的三甲基化(histone H3 lysine 4 trimethylation, H3K4me3),进而增强人肝癌基因的表达,促进细胞有丝分裂、代谢及生物成因,证实JNK1激活与细胞分化的基因表达呈负相关[29]。JNK1蛋白在肺癌中的表达高于正常的肺组织,且与分化程度呈负相关,细胞分化程度越低JNK1的表达能力越高,其中低分化的肺癌中JNK1的表达最高[30]。JNK可调控细胞生存,Ruan等[31]研究了JNK对TNF-α诱导的细胞凋亡的作用机制,在HepG2细胞中,过度表达JNK不活跃的突变体和抑制JNK活性的抑制剂均可增强TNF-α诱导的细胞凋亡,强有力地证明了JNK具有抑制TNF-α诱导肿瘤细胞凋亡,其机制在于JNK作为HSP27磷酸化的上游激酶,与NF-κB相互作用调节HSP27的活性。WNT5B被报道在肿瘤细胞系和组织中过度表达[32-34],研究[35]显示,过度表达的WNT5B可显著提高COLO205细胞增殖、迁移和侵袭的能力,其机制在于JNK信号通路活化使得WNT5B细胞过度表达,进而促进结肠癌细胞的发生。
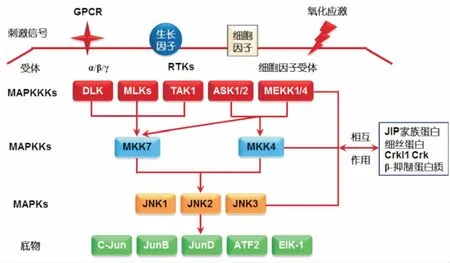
图1 JNK信号通路活化机制[24-26]
2.2 JNK激活抑制肿瘤形成
现有研究[36-37]发现JNK与肿瘤的抑制也密切相关,JNK信号通路的活化可使JNK磷酸化表达上调,调控肿瘤细胞的凋亡,抑制子宫内膜癌、前列腺癌DU145细胞的增殖。JNK在激活外在的死亡受体和固有的线粒体凋亡途径方面起着重要的作用,JNKs通过特定转录因子的反式激活上调促凋亡基因激活凋亡信号,或直接通过磷酸化调控线粒体促凋亡或抗凋亡蛋白活性来达到抑制肿瘤细胞发生的目的[38]。DHA可通过JNK途径上调Bax、caspase3/9和PARP的退化形式,下调Bcl-2的表达和Bcl-2/Bax的比值,从而抑制人胃癌BGC-823细胞的活力[39]。
另外,活性氧(reactive oxygen species, ROS)的产生是诱导肿瘤细胞凋亡的核心步骤之一,与ROS相关的JNK途径的活化对诱导细胞凋亡也十分重要[40]。研究[41]发现,冬凌草甲素可使ROS诱导DNA氧化损伤应答和JNK信号通路的激活,诱导细胞内源性凋亡,抑制ROS的活性可阻滞细胞凋亡和JNK的磷酸化,进而抑制肿瘤生长。
3 植物花青素调节JNK信号通路
植物花青素可以通过JNK信号通路调节肿瘤细胞的生命过程,其抗肿瘤机制与细胞增殖、分化、凋亡和侵袭转移相关,见图2。
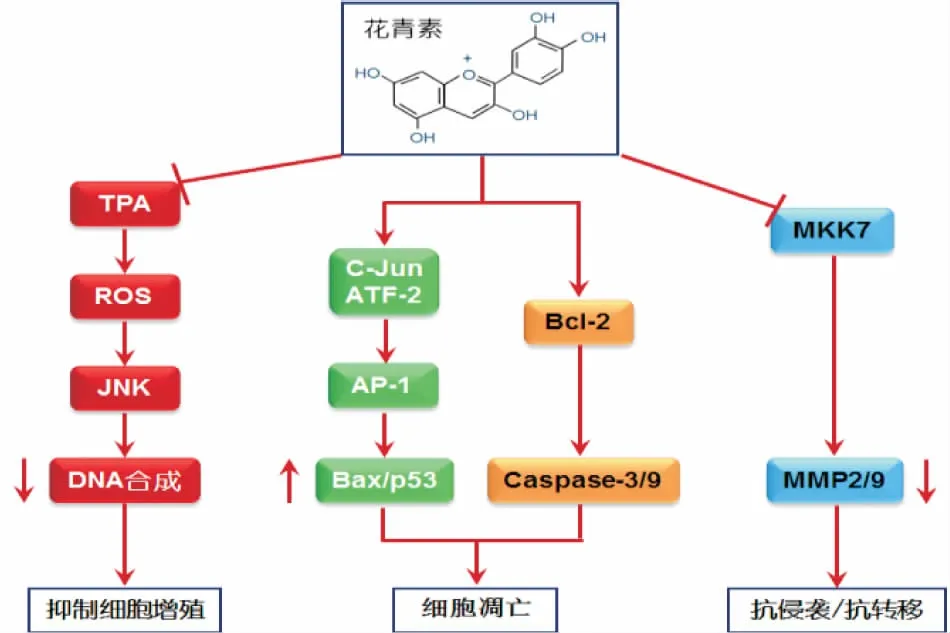
图2 植物花青素通过JNK信号通路抗肿瘤作用机制[42]
3.1 植物花青素与细胞增殖和分化
JNK信号通路调节肿瘤细胞增殖的机制主要与诱导肿瘤细胞凋亡相关,JNK信号通路的关键酶之一——促分裂原活化蛋白激酶MKK4,具有促进肿瘤细胞凋亡,从而抑制肿瘤细胞的增殖的功能[43]。研究[18]发现,JNK在肿瘤细胞中处于过度激活的状态,表明JNK与肿瘤发生密切相关,其机制可能与JNK具有促增殖作用有关。在致癌物Ras/Raf诱导的果蝇肿瘤模型和人脑部肿瘤中发现,JNK信号通路被激活,从而引起肿瘤细胞的异常增殖[44-45]。其调控机制与细胞周期有关,细胞周期分为G1、S、G2和M 4个时期,其中G1期是从有丝分裂到DNA复制前的一段时期,当JNK被刺激因素激活时,JNK迅速从细胞质转移到细胞核,激活c-Jun磷酸化,c-Fos与c-Jun组成异二聚体AP-1,形成转录激活因子,参与调控细胞周期,上调G1期DNA的合成,促进细胞分裂增殖[46]。近年来,国内外关于花青素抗肿瘤机制的研究日益增多。Lim等[47]研究了飞燕草素对ES2卵巢癌细胞的增殖、侵袭和凋亡机制,结果表明飞燕草素治疗组与ES2卵巢癌细胞JNK、ERK1/2和AKT的磷酸化程度呈剂量依赖性,表明飞燕草素可以抑制JNK信号通路下游的靶分子,从而抑制卵巢癌细胞的增殖和侵袭。同样,黑米皮提取物中的花青素可通过激活JNK信号通路,上调p-JNK的表达,改变前列腺癌PC-3细胞的周期分布,将癌细胞阻滞在G1期,使得细胞无法合成DNA,干扰蛋白质代谢,抑制分裂,进而抑制癌细胞的增殖,促使PC-3细胞凋亡[48]。植物花青素对12-O-十四烷酰佛波醇-13-乙酸酯(12-O-tetradecanoyl phorbol-13-acetate, TPA)刺激下的JB6细胞的致瘤性有一定的抑制作用,研究[49]结果显示,B环上具有邻二羟基结构的花青素如飞燕草素能够抑制TPA诱导的细胞癌变和激活蛋白-1的转录,其作用机理在于后期阻断JNK信号通路中c-Jun蛋白激酶的磷酸化表达。植物花青素还可通过下调JNK途径JNK1/2磷酸化抑制TPA诱导的前列腺增生[50]。
3.2 植物花青素与细胞凋亡
JNK可介导多种胞外刺激诱导的细胞凋亡,参与了许多细胞凋亡的发生。JNK调控细胞凋亡通过2个主要的机制:① 活化的JNK通过转录的方式,上调c-Jun和ATF-2磷酸化,激活转录因子AP-1的活性,以及激活Fas/FasL信号通路中相关蛋白的表达,从而上调下游促凋亡蛋白Bax、p53等的表达;② JNK通过非转录方式调节Bcl-2蛋白家族的磷酸化改变线粒体膜电位,诱导细胞色素c的释放,激活caspase-9/3的活化,进一步诱导细胞凋亡。Bcl-2蛋白家族是线粒体途径凋亡的主要调控者,分为促凋亡亚族(如Bax、Bak)、抗凋亡亚族(如Bcl-2、Bcl-xl)以及BH3-only蛋白(如Bim)3类[51-52]。Bax蛋白的上调增强了细胞的促凋亡性,Bcl-2蛋白的下调降低了细胞的抗凋亡性,Bcl-2蛋白的下调和Bax蛋白的上调促进了细胞的凋亡。活化的JNK可留在细胞质中通过磷酸化作用激活Bcl-2蛋白家族中的Bax,也可以磷酸化激活Bim蛋白或抑制抗凋亡蛋白Bcl-2而激活Bax[52]。
植物花青素被认为是诱导多种肿瘤细胞凋亡的诱导剂,如乳腺癌、前列腺癌、结肠癌、肝癌和白血病细胞[53-55]。研究[56]发现,植物花青素可通过JNK信号通路阻滞细胞周期并诱导细胞凋亡。洛神花青素通过阻滞人类血癌细胞MOLT4的细胞周期在subG1期,降低细胞质中线粒体膜电位,上调Bax、p-JNK等促凋亡蛋白的表达,促使血癌细胞凋亡[57]。飞燕草素刺激c-Jun和JNK磷酸化在mRNA和蛋白水平的表达,诱导肝癌细胞HepG2的凋亡,同时伴随着Bcl-2蛋白的下调和Bax蛋白的上调[58]。JNK信号通路还参与了莲房原花青素诱导的HepG2细胞的自噬和凋亡,使得细胞内p-JNK蛋白的表达上调,促进JNK磷酸化,诱导凋亡[59]。Agarwal等[60]对葡萄籽提取物原花青素抗前列腺DU145癌细胞的研究较为深入,发现葡萄籽提取物原花青素能够显著增加c-Jun、JNK1和JNK2的磷酸化水平,激活JNK的表达,诱导前列腺癌细胞的凋亡,而且使用JNK抑制剂也显著抑制了葡萄籽提取物原花青素诱导的凋亡作用。从黑树莓中提取的矢车菊素可刺激ROS依赖性活化的JNK信号通路,激活Bim介导的线粒体途径,导致人白血病和淋巴瘤HL-60细胞株凋亡,Bim的下调或Bcl-2/Bcl-xl的过度表达都会抑制癌细胞的凋亡[61]。花青素和飞燕草素对氧化应激诱导的细胞毒性具有保护作用,这些作用也是通过抑制JNK的磷酸化来实现的[62]。由此可看出,植物花青素诱导恶性肿瘤细胞凋亡的机制与JNK信号通路密切相关。
3.3 植物花青素与肿瘤的侵袭和转移
侵袭和转移是肿瘤细胞最重要的特性,JNK信号通路在乳腺癌、胃癌、结肠癌、食管癌等多种恶性肿瘤的侵袭演进中扮演着重要的作用[63],各种试验[64-65]证明,肿瘤细胞的侵袭和转移能力随JNK表达的升高而升高。总结JNK信号通路参与肿瘤侵袭和转移的过程,发现其在侵袭和转移过程中起到中介和放大信号的作用,其调节肿瘤细胞的侵袭和转移的作用机制主要有两方面:① 接受多种多样的刺激信号(如环境应力、生长因子、细胞因子等);② 通过JNK的级联放大反应作用于下游成员(如核转录因子),进而调控基因表达,使得癌细胞的基质金属蛋白酶(matrix metalloprotein, MMP)分泌增强,增加对癌细胞基质层的破坏降解,导致细胞与细胞间的黏附力下降,使肿瘤细胞的侵袭和转移能力增强。
植物花青素可通过抑制JNK磷酸化的表达抑制肿瘤细胞的侵袭和转移。MMP2和MMP9可通过降解细胞外基质的不同蛋白质破坏组织屏障,在肿瘤侵袭和转系过程中发挥着重要的作用。黑米提取物中的花青素可抑制jnk mRNA及蛋白的表达,降低JNK磷酸化水平,通过JNK信号通路下调基质金属蛋白酶MMP家族的MMP2和MMP9的分泌,进而抑制乳腺癌细胞的侵袭和转移[66-67]。乙醇是一种肿瘤促进剂,流行病学研究[68]显示,乙醇可提高乳腺癌细胞的转移能力,p130Cas/cRK耦合或JSAP1(JNK/应激活化蛋白激酶相关蛋白1)调控JNK活化介导细胞迁移,p130Cas作为Crk的相关底物,以FAK/cSrc依赖模式被FAK磷酸化,p130Cas磷酸化与Crk形成适配复合物激活Rac1和JNKs,乙醇增强p130Cas与FAK/cSrc的结合以及p130Cas的磷酸化,促进p130Cas和JNKs的活化,矢车菊素-3-葡萄糖苷(G3G)可抑制乙醇诱导的JNK磷酸化和p130Cas/JNK的相互作用。飞燕草素是一个潜在的抑制癌细胞转移的试剂,有研究[69]证实飞燕草素可抑制PMA激活的JNK MAPK通路,显著抑制PMA诱导的MCF-7人类乳腺癌细胞MMP-9的表达,并抑制MMP-9基因的转录活性,下调MCF-7癌细胞的侵袭和转移能力。
4 展望
膳食花青素或者富含丰富花青素的提取物作为黄酮化合物的一类重要亚族,在减少氧化应激、癌细胞的增殖和侵袭、炎症以及血管再生等方面起着重要的作用。JNK作为一类重要的丝裂原活化蛋白激酶,尽管在介导细胞死亡、肿瘤的发生和生存方面存在争议,但不能否认JNK可作为治疗肿瘤疾病的一个分子靶点。植物花青素能通过调控JNK信号通路达到抑制肿瘤,是一种可用来作为癌症治疗的候选药物。现有关于植物花青素抑制肿瘤的研究大多基于动物模型和细胞试验,临床试验甚少。因此,后续应加强临床试验以进一步验证植物花青素在人体的适用性。
随着人类对健康的重视程度日益升高,关于生物学领域对植物花青素通过JNK信号通路抗肿瘤的研究将进一步深入,JNK信号通路的作用机制仍需进一步阐明,为探究植物花青素发挥抗肿瘤机制提供参考依据,以期能更好地应用于功能食品和临床医学。
[1] SEHITOGLU M H, FAROOQI A A, QURESHI M Z, et al. Anthocyanins: targeting of signaling networks in cancer cells[J]. Asian Pacific Journal of Cancer Prevention, 2014, 15(5): 2 379-2 381.
[2] HEASLEY L E, HAN S Y. JNK regulation of oncogenesis[J]. Molecules & Cells, 2006, 21(2): 167-173.
[3] PRIOR R L, WU Xian-li. Anthocyanins: structural characteristics that result in unique metabolic patterns and biological activities[J]. Free Radical Research, 2006, 40(10): 1 014-1 028.
[4] KRISTO A S, KLIMISZACAS D, SIKALIDIS A K. Protective role of dietary berries in cancer[J]. Antioxidants, 2016, 5(4): 1-23.
[5] 王朔. CD44V6和VEGF-C及JNK在胃癌组织中的表达及临床意义[D]. 大连: 大连医科大学, 2010: 22-28.
[6] TANOUE T, YAMAMOTO T, MAEDA R, et al. A novel MAPK phosphatase MKP-7 acts preferentially on JNK/SAPK and p38 alpha and beta MAPKs[J]. Journal of Biological Chemistry, 2001, 276(28): 26 629-26 639.
[7] ONO R, MATSUOKA J, YAMATSUJI T, et al. M-RIP, a novel target of JNK signaling and a requirement for human cancer cell invasion[J]. International Journal of Molecular Medicine, 2008, 22(2): 199-203.
[8] REDDIVARI L, VANAMALA J, SAFE S H, et al. The bioactive compounds -chaconine and gallic acid in potato extracts decrease survival and induce apoptosis in LNCaP and PC3 prostate cancer cells[J]. Nutrition and Cancer-an International Journal, 2010, 62(5): 601-610.
[9] 郭连英. JNK/SAPK信号传导通路在榄香烯抗肝癌效应中的作用[J]. 中国肿瘤生物学杂志, 2005, 12(3): 205-209.
[10] DONGYEOK S. Induction of apoptosis in human colon cancer HCT-116 cells by anthocyanins through suppression of Akt and activation of p38-MAPK[J]. International Journal of Oncology, 2009, 35(6): 1 499-1 504.
[11] MEDDA R, LYROS O, SCHMIDT J L, et al. Anti-inflammatory and anti-angiogenic effect of black raspberry extract on human esophageal and intestinal microvascular endothelial cells[J]. Microvascular Research, 2015, 97: 167-180.
[12] 崔建, 李晓岩. 花青素抗肿瘤作用机制研究进展[J]. 食品科学, 2014, 35(13): 310-315.
[13] GAO Shi-chao, YIN Hai-bo, LIU Hong-xiao, et al. Research progress on MAPK signal pathway in the pathogenesis of osteoarthritis[J]. China Journal of Orthopaedics and Traumatology, 2014, 27(5): 441-444.
[14] WANG Juan, TAI Gui-xiang. Role of C-Jun N-terminal kinase in hepatocellular carcinoma development[J]. Targeted Oncology, 2016, 11(6): 723-738.
[15] YAN Dong, AN Guang-yu, KUO M T. c-Jun N-terminal kinase signalling pathway in response to cisplatin[J]. Journal of Cellular & Molecular Medicine, 2016, 20(11): 2 013-2 019.
[16] PAL M, FEBBRAIO MA, LANCASTER GI. The roles of c-Jun NH2-terminal kinases (JNKs) in obesity and insulin resistance[J]. Journal of Physiology, 2016, 594(2): 267-279.
[17] LIU Jing, LIN An-ning. Role of JNK activation in apoptosis: a double-edged sword[J]. Cell Research, 2005, 15(1): 36-42.
[18] SABAPATHY K, HOCHEDLINGER K, NAM S Y, et al. Distinct roles for JNK1 and JNK2 in regulating JNK activity and c-Jun-dependent cell proliferation[J]. Molecular Cell, 2004, 15(5): 713-725.
[19] NEIDHART S, ANTONSSON B, GILLIÉRON C, et al. c-Jun N-terminal kinase-3 (JNK3)/stress-activated protein kinase-beta (SAPKbeta) binds and phosphorylates the neuronal microtubule regulator SCG10[J]. FEBS Letters, 2001, 508(2): 259-264.
[20] WESTON C R, DAVIS R J. The JNK signal transduction pathway[J]. Current Opinion in Genetics & Development, 2007, 19(2): 142-149.
[21] AKELLA R, MOON T M, GOLDSMITH E J. Unique MAP Kinase binding sites[J]. Biochimica et Biophysica Acta, 2008, 1 784(1): 48-55.
[22] XU Zhi-heng, KUKEKOV N V, GREENE L A. POSH acts as a scaffold for a multiprotein complex that mediates JNK activation in apoptosis[J]. EMBO Journal, 2003, 22(2): 252-261.
[23] BROWN M D, SACKS D B. Protein scaffolds in MAP kinase signalling[J]. Cellular Signalling, 2009, 21 (4): 462-469.
[24] ZEKE A, MISHEVA M, REMÉNYI A, et al. JNK signaling: regulation and functions based on complex protein-protein partnerships[J]. Microbiology and Molecular Biology Reviews, 2016, 80(3): 793-835.
[25] ZHAO Hua-fu, WANG Jing, TONY T. The phosphatidylinositol 3-kinase/Akt and c-Jun N-terminal kinase signaling in cancer: alliance or contradiction? (review)[J]. International Journal of Oncology, 2015, 47(2): 429-436.
[26] COFFEY E T. Nuclear and cytosolic JNK signalling in neurons[J]. Nature Reviews Neuroscience, 2014, 15(5): 285-299.
[27] XIE X, KAOUD T S, EDUPUGANTI R, et al. c-Jun N-terminal kinase promotes stem cell phenotype in triple-negative breast cancer through upregulation of Notch1 via activation of c-Jun[J]. Oncogene, 2017, 36(18): 2 599-2 608.
[28] FUJISHITA T, AOKI M, TAKETO M M. JNK signaling promotes intestinal tumorigenesis through activation of mtor complex 1 in apc(delta 716) mice[J]. Gastroenterology, 2011, 140(5): 1 556-1 563.
[29] CHANG Qing-shan, ZHANG Ya-dong, BEEZHOLD K J, et al. Sustained JNK1 activation is associated with altered histone H3 methylations in human liver cancer[J]. Journal of Hepatology, 2009, 50(2): 323-333.
[30] 谷燕娇, 高志安. JNK在不同分化程度肺癌组织中的表达[J]. 数理医药学杂志, 2009, 22(2): 156-157.
[31] RUAN Jie, QI Zhi-lin, SHEN Lei, et al. Crosstalk between JNK and NF-kappa B signaling pathways via HSP27 phosphorylation in HepG2 cells[J]. Biochemical and Biophysical Research Communications, 2015, 456(1): 122-128.
[32] ZHANG Ying, LIN Lian-jie, JIN Yu, et al. Overexpression of WNT5B promotes COLO 205 cell migration and invasion through the JNK signaling pathway[J]. Oncology Reports, 2016, 36(1): 23-30.
[33] RENO E, HAUGHIAN J, JACKSON T, et al. c-Jun N-terminal kinase regulates apoptosis in endometrial cancer cells[J]. Apoptosis, 2009, 14(6): 809-820.
[34] SAITOH T, KATOH M. Expression and regulation of WNT5A and WNT5B in human cancer: up-regulation of WNT5A by TNFalpha in MKN45 cells and up-regulation of WNT5B by beta-estradiol in MCF-7 cells[J]. International Journal of Molecular Medicine, 2002, 10(3): 345-349.
[35] DING S, LEI Q, YANG X, et al. Influence of adriamycin on changes in Nanog, Oct-4, Sox2, ARID1 and Wnt5b expression in liver cancer stem cells[J]. World Journal of Gastroenterology, 2014, 20(22): 6 974-6 980.
[36] MANGIONI S, VIGANP, LATTUADA D, et al. Overexpression of the Wnt5b gene in leiomyoma cells: implications for a role of the Wnt signaling pathway in the uterine benign tumor.[J]. Journal of Clinical Endocrinology & Metabolism, 2005, 90(9): 5 349-5 355.
[37] 谭亚芳, 李娟, 胡树枝, 等. 鸦胆子苦醇抑制人前列腺癌DU145细胞生长及作用机制[J]. 广西植物, 2015(3): 431-436.
[38] DHANASEKARAN D N, REDDY E P. JNK signaling in apoptosis[J]. Oncogene, 2008, 27(48): 6 245-6 251.
[39] ZHANG Shu-yi, SHI Lei, MA Hong-wen, et al. Dihydroartemisinin induces apoptosis in human gastric cancer cell line BGC-823 through activation of JNK1/2 and p38 MAPK signaling pathways[J]. Journal of Receptor and Signal Transduction Research, 2017, 37(2): 174-180.
[40] ZHA Jie, CHEN Fei-li, DONG Hui-juan, et al. Disulfiram targeting lymphoid malignant cell lines via ROS-JNK activation as well as Nrf2 and NF-kB pathway inhibition[J]. Journal of Translational Medicine, 2014, 12(1): 1-9.
[41] XU Zi-zhen, FU Wan-bin, JIN Zhen, et al. Reactive oxygen species mediate oridonin-induced apoptosis through DNA damage response and activation of JNK pathway in diffuse large B cell lymphoma[J]. Leukemia & Lymphoma, 2015, 57(4): 888-898.
[42] HOU De-xing, FUJII M, TERAHARA N, et al. Molecular mechanisms behind the chemopreventive effects of anthocyanidins[J]. Biomed Research International, 2004(5): 321-325.
[43] 王琳, 李国文, 顾浩, 等. JNK信号通路在热化疗抑制人小细胞肺癌细胞生长中的作用[J]. 山东医药, 2009, 49(33): 20-22.
[44] UHLIROVA M, JASPER H, BOHMANN D. Non-cell-autonomous induction of tissue overgrowth by JNK/Ras cooperation in a Drosophila tumor model[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(37): 13 123-13 128.
[45] ANTONYAK M A, KENYON L C, GODWIN A K, et al. Elevated JNK activation contributes to the pathogenesis of human brain tumors[J]. Oncogene, 2002, 21(33): 5 038-5 046.
[46] VIVAS-MEJIA P, BENITO J M, FERNANDEZ A, et al. c-Jun-NH2-kinase-1 inhibition leads to antitumor activity in ovarian cancer[J]. Clinical Cancer Research, 2010, 16(1): 184-194.
[47] LIM W, JEONG W, SONG G. Delphinidin suppresses proliferation and migration of human ovarian clear cell carcinoma cells through blocking AKT and ERK1/2 MAPK signaling pathways[J]. Molecular & Cellular Endocrinology, 2016, 422: 172-181.
[48] 姜伟伟, 遇旭东, 任国峰. 黑米皮提取物对PC-3细胞增殖的抑制作用[J]. 卫生研究, 2013, 42(3): 474-477.
[49] HOU De-xing, KAI K, LI Jian-jian, et al. Anthocyanidins inhibit activator protein 1 activity and cell transformation: structure-activity relationship and molecular mechanisms[J]. Carcinogenesis, 2004, 25(1): 29-36.
[50] AFAQ F, SALEEM M, KRUEGER C G, et al. Anthocyanin- and hydrolyzable tannin-rich pomegranate fruit extract modulates MAPK and NF-kB pathways and inhibits skin tumorigenesis in CD-1 mice[J]. International Journal of Cancer, 2005, 113(3): 423-433.
[51] SUI Xin-bing, KONG Na, YE Li, et al. p38 and JNK MAPK pathways control the balance of apoptosis and autophagy in response to chemotherapeutic agents[J]. Cancer Letters, 2014, 344(2): 174-179.
[52] BOGOYEVITCH M A. Uses for JNK: the many and varied substrates of the c-Jun[J]. Microbiology & Molecular Biology Reviews, 2013, 70(4): 1 061-1 095.
[53] LAMY S, LAFLEUR R, BÉDARD V, et al. Anthocyanidins inhibit migration of glioblastoma cells: structure-activity relationship and involvement of the plasminolytic system[J]. Journal of Cellular Biochemistry, 2007, 100(1): 100-111.
[54] HO Mao-lin, CHEN Pei-ni, CHU Shu-chen, et al. Peonidin 3-glucoside inhibits lung cancer metastasis by downregulation of proteinases activities and MAPK pathway[J]. Nutrition and Cancer, 2010, 62(4): 505-516.
[55] CHEN Pei-ni, CHU Shu-chen, CHIOU Hui-lin, et al. Mulberry anthocyanins, cyanidin 3-rutinoside and cyanidin 3-glucoside, exhibited an inhibitory effect on the migration and invasion of a human lung cancer cell line[J]. Cancer Letters, 2006, 235(2): 248-259.
[56] DOMITROVIC R. The molecular basis for the pharmacological activity of anthocyans[J]. Current Medicinal Chemistry, 2011, 18(29): 4 454-4 469.
[57] 曾琬玲. 洛神花青素在人类血癌细胞株(MOLT-4)和利用小鼠血癌细胞株(WEHI-3)诱发血癌模式的细胞生长与凋亡之探讨[D]. 中山: 中山医学大学, 2012: 5-8.
[58] YEH C T, YEN G C. Induction of apoptosis by the anthocyanidins through regulation of Bcl-2 gene and activation of c-Jun N-Terminal kinase cascade in hepatoma cells[J]. Journal of Agricultural & Food Chemistry, 2005, 53(5): 1 740-1 749.
[59] 许慧. 莲房原花青素诱导ROS积蓄介导HepG2细胞自噬和凋亡的研究[D]. 镇江: 江苏大学, 2016: 63-67.
[60] 常徽, 蒋宝泉. 葡萄籽提取物原花青素生物药理活性研究进展[J]. 环境卫生学杂志, 2005, 32(2): 72-76.
[61] FENG Ren-tian, NI Hong-min, WANG Shiow Y, et al. Cyanidin-3-rutinoside, a natural polyphenol antioxidant, selectively kills leukemic cells by induction of oxidative stress[J]. Journal of Biological Chemistry, 2007, 282(18): 13 468-13 476.
[62] CHEOL N D, SOOL H Y, BEEN N J, et al. Cytoprotective mechanism of cyanidin and delphinidin against oxidative stress-induced tenofibroblast death[J]. Biomolecules & Therapeutics, 2016, 24(4): 426-432.
[63] CELLURALE C, SABIO G, KENNEDY N J, et al. Requirement of c-Jun NH2-terminal kinase for Ras-initiated tumor formation[J]. Molecular & Cellular Biology, 2011, 31(7): 1 565-1 576.
[64] 张宇虹, 唐建武, 王绍清, 等. shRNA抑制小鼠肝癌细胞株JNK的表达及细胞迁移和侵袭[J]. 吉林大学学报: 医学版, 2009, 35(3): 410-414.
[65] 周燕红, 何小飞, 高卉, 等. JNK信号通路在大肠癌侵袭和转移中的作用及机制[J]. 世界华人消化杂志, 2009, 17(21): 2 142-2 146.
[66] CHANG Hui, YU Bin, YU Xiao-ping, et al. Anticancer activities of an anthocyanin-rich extract from black rice against breast cancer cells in vitro and in vivo[J]. Nutrition & Cancer, 2010, 62(8): 1 128-1 136.
[67] CHEN Xiang-yan, ZHOU Jie, LUO Li-ping, et al. Black rice anthocyanins suppress metastasis of breast cancer cells by targeting RAS/RAF/MAPK pathway[J]. Biomed Research International, 2015, 2 015(5): 1-11.
[68] XU Mei, BOWER K A, WANG Si-ying, et al. Cyanidin-3-Glucoside inhibits ethanol-induced invasion of breast cancer cells overexpressing ErbB2[J]. Molecular Cancer, 2010, 9(1): 1-14.
[69] IM N K, JANG W J, JEONG C H, et al. Delphinidin suppresses PMA-induced MMP-9 expression by blocking the NF-κB activation through MAPK signaling pathways in MCF-7 human breast carcinoma cells[J]. Journal of Medicinal Food, 2014, 17(8): 855-861.
Plant anthocyanin exert antitumor effect and mechanism of by JNK signaling pathway
ZHIQi1
LIFu-xiang1
YANGYa-xuan1
TIANYong1
TANGYu1
SHIFang1
MINGJian1,2
(1.CollegeofFoodScience,SouthwestUniversity,Chongqing400715,China; 2.ChongqingEngineeringResearchCenterofSpecialFoods,Chongqing400715,China)
JNK signaling pathway plays an important role in the pathogenesis and development of tumor. In this study, the composition and activation mechanism of JNK signaling pathway was reviewed. Moreover, the ability of inhibiting the proliferation, invasion and apoptosis of breast cancer, prostate cancer, liver cancer, etc by plant anthocyanin was summarized, in order to provide a certain basis for the application of plant anthocyanins in developing clinical medicine and drugs.
plant anthocyanins; JNK; signaling pathway; antitumor
重庆市社会民生科技创新专项(编号:cstc20l5stums-ztzx80006);国家自然科学基金面上项目(编号:31471576);重庆市特色食品工程技术研究中心能力提升项目(编号:cstc2014pt-gc8001)
郅琦,女,西南大学在读硕士研究生。
明建(1972—),男,西南大学教授,博士。 E-mail:mingjian1972@163.com
2017—05—09
10.13652/j.issn.1003-5788.2017.07.046
