发芽糙米多糖双水相萃取工艺优化及其抗氧化活性
2017-09-22刘晓飞
刘晓飞
王 鑫2
孟庆虹1
张 宇2
龚丽丽2
马永强2
卢淑雯1
(1. 黑龙江省农业科学院博士后科研工作站,黑龙江 哈尔滨 150086;2. 哈尔滨商业大学食品工程学院,黑龙江 哈尔滨 150076)
发芽糙米多糖双水相萃取工艺优化及其抗氧化活性
刘晓飞1,2
王 鑫2
孟庆虹1
张 宇2
龚丽丽2
马永强2
卢淑雯1
(1. 黑龙江省农业科学院博士后科研工作站,黑龙江 哈尔滨 150086;2. 哈尔滨商业大学食品工程学院,黑龙江 哈尔滨 150076)
以发芽糙米为原料,采用超声波辅助双水相法萃取对发芽糙米多糖的分配系数进行研究,多糖得率作为考察目标,通过正交试验确定超声波辅助双水相萃取发芽糙米多糖的最佳提取工艺条件。结果表明:发芽糙米多糖最优提取工艺为选用PEG6000、PEG6000添加量15.7%、硫酸铵添加量14.8%、萃取时间40 min,该条件下多糖得率为81.07%。并采用DPPH法、邻苯三酚自氧化法和邻二氮菲法检测提取的多糖抗氧化活性。研究发现发芽糙米多糖对DPPH自由基、超氧阴离子自由基以及羟基自由基均有较强的抗氧化作用。
发芽糙米;多糖;超声波;双水相萃取;抗氧化性
糙米是稻谷在加工过程中保留果皮、种皮、糊粉层和胚,经砻谷仅脱去颖壳后的谷粒。糙米是一种全粮食品,是功能食品最好的来源,并且普遍具有多项保健功能[1]。糙米发芽时大量酶被激活和释放,生成γ-氨基丁酸等有益的生物活性成分[2-3],使发芽糙米具有抗氧化,降低血脂、降血压、降血糖等作用,已被作为功能性食品配料和营养强化剂而广泛应用于食品、医药等行业中[4]。
双水相萃取是一种新型的生物分离技术,具有分离条件温和、传质速度快、成相时间短、能耗低、适合大规模操作、生物亲和性好等优点[5-6],已经广泛应用于食品化工、细胞生物学、生物工程、植物有效成分的分离等[7]。孙亚莉等[8]利用双水相体系萃取分离葡萄籽多糖,分别考察了PEG质量分数、硫酸铵质量分数和萃取温度3个因素对葡萄籽多糖的影响,最佳萃取率可达55.1%。Xing Jianmin等[9]采用双水相萃取超滤膜结合的方法提取芦荟多糖,结果显示芦荟多糖纯度高,富含甘露糖单糖,且葡萄糖残留物较少。刘琳等[10]利用乙醇/K2CO3双水相实现一步操作分离提取桦褐孔菌发酵液中的三萜化合物和多糖,此方法分离效果好,有利于产品的后续纯化。
目前对发芽糙米的研究主要集中在发芽工艺[11-13]、γ-氨基丁酸富集[14-15]、糙米发芽后营养物质的变化情况[16-17]及以发芽糙米为原料的各种食品制作上[18-19],目前中国尚无发芽糙米多糖提取的研究,因此,本试验以发芽糙米为原料,采用聚乙二醇(PEG)/硫酸铵双水相体系对萃取发芽糙米多糖的提取条件进行优化,并对多糖抗氧化性进行研究,以期为发芽糙米多糖的开发利用提供理论依据。
1 材料与方法
1.1 试验材料
稻谷:龙粳,黑龙江省农业科学院。
1.2 试验仪器
超声波细胞粉碎仪:JY92-ⅡD型,宁波新芝生物科技股份有限公司;
紫外可见分光光度计:SP-752PC型,上海光谱仪器有限公司;
台式高速离心机:TGL-16G型,湖南星科科学仪器有限公司;
电热恒温水浴锅:HHS-12型,上海东星建材实验设备有限公司;
电子分析天平:BS224S型,赛多利斯科学仪器有限公司。
1.3 试验方法
1.3.1 糙米发芽 龚谷机去除稻谷外壳得到糙米,去除不完整的米粒和杂质,将糙米放入去离子水中浸泡2 h,取出均匀平铺托盘上,在恒温恒湿箱中进行发芽(温度30 ℃、湿度98%、发芽24 h)[20]。80 ℃恒温干燥箱中灭酶30 min后,55 ℃恒温烘干,粉碎过筛(80目)备用。
1.3.2 总糖含量测定 采用苯酚硫酸法[19]。
1.3.3 双水相萃取体系的制备 取发芽糙米粉10.0 g,加入蒸馏水,料液比1∶10 (g/mL),超声功率500 W超声25 min[22],超声温度50 ℃,冷却至室温,3 000 r/min 离心20 min,取上清液,蒸馏水定容至1 000 mL,待用。单因素试验时每次取样20 mL,称取一定质量的PEG,溶解后称取不同质量的硫酸铵,振荡混合,静置40 min。分相后记录上下相体积,620 nm波长下检测,计算出多糖在不同双水相体系中的含量[21-22]。

(1)

(2)

(3)
式中:
K——发芽糙米多糖在PEG/硫酸铵两相体系中的分配系数;
R——上下相体积之比;
Y——多糖在上相中的得率,%;
Ca——上相中多糖质量浓度,mg/mL;
Cb——下相中多糖质量浓度,mg/mL;
Va——上相体积,mL;
Vb——下相体积,mL。
1.3.4 发芽糙米多糖单因素优化
(1) PEG分子质量:发芽糙米多糖提取液20 mL,硫酸铵添加量5.0 g,分别加入4.0 g PEG2000、PEG4000、PEG6000、PEG8000、PEG10000,形成双水相体系,于分液漏斗中萃取40 min。分相完全后,记录上下相体积,研究发芽糙米中多糖的得率。
(2) PEG添加量:发芽糙米多糖提取液20 mL,硫酸铵添加量5.0 g,PEG6000添加量分别为3.0,3.5,4.0,4.5,5.0 g,形成双水相体系,于分液漏斗中萃取40 min。分相完全后,记录上下相体积,研究发芽糙米中多糖的得率。
(3) 硫酸铵添加量:发芽糙米多糖提取液20 mL,PEG6000添加量4.0 g,硫酸铵添加量分别为3.0,4.0,5.0,6.0,7.0 g,形成双水相体系,于分液漏斗中萃取40 min。分相完全后,记录上下相体积,研究发芽糙米中多糖的得率。
(4) 萃取时间:发芽糙米多糖提取液20 mL,硫酸铵添加量5.0 g,PEG6000添加量4.0 g,形成双水相体系,于分液漏斗中萃取20,30,40,50,60 min。分相完全后,记录上下相体积,研究发芽糙米中多糖的得率。
1.3.5 发芽糙米多糖抗氧化性的测定
(1) DPPH·清除率的测定:参照文献[23],按式(4)计算DPPH·清除率D。

(4)
式中:
D——DPPH·清除率,%;
A0——空白管吸光值;
Ai——多糖样品吸光值;
Aj——多糖样品对照组吸光值。

(5)
式中:

ΔA0——空白管吸光值;
ΔA——多糖样品吸光值。
(3) 羟基自由基(·OH)清除率的测定:参照文献[25],按式(6)计算·OH清除率E。
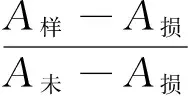
(6)
式中:
E——·OH清除率,%;
A样——多糖样品吸光值;
A未——未损伤管的吸光值;
A损——损伤管的吸光值。
2 结果与分析
2.1 葡萄糖标准曲线绘制
葡萄糖标准曲线见图1。

图1 葡萄糖标准曲线
葡萄糖回归方程:y=0.012x-0.003 5,R2=0.989 6,曲线相关性较好。
2.2 双水相萃取发芽糙米的分配平衡单因素试验
2.2.1 PEG分子量对发芽糙米多糖得率的影响 发芽糙米中多糖在不同双水相体系中上下相溶液中的含量及多糖得率的结果见图2~4。

图2 分配系数K与PEG分子量的关系

图3 上下相体积比与PEG分子量的关系

图4 多糖得率与PEG分子量的关系
由图2~4可知,在硫酸铵添加量一定的情况下,PEG相对分子质量的变化,使得上下相体积比R有微小波动,但总体变化不大。而多糖分配系数K和多糖得率受PEG分子量影响较大,随着PEG相对分子质量的增大,双水相黏度增大,成相物质分子的空间阻碍作用增加[8],导致K值呈现先增后减的趋势,在PEG6000处有最大值,因此,PEG6000最有利于发芽糙米多糖在上相富集,得率为75.27%。
2.2.2 PEG添加量对发芽糙米多糖得率的影响 发芽糙米中多糖在不同双水相体系中上下相溶液中的含量及得率见图5~7。
由图5~7可知,随着PEG添加量的增加,上下相体积比R变化幅度不大,而分配系数K则呈现明显的先增后减的趋势,受此影响,多糖得率表现出同样的走势,并在PEG添加量达到15.7%时出现最大值(65.03%),继续增加PEG添加量会导致溶液的黏度很大,给生产过程带来不利影响,并且多糖得率开始降低,与马新辉等[28]的试验结果相近。

图5 分配系数K与PEG添加量的关系
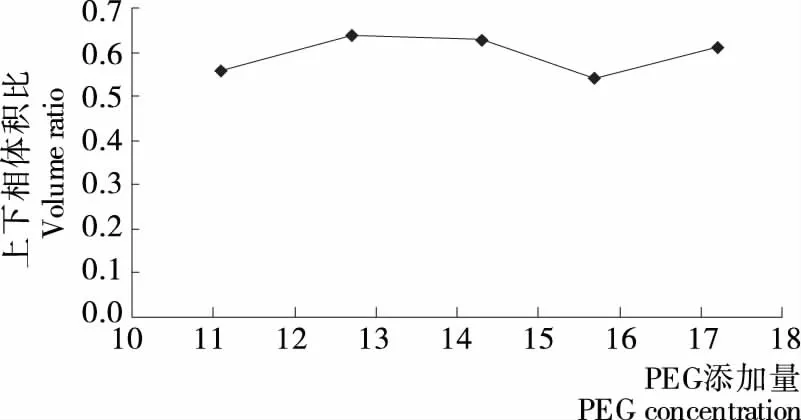
图6 上下相体积比与PEG添加量的关系
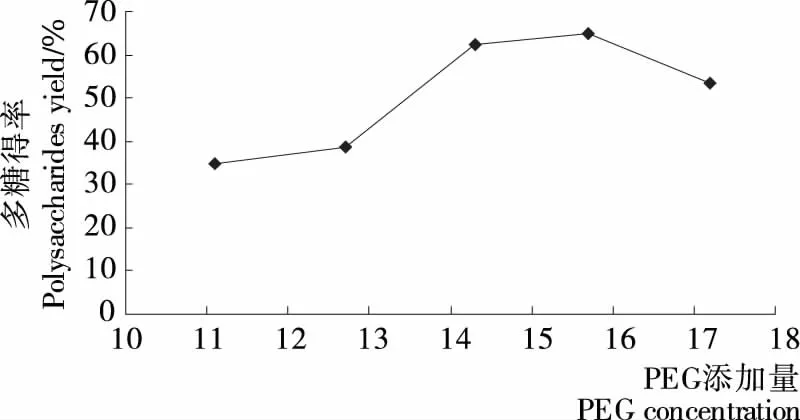
图7 多糖得率与PEG添加量的关系
2.2.3 硫酸铵添加量对发芽糙米多糖得率的影响 发芽糙米多糖在不同双水相体系中上下相溶液中的含量及得率见图8~10。
由图8~10可知,硫酸铵的添加量对上下相体积比和分配系数有较大影响,2组数据都随着硫酸铵添加量的增加呈现先增后减的趋势;添加量为14.8%时,分配系数有最大,而上下相体积比最大值则出现在添加量为20.6%处。由此,综合2组数据所得多糖得率总体变化不大,在硫酸铵添加量为14.8%处有最大值(73.25%)。考虑到双水相体系中硫酸铵添加量过大时,会造成硫酸铵不溶解,影响PEG的回收[27],故选择硫酸铵添加量为14.8%。
2.2.4 萃取时间对发芽糙米多糖得率的影响 发芽糙米中多糖在不同双水相体系中上下相溶液中的含量及得率见图11~13。
由图11~13可知,时间因素对于整个双水相萃取过程影响不大,上下相体积比和分配系数都随萃取时间的延长逐渐增大,但变化幅度较小,当时间增加至40 min时,曲线趋于平缓,不再增加,甚至还有较小程度的降低。原因可能是超声波对多糖得率的影响起初起到促进作用,超过一定时间后,超声波会导致多糖的部分降解。所以确定萃取时间为40 min最适宜。

图8 分配系数K与硫酸铵添加量的关系

图10 多糖得率与硫酸铵添加量的关系
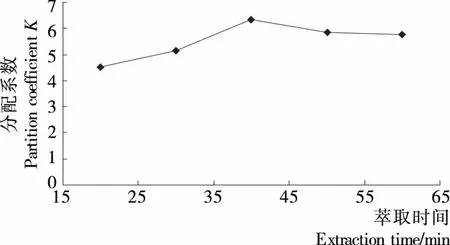
图11 分配系数K与萃取时间的关系
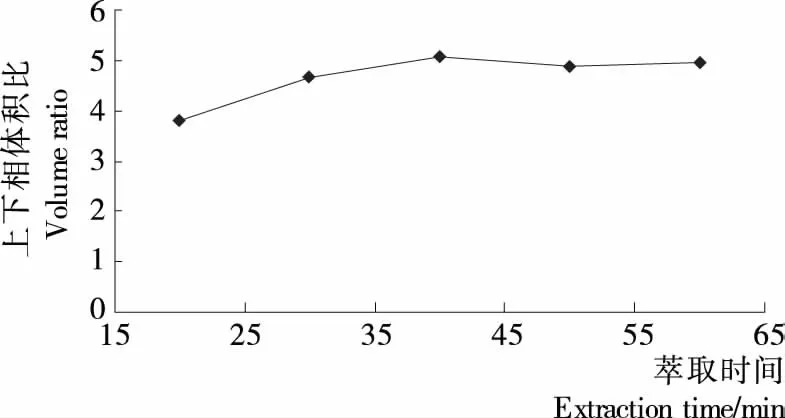
图12 上下相体积比与萃取时间的关系

图13 多糖得率与萃取时间的关系
2.3 超声波辅助双水相萃取多糖的正交试验结果
在单因素试验的基础上,以多糖得率为评价指标,对PEG分子量、PEG质量分数、硫酸铵质量分数、萃取时间进行正交试验,试验设计与结果见表1、2。
由表2可知,各因素对多糖得率的影响大小顺序为:PEG分子量>硫酸铵质量分数>PEG质量分数>萃取时间。正交试验最优组合A2B3C2D2,即选用PEG6000、PEG6000添加量15.7%、硫酸铵添加量14.8%、萃取时间40 min,在此条件下进行验证实验,重复3次,取其平均值,多糖得率为81.07%。
2.4 发芽糙米多糖抗氧化活性
2.4.1 DPPH法测定发芽糙米多糖抗氧化性 发芽糙米多糖浓度与DPPH·的清除关系见图14。
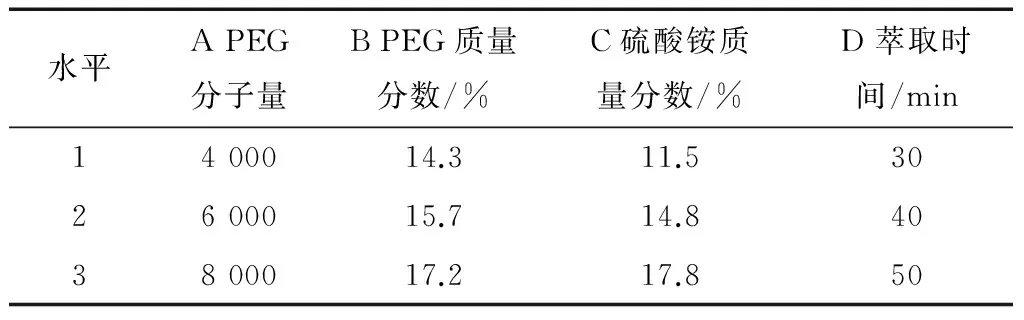
表1 正交设计试验

表2 多糖提取条件优化正交试验结果与分析
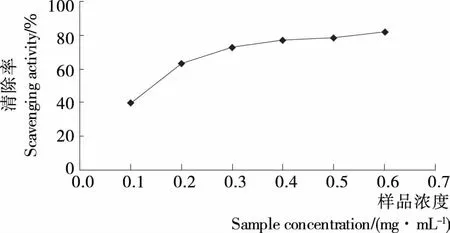
图14 多糖浓度与DPPH·清除的关系
Figure 14 Scavenging effect of polysaccharide from germinated brown rice by DPPH· method
由图14可知,DPPH·的清除率随着发芽糙米多糖浓度的增加而增大,呈现剂量依赖性,当葡萄糖浓度为0.6 mg/mL时,DPPH·清除率达到81.85%。说明发芽糙米多糖具有良好的DPPH·清除活性。
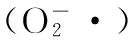
由图15可知,多糖浓度<0.3 mg/mL时,对超氧阴离子自由基的清除能力基本保持在55%左右,之后继续增大多糖浓度,其清除超氧阴离子自由基的能力逐渐增强,当浓度达到0.6 mg/mL时,超氧阴离子自由基清除率达到68.77%,说明发芽糙米多糖对超氧阴离子自由基具有较好清除作用。

图15 多糖浓度与超氧阴离子自由基清除的关系

2.4.3 邻二氮菲法测定发芽糙米多糖抗氧化性 发芽糙米多糖浓度与羟基自由基(·OH)的清除关系见图16。
由图16可知,对羟基自由基的清除能力随多糖浓度升高逐渐增强,当发芽糙米多糖浓度达到0.5 mg/mL时,趋于稳定,羟基自由基清除率约为53%,抗氧化性最强。与黄越等[29]的研究结果相似。

图16 多糖浓度与羟基自由基清除的关系
Figure 16 Scavenging effect of polysaccharide from germinated brown rice by ·OH method
3 结论
经对影响多糖得率的因素进行单因素试验,并通过正交试验确定超声波辅助双水相法萃取发芽糙米多糖的最佳工艺条件为:选用PEG6000、PEG6000添加量15.7%、硫酸铵添加量14.8%、萃取时间40 min,此条件下多糖得率为81.07%。萃取过程简单可行,可以进一步优化双水相的组分以期得到收率更高的发芽糙米多糖。
发芽糙米多糖具有较强的抗氧化作用,对DPPH自由基、超氧阴离子以及羟基自由基清除率分别达到81.85%,68.77%,53.00%。发芽糙米多糖可以作为一种良好的抗氧化剂进行开发利用。
[1] 孟春玲, 孟庆虹, 张守文. 发芽糙米的营养功能和进一步开发利用[J]. 中国食品添加剂, 2014(5): 156-160.
[2] 曾丹, 李远志, 陈友清, 等. 酶解工艺对改善发芽糙米口感的影响[J]. 食品与机械, 2011, 27(6): 71-74.
[3] CHO Dong Hwa, LIM Seung Taik. Germinated brown rice and its bio-functional compounds[J]. Food Chemistry, 2016, 196(8): 259-271.
[4] 刘岚, 尹珺, 谭钤文. 几种发芽糙米食品感观评价研究[J]. 粮食与饲料工业, 2009(10): 1-4.
[5] FREIRE Mara G, CLAUDIO Ana Filipa M, ARAUJO J M, et al. Aqueous biphasic systems: a boost brought about by using ionic liquids[J]. Chem Soc Rev, 2012, 41(14): 4 966-4 955.
[6] 谢蓝华, 杜冰, 张嘉怡, 等. 双水相萃取技术在食品工业中的应用研究进展[J]. 食品与机械, 2012, 28(5): 234-238.
[7] 马永强, 荆丽荣, 刘晓飞. 双水相超声波法辅助提取甜玉米多酚及抑菌性研究[J]. 食品科学, 2013, 34(24): 61-64.
[8] 孙亚莉, 张瑾, 裴淑平, 等. 双水相体系萃取分离葡萄籽多糖[J]. 中国酿造, 2013, 32(7): 89-93.
[9] XING Jian-min, LI Fen-fang. Separation and purification of aloe polysaccharides by a combination of membrabe ultrafiltration and aqueous two-phase extraction[J]. Applied Biochemistry and Biotechnology, 2009, 158(1): 11-19.
[10] 刘琳, 宋丽敏. 桦褐孔菌发酵液中三萜化合物和多糖的微波辅助双水相萃取[J]. 食品与发酵工业, 2016, 42(5): 246-252.
[11] 江湖, 付金衡, 苏虎, 等. 富钙发芽糙米的生产工艺研究[J]. 食品科学, 2009, 30(16): 83-85.
[12] 张强, 郑先哲, 贾富国, 等. 循环加湿工艺降低发芽糙米爆腰增率并提高得率[J]. 农业工程学报, 2013, 29(11): 241-247.
[13] 周艳华, 李涛. 糙米发芽富集γ-氨基丁酸工艺优化的研究[J]. 粮食与食品工业, 2013, 20(5): 17-20.
[14] 耿程欣, 杨润强, 顾振新. 活性化糙米富集γ-氨基丁酸的雾化液组分优化[J]. 食品科学, 2015, 63(6): 35-39.
[15] 郑艺梅. 发芽糙米营养特性γ-氨基丁酸富集及生理功效的研究[D]. 武汉: 华中农业大学, 2006.
[16] 鲍会梅. 糙米发芽过程中主要营养成分变化的研究[J]. 食品研究与开发, 2016, 37(22): 27-31.
[17] 丁俊胄, 刘贞, 赵思明, 等. 糙米发芽过程中内源酶活力及主要成分的变化[J]. 食品科学, 2011, 32(11): 29-32.
[18] 曹磊, 夏青, 宋玉. 亲水胶体对发芽糙米面包品质特性的影响[J]. 食品与机械, 2017, 33(1): 174-178.
[19] 谢洁, 周剑新, 蒲海燕. 发芽糙米粉馒头制作工艺研究[J]. 粮食与油脂, 2016, 29(11): 10-12.
[20] 罗曦, 曾亚文, 杨树明, 等. 不同发芽时间下发芽稻谷和糙米不同部位γ-氨基丁酸含量差异[J]. 食品科学, 2009, 30(13): 124-128.
[21] 徐海军, 孙稹稹. 应用双水相萃取技术提取香菇多糖的研究[J]. 天然产物研究与开发, 2013(25): 982-985.
[22] 王鑫, 高爽, 谢静南. 异丙醇—硫酸铵双水相体系分离甜玉米多糖[J]. 食品工业科技, 2016, 37(23): 170-175.
[23] 秦微微, 金婷, 宋学东, 等. 双水相萃取米糠多糖工艺条件的探究[J]. 中国调味品, 2014, 39(3): 54-58.
[24] 五江, 班立桐. 应用双水相萃取技术提取双孢菇多糖的研究[J]. 食品研究与开发, 2011, 32(7): 4-6.
[25] 张春雪, 田智宇, 王振兴, 等. 核桃皮多糖微波辅助提取工艺及抗氧化活性研究[J]. 食品与机械, 2016, 32(7): 146-151.
[26] 何玲玲, 王新, 刘彬, 等. 板栗多糖的分离纯化及抗氧化活性研究[J]. 食品与机械, 2010, 26(2): 72-75.
[27] GEORGE Z, GIOKAS D, VLESSIDIS A. The effects of solvent preoxidation on in hibited chemiluminescence of pyrogallol oxidation in flow injection analysis and liquid chromatography[J]. Analytica Chimica Acta, 2006, 565(1): 56-62.
[28] 马新辉, 李荣庭, 赵晓涵. 双水相体系萃取蓝莓多糖的分配平衡研究[J]. 食品工业科技, 2017, 38(3): 211-220.
[29] 黄越, 周春晖, 黄惠华. 不同提取方法猴头菇粗多糖的表征及其抗氧化活性的比较[J]. 食品工业科技, 2017, 38(3): 80-86.
Extraction of polysaccharide from germinated brown rice by aqueous two-phase system and research of its antioxidant activity
LIUXiao-fei1,2
WANGXin1
MENGQing-hong1
ZHANGYu2
GONGLi-li2
MAYong-qiang2
LUShu-wen1
(1.HeilongjiangAcademyofAgriculturalSciencesPostdoctoralProgramme,Harbin,Heilongjiang150086,China; 2.KeyLaboratoryforFoodScienceandEngineering,HarbinUniversityofCommerce,Harbin,Heilongjiang150076,China)
The polysaccharide was extracted by the ultrasonic-assisted aqueous two-phase technology from germinated brown rice. The phase separation ability of different in PEG/(NH4)2SO4system was studied according to the polysaccharide yield. The yield of polysaccharide substance of germinated brown rice was determined by orthogonal experiment. The optimum process conditions were determined. Results were showed as follows: the mass fraction of PEG6000 was 15.7%, the mass fraction of ammonium sulfate was 14.8% and extraction time was 40 min. The yield of polysaccharide substance from germinated brown rice was 81.07% in the optimum conditions. Morever, the anti-oxidation of polysaccharide substance from germinated brown rice were studied by methods of DPPH, pyrogallol autoxidation and phenanthroline. The results showed that the polysaccharide of brown rice had stronger antioxidant effect to DPPH, ultra oxygen anion and hydroxyl radicals.
Germinated brown rice; polysaccharide; ultrasonic; two-phase extraction; antioxidant activity
黑龙江省博士后资助经费(编号:LBH-Z15200);黑龙江省教育厅科学技术研究项目(编号:12541189)
刘晓飞,女,哈尔滨商业大学副教授,博士。
卢淑雯(1968—),女,黑龙江省农业科学院研究员,博士。E-mail:shuwenl@sina.com
2017—05—16
10.13652/j.issn.1003-5788.2017.07.033
