UV-C处理对蓝莓果实低温贮藏品质的影响
2017-09-22张菊华
张菊华
李高阳1
王 伟2
林树花1
刘 伟1
谭 欢1
(1. 湖南省农业科学院农产品加工研究所,湖南 长沙 410125;2. 湖南大学研究生院隆平分院,湖南 长沙 410125)
UV-C处理对蓝莓果实低温贮藏品质的影响
张菊华1
李高阳1
王 伟2
林树花1
刘 伟1
谭 欢1
(1. 湖南省农业科学院农产品加工研究所,湖南 长沙 410125;2. 湖南大学研究生院隆平分院,湖南 长沙 410125)
为了开发蓝莓的绿色保鲜技术,分别采用1.0,2.0,4.0 kJ/m2UV-C处理南高从蓝莓,并于(4±0.5) ℃下贮藏,期间每7 d测定果实品质的变化。研究结果表明:UV-C处理在提升蓝莓贮藏品质等方面有较好的效果,其中2.0 kJ/m2处理对蓝莓贮藏保鲜效果最好,能有效抑制采后蓝莓的失重和腐烂,贮藏至35 d时相比对照组失重率减少11.4%,腐烂率减少14.8%,推迟发病7~14 d,硬度提高16.74%,总黄酮含量提高7.65%,总酚含量提高9.93%;PAL、CAT、PPO酶活分别为对照的1.08,1.45,1.28倍。说明适宜剂量UV-C处理可抑制采后蓝莓果实的腐烂,提高蓝莓品质及防御性酶活性。
蓝莓;UV-C;贮藏品质;防御性酶活性
近年来,果蔬采后潜在的抗病性被认识,通过低剂量短波紫外线照射诱导果蔬自身抗病性提高,可减少化学保鲜剂的应用,是一种安全高效的贮藏保鲜技术。短波紫外线(ultraviolet-C,UV-C)抗病机理是采用低剂量的潜在有害因素照射,造成DNA的可修复损伤,诱导活着的有机体产生胁迫反应,可诱导果蔬产生抗真菌物质和延迟成熟[1]2-3。低剂量UV-C照射在控制桃[2-4]、草莓[5-6]、杨梅[7]、葡萄[8]、香梨[9-10]、红枣[11]等水果腐烂、诱导抗病性方面具有较好的效果。蓝莓果实营养丰富,果肉细腻,酸甜适度,有“浆果之王”的美誉[12]。在蓝莓的UV-C处理方面,Erkan等[13]研究了UV-C对采后蓝莓抗氧化能力及腐烂率的影响,证实了不同的UV-C处理均降低蓝莓的腐烂率,其中辐照处理5 min效果最好。杨乐等[14]研究发现UV-C处理能促进不同发育时期蓝莓果实总酚和类黄酮的积累,显著降低幼果查尔酮异构酶(CHI)活性,增加其余发育时期果实的苯丙氨酸解氨酶(PAL)及CHI活性,且照射10 min效果最为显著。唐坚等[15]研究发现采后蓝莓经紫外辐照处理后提高了总糖、可溶性固形物和总酚的含量,失重率没有明显变化,紫外辐照和冰温贮藏可以提升蓝莓的贮藏品质。董生忠等[16]研究发现5 kJ/m2UV-C和冰温贮藏(-2±0.5) ℃联合处理能有效抑制蓝莓呼吸强度、失重率和腐烂率的上升,提高超氧化物歧化酶(SOD)、抗坏血酸过氧化物酶(APX)和PAL活性。Chau T. T. Nguyen等[17]研究了UV-A,B,C预处理对杜克蓝莓冷藏过程中品质及花青素的影响,结果证实UV-B,C预处理能增加蓝莓的耐贮性和植物化学成分的积累。蓝莓的UV-C处理取得了一定的研究进展,但缺乏对蓝莓总黄酮、葡萄糖、果糖及防御性酶活性等较系统性的研究。
本试验通过不同剂量UV-C预处理结合4 ℃冷藏方法,研究南高从蓝莓贮藏期间的腐烂率、失重率、硬度、葡萄糖、果糖、总酚、总黄酮等品质指标及苯丙氨酸解氨酶(PAL)、过氧化物酶(POD)、多酚氧化酶(PPO)、过氧化氢酶(CAT)等防御性酶活性变化规律,为蓝莓开展UV-C前处理结合冷藏保鲜技术提供借鉴,为开发蓝莓的绿色保鲜技术提供理论依据。
1 材料与方法
1.1 材料
蓝莓:南高从,2016年7月8日采自湖南省长沙县路口镇的星城明月生态农业科技发展有限公司的蓝莓基地。果实采后2 h内运至实验室,选择成熟度一致、大小均匀、无腐烂的果实在10 ℃下,预冷10 h,备用。
1.2 仪器及试剂
1.2.1 仪器
高效液相色谱仪:LC-20AT型,PDA检测器,日本 Shimadzu公司;
UV-C短波紫外线:TUV G30T8 900mm型,254 nm,30 W,3支,飞利浦公司;
紫外分光光度计:UV-1800型,日本 Shimadzu公司;
手持式紫外线强度计:TAINATN-2254型,台湾泰纳公司;
冷冻离心机:Avanti J-26XP型,美国贝克曼库尔特有限公司;
质构仪:CT3型,美国Brookfield 公司;
电子天平:AL204型,梅特勒-托利多(上海)有限公司;
电导率仪:DDS-11A型,上海雷磁仪器厂;
pH计:Mettler Toledo Delta 320型,梅特勒-托利多(上海)有限公司。
1.2.2 试剂
果糖、葡萄糖标准品:美国Sigma公司;
愈创木酚、邻苯二酚:生化试剂,上海阿拉丁生化科技股份有限公司;
Folin酚试剂:合肥博美生物科技有限责任公司;
没食子酸、芦丁标准品:北京博研科创生物技术有限公司;
其他化学试剂:分析纯,国药集团化学试剂有限公司;
超纯水:18 MΩ,Millipore Milli QRG型超纯水系统制备。
1.3 方法
1.3.1 UV-C处理及贮藏条件 用紫外线强度计测定一定距离(灯管与蓝莓的距离为20 cm)的紫外照射强度,根据照射时间确定照射剂量,CK为不照射。蓝莓预冷后进行UV-C处理,剂量为1.0,2.0,4.0 kJ/m2,每个剂量处理3 kg。将蓝莓分装到带透气孔的塑料盒中,125 g/盒,置于温度(4±0.5) ℃、相对湿度80%~85%的条件下贮藏,每0,7,14,21,28,35 d取样,样品经-80 ℃预冻后粉碎处理测定其各项指标,每个阶段取3个重复样。
1.3.2 失重率测定 失重率是衡量果蔬保鲜效果的一个重要指标,按式(1)计算:

(1)
式中:
c——失重率,%;
m1——贮藏前果实重量,g;
m2——测定时果实重量,g。
1.3.3 腐烂率测定 以蓝莓果实发生霉变、果肉质地塌陷、果肉变色为腐烂。腐烂率是指腐烂果个数占果实初始总个数的百分比,按式(2)计算:

(2)
式中:
c——腐烂率,%;
n1——果实初始总个数,个;
n2——腐烂果个数,个。
1.3.4 硬度测定 采用质构仪,选用直径为1 mm的TA9型不锈钢探头,测试速度0.5 mm/s,穿透距离2 mm,循环2次。第一个峰的峰高为最大力,用以表示硬度值,结果用N表示,每次取10粒果实测定,取平均值。
1.3.5 细胞膜透性测定 参照文献[18],以煮沸前后电导率之比所得的相对电导率(%)来表示细胞膜透性的大小。
1.3.6 丙二醛含量测定 参照文献[19]。
1.3.7 总酚含量测定 采用Folin-Ciocalteu比色法[20]。标准曲线方程y=0.001 6x+0.102 8,R2=0.995 4(x表示没食子酸浓度,mg/L;y表示OD值)。
1.3.8 总黄酮含量测定 采用NaNO2—Al(NO3)3—NaOH比色法[20]。标准曲线方程y=0.001 1x+0.063 1,R2=0.992 7(x表示芦丁标准物质浓度,mg/L;y表示OD值)。
1.3.9 葡萄糖、果糖含量测定 称取3.0 g果肉加少量超纯水溶解,然后用超纯水定容到25 mL,超声处理30 min,用0.45 μm的针头滤器过滤后进行HPLC分析,色谱条件:色谱柱:YMC-Pack Polyamine Ⅱ,250 mm×4.6 mm I.D;柱温25 ℃;流动相:乙腈/水(体积比75/25),流速1.00 mL/min,进样体积20 μL,每个样品重复3次。果糖、葡萄糖标准品浓度梯度为10.0,5.0,2.5,0.5 mg/mL,每个浓度重复3次。果糖、葡萄糖标准曲线方程分别为y=1.17×10-5x-2.0×10-2(R2=0.999);y=1.14×10-5x+0.116(R2=0.999)(x表示果糖、葡萄糖浓度,mg/mL;y表示强度,μV)。
1.3.10 防御性酶活性测定
(1) 苯丙氨酸解氨酶(PAL)活性测定:PAL酶液提取方法按照Zhang等方法[21]。酶活测定反应体系为: 0.1 mol/L硼酸缓冲液(pH 8.8)1.9 mL、20 mmol/L苯丙氨酸1 mL和酶提取液0.1 mL,反应液在37 ℃水浴中保温1 h后,用0.1 mL质量分数1% HCl终止反应,测定保温前后290 nm 处OD值,以每小时OD290值变化0.01为一个酶活性单位。按式(3)计算PAL酶活。

(3)
式中:
PAL——PAL酶活性,U/(g·h);
Vt——酶液提取液总体积,mL;
Vs——测定酶液总体积,mL;
t——反应时间,h。
(2) 过氧化氢酶(catalase,CAT)活性测定:CAT酶液提取方法参考Chance和Maehly的方法[22]。反应液含有0.1 mol/L的磷酸缓冲液(pH 7.8)1.9 mL、0.3% H2O2(以pH 7.8的0.05 mol/L磷酸缓冲液配制)1.0 mL、粗酶液0.1 mL,在240 nm处测定光吸收值变化。酶活力单位定义为每分钟OD240值减少0.01为1个酶活单位。以PBS为对照调零,连续测定3 min。按式(4)计算CAT酶活。
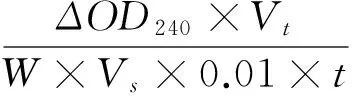
(4)
式中:
CAT——CAT酶活性,U/(g·min);
Vt——酶液提取液总体积,mL;
Vs——测定酶液总体积,mL;
t——反应时间,min。
(3) 过氧化物酶(peroxidase,POD)活性及多酚氧化酶(polyphenol oxidase,PPO)活性的测定:酶液提取方法同CAT提取法。
POD测定反应液:质量分数4.0%的愈创木酚0.1 mL、质量分数0.46% H2O20.1 mL、0.2 mol/L的磷酸缓冲液(pH 7.0) 2.75 mL、酶液0.05 mL。加入酶液后,测定OD470值变化,以每分钟OD470值升高0.01表示一个酶活性单位。以缓冲液调零,依次加缓冲液,愈创木酚、酶液,最后加H2O2快速颠倒混匀,连续读取3 min。按式(5)计算POD酶活。

(5)
式中:
POD——POD酶活性,U/(g·min );
Vt——酶液提取液总体积,mL;
Vs——测定酶液总体积,mL;
t——反应时间,min。
PPO测定反应液: 0.05 mol/L的磷酸缓冲液(pH 7.0) 1.5 mL、0.05 mol/L 邻苯二酚溶液1.0 mL,最后加入0.5 mL 酶提取液,以缓冲液为参比,连续测定3 min,以每分钟内OD410值升高0.01为一个单位。按式(6)计算PPO酶活。
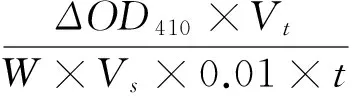
(6)
式中:
PPO——PPO酶活性,U/(g·min );
Vt——酶液提取液总体积,mL;
Vs——测定酶液总体积,mL;
t——反应时间,min。
1.3.11 数据处理 各指标均重复测定3次,结果以平均值±标准差表示。所有图表绘制采用Origin 8和 Excel 2003进行处理;利用SPSS 16.0进行显著性分析,置信概率为0.95,P<0.05为差异显著。
2 结果与分析
2.1 对蓝莓失重率与腐烂率的影响
蓝莓贮藏过程中水分会因蒸腾作用而散失,同时呼吸作用分解有机物产生CO2和H2O,造成质量损失。由图1可知,4个处理的蓝莓果实失重率显著增加,且各处理间差异显著(P<0.05),1.0,2.0 kJ/m2处理失重率低于CK,4.0 kJ/m2的失重率最高,说明适宜剂量的UV-C处理在一定程度上降低了蓝莓果实的失重率,与文献[23]和[17]的研究结果基本一致。贮藏至35 d,各组(CK,1.0,2.0,4.0 kJ/m2)的失重率分别为(14.67±1.23)%,(12.01±0.95)%,(13.0%±0.85)%,(16.83±1.19)%,各组间的差异显著(P<0.05)。
低剂量的UV-C照射可以直接杀死致病菌,更重要的是可以诱导果蔬产生抗病机制,增强抗病性[1]3。由图2可知,腐烂率随贮藏时间的延长呈上升趋势,0~14 d时4组蓝莓果实腐烂率无显著变化(P>0.05),14 d后随时间的延长腐烂率显著升高(P<0.05),35 d时各处理间差异显著(P<0.05),其中2.0 kJ/m2处理组相对于CK组腐烂率降低14.8%。2.0 kJ/m2处理可延迟蓝莓果实发病7~14 d。与厉维江等[8]、ERKAN M等[13]、PERKINS-VEAZIE P等[24]采用UV-C处理对葡萄等的腐烂率研究结果一致。

图1 贮藏期间蓝莓失重率变化

图2 贮藏期间蓝莓腐烂率变化
2.2 对蓝莓贮藏期间相对电导率与MDA含量的影响
相对电导率是衡量细胞膜透性的参数,电导率越大,表明细胞膜功能性越差,膜透性增加。由图3可知,随着贮藏期的延长,蓝莓果实的相对电导率逐渐增大。贮藏后期(28~35 d)UV-C处理的相对电导率高于CK,但各处理组间差异不显著(P>0.05),显示经UV-C辐照后对蓝莓果实的膜结构产生了一些不良影响,导致果实细胞膜透性增加,可能是UV-C辐照影响细胞膜上的脂类物质的物理相变及分布[25]。与陈奕兆等[3]采用UV-C处理水蜜桃的研究结果基本一致。
丙二醛(MDA)是膜脂过氧化作用之后的重要产物之一,通过MDA的测定可以比较果实的衰老程度。由图4可知。贮藏0~28 d时,果实组织中MDA含量呈缓慢上升趋势;贮藏28~35 d时,呈下降趋势。贮藏至35 d时,各处理组间的差异不显著(P>0.05),证明UV-C对果实内部膜脂过氧化作用具有一定的调节作用。
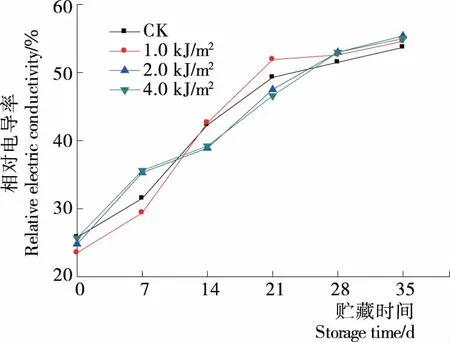
图3 贮藏期间蓝莓相对电导率变化
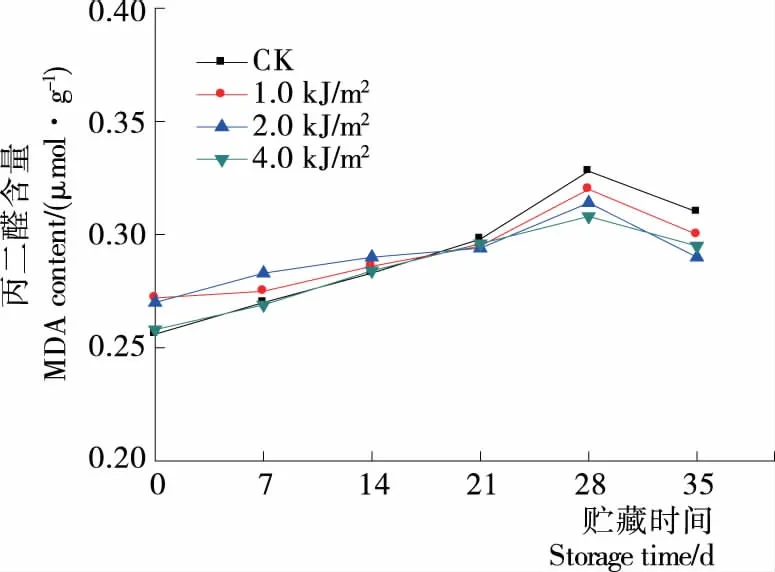
图4 贮藏期间蓝莓丙二醛含量变化
2.3 对蓝莓贮藏期间硬度的影响
由图5可知,对照组整个贮藏期间呈缓慢下降趋势;UV-C各处理组间趋势基本相似,贮藏初期(0~14 d)呈现下降趋势,贮藏中后期(14~35 d)呈现先上升后下降的趋势。贮藏35 d时,CK与各UV-C处理组之间差异显著(P<0.05)。Kramer等[26]认为UV-C处理能够减缓果实中多胺的损失,从而降低细胞壁降解酶的活性,达到维持果实硬度的效果。且UV-C处理对多种致病菌具有杀灭作用,明显降低了微生物对细胞壁结构的影响。

图5 贮藏期间蓝莓硬度变化
2.4 对蓝莓葡萄糖、果糖的影响
由于糖的种类和含量的差异,使得不同品种、不同成熟度的果实采后具有不同的风味口感。蓝莓中的可溶性糖为葡萄糖和果糖。由图6可知,0~28 d时,各处理组葡萄糖呈上升趋势,贮藏28~35 d时,1.0,2.0 kJ/m2处理相比CK促进了果实中葡萄糖含量的下降,4.0 kJ/m2处理维持较高的水平,且显著高于对照(P<0.05),其原因并不清晰。由图7可知,贮藏期间果糖呈上升趋势,贮藏前期(0~7 d),各UV-C处理组果糖含量显著低于CK组(P<0.05);贮藏后期(14~35 d),4.0 kJ/m2处理组显著高于CK(P<0.05),UV-C处理促进蓝莓果实中果糖含量升高,维持果实较高的果糖水平,可能是UV-C的照射诱导了有机酸通过糖异生途径合成糖[23]。
2.5 对蓝莓贮藏期间总黄酮、总酚含量的影响
次生酚类化合物、类黄酮等是植物受病原微生物侵害时自身产生的一类起防卫作用的化合物,这些次生代谢物均有抑菌性质,可抑制真菌孢子萌发和菌丝生长,而且这两类都是苯丙烷类代谢的直接或间接产物,其生成量与PAL活性呈正相关关系。
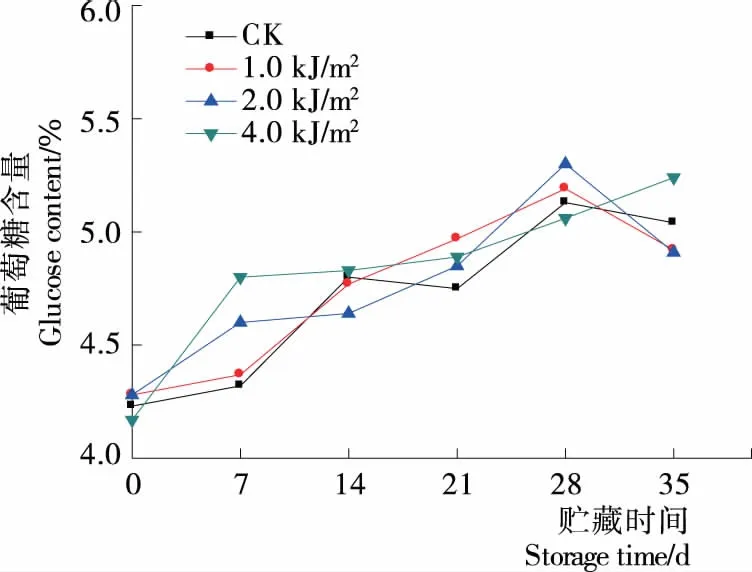
图6 贮藏期间蓝莓葡萄糖含量变化
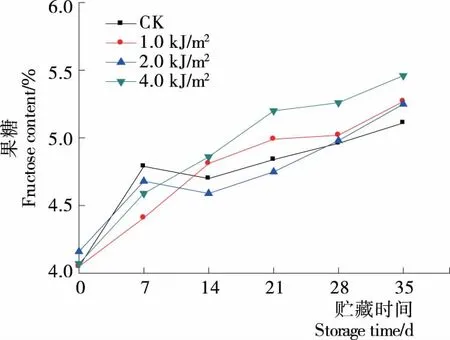
图7 贮藏期间蓝莓果糖含量变化
由图8可知,4组处理的总黄酮含量呈现先上升后下降的趋势,CK组呈缓慢上升趋势,相比对照各UV-C处理在贮藏7 d后总黄酮含量显著升高(P<0.05),贮藏至28 d,各处理总黄酮含量达到峰值,贮藏后期呈下降趋势。贮藏35 d时,1.0,2.0,4.0 kJ/m2处理总黄酮含量相对CK分别增加了2.76%,7.65%,14.89%,其中2.0,4.0 kJ/m2处理显著高于CK(P<0.05)。
由图9可知,总酚含量变化与总黄酮的变化基本一致,UV-C处理组14 d时总酚的含量显著性升高(P<0.05),贮藏28 d时各处理组总酚含量达到峰值,贮藏后期呈下降趋势,贮藏35 d时1.0,2.0,4.0 kJ/m2处理总酚含量相对CK分别增加了1.57%,9.93%,17.84%,其中2.0,4.0 kJ/m2处理显著高于CK(P<0.05)。总酚变化规律与唐坚等[15]的研究结果基本一致。
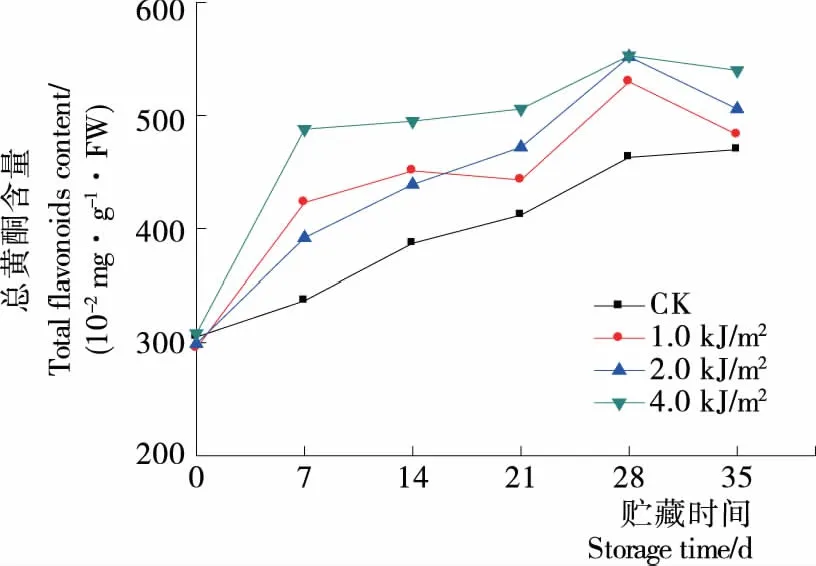
图8 贮藏期间蓝莓总黄酮含量变化
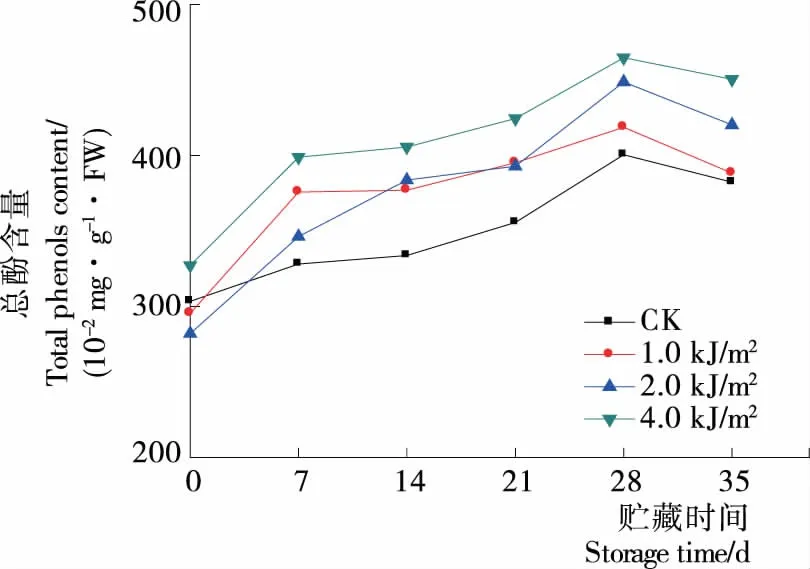
图9 贮藏期间蓝莓总酚含量变化
结合图8、9可知,UV-C处理组的总黄酮、总酚含量高于CK组,其中2.0,4.0 kJ/m2含量随时间的延长均显著高于对照(P<0.05),黄酮和酚类等物质均通过苯丙烷类代谢途径合成,说明UV-C处理有诱导蓝莓果实中苯丙烷类产物合成的作用。贮藏期间蓝莓的总黄酮、总酚含量都呈现先上升后下降的趋势,蓝莓果实经UV-C处理刺激了总黄酮、总酚的合成。贮藏初期,果实膜结构较为完整,总黄酮、总酚的合成占主体,导致其含量呈现上升趋势;贮藏28 d后,果实离体时间长导致合成能力降低,随着膜结构的破坏,总黄酮、总酚含量呈现下降趋势[27]。
2.6 对蓝莓贮藏期间防御性酶活性的影响
PAL往往被逆境条件激发(如寒冷、伤害、病虫感染等)使其活性提高,增强苯丙烷类代谢。由图10可知,各处理组的 PAL活性总体呈波动变化趋势,贮藏初期(0~14 d),PAL酶活性变化较小;UV-C处理促进了贮藏后期PAL活性升高,最高波峰出现在贮藏21 d,比总黄酮和总酚的波峰出现提前7 d。贮藏21~35 d时,2.0,4.0 kJ/m2处理蓝莓的PAL活性显著高于CK(P<0.05),UV-C照射可诱导PAL酶活增加,其辐照剂量与PAL酶活性呈正相关。

图10 贮藏期间蓝莓PAL酶活变化
CAT作用是清除代谢产生的H2O2,以避免其积累对细胞产生氧化破坏,活性的高低与植物的抗逆性有关[28]。由图11可知,贮藏期间,各处理CAT活性呈现波动性升高的趋势,在贮藏前期逐渐产生大量的活性氧自由基,诱导机体清除自由基的自我保护性反应增加,引起CAT活性上升,贮藏7 d各UV-C处理组显著高于0 d(P<0.05),各处理组在28 d时, CAT酶活出现最高峰,随着H2O2的积累,贮藏后期(28~35 d)UV-C处理的CAT活性显著高于CK(P<0.05),贮藏至35 d时,CK,1.0,2.0,4.0 kJ/m2处理组的CAT活性分别下降至(22.9±1.8),(30.1±2.3),(33.3±1.5),(30.9±2.0) U/(min·g·FW),其中2.0 kJ/m2处理是CK的1.45倍。

图11 贮藏期间蓝莓CAT酶活变化
PPO广泛存在于植物体中,是酶促褐变中起主要作用的酶之一[29]。由图12可知,贮藏初期(0~14 d)PPO酶活呈下降趋势,其中贮藏中期(14~28 d)呈上升趋势,贮藏28 d时达到峰值,UV-C各处理显著高于CK(P<0.01),贮藏后期(28~35 d)呈下降趋势,贮藏至35 d时,2.0 kJ/m2处理的PPO酶活最高,是CK的1.28倍。UV-C处理相比CK提高了蓝莓的PPO酶活,与厉维江等[8]研究UV-C处理对葡萄PPO影响的结果一致。PPO酶活变化趋势与CAT酶较一致,2.0 kJ/m2处理的这2种酶活在贮藏期保持较高水平,尤其贮藏28~35 d酶活最高,且腐烂率较低,在抗病性方面表现良好的效果,表明这2种防御酶与蓝莓的抗病性具有较好的相关性。

图12 贮藏期间蓝莓PPO酶活变化
POD反映植物体内的代谢及抗逆性的变化,POD能清除活性氧自由基,减少对细胞膜的伤害,对蓝莓果实具有一定的保护作用。由图13可知,蓝莓果实的POD活性在贮藏期间呈现波动趋势。CK,1.0,2.0,4.0 kJ/m2组贮藏至35 d时,酶活分别是贮藏0 d的0.99,1.0,1.0,1.10倍,各组间的差异不显著(P>0.05),表明UV-C处理对提升蓝莓POD酶活效果不明显。
3 结论
(1) 本研究采用不同剂量UV-C处理蓝莓,研究低温贮藏条件下的贮藏效果,结果表明:2.0 kJ/m2处理对蓝莓贮藏保鲜效果最好,有效抑制了采后蓝莓的失重和腐烂,贮藏至35 d时相比CK失重率减少11.4%,腐烂率减少14.8%,推迟发病7~14 d,硬度提高16.74%,总黄酮含量提高7.65%,总酚含量提高9.93%;PAL、CAT、PPO酶活分别为CK的1.08,1.45,1.28倍,说明UV-C处理对采后蓝莓提高贮藏品质及防御性酶活性有较好的效果。
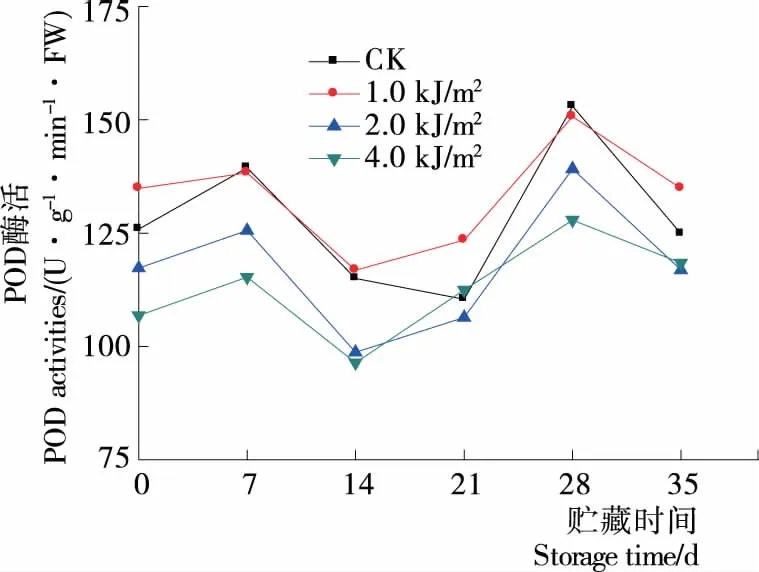
图13 贮藏期间蓝莓POD酶活变化
高剂量4.0 kJ/m2处理在保持果实硬度、提升果实的总黄酮、总酚含量及PAL酶活方面表现出较好的效果,但在抑制果实失重和腐烂方面效果相对较差,可能与高剂量的UV-C对果实组织会产生灼伤等破坏作用相关[30],导致果实的失重率和腐烂率上升。
(2) 本试验开展UV-C处理保鲜蓝莓的研究,腐烂率、失重率等与厉维江等[8]、ERKAN M等[13]、PERKINS-VEAZIE P等[24]对蓝莓和葡萄的研究结果基本一致,同时本文针对低温贮藏期间的总黄酮、葡萄糖、果糖及防御性酶活性等指标进行了较系统的研究,阐明了在贮藏期间这些指标的变化规律,进一步完善了对UV-C处理蓝莓保鲜的基础研究。
(3) 适宜剂量的UV-C处理能提高蓝莓的贮藏品质,是一种绿色防腐保鲜方法,但与一些涂膜保鲜方法相比,在降低失重率和腐烂率等方面还存在不足,如能作为预处理方法与其他绿色保鲜方法结合使用,进一步提升保鲜效果,将会在蓝莓的天然保鲜中发挥重要作用。
[1] 刘长虹. 中短波紫外线调节采后番茄品质及相关次生代谢的效应与机理[D]. 杭州: 浙江大学, 2012.
[2] 陈奕兆, 刚成诚, 王亦佳, 等. UV-C处理对水蜜桃果实冷害及贮藏品质的影响[J]. 中国南方果树, 2013, 42(1): 16-21.
[3] 梁敏华, 雷建敏, 邵佳蓉, 等. UV-C处理对桃果实酚类物质代谢和贮藏品质的影响[J]. 核农学报, 2015, 29(6): 1 088-1 093.
[4] 崔志宽, 李阳, 李建龙, 等. UV-C预处理加真空包装组合处理对凤凰水蜜桃保鲜效果的影响[J]. 天津农业科学, 2013, 19(3): 22-27.
[5] 程玉豆, 李丹, 冯云霄. UV-C处理对采后草莓果实腐烂及相关基因表达的影响[J]. 现代食品科技, 2016, 32(2): 152-157.
[6] 蔡艳, 施丽愉, 陈伟, 等. UV-C处理对采后草莓果实品质和活性氧代谢的影响[J]. 中国食品学报, 2015, 15(3): 128-134.
[7] 喻譞, 姜璐璐, 王焕宇, 等. UV-C处理对杨梅采后品质及苯丙烷类代谢的影响[J]. 食品科学, 2015, 36(12): 255-259.
[8] 厉维江, 厉超阳, 谢亚利, 等. 采后UV-C处理对葡萄抗病性和品质的影响[J]. 安徽农业科学, 2011, 39(9): 5 351-5 353.
[9] 陆仙英, 刘长虹, 蒋振晖, 等. 采后UV-C处理对延缓香梨软化及相关酶活性的影响[J]. 中国食品学报, 2012, 12(7): 134-138.
[10] 李学文, 廖亮, 黄玲, 等. 紫外光(UV-C)处理对库尔勒香梨采后病斑扩展和抗病性的影响[J]. 新疆农业大学学报, 2014, 37(2): 159-16.
[11] 王金丽, 林强, 李建杰, 等. 壳聚糖及UV-C处理对冬枣贮藏品质的影响[J]. 食品科学, 2010, 31(22): 462-466.
[12] 李斌, 雷月, 孟宪军, 等. 蓝莓营养保健功能及其活性成分提取技术研究进展[J]. 食品与机械, 2015, 31(6): 251-253.
[13] ERKAN M, WANG S Y, WANG C Y, et a1. Effect of UV-C illumination on antioxidant capacity and postharvest decay in blueberry fruit[J]. Journal of Food, Agriculture & Environment, 2013, 11(3/4): 434-436.
[14] 杨乐, 侯智霞, 杨俊枫, 等. UV-C对蓝莓酚类物质及其相关酶活性的影响[J]. 浙江农业学报, 2015, 27(6): 955-960.
[15] 唐坚, 乔勇进, 王凯晨, 等. 不同物理处理方式对蓝莓贮藏品质的影响[J]. 农产品加工, 2015(1): 43-46.
[16] 董生忠, 徐方旭, 刘诗扬, 等. 短波紫外线(UV-C)结合冰温贮藏对蓝莓采后保鲜效果的影响[J]. 北方园艺, 2017(2): 142-144.
[17] NGUYEN C T T, KIM J, YOO K S, et a1. Effect of Prestorage UV-A, -B, and -C Radiation on Fruit Quality and Anthocyanin of ‘Duke’ Blueberries during Cold Storage[J]. Journal of Agricultural and Food Chemistry, 2014, 62: 12 144-12 151.
[18] LIU Hai, SONG Li-li, YOU Yan-li, et al. Cold storage duration affects litchi fruit quality,membrane permeability, enzyme activities and energy charge during shelf time at ambient temperature[J]. Postharvest Biology and Technology, 2011, 60(1): 24-30.
[19] DUAN Xue-wu, LIU Ting, ZHANG Dan-dan, et al. Effect of pure oxygen atmosphere on antioxidant enzyme and antioxidant activity of harvested litchi fruit during storage[J]. Food Research International, 2011, 44(7): 1 905-1 911.
[20] WANG Rong-rong, DING Sheng-hua, ZHAO Dan-dan, et al. Effect of dehydration methods on antioxidant activities, phenolic contents,cyclic nucleotides,and volatiles of jujube fruits[J]. Food Science and Biotechnology, 2016, 25(1): 137-143.
[21] ZHANG Zhan-quan, TIAN Shi-ping, ZHU Zhu, et al. Effects of 1-methylcyclopropene(1-MCP) on ripening and resistance of jujube (Zizyphusjujubacv. Huping) fruit against postharvest disease[J]. Food Science and Technology, 2012, 45(1): 13-19.
[22] CHANCE B, MAEHLY A C. Assay of catalases and peroxidases[J]. Methods in Enzymology, 1955, 2(55): 764-775.
[23] 于刚, 栾雨时, 安利佳. UV-C处理对蓝莓贮藏保鲜及品质的影响[J]. 食品研究与开发, 2013, 34(2): 92-95.
[24] PERKINS-VEAZIE P, COLLINS J K,HOWARD L. Blueberry fruit response to postharvest application of ultraviolet radiation[J].Postharvest Biology and Technology, 2008, 47(3): 280-285.
[25] BAkA M, MERCIER R, CORCUFF F, et a1. Photochemical treatment to improve storability of fresh strawberries[J]. Journal of Food Science, 1999, 64(6): 1 068-1 072.
[26] KRAMER G F, WANG C Y, CONWAY W S. Correlation of reduced softening and increased polyamine levels during low-oxygen storage of McIntosh apples[J]. Journal of the American society for Horticultural Science, 1989, 114(6): 942-946.
[27] 王瑞, 岑顺友, 谢国芳, 等. 不同晚熟蓝莓贮藏期间的品质变化研究[J]. 现代食品科技, 2014, 30(3): 43-48.
[28] SHAH K, KUMAR R G, VERMA S, et al. Effect of cadmium on lipid peroxidation, superoxide anion generation and activities of antioxidant enzymes in growing rice seedlings[J]. Plant Science, 2001, 161(6): 1 135-1 144.
[29] 张海伟, 张晓晴, 张雨露, 等. 前处理方式对蓝莓贮藏品质的影响[J]. 食品与机械, 2016, 32(9): 105-108.
[30] MARQUENIE D, MICHIELS C W, GEERAERD A H, et al. Using survival analysis to investigate the effect of UV-C and heat treatment on storage rot of strawberry and sweet cherry[J]. International Journal of Food Microbiology, 2002, 73(2/3): 187-196.
Effect of UV-C treatment on quality of blueberries fruit in low-temperature storage
ZHANGJu-hua1
LIGao-yang1
WANGWei2
LINShu-hua1
LIUWei1
TANHuan1
(1.HunanAgriculturalSciencesAcademyofAgriculturalProductsProcessingInstitute,Changsha,Hunan410125,China; 2.LongpingBranch,GraduateSchoolofHunanUniversity,Changsha,Hunan410125,China)
In order to develop green preservation technology of blueberry,Southernhighbushblueberries were treated by using different doses of UV-C (1.0, 2.0, 4.0 kJ/m2), and storaged at (4±0.5) ℃, changes of the quality were measured every 7 d during storage period, control samples was untreated. The results showed that UV-C treatment had better effect on improving the storage quality of blueberry, and 2 kJ/m2treatment was the best on preservation effect of blueberry, which can effectively inhibit weight loss and rotting of postharvest blueberry; when storaged for 35 days and compared to the control group, the weight loss rate reduced 11.4%, decay rate decreased 14.8%, disease time was delayed for 7~14 d, hardness was improved 16.74%, total flavonoids content was increased 7.65%, total phenolic content was increased 9.93%; PAL, CAT and PPO enzyme activity were increased by 1.08 times, 1.45 times and 1.28 times, respectively. This showed that proper UV-C dose could inhibit the decay of blueberry and enhance the quality and defense enzyme activities of blueberry.
blueberry; ultraviolet-C; storage quality
国家科技支撑计划课题(编号:2015BAD16B01);湖南省重点研发计划(编号:2016NK2182)
张菊华,女,湖南省农业科学研究院农产品加工研究所研究员,硕士。
李高阳(1971—),男,湖南省农业科学研究院农产品加工研究所研究员,博士。E-mail:Lgy7102@163.com
2017—06—07
10.13652/j.issn.1003-5788.2017.07.028
