恶性肿瘤合并静脉血栓栓塞症的临床特点及相关危险因素分析
2017-09-22谢贤和
吴 卿, 谢贤和
恶性肿瘤合并静脉血栓栓塞症的临床特点及相关危险因素分析
吴 卿, 谢贤和
目的探讨恶性肿瘤合并静脉血栓栓塞症(VTE)的临床特点和相关危险因素。方法收集恶性肿瘤合并VTE的患者177例为研究组,并以同期入院的恶性肿瘤但未合并VTE的100例患者为对照组,回顾性分析并比较2组患者的临床资料及可能存在的危险因素。结果VTE多发生在恶性肿瘤确诊的3月内,以肺癌最常见。高龄、合并疾病、白细胞计数增高、血红蛋白降低、凝血酶原时间增高、活化的部分凝血活酶时间增高、纤维蛋白原增高、D-二聚体增高在研究组中发生率较高,与对照组比较,差别有统计学意义(P<0.05);合并糖尿病、冠心病、感染、长期卧床、VTE病史、肿瘤压迫、接受化疗、生物治疗、中心静脉置管、激素治疗、止血药治疗、粒细胞集落刺激因子治疗、输血等,研究组的发生比例较对照组高,差别有统计学意义(P<0.05)。多因素Logistic回归分析结果显示,合并冠心病、中心静脉置管、接受激素治疗为恶性肿瘤合并VTE的独立危险因素(P<0.05);感染是恶性肿瘤合并VTE或肺栓塞的独立危险因素(P<0.05)。结论有冠心病、中心静脉置管、感染、接受激素治疗的恶性肿瘤患者易发生VTE,其中感染是恶性肿瘤合并肺栓塞的高危因素。
肿瘤; 静脉血栓栓塞; 肺栓塞; 深静脉血栓形成; 危险因素
静脉血栓栓塞症(venous thromboembolism, VTE)是肿瘤发展自然病程及抗肿瘤治疗过程中的常见并发症,包括深静脉血栓形成(deep venous thrombosis, DVT)和肺栓塞,后者是恶性肿瘤患者猝死的常见原因之一,严重影响预后。血栓常常作为隐性癌的临床表现出现,VTE是仅次于恶性肿瘤本身引起患者死亡的第2位原因[1-2]。随着抗肿瘤新技术的应用,恶性肿瘤患者血栓发生率呈现上升趋势。2013年1月-2016年9月,笔者科室收治恶性肿瘤合并VTE的患者177例,现回顾性分析其临床资料,探讨潜在的危险因素,以期做到早期预防,避免发生VTE,报告如下。
1 对象与方法
1.1 对象 177例中,男性91例,女性86例;年龄(56.82±13.80)岁(18~84岁)。肺癌41例,胃癌22例,宫颈癌15例,结直肠癌13例,恶性淋巴瘤14例,肝癌10例,泌尿系(肾、输尿管、膀胱)癌10例,卵巢癌7例,乳腺癌7例,胰腺癌6例,子宫内膜癌6例;DVT 120例,肺栓塞57例。收集同期入院但不合并VTE的恶性肿瘤患者100例作为对照组,男性55例,女性45例;年龄(53.89±11.81)岁(19~77岁)。肺癌18例,胃癌15例,宫颈癌8例,结直肠癌9例,恶性淋巴瘤5例,肝癌6例,泌尿系癌6例,卵巢癌4例,乳腺癌6例,胰腺癌3例,子宫内膜癌2例。
纳入标准:(1)恶性肿瘤均经组织病理学或细胞学检查证实;(2)DVT经彩色多普勒超声检查诊断;(3)肺栓塞的诊断按中华医学会呼吸病学分会制定的《肺血栓栓塞症诊断和治疗指南》(草案)诊断标准[3]:存在危险因素;不明原因的呼吸困难、胸痛、晕厥和休克;结合心电图、X线胸片、动脉血气分析等基本检查;螺旋CT肺动脉造影、核素肺V/Q显像、磁共振肺动脉造影等任一项检查阳性可确诊。
1.2 方法 收集2组患者的一般情况[性别、年龄、TNM分期、合并疾病、体质量指数(body mass index, BMI)],辅助检查[白细胞计数、血小板计数、血红蛋白、凝血酶原时间(prothrombin time, PT)、活化的部分凝血活酶时间(activated partial thromboplastin time, APTT)、纤维蛋白原(fibrinogen, FIB)、D-二聚体],危险因素[吸烟、饮酒、高血压、糖尿病、冠心病、感染、化疗、放疗、生物治疗、长期卧床、血栓病史、肿瘤压迫、中心静脉置管,激素、止血药、输血、粒细胞集落刺激因子(granulocyte colony stimulating factor, G-CSF)、促红细胞生成素(hemopoietin,EPO)治疗],同时收集研究组静脉血栓发生的时间及部位等。
2 结 果
2.1 2组基本资料对比 研究组与对照组的性别、肿瘤分期、BMI、血小板计数比较,差别无统计学意义(P>0.05)。≥60岁(高龄)、合并疾病、白细胞计数增高、血红蛋白降低、PT增高、APTT增高、FIB增高、D-二聚体增高在研究组中的发生率均高于对照组,且差别有统计学意义(P<0.05,表1)。
2.2 研究组主要肿瘤类型及构成比、血栓部位及发生时间 177例恶性肿瘤合并VTE患者中,肺癌所占比例最高(41例,23.16%),其次依次为胃癌(22例,12.43%)、宫颈癌(15例,8.47%)、恶性淋巴瘤(14例,7.91%);肺栓塞与DVT分别为57,120例,DVT的发生部位以左下肢最多见;在确诊恶性肿瘤前发生VTE者45例(25.42%),发生于肿瘤确诊后3月内(包括同时发现)者95例(53.67%),3~6月者26例(14.69%),6~12月者8例(4.52%),>12月者3例(1.70%)(图1)。

1:肺栓塞;2:左上肢深静脉血栓形成;3:右上肢深静脉血栓形成;4:左下肢深静脉血栓形成;5:右下肢深静脉血栓形成;6:多部位血栓形成;7:确诊恶性肿瘤前;8:确诊恶性肿瘤3月内;9:确诊恶性肿瘤3~6月;10:确诊恶性肿瘤6~12月;11:确诊肿瘤>1年.图1 血栓的部位及发生时间Fig 1 The location and time of VTE
2.3 恶性肿瘤合并VTE的危险因素分析 通过Pearson卡方检验或卡方检验的校正公式进行单因素分析显示,2组在合并糖尿病、冠心病、感染、长期卧床、VTE病史、肿瘤压迫、接受化疗、生物治疗、中心静脉置管、激素治疗、止血药治疗、G-CSF治疗、输血等方面存在差异,且差别有统计学意义(P<0.05,表2)。
2.4 恶性肿瘤合并VTE的多因素Logistic回归分析 以合并糖尿病、冠心病、感染、长期卧床、有VTE病史、肿瘤压迫,接受化疗、生物治疗、中心静脉置管、激素治疗、止血药治疗、G-CSF治疗和输血为自变量,发生VTE为因变量,行多因素Logistic回归分析。结果表明,冠心病、中心静脉置管、感染、激素治疗均为VTE发生的独立危险因素(P<0.05,表3)。
表12组患者基本资料对比情况
Tab1The comparison of two group patients with basic information
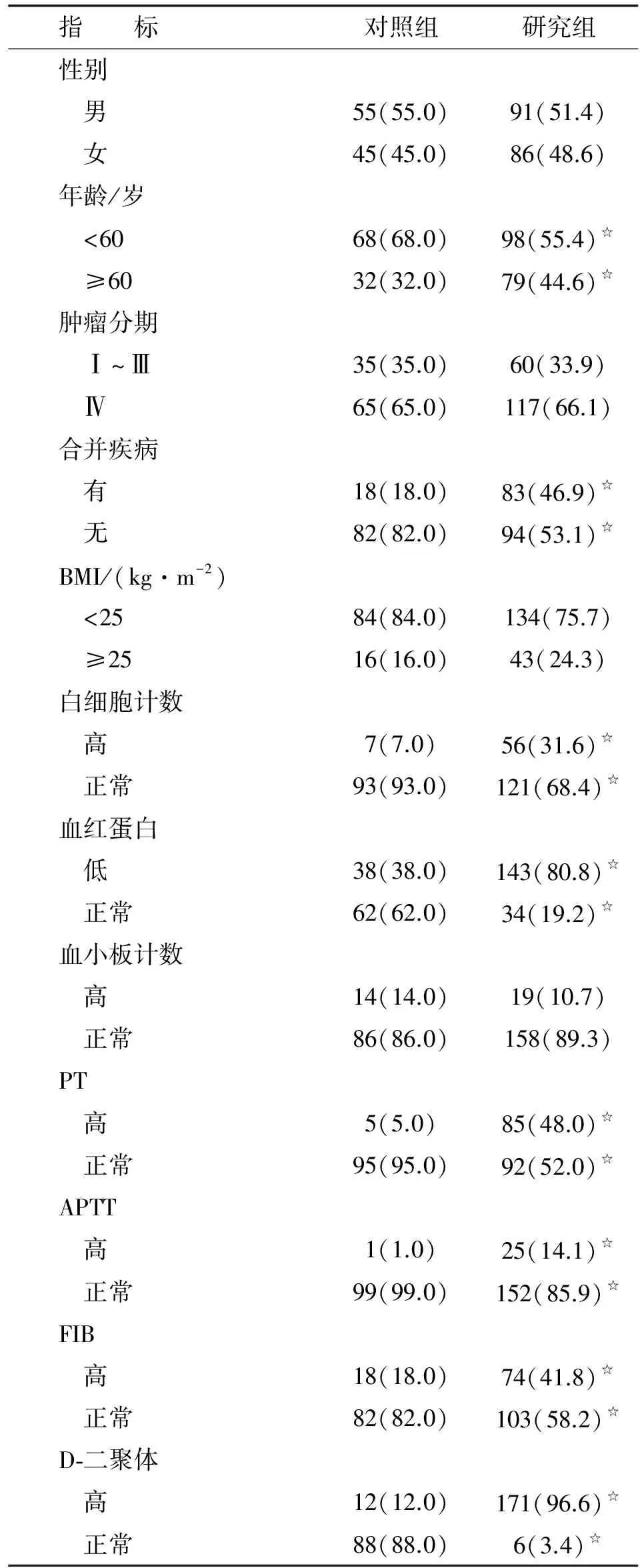
指 标对照组研究组性别 男55(55.0)91(51.4) 女45(45.0)86(48.6)年龄/岁 <6068(68.0)98(55.4)☆ ≥6032(32.0)79(44.6)☆肿瘤分期 Ⅰ~Ⅲ35(35.0)60(33.9) Ⅳ65(65.0)117(66.1)合并疾病 有18(18.0)83(46.9)☆ 无82(82.0)94(53.1)☆BMI/(kg·m-2) <2584(84.0)134(75.7) ≥2516(16.0)43(24.3)白细胞计数 高7(7.0)56(31.6)☆ 正常93(93.0)121(68.4)☆血红蛋白 低38(38.0)143(80.8)☆ 正常62(62.0)34(19.2)☆血小板计数 高14(14.0)19(10.7) 正常86(86.0)158(89.3)PT 高5(5.0)85(48.0)☆ 正常95(95.0)92(52.0)☆APTT 高1(1.0)25(14.1)☆ 正常99(99.0)152(85.9)☆FIB 高18(18.0)74(41.8)☆ 正常82(82.0)103(58.2)☆D⁃二聚体 高12(12.0)171(96.6)☆ 正常88(88.0)6(3.4)☆
表中数据为n(%). BMI:体质量指数;PT:凝血酶原时间;APTT:活化的部分凝血活酶时间;FIB:血浆纤维蛋白原. 与对照组比较,☆:P<0.05.
表2恶性肿瘤合并VTE的危险因素分析
Tab2The risk factors analysis of malignancies complicated with VTE
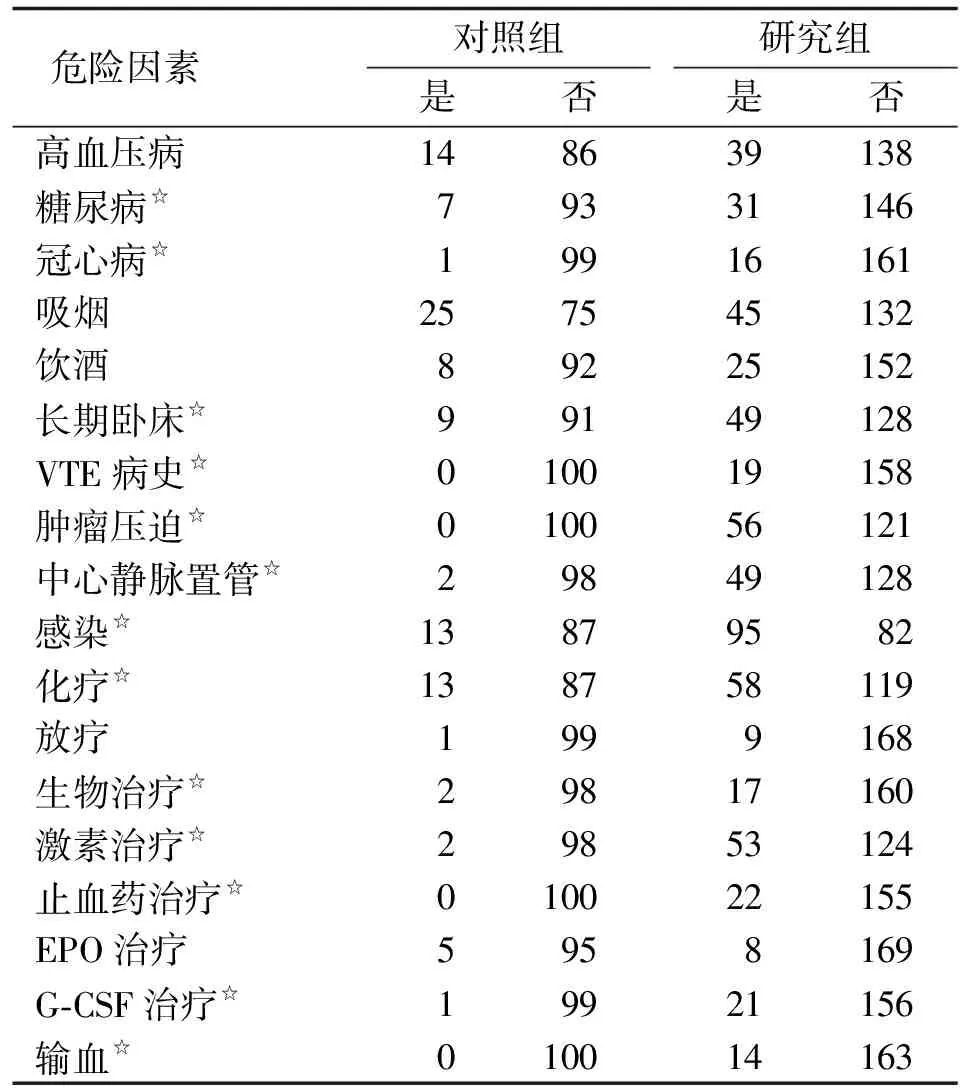
危险因素对照组是否研究组是否高血压病148639138糖尿病☆79331146冠心病☆19916161吸烟257545132饮酒89225152长期卧床☆99149128VTE病史☆010019158肿瘤压迫☆010056121中心静脉置管☆29849128感染☆13879582化疗☆138758119放疗1999168生物治疗☆29817160激素治疗☆29853124止血药治疗☆010022155EPO治疗5958169G⁃CSF治疗☆19921156输血☆010014163
表中数据为n. VTE:静脉血栓栓塞症;EPO:促红细胞生成素;G-CSF:粒细胞集落刺激因子. 2组间比较,☆:P<0.05.
2.5 肺栓塞者与对照组的比较
2.5.1 肺栓塞者的基本情况 57例恶性肿瘤合并肺栓塞的患者中,男性26例,女性31例;年龄(57.32±15.78)岁(18~84岁);Ⅰ~Ⅲ期及Ⅳ期者分别为16,41例;其中肺癌21例,胃癌8例,宫颈癌2例,结直肠癌1例,恶性淋巴瘤3例,肝癌5例,泌尿系癌3例,卵巢癌2例,乳腺癌1例,胰腺癌3例,子宫内膜癌1例。
2.5.2 恶性肿瘤合并肺栓塞的单因素、多因素分析 在单因素分析中,肺栓塞者与对照组比较,在合并冠心病、感染、长期卧床、VTE病史、肿瘤压迫、接受化疗、中心静脉置管、激素治疗、止血药治疗等方面存在差异,且差别有统计学意义(P<0.05,表4)。将恶性肿瘤合并肺栓塞进行多因素Logistic回归分析,以合并冠心病、感染、长期卧床、VTE病史、肿瘤压迫和接受化疗、静脉置管、激素治疗、止血药治疗为自变量,肺栓塞的发生为因变量。结果表明,感染是肺栓塞发生的独立危险因素(P<0.05,表5)。

表3 恶性肿瘤合并VTE的多因素Logistic回归分析
VTE:静脉血栓栓塞症;G-CSF:粒细胞集落刺激因子.
3 讨 论
VTE是恶性肿瘤患者最常见且最严重的并发症之一。恶性肿瘤患者中VTE的发生率较高,与普通人群相比,其发生VTE的风险增加了4~7倍[4-8]。癌症患者的尸检报告显示,发生VTE者占50%[9]。研究表明,合并VTE的恶性肿瘤患者通常预后不佳[10]。因此,尽早发现恶性肿瘤合并VTE的高风险人群,早期做好预防措施,对临床医生及时诊断治疗、改善患者的生存质量、延长生存期都具有重要临床意义。
部分恶性肿瘤起病隐匿,无明显临床症状,静脉血栓可为首发症状[11];约10%特发性VTE患者在诊断VTE后的数月内发现了恶性肿瘤,VTE患者新发恶性肿瘤的风险是无VTE病史者的3.2~4.8倍[1]。本研究177例中,在确诊恶性肿瘤前发生VTE者45例(25.42%),在确诊后3月内发生VTE者95例(53.67%),且随时间的推移,VTE的发生率逐渐降低,与文献报道基本一致[6]。不同部位的恶性肿瘤发生VTE的风险也不同。Horsted等报道,肿瘤相关VTE的发生率按肿瘤部位依次为胰腺癌、脑癌、肺癌、血液系统肿瘤、结直肠癌、骨肿瘤、前列腺癌和乳腺癌[12];其他大型多中心的研究结果类似:血液系统肿瘤、肺癌、消化道肿瘤、脑癌和妇科肿瘤患者发生VTE的风险明显增加[13-14]。本研究以肺癌所占比例最高,为23.16%(41/177),可能与肺癌发病率高有关,与有关报道一致[15]。
表4恶性肿瘤合并肺栓塞的危险因素分析
Tab4The risk factors analysis of malignancies complicated with Pulmonary Embolism
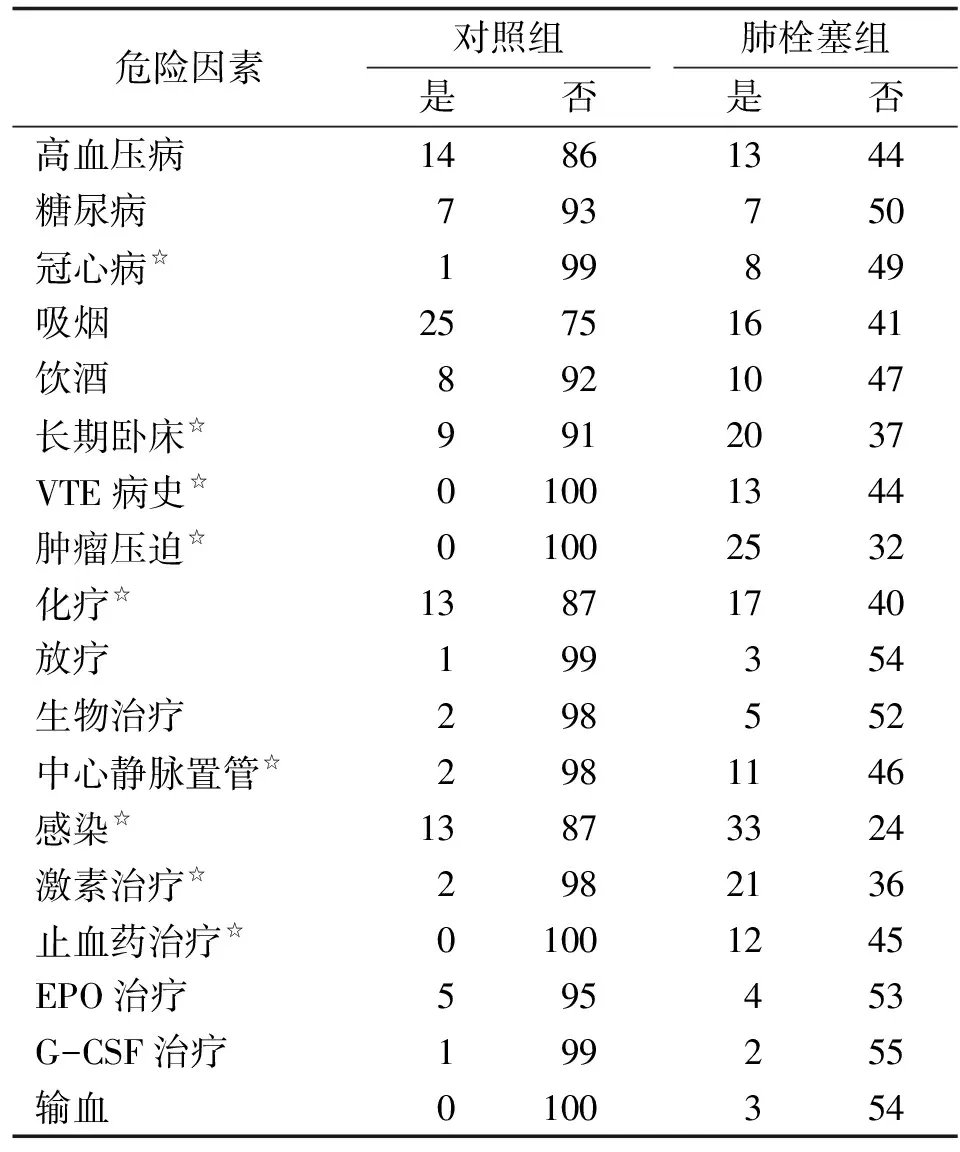
危险因素对照组是否肺栓塞组是否高血压病14861344糖尿病793750冠心病☆199849吸烟25751641饮酒8921047长期卧床☆9912037VTE病史☆01001344肿瘤压迫☆01002532化疗☆13871740放疗199354生物治疗298552中心静脉置管☆2981146感染☆13873324激素治疗☆2982136止血药治疗☆01001245EPO治疗595453G-CSF治疗199255输血0100354
VTE:静脉血栓栓塞症;EPO:促红细胞生成素;G-CSF:粒细胞集落刺激因子. 2组间比较,☆:P<0.05.
本研究结果也提示,≥60岁的恶性肿瘤患者发生VTE的风险增加。VTE的发病率随着年龄的增长而增加,许多恶性肿瘤的发病率也与年龄存在正比关系,故高龄是VTE和恶性肿瘤共同的发病危险因素。因此,对于年龄较大的恶性肿瘤患者,尤其是合并高危因素的患者,需注意预防血栓形成。本研究结果显示,恶性肿瘤合并VTE的患者常表现为PT,APTT,FIB及D-二聚体、白细胞计数增高,血红蛋白降低。其中,D-二聚体是凝血系统激活和继发性纤溶亢进的指标,是恶性肿瘤合并静脉血栓形成的预后指标,高水平D-二聚体的患者,其预后明显低于低水平或正常水平者(P=0.038)[16]。有研究报道[17],30%~60%恶性肿瘤患者体内会出现活化血小板计数升高,不仅导致血流减慢、造成血栓形成,也利于癌细胞的侵袭扩散。同时,癌细胞能促进体内造血细胞产生多种免疫细胞,如白细胞、血红蛋白等,继而导致血液呈高凝状态。但在本研究中,2组患者的血小板计数差别并无统计学意义,甚至研究组的血红蛋白较对照组低。原因可能如下:(1)研究组中进行放化疗的人数较对照组多,骨髓抑制对血小板及血红蛋白结果有一定影响;(2)纳入研究的患者中,Ⅳ期者较多,病情较重,机体处于一种造血抑制状态,因而血小板及血红蛋白下降。
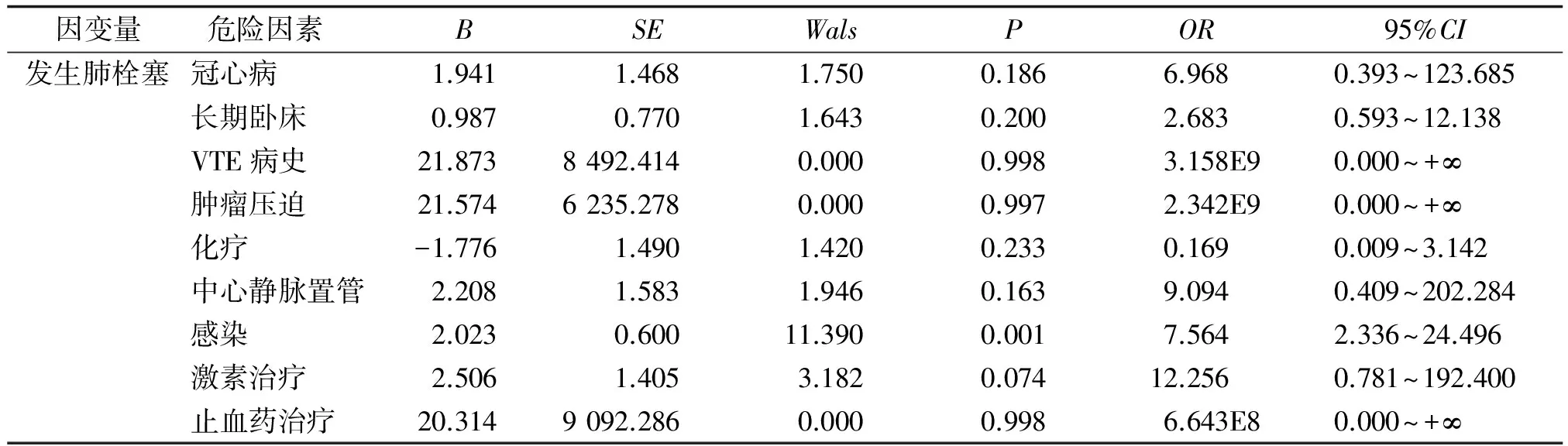
表5 恶性肿瘤合并肺栓塞的多因素Logistic回归分析
VTE:静脉血栓栓塞症.
在恶性肿瘤合并VTE的危险因素分析中,单因素分析显示,多种基础疾病(如糖尿病、冠心病)、长期卧床、VTE病史、合并感染、接受化疗、生物治疗、中心静脉置管、激素治疗、止血药治疗、G-CSF治疗和输血等均是VTE发生的相关危险因素,与其他的研究相似[12,18-19]。多因素回归分析显示,合并冠心病、中心静脉置管、感染、激素治疗是恶性肿瘤合并VTE的独立危险因素。冠心病是动脉血栓性疾病,与VTE存在某些共同的发病机制,如内皮细胞应激、血小板和白细胞活化等[20];二者的存在具有相关性,如一些导致动脉血栓的传统危险因素也是引起静脉血栓的危险因素[21];一些遗传因素也被证实同时与静脉和动脉血栓有关,如Ⅴ因子突变、凝血素G20210A突变,但这2种情况下发生静脉血栓的危险是动脉血栓的10倍[22];临床上也有证据表明,症状性动脉血栓的患者发生静脉血栓的风险增加[23]。中心静脉置管已广泛应用于恶性肿瘤患者的治疗中,常见并发症为导管相关性感染和血栓,导管相关血栓形成的发生率为9%[24],其机制可能与血管内皮损伤、血流缓慢、组织因子释放、启动外源性凝血通路、血液高凝状态、导管材料和导管位置等相关。激素治疗不仅会直接造成血管内皮损伤,导致内皮细胞脱落,启动内皮促凝机制,同时也可降低抗凝物质如蛋白C和蛋白S的水平,增加纤溶酶原激活物抑制剂-1的水平,促进血栓的形成[25]。恶性肿瘤患者合并感染时,可触发机体免疫防御机制,刺激机体产生大量炎症介质,造成血管内皮细胞损伤,破坏血管壁,促进血液高凝状态的形成;同时,感染往往会引起白细胞水平增加,而白细胞本身可能参与静脉血栓的形成过程,尤其是单核细胞和中性粒细胞[26]。
VTE包括DVT和肺栓塞,是其在不同部位和不同阶段发生的2种临床表现形式,但二者存在较大差异,最主要的区别是预后不同。DVT常导致静脉炎后综合征,而肺栓塞往往致死或致慢性栓塞性肺动脉高压;后者的危害较前者更严重,占肿瘤患者住院期间主要死亡原因的第2位[27]。由于恶性肿瘤合并肺栓塞具有高漏诊率、高病死率和病残率,一旦发生会导致患者生存期明显缩短,治疗难度增加,治疗费用增高,因此早期诊断及预防显得尤为重要。本研究单独对肺栓塞组与对照组进行了亚组分析,结果显示,合并冠心病、感染、长期卧床、VTE病史、肿瘤压迫、接受化疗、中心静脉置管、激素治疗、止血药治疗是恶性肿瘤合并肺栓塞的相关危险因素,其中感染是恶性肿瘤合并肺栓塞的独立危险因素。因此,临床上对于合并上述因素的恶性肿瘤患者应高度警惕其发生肺栓塞的可能,应采取有效的预防和治疗措施,提高诊治水平,减少肺栓塞的发生,延长患者的生存时间。
肿瘤自身因素、患者因素和肿瘤治疗相关因素通过多种机制破坏机体的凝血、抗凝及纤溶系统的平衡,使患者出现不同程度的高凝状态或易栓状态,促进了VTE的形成,造成了病情复杂化,不但增加了治疗难度,而且严重影响患者的生活质量和预后。因此VTE的预防是一个极富挑战性的问题。已证实低分子肝素可用于实体瘤VTE的防治。近年来,新型口服抗凝药物(如达比加群、利伐沙班)也应用于恶性肿瘤合并VTE的防治。但对于不同类型恶性肿瘤、合并不同并发症时的具体防治选择仍需大量临床试验进一步探索与证实。
[1] Lee A Y. Thrombosis and cancer: the role of screening for occult cancer and recognizing the underlying biological mechanisms[J].HematologyAmSocHematolEducProgram, 2006, 2006(1):438-443.
[2] Korte W. Cancer and thrombosis:an increasingly important association[J].SupportCareCancer, 2008,16(3):223-228.
[3] 中华医学会呼吸病学会.肺血栓栓塞症的诊断和治疗指南(草案)[J]. 中华结核和呼吸杂志, 2001,24(5):259-264.
[4] Prandoni P, Falanga A, Piccioli A. Cancer and venous thromboembolism[J].LancetOncol, 2005,6(6):401-410.
[5] Heit J A. Cancer and venous thromboembolism: scope of the problem[J].CancerControl, 2005,12(Suppl 1):5-10.
[6] Blom J W, Doggen C J, Osanto S,etal. Malignancies,prothrombotic mutations,and the risk of venous thrombosis[J].JAMA, 2005,293(6):715-722.
[7] Lee A Y, Levine M N. Venous thromboembolism and cancer:risks and outcomes[J].Circulation, 2003,107(23):117-121.
[8] Lyman G H, Khorana A A, Falanga A,etal. American society of clinical oncology guideline:recommendations for venous thromboembolism prophylaxis and treatment in patients with cancer[J].JClinOncol, 2007,25(4):5490-5505.
[9] Bergqvist D, Caprini J A, Dotsenko O,etal. Venous thromboembolism and cancer[J].CurrProblSurg, 2007,44(3):157-216.
[10] Sorensen H T, Mellemkjaer L P, Olsen J H,etal. Prognosis of caners associated with venous thromboembolism[J].NEnglJMed, 2000,343(25):1846-1850.
[11] 葛洪峰,段永建.静脉血栓形成为首发表现恶性肿瘤44例临床分析[J]. 中华肿瘤防治杂志, 2010,17(4):299-300.
[12] Horsted F, West J, Graingem J. Risk of venous thromboembolism in patients with cancer: a systematic review and meta-analysis[J].PLoSMed, 2012,9(7): e1001275.
[13] Cronin-fenton D P, Sondergaard F, Pedersen L A,etal. Hospitalisation for venous thromboembolism in cancer patients and the general population: a population-based cohort study in Denmark, 1997-2006[J].BrJCancer, 2010,103(7):947-953.
[14] Walker A J, Card T R, West J,etal. Incidence of venous thromboembolism in patients with cancer - a cohort study using linked united kingdom databases[J].EurJCancer, 2013,49(6):1404-1413.
[15] 李 国,陆慰萱,王 辰.恶性肿瘤合并肺栓塞60例临床分析[J].中华肿瘤学杂志, 2009,31(7):550-553.
[16] 林 莉,徐建国,王 岩,等.恶性肿瘤合并静脉血栓形成35例临床研究[J]. 临床肿瘤学杂志, 2010,15(2):153-156.
[17] Nand S, Messmore H. Hemostasis in malignancy[J].AmJHematol, 1990,35(1):45-55.
[18] Mandala M, Clerici M, Corradino I, et a1. Incidence risk factors and clinical implications of venous thromboembolism in cancer patients trelated within the context of phase Istudies: the SENDO experience[J].AnnOncol, 2012,23(6):1416-1421.
[19] 闫振宇,华宝来,马西虎,等. 672例VTE相关危险因素分析[J]. 中华血液学杂志, 2007,28(9):579-582.
[20] Lowe G D. Common risk factors for both arterial and venous thrombosis[J].BrJHaematol, 2008,140(5):488-495.
[21] Boekholdt S M, Kramer M H. Arterial thrombosis and the role of thrombophilia[J].SeminThrombHemost, 2007,33(6):588-596.
[22] Ye Z, Liu E H, Higgins J P,etal. Seven hemostatic gene polymorphisms in coronary disease: meta-analysis of 66155 cases and 91307 controls[J].Lancet, 2006,367(9511):651-658.
[23] Eliasson A, Bergqvist D, Bjorck M,etal. Incidence and risk of venous thromboembolism in patients with verified arterial thrombosis:a population study based on 23796 consecutive autopsies[J].JThrombHaemost, 2006,4(9):1897-1902.
[24] Boersma R S, Hamulyak K, Tuinenburg A,etal. Biomarkers for prediction of central venous catheter related-thrombosis in patients with hematological malignancies[J].ClincialandAppliedThrombosis/Hemostasis, 2015,22(8):1-5.
[25] Musaallam K M, Dabdaleh F S, Shamseddine A I,etal. Incidence and prophylaxis of venous thromboembolic events in multiple myeloma patients receiving immunomodulatory therapy[J].ThrombRes, 2009,123(5):679-686.
[26] Connolly G C, Khorana A A, Kuderer N M,etal. Leukocytosis, thrombosis and early mortality in cancer patients initiating chemotherapy[J].ThrombRes, 2010,126(2):113-118.
[27] Khorana A A, Francis C W, Culakova E,etal. Thromboembolism is a leading cause of death in cancer patients receiving outpatient chemotherapy[J].ThrombHaemost, 2007,5(3):632-634.
(编辑:何佳凤)
Clinical Analysis on the Characteristics and Risk Factors of Malignancies Complicated with Venous Thromboembolism
WU Qing, XIE Xianhe
Department of Chemotherapy, The First Affiliated Hospital of Fujian Medical University, Fuzhou350005, China
Objective Exploring the clinical characteristics and risk factors of malignancies complicated with venous thromboembolism (VTE). Methods 177 patients with malignancies complicated with VTE (experimental group), and 100 patients with malignancies of non-VTE (control group) were collected from First Affiliated Hospital of Fujian Medical University from January 2013 to September 2016. Clinical characteristics and risk factors of the data were retrospectively analyzed. Result VTE was observed during the first three months after the malignancy diagnosis, and the most common malignancy was lung cancer. The most common location of deep venous thrombosis(DVT)was the left lower limb. Compared with control group, experimental group showed higher rates in malignancies with aged, concurrent disease, increased white blood cell count, lower hemoglobin, increased prothrombin time, increased activated partial thromboplastin time, increased plasma fibrinogen, and increased D-Dimer (P<0.05). Additionally, compared with control group, experimental group suggested that the incidence of diabetes, coronary heart disease, infection, long-term bed, history of VTE, oncothlipsis, hemostatic treatment, chemotherapy, biotherapy, central venous catheter, hormonotherapy, granulocyte colony stimulating factor and blood transfusion were higher (P<0.05). Binary Logistic regression analysis indicated that coronary heart disease, central venous catheter and hormonotherapy were independent risk factors of malignancies complicated with VTE (P<0.05) while the infection was independent risk factor of malignancies complicated with both VTE and pulmonary embolism (P<0.05). Conclusion The malignancies with coronary heart disease, central venous catheter, infection, hormonotherapy were at risk of VTE while the malignancies with infection were at risk of pulmonary embolism.
neoplasms; venous thromboembolism; pulmonary embolism; venous thrombosis; risk factors
2017-03-08
福建医科大学 附属第一医院化疗科,福州 350005
吴 卿,女,住院医师,医学硕士
谢贤和. Email: 13976868269@163.com
R543; R619.2; R73
: A
: 1672-4194(2017)04-0228-06
