芹菜素抗乳腺癌多药耐药MCF-7/ADR细胞作用的研究
2017-09-21赵亚新刘洁凡江明华钱海鑫
赵亚新,刘洁凡,江明华,钱海鑫
1. 苏州大学附属第一医院普外科,江苏 苏州,215006;2. 温州医科大学附属第一医院全科医学肿瘤科,浙江 温州,325000;3. 温州医科大学附属第二医院检验科,浙江 温州,325000;4.温州医科大学附属第二医院普外科,浙江 温州,32500
芹菜素抗乳腺癌多药耐药MCF-7/ADR细胞作用的研究
赵亚新1,4,刘洁凡2,江明华3,钱海鑫1
1. 苏州大学附属第一医院普外科,江苏 苏州,215006;2. 温州医科大学附属第一医院全科医学肿瘤科,浙江 温州,325000;3. 温州医科大学附属第二医院检验科,浙江 温州,325000;4.温州医科大学附属第二医院普外科,浙江 温州,32500
背景与目的:肿瘤多药耐药细胞是肿瘤化疗失败的主要原因,也是恶性肿瘤复发、转移等的重要因素。目前发现芹菜素对多种恶性肿瘤细胞具有抗肿瘤作用,但对肿瘤多药耐药细胞的作用研究较少。该研究拟了解芹菜素对乳腺癌多药耐药MCF-7/ADR细胞的作用,初步探讨芹菜素逆转肿瘤多药耐药性的作用。方法:选取人乳腺癌多药耐药MCF-7/ADR细胞为主要研究对象,以芹菜素作用为实验组,以ADR作用为对照组,用MTT法检测细胞生长增殖情况,PI染色法检测细胞周期分布情况,Annexin V/PI法检测细胞凋亡状态情况,MTT法进行体外药物敏感性分析,Rhodamine-123储留检测细胞内药物蓄积和外排情况,采用蛋白[质]印迹法(Western blot)检测细胞内P-gp蛋白的表达情况,采用反转录聚合酶链式反应(reverse transcription-PCR,RT-PCR)检测多药耐药MDR1基因的转录情况。结果:与对照组相比,芹菜素明显抑制了MCF-7/ADR细胞增殖,阻滞了MCF-7/ADR细胞周期的进展,明显诱导了MCF-7/ADR细胞凋亡的增加;芹菜素作用下ADR对MCF-7/ADR细胞的IC50为(12.37±0.18)μg/mL,明显低于单用ADR对MCF-7/ADR的IC50(39.83±0.29)μg/mL (P<0.05),其逆转倍数为3.22;芹菜素增加了MCF-7/ADR细胞内Rhodamine-123的蓄积;与亲本细胞MCF-7相比,MCF-7/ADR细胞内的MDR1基因为高转录水平、P-gp蛋白为高表达状态;芹菜素作用下MCF-7/ADR细胞内的MDR1基因转录水平和P-gp蛋白的表达水平均下降。结论:芹菜素具有明显的抗MCF-7/ADR细胞作用,同时具有逆转MCF-7/ADR细胞肿瘤多药耐药性功能,其机制可能与降低MDR1基因转录和下调P-gp蛋白介导的药物外转运功能有关。
芹菜素;乳腺癌多药耐药;细胞凋亡;逆转
肿瘤多药耐药细胞的存在是导致肿瘤化疗失败的主要原因,也是恶性肿瘤复发、转移等的重要因素。对肿瘤多药耐药的研究是目前肿瘤领域研究的热门。芹菜素(apigenin,AP)是一种天然的黄酮类化合物,以植物黄色素的形式广泛存在于茶叶、蔬菜、水果和香料中。目前研究发现芹菜素对多种恶性肿瘤细胞具有抗肿瘤作用,但对肿瘤多药耐药细胞的作用研究较少。本研究通过研究芹菜素对乳腺癌多药耐药细胞株(MCF-7/ADR)的作用,初步探讨芹菜素抗肿瘤多药耐药细胞的作用。
1 材料和方法
1.1 主要材料
人乳腺癌MCF-7/ADR、MCF-7细胞购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所细胞库;芹菜素(货号与规格:42251-10MG,CAS号,520-36-5)购自美国Sigma公司,纯度大于99%,用DMSO配制,于-20 ℃条件下保存;碘化丙啶(propidium iodide,PI)、噻唑蓝[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT]、AnnexinⅤ-FITC/PI凋亡检测试剂盒、鼠抗人P-gp单抗、鼠抗人GAPDH单抗、鼠HRP标记羊抗鼠二抗、即用反转录聚合酶链式反应(reverse transcription-PCR,RT-PCR)扩增试剂盒(Taq)、 Taq DNA聚合酶(Taq DNA聚合酶)等均购自美国Sigma公司;多药耐药基因(multidrug resistance gene,MDR)家族的MDR1基因,其上游引物:5’-CTGTTATTCGTTGTCTGCACCACGA-3’,下游引物:5’-AGGGTGTCAAATTTATCT GCACTT-3;GAPDH上游引物:5’-ACCACAC TTCCATCTCCATCAC-3’,下游引物:5’-ACCACACTTCCATCTCCATCAC-3’,由生工生物工程(上海)股份有限公司合成;多柔比星(adriamycin,ADR)购自中国山东齐鲁制药有限公司。
1.2 细胞培养
乳腺癌MCF-7细胞于RPMI-1640培养液中培养,MCF-7/ADR细胞株在加入1.0 µmo1/L ADR的RPMI-1640培养液中培养以维持其耐药性。实验前两周将其置于无ADR的RPMI-1640培养液中培养。两者均于37 ℃,CO2体积分数为5%培养箱中培养,用0.25%胰蛋白酶消化,2~3 d传代1次。实验时取各对数生长周期的细胞按需接种。试验中不同浓度的芹菜素是指10、20、 40和80 μmol/L。
1.3 细胞增殖
采用MTT比色法检测细胞增殖情况。取对数生长周期的MCF-7/ADR细胞,制成单细胞悬液,每孔100 µL接种于96孔板,每组设3个复孔。实验组:不同浓度芹菜素组;对照组:ADR组。继续培养;分别于第1、2、3、4、5和6 d,加入MTT溶液20 µL(5g/L),选495 nm波长,以不加细胞只加培养液为空白对照凋零,在酶联免疫检测仪上测各孔吸光度(D)值。以吸收值为纵坐标,时间为横坐标绘制细胞生长曲线。
1.4 细胞周期检测
采用PI单染色法检测细胞周期。同前进行MCF-7/ADR细胞接种,给予不同浓度的芹菜素处理后继续培养48 h,制成单细胞悬液离心洗涤后加入400 µL PI(50 μg/mL)、10 µL RnaseA(20 µg/mL),用300目尼龙膜过滤样品,选488 nm波长在流式细胞仪上测定,进行细胞周期的分析。
1.5 细胞凋亡实验
采用AnnexinⅤ/PI双染色法检测细胞凋亡情况。同前进行细胞接种,给予不同浓度的芹菜素处理,继续培养48 h后制成单细胞悬液,离心洗涤后加入5 μL AnnexinⅤ-FITC和10 µL PI混匀,用流式细胞仪进行检测,并以仪器所配软件进行数据处理,计算细胞凋亡率。细胞凋亡率=凋亡细胞数/(凋亡细胞数+正常细胞数) ×100%。
1.6 体外药物敏感性
采用MTT比色法观测体外药物敏感性。根据前期实验结果,选浓度为10 μmol/L的芹菜素和作用时间为24 h用于体外药物敏感性,以免芹菜素自身毒性过大,干扰增敏实验。同前进行细胞接种,实验组加芹菜素(10 μmol/L)+不同浓度的ADR,对照组给予加不同浓度的ADR,培养24 h后于酶联免疫监测仪上,检测波长570 nm的每孔光密度值(D570nm);抑制率(%)=(1-D实验孔/D对照孔)×100%,由线性回归分析,计算ADR半数抑制浓度IC50。逆转指数为ADR的IC50值与芹菜素作用下ADR的IC50值的比值。
1.7 药物转运功能
采用Rhodamine123储留实验检测药物转运功能。同前进行细胞接种,加入不同浓度芹菜素,继续培养48 h,将浓度为5 μg/mL的Rhodamine123液上流式细胞仪,同时设定不含Rhodamine123的细胞作为对照,检测荧光强度,激发波长为488 nm,发射波长为530 nm。以平均荧光强度值表示细胞内Rhodamine123的浓度,计算药物蓄积浓度。
1.8 P-gp蛋白表达情况检测
采用蛋白[质]印迹法(Western blot)技术检测P-gp蛋白的表达情况。同前进行细胞接种,给予不同浓度的芹菜素,收集细胞蛋白样本,SDS-PAGE,转膜,封闭,加一抗、二抗,以GAPDH为参照,采用ECL化学发光试剂盒进行化学发光法显影,以每条蛋白电泳带的灰度值表示P-gp蛋白的表达量。同时用Western blot技术测定亲本细胞MCF-7的P-gp蛋白表达作对照组。
1.9 多药耐药基因MDR1 mRNA的表达
采用RT-PCR检测多药耐药基因MDR1的mRNA的表达。同前进行细胞接种,给予不同浓度的芹菜素,收集细胞加入l mL TRIzol裂解细胞,取RNA样本,应用反转录反应系统。设置反应参数:预变性94 ℃,5 min;94 ℃变性、退火、延伸,30 s;55 ℃,60 s;72 ℃,70 s,共35个循环;末次延伸:72 ℃,7 min。进行PCR扩增,取PCR产物在琼脂糖凝胶上电泳,溴化乙锭染色。将凝胶电泳图像输入凝胶分析系统,以GAPDH作为内参照,应用Image Analysis Software进行表达强度分析,按下公式计算相对表达量。相对表达量=细胞PCR产物表达强度/GAPDH表达强度。同时用RT-PCR技术测定亲本细胞MCF-7的MDR1 mRNA的表达作对照组。
1.10 统计学处理
采用SPSS 16.0软件进行统计学处理。计量资料采用表示,组间比较采用t检验,多组间比较采用方差分析;计数资料以绝对值表示,采用χ2检验进行分析。P<0.05为差异有统计学意义。
2 结 果
2.1 芹菜素对MCF-7/ADR细胞生长的影响
结果显示,芹菜素对MCF-7/ADR细胞增殖有抑制作用,浓度为20、40和80 μmol/L的3组与对照组相比差异均有统计学意义(P<0.05);芹菜素浓度组别两两相比差异均有统计学意义(P<0.05,图1)。
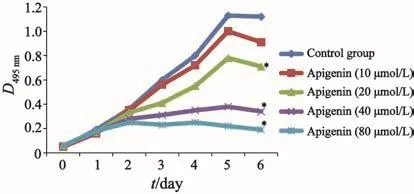
图 1 芹菜素对乳腺癌MCF-7/ADR细胞增殖的影响Fig. 1 E ff ects of apigenin on proliferation of MCF-7/ADR cells
2.2 芹菜素对MCF-7/ADR细胞周期的影响
芹菜素对MCF-7/ADR细胞周期的影响见表1。在芹菜素的作用下,MCF-7/ADR细胞周期分布出现变化,主要表现在G1期细胞减少,S期细胞增加。与对照组相比,除芹菜素浓度为10 μmol/L的组别外,其他各浓度组与对照组相比差异均有统计学意义(P<0.05)。浓度组别间相比,各芹菜素浓度组别两两相比差异均有统计学意义(P<0.05)。
2.3 芹菜素对MCF-7/ADR细胞凋亡的影响
在芹菜素的作用下,MCF-7/ADR细胞的凋亡率出现变化,主要表现为凋亡率有不同程度的增加。除芹菜素浓度为10 μmol/L的组别外,其他各浓度组与对照组相比有差异均有统计学意义(P<0.05);浓度组别间相比,各芹菜素浓度组别间两两相比差异均有统计学意义(P<0.05,表1,图2)。
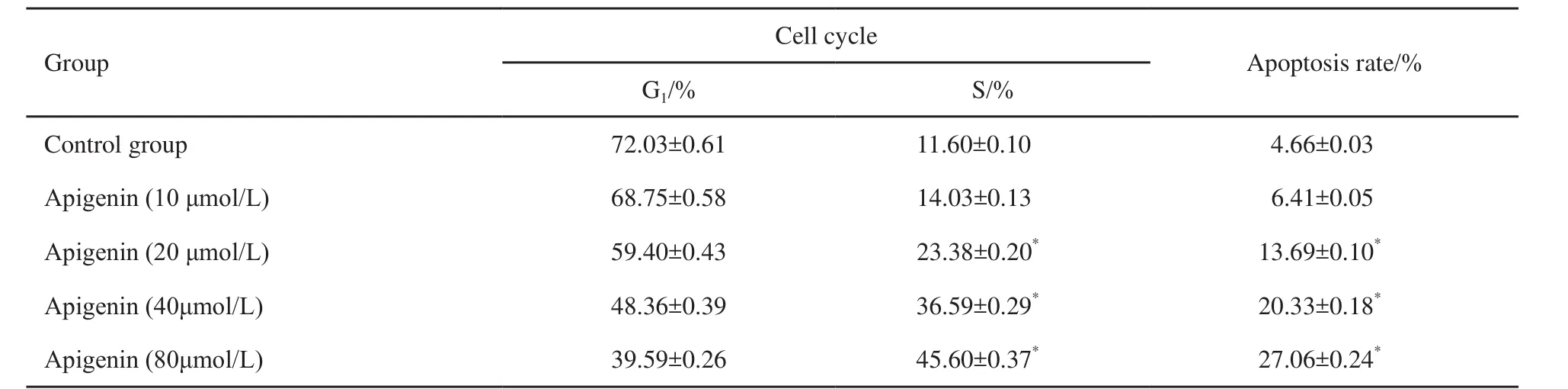
表 1 芹菜素对乳腺癌MCF-7/ADR细胞周期及凋亡的影响Tab. 1 E ff ects of apigenin on cell cycle and apoptosis of MCF-7/ADR cells

图 2 芹菜素对乳腺癌MCF-7/ADR细胞凋亡的影响Fig. 2 E ff ects of apigenin on cell apoptosis of MCF-7/ADR cells
2.4 芹菜素作用下MCF-7/ADR细胞对化疗药物敏感性的变化
研究结果显示,随着ADR浓度的升高,对MCF-7/ADR细胞抑制率随之上升。对比单用ADR组和ADR联合芹菜素组发现,联合应用组的ADR对MCF-7/ADR细胞的抑制率要高,两组相比差异有统计学意义(P<0.05)。单药ADR对MCF-7/ADR的IC50为(39.83±0.29)μg/mL,在芹菜素联合作用下,ADR对MCF-7/ADR的IC50下降为(12.37±0.58)μg/mL(P<0.01),芹菜素对ADR在乳腺癌多药耐药细胞MCF-7/ADR上的逆转倍数为3.22(表2)。
2.5 芹菜素作用下MCF-7/ADR细胞对药物转运功能的变化情况
在芹菜素的作用下,Rhodamine123在MCF-7/ADR细胞内的潴留率出现增加,外排减少。芹菜素组与对照组相比差异有统计学意义(P<0.05);芹菜素浓度组别两两相比差异有统计学意义(P<0.05,图3、4)。
2.6 芹菜素对MCF-7/ADR细胞P-gp蛋白表达的影响
研究结果显示,P-gp蛋白在亲本细胞MCF-7内为低表达,在耐药细胞MCF-7/ADR内为高表达。同时发现在芹菜素作用下,MCF-7/ADR细胞内P-gp蛋白的表达减少。灰度扫描定量分析显示,10、20、40和80 μmol/L等各组MCF-7/ADR内P-gp蛋白的表达为对照组的83.61%、72.7%、53.49%和49.26%,提示随着芹菜素浓度增加,MCF-7/ADR内P-gp蛋白的表达水平逐渐下调,部分组间比较差异有统计学意义(图5、6,P<0.05)。
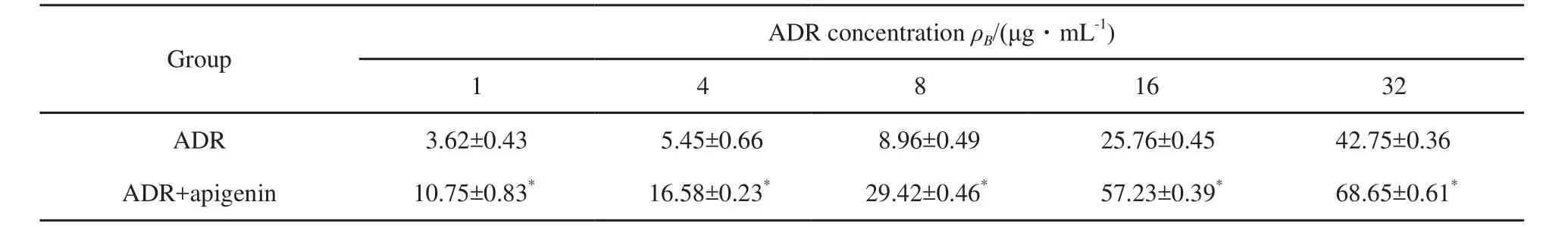
表 2 不同浓度ADR对MCF-7/ADR的抑制率Tab. 2 Inhibition rate of ADR by di ff erent concentrations for MCF-7/ADR(%)
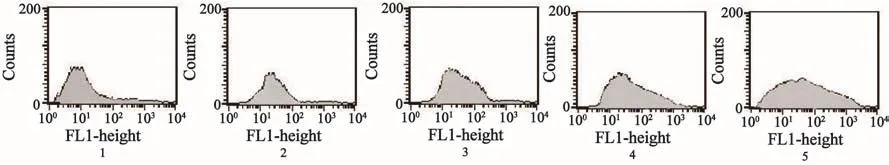
图 3 芹菜素对MCF-7/ADR细胞内Rhodamine123荧光强度的影响Fig. 3 E ff ect of apigenin on Rhodamine123 fl uorescence intensity in MCF-7/ADR cells
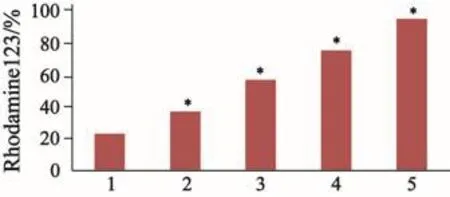
图 4 芹菜素对MCF-7/ADR细胞内Rhodamine123蓄积的影响Fig. 4 E ff ect of apigenin on Rhodamine123 accumulation in MCF-7/ADR cells
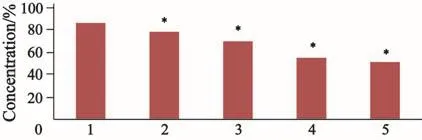
图 5 芹菜素对MCF-7/ADR细胞内P-gp蛋白表达的影响Fig. 5 E ff ect of apigenin on the expression of P-gp protein in MCF-7/ADR cells

图 6 芹菜素对MCF-7/ADR细胞内P-gp蛋白表达的影响Fig. 6 E ff ect of apigenin on the expression of P-gp protein in MCF-7/ADR cells
2.7 芹菜素对MCF-7/ADR细胞的MDR1基因转录的影响
MDR1基因转录在亲本细胞MCF-7内为低水平转录,在耐药细胞MCF-7/ADR内为高水平转录。同时发现在芹菜素作用下,MCF-7/ADR细胞内MDR1基因转录水平出现变化,表现为随着芹菜素浓度的增加,MCF-7/ADR细胞内MDR1基因的mRNA表达逐渐下调(图7)。
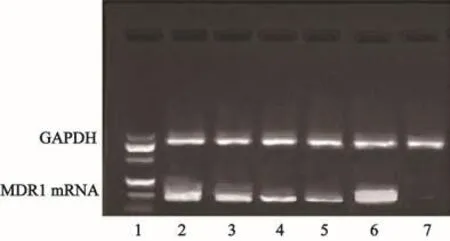
图 7 芹菜素对MCF-7/ADR细胞MDR1基因转录的影响Fig. 7 E ff ects of apigenin on the transcription ofMDR1 gene in MCF-7/ADR cells
3 讨 论
肿瘤多药耐药细胞是恶性肿瘤组织中一类特殊的肿瘤细胞,可从肿瘤干细胞分化产生,也可由一般肿瘤细胞转化产生;可原本存在,也可通过化疗药物或其他因素诱导产生。由于肿瘤多药耐药细胞具有肿瘤多药耐药性,即对所有的抗肿瘤药物(化疗药物)均产生耐药,因此肿瘤多药耐药细胞是肿瘤多药耐药的主要根源。在临床治疗中,肿瘤多药耐药细胞的存在严重影响化疗效果和患者预后,逆转肿瘤多药耐药可明显提高临床治疗恶性肿瘤的预后。
自1981年首次发现钙通道拮抗剂维拉帕米对肿瘤多药耐药有逆转作用起[1],逆转肿瘤多药耐药的逆转剂研究一直没有停止。理想的逆转剂应具有多个特性:作用靶点广泛,抗肿瘤活性同时又兼有明显的逆转肿瘤多药耐药特性,中毒剂量与逆转剂量差距明显,来源广泛。但目前发现这些逆转剂的逆转作用靶点单一、逆转效果不明显、逆转剂量与中毒剂量接近等原因无法应用于临床。芹菜素又名芹黄素,分子式C15H10O6,相对分子质量为270。芹菜素结构式中的5、7、4位置3个羟基和C2C3双键决定其独特的药理学效应和生物学特性。研究发现芹菜素在抗炎[2]、抗氧化[3]、心脑血管系统疾病[4-5]以及抗肿瘤方面[6-10]均有广泛的研究。其中抗肿瘤作用的研究是目前研究的热点,在人体大部分肿瘤,如乳腺癌[6]、胃癌[7]、肺癌[8]、前列腺癌[9]、卵巢癌[10]等的研究中均发现芹菜素具有抑制肿瘤细胞增殖作用。但是,芹菜素抗肿瘤多药耐药细胞作用的相关研究报道较少,其逆转肿瘤多药耐药领域的研究更少。该研究选用人乳腺癌ADR多药耐药MCF-7/ADR细胞,初步探讨芹菜素抗肿瘤多药耐药细胞的作用,探索芹菜素逆转肿瘤多药耐药的可能性。从芹菜素抗MCF-7/ADR细胞增殖等相关实验中发现,与对照组相比,芹菜素可明显抑制MCF-7/ADR细胞的生长增殖,可明显阻滞MCF-7/ADR细胞从S期进入G2/M期,也具有诱导MCF-7/ADR细胞凋亡的作用,统计发现,芹菜素浓度在20 μmol/L以上各组与ADR对照组相比差异有统计学意义(P<0.05)。另外实验还发现,芹菜素对MCF-7/ADR细胞的上述作用与芹菜素的浓度有一定的相关性。通过不同芹菜素浓度组间对比发现,上述作用效应随着芹菜素的浓度的增加而增强。上述结果得出,芹菜素具有抗MCF-7/ADR细胞的作用,这拓广了我们对芹菜素抗肿瘤作用领域的研究,也为后续研究芹菜素对其他肿瘤多药耐药细胞的作用奠定了基础。体外MCF-7/ADR细胞药物敏感性实验发现,在低浓度芹菜素(10 μmol/L)的作用下,MCF-7/ADR细胞对ADR的敏感性明显提高,其逆转倍数达3.22,提示芹菜素同时还具有一定的逆转肿瘤多药耐药的功能。Rhodamine123外排主要由细胞膜上P-gp蛋白介导。P-gp蛋白由Juliano和Ling等于1976年发现,其编码基因位于人染色体7q21,也称为MDR基因。由MDR1基因编码产生的P-gp是一个ATP依赖性药物外排泵,能利用ATP水解释放的能量,主动地将疏水亲脂性药物转运至细胞外,导致细胞内药物浓度低于杀伤浓度,从而产生耐药[11]。由P-gp介导的药物外排机制称为经典的MDR机制,抑制MDR1转录及编码产物P-gp的表达,可以达到逆转多药耐药作用。本研究中Rhodamine123蓄积实验发现,在芹菜素作用下Rhodamine123在MCF-7/ADR细胞内潴留率增加,外排率减少,且芹菜素的作用浓度越高,其MCF-7/ADR细胞内Rhodamine123潴留率越高。因此推测芹菜素可能是通过细胞膜上P-gp蛋白的作用,提高了ADR对MCF-7/ADR细胞敏感性而产生逆转多药耐药性作用。为进一步证实,应用Western blot实验检测芹菜素作用下的MCF-7/ADR细胞内P-gp蛋白表达情况和应用RT-PCR技术检测芹菜素作用下的MCF-7/ADR细胞内MDR1基因的转录情况。实验结果发现,原先MCF-7/ADR细胞内高表达的P-gp蛋白和高水平转录的MDR1基因,在芹菜素的作用下两者均出现了下调,且P-gp蛋白的表达和MDR1基因的转录水平下调强度与芹菜素的作用浓度有关,具体的信号调控机制仍待后续的进一步研究。综上所述,芹菜素具有明显的抗MCF-7/ ADR细胞作用,同时具有逆转MCF-7/ADR细胞肿瘤多药耐药性功能,其机制可能与降低MDR1基因转录和下调P-gp蛋白介导的药物外转运功能有关。
[1] TSURUO T, LIDA H, TSUKAGOSHI S, et al. Overcoming of vincristine resistance in P388 leukemiain vivoandin vitrothrough enhanced cytotoxicity of vincristine and vinblastine by verapamil [J]. Cancer Res, 1981, 41(5): 1967-1972.
[2] ZHANG F, LI F, CHEN G. Neuroprotective e ff ect of apigenin in rats after contusive spinal cord injury[J]. Neurol Sci, 2014, 35(4): 583-588.
[3] HUANG C S, LI C K, LIN A H, et al. Protection by chrysin, apigenin, and luteolin against oxidative stress is mediated by the Nrf2-dependent up-regulation of heme oxygenase 1 and glutamate cysteine ligase in rat primary hepatocytes[J]. Arch Toxicol, 2013, 87(1): 167-178.
[4] WANG Q, ZENG P, LIU Y, et al. Inhibition of autophagy a-meliorates atherogenic inflammation by augmenting apigenin-induced macrophage apoptosis[J]. Int Immunopharmacol, 2015, 27(1): 24-25.
[5] BUWA C C, MAHAJAN U B,PATIL C R,et al. Apigenin attenuates β-receptor-stimulated myocardial injury via safeguarding cardiac functions and escalation of antioxidant defence system[J]. Cardiovasc Toxicol, 2016, 16(3): 286-297.
[6] SEO H S,CHOI H S,KIM S R, et al. Apigenin induces apoptosis via extrinsic pathway, inducing p53 and inhibiting STAT3 and NFκB signaling in HER2-overexpressing breast cancer cells[J]. Mol Cell Biochem, 2012, 366(1-2): 319-334.
[7] CHEN J Y, CHENJ Q, LI Z Y, et al. The apoptotic effect of apigenin on human gastric carcinoma cells through mitochondrial signal pathway[J]. Tumor Biol, 2014, 35(8): 7719-7726.
[8] LU H F,CHIE Y J,YANG M S, et al. Apigenin induces caspase-dependent apoptosis in human lung cancer A549 cells through Bax-and Bcl-2-triggered mitochondrial pathway[J]. IntJ Oncol, 2010, 36(6): 1477-1484.
[9] SINGH V, SHARMA V,VERMA V, et al. Apigenin manipulates the ubiquitin-proteasome system to rescue estrogen receptor-β from degradation and induce apoptosis in prostate cancer cells[J]. Eur J Nutr, 2015, 54(8): 1255-1267.
[10] SUH Y A, JO S Y, LEE H Y, et al. Inhibition of IL-6/STAT3 axis and targeting Axl and Tyro3 receptor tyrosine kinases by apigenin circumvent taxol resistance in ovarian cancer cells[J]. Int Oncol, 2015, 46(3): 1405-1411.
[11] VELINGKAR V S, DANDEKAR V D. Modulation of P-glycoprotein mediated multidrug resistance (Mdr) in cancer using chemosensitizers[J]. IJPSR, 2010, 1(2): 104-111.
E ff ect of apigenin on the multidrug resistant breast cancer cell line MCF-7/ADR
ZHAO Yaxin1,4, LIU Jiefan2, JIANG Minghua3, QIAN Haixin1
(1. Department of General Surgery, the First Affiliated Hospital of Soochow University, Suzhou 215006, Jiangsu Province, China; 2. Department of General Medicine, the First Affiliated Hospital of Wenzhou Medical University, Wenzhou 325000, Zhejiang Province, China; 3. Department of Clinical Laboratory, the Second Affiliated Hospital of Wenzhou Medical University, Wenzhou 325000, Zhejiang Province, China; 4. Department of General Surgery, the Second Affiliated Hospital of Wenzhou Medical University, Wenzhou 325000, Zhejiang Province, China)
Background and purpose:Multidrug resistance of tumor cells is the main factor for the failure of chemotherapy. It is found that the apigenin has the anti-tumor e ff ect, but its role in multidrug resistant cells was rarely reported. This study aimed to investigate the e ff ect of apigenin on multidrug resistant breast cancer cell line MCF-7/ ADR, and to explore the role of apigenin in reversing multidrug resistance.Methods:The MCF-7/ADR cells were cultured with di ff erent concentrations of apigenin, and the same cells were cultured with ADR in the control group. Thecell proliferation was detected by MTT, the cell cycle distribution was detected by PI, and the cell apoptosis was detected by Annexin V/PI. The drug sensitivityin vitrowas detected by the method of MTT, and the drug retention rate was detected by rhodamine 123 accumulation. The expression of P-gp protein was measured by Western blot, the RT-PCR method was used to detect the transcription of multidrug resistance geneMDR1.Results:The MCF-7/ADR cell proliferation was inhibited by the apigenin, the cell cycle progression was blocked by the apigenin, and the cell apoptosis was induced by the apigenin. There were signi fi cant di ff erences between the apigenin group and the ADR group (P<0.05). The IC50of ADR on MCF-7/ADR cell was (12.37±0.18) μg/mL with the apigenin e ff ect, while the IC50of ADR on MCF-7/ADR cell was (39.83±0.29) μg/mL without the apigenin effect (P<0.05). The reversal index was 3.22. The retention rate of rhodamine 123 in MCF-7/ADR cells in the apigenin group was higher than that in the ADR group. TheMDR1 gene transcription level in MCF-7/ADR cells was higher than that in the MCF-7 cells, and the P-gp expression in MCF-7/ADR cells was higher than that in the MCF-7 cells. However, the level ofMDR1 gene transcription and P-gp expression were down-regulated by the apigenin in the MCF-7/ADR cells.Conclusion:The apigenin had anti-MCF-7/ ADR e ff ect, and played the role of reversing multidrug resistance in the MCF-7/ADR cells. The mechanism may be related to down-regulation of theMDR1gene transcription and the P-gp mediated drug efflux function.
Apigenin; Breast cancer; Multiple drug resistance; Apoptosis; Reverse
QIAN Haixin E-mail: Qianhaixin1@hotmail.com
10.19401/j.cnki.1007-3639.2017.08.008
R737.9
A
1007-3639(2017)08-0648-07
2017-02-20
2017-06-25)
温州市科技局项目(Y20100257;Y20160403);浙江省中医药管理局项目(2009YB024)。
钱海鑫 E-mail: qianhaixin1@hotmail.com
