Oncotype DX 21基因检测在ER阳性早期乳腺癌中的应用
2017-09-21颖柳光宇
章 颖柳光宇
复旦大学附属肿瘤医院乳腺外科,复旦大学上海医学院肿瘤学系,上海200032
Oncotype DX 21基因检测在ER阳性早期乳腺癌中的应用
章 颖综述柳光宇审校
复旦大学附属肿瘤医院乳腺外科,复旦大学上海医学院肿瘤学系,上海200032
在诸多评估雌激素受体(estrogen receptor,ER)阳性早期乳腺癌复发风险的多基因工具中,Oncotype DX 21基因检测因其独特的疗效预测作用而被广泛应用于淋巴结阴性患者。多项回顾性研究已证明其在淋巴结阳性人群同样具有预后预测价值,但前瞻性临床试验证据仍不充分。该检测能协同其他重要临床病理因素,影响乳腺癌患者的辅助治疗方案,且具较高的成本效益。该研究就21基因检测对早期乳腺癌患者的预后预测价值、独特优势、辅助治疗决策影响、成本效果和现存争议进行综述。
乳腺癌;Oncotype DX;21基因检测;预后;化疗
约15%的雌激素受体(estrogen receptor,ER)阳性的早期乳腺癌患者通过5年内分泌治疗可以达到治愈的效果,化疗可显著降低这些患者的复发转移风险[1]。因此,治疗ER阳性的早期乳腺癌患者的一大挑战是如何筛选出需要化疗的高危群体。传统的临床病理因素和免疫组织化学指标仅部分提示预后,对治疗决策帮助有限。为更好地判断预后,识别潜在化疗获益的人群,多种基因检测工具及临床病理评分系统应运而生。其中,21基因检测(商品名OncotypeDX,以下简称“21基因检测”,美国Genomic Health公司)的应用最为广泛。它运用反转录聚合酶链反应(reverse transcription polymerase chain reaction,RT-PCR)技术,通过检测16个乳腺癌相关基因和5个参考基因的表达水平计算复发评分(recurrence score,RS)情况(表1)。既往3项临床研究均证明,这16个乳腺癌相关基因的表达与预后高度相关;而参考基因表达变异率低,且在此3项研究中均与乳腺癌预后无关[2-4]。RS小于18、18到31之间和31以上分别表示10年远处转移低、中、高危险度[5]。

表 1 Oncotype DX 21基因检测基因列表Tab. 1 Oncotype DX (Genomic Health) gene list
1 预后和预测价值
1.1 在淋巴结阴性患者中的预后预测价值
21基因检测的预后价值首先在以ER阳性、淋巴结阴性的早期乳腺癌患者为研究对象的NSABP B14临床试验中被验证[5]。该人群中,RS低、中、高危患者所占比例分别为51%、22%和27%。相较低危患者,高危组的10年远处转移率显著升高(30.5%vs6.8%,P<0.001)。多因素分析提示,RS为ER阳性早期乳腺癌的独立预后因素(P<0.001)。随后,一项基于社区医院的大型患者对照研究表明,不论是否接受他莫昔芬治疗(P=0.003和0.030),不同RS危险度的ER阳性早期乳腺癌患者10年乳腺癌死亡率不同[6],由此奠定了21基因在实际临床工作中的应用价值。近10年,更多前瞻性、回顾-前瞻性研究再次验证了21基因检测在ER阳性、淋巴结阴性乳腺癌中的预后价值[7-11]。
此外,21基因检测还能预测乳腺癌患者辅助治疗的疗效。在B14研究中,RS低、中危患者可从5年内分泌治疗中获益(P=0.039和0.020),而这种获益在高危患者中差异无统计学意义(P=0.820)[12],提示高危患者的内分泌治疗获益可能被化疗掩盖。NSABP B-20研究发现,高危患者接受化疗可使10年远处转移发生率绝对值下降27.6%(HR=0.26,95%CI:0.13~0.53,P<0.001),而低危患者即便有获益也非常微小(HR=1.31,95%CI:0.46~3.78,P=0.610)[10]。RS和化疗的交互检验差异有统计学意义(P=0.038)。虽然中危组未能表现出明显的化疗获益(HR=0.61,95%CI:0.24~1.59,P=0.390),但统计的不确定性尚不能完全排除该人群潜在的化疗获益可能。随着RS评分的升高,化疗获益也逐渐增大,但该研究未能精确计算出化疗获益的RS cut-off值。随后,针对不同化疗方案的亚组分析结果相似,提示RS评分与化疗获益的关系具有方案非特异度。
考虑到21基因检测被多个大型临床试验广泛验证的预后和预测价值(表2),NCCN指南、美国临床肿瘤学会、St. Gallen专家共识[13-14]均推荐对ER阳性、HER-2阴性的早期乳腺癌患者行21基因检测,从而判断预后,辅助决策治疗。
1.2 在淋巴结阳性患者中的预后预测价值
21基因检测主要针对ER阳性、淋巴结阴性的乳腺癌患者,其在淋巴结阳性人群中的应用价值仍有待观察。近年来,越来越多的研究关注21基因检测在淋巴结阳性乳腺癌患者的应用。一项针对SWOG S8814临床试验的回顾性分析包含了367例ER阳性、淋巴结阳性的乳腺癌患者[15]。RS在仅接受他莫昔芬内分泌治疗人群中有预后价值(P=0.006)。调整阳性淋巴结个数后,RS低危组未显示化疗获益(P=0.97,HR=1.02,95%CI:0.54~1.93),而RS高危组接受化疗则能明显改善无病生存(P=0.03,HR=0.59,95%CI:0.35~1.01)。交互检验提示,RS对化疗的疗效预测作用在5年内较为显著(P=0.029)。虽然累积化疗获益持续到第10年,但第5到第10年的RS疗效预测作用差异无统计学意义(P=0.58)。基于该研究结果,NCCN指南推荐绝经后1~3个淋巴结阳性的ER阳性乳腺癌患者行21基因检测。
此后,多项前瞻性临床试验的回顾性分析和前瞻性临床试验结果都再次验证RS在淋巴结阳性人群的预后价值,研究人群大多数为pN1乳腺癌患者(表3)[9,11,16-18]。
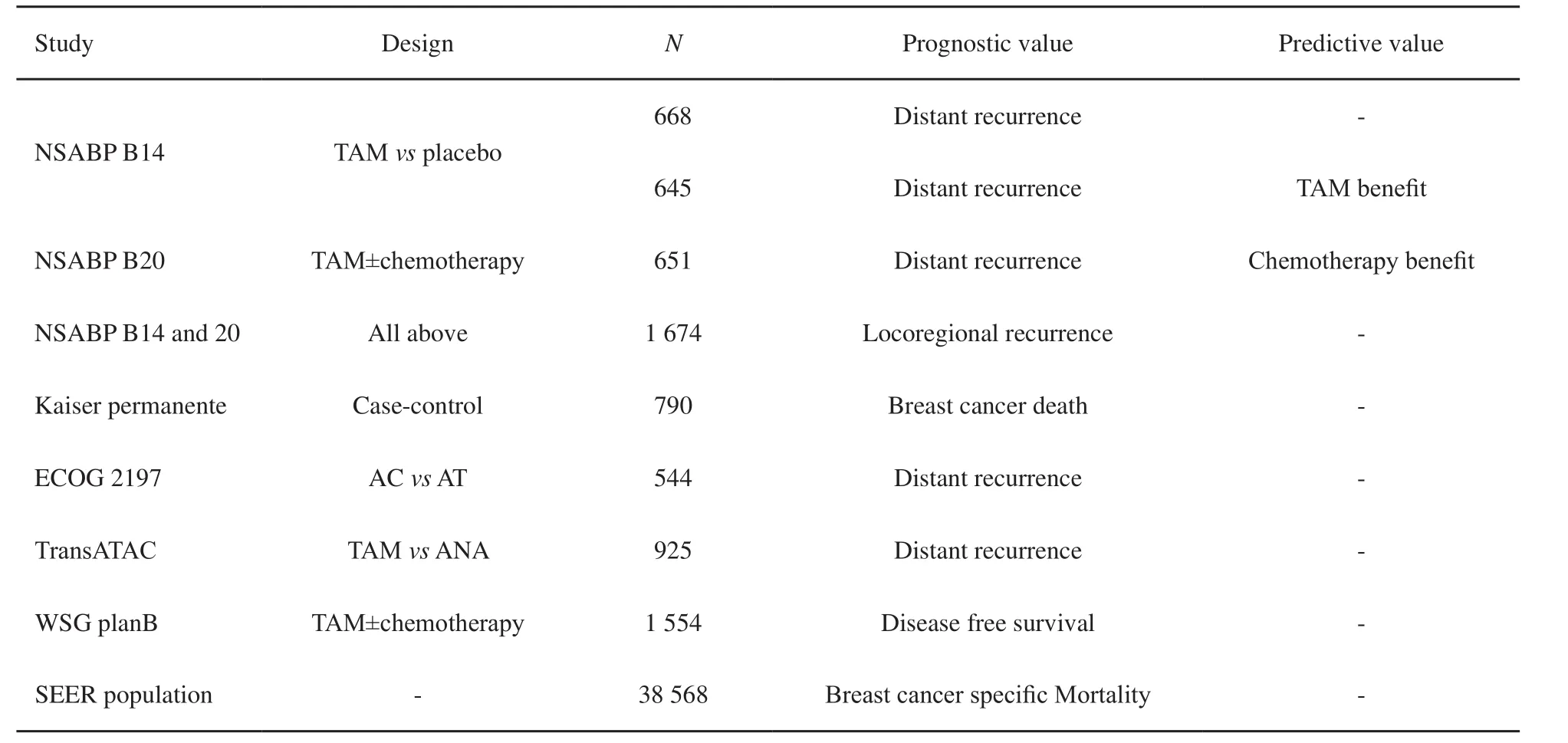
表 2 21基因检测应用于淋巴结阴性人群的前瞻性临床试验汇总Tab. 2 A summary of prospective clinical studies of 21-gene assay in node-negative population.
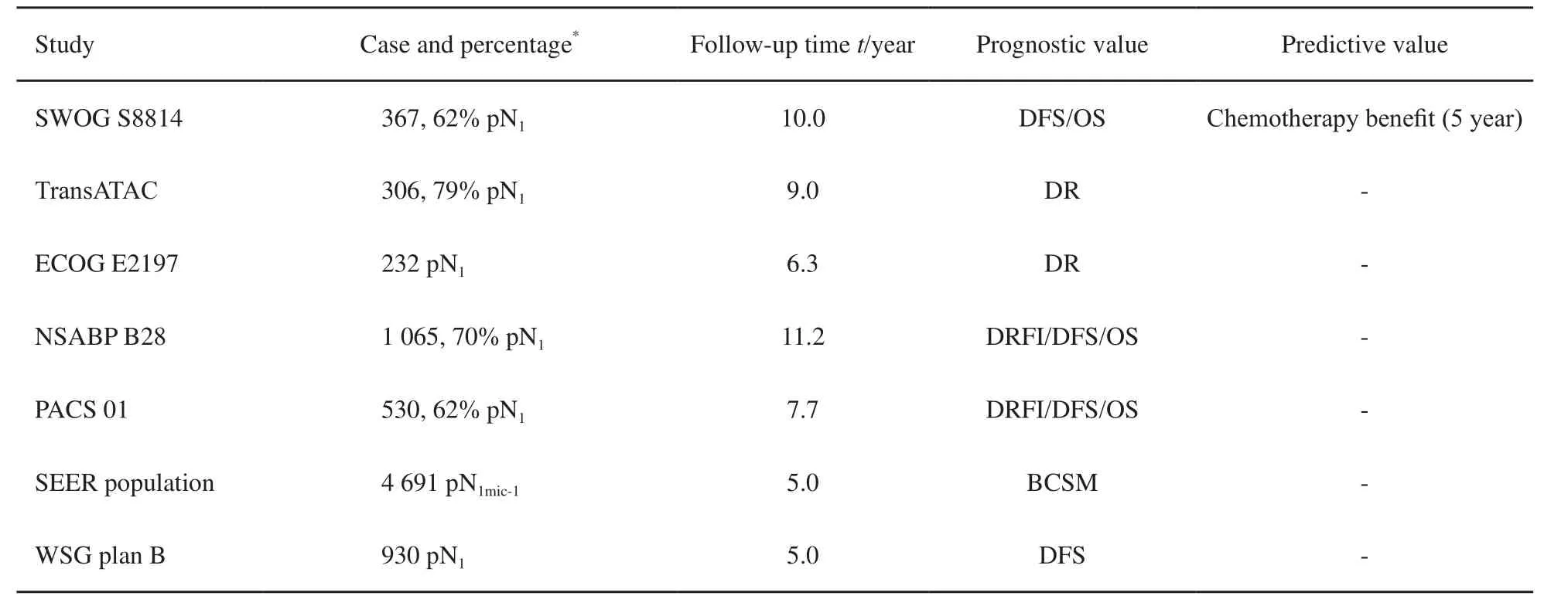
表 3 21基因检测应用于淋巴结阳性人群的前瞻性临床试验汇总Tab. 3 A summary of prospective clinical studies of 21-gene assay in node-positive population.
2 优 势
2.1 相对于传统临床病理因素的优势
在21基因检测工具上市前,乳腺癌的辅助治疗决策主要依赖于传统临床病理因素,如年龄、肿块大小、组织学分级、淋巴结状态、脉管癌栓侵犯等。基于SEER数据库信息和EBCTCG分析,结合乳腺癌危险因素判断预后、预测疗效的工具如Adjuvant! Online(AO)[19]也曾广泛应用于临床。在B14和B20研究中,RS(P<0.001)和AO(P=0.002)均为乳腺癌远处转移独立预后因素;但仅RS可预测化疗疗效——分别以无远处转移间期、总生存率、无病生存率为研究终点时,交互检验结果显示差异有统计学意义(P=0.031、0.011和0.082)。针对B20研究的更大样本队列再分析发现,当以总生存率为终点时,AO具有预测价值(P=0.009);而以无远处转移间期(P=0.219)和无病生存率(P=0.099)为终点时,AO依然没有化疗疗效预测作用[20]。
相较单独应用21基因检测或RS联合AO,RS联合临床病理因素(如组织学分级和肿块大小)具有更高的预后价值[20]。联合RS、年龄、组织学分级、肿块大小的RSPC(RS-pathology-clinical)工具不仅能提高RS的预后价值(P<0.001),还具有更明显的危险区分度,但不能预测化疗疗效(P=0.100)[21]。
2.2 相对于其他多基因检测工具的优势
除21基因外,其他常用的多基因检测工具有MammaPrint、PAM50、EndoPredict、BCI(breast cancer index)等[22]。尽管适用人群和危险度划分略有不同,每种多基因检测工具的预后价值均在临床队列中获得验证[23-25];但21基因检测的证据最充分,且是唯一被证实能预测化疗疗效的工具[22]。因此,美国临床肿瘤学会强烈推荐其在ER阳性、HER-2阴性、淋巴结阴性乳腺癌患者中的应用[13]。
3 对辅助治疗决策的影响及成本效果
近10年来,21基因检测显著减少了ER阳性早期乳腺癌患者的化疗率(20.0%~74.0%),且具较高的成本效益[26-27]。RS结果改变了31.4%的患者的辅助治疗决策[28]。其中,83.3%免于化疗,仅16.4%的患者需加用化疗[29]。Meta分析指出,21基因检测不仅成本效益比高,还能节约治疗开支。纳入分析的18项研究中,7项含有淋巴结阳性人群,提示该检测在淋巴结阳性人群依然具有成本效益[27]。
值得注意的是,所有成本效果分析研究都有一个共同的不足之处,即默认RS评分带来的化疗决策改变是正确的。大多数成本效益来自于辅助化疗应用的减少,但降低化疗率可能产生的乳腺癌复发风险增高带来的潜在支出和后果却未被模型充分估计。前瞻性临床试验TAILORx将弥补这一缺陷[26]。
4 争议与展望
TAILORx临床试验旨在研究中危组患者是否应当接受辅助化疗[30]。B14研究结果提示,在接受5年他莫昔芬内分泌治疗的人群中,RS11和25对应的10年远处转移风险分别为10%和20%[5]。因此,TAILORx研究以RS评分11和25重新定义乳腺癌复发危险度,低、中、高危患者分别占入组人群的15.9%、67.3%和16.9%。目前,仅接受内分泌治疗的低危组患者5年无远处转移率为99.3%,该结果再次验证了RS低危患者可安全免于化疗的假设[30]。中、高危组结果预计在今年公布,其结果将用于指导RS评分在11和25之间的ER阳性、淋巴结阴性乳腺癌患者的辅助治疗。
基因多项临床研究已验证pN1患者RS的预后价值,但其对化疗疗效的预测价值仍缺乏前瞻性数据。正在进行的RxPONDER试验入组pN1期乳腺癌患者,旨在探究中、低危(RS小于等于25)患者辅助化疗的获益情况。该研究结果将为我们提供更多21基因检测应用于淋巴结阳性人群的证据。
5 总结
因其独特的化疗预测价值,Oncotype DX 21基因检测被广泛应用于ER阳性、淋巴结阴性乳腺癌患者的预后判断和辅助治疗决策。多项前瞻性或回顾-前瞻性研究均证实RS在pN1患者中的预后价值,但其化疗预测价值的验证仍不充分。RS是ER阳性早期乳腺癌的独立预后因素,联合肿块大小、组织学分级、年龄等临床病理因素时可增加预后价值。21基因检测显著减少ER阳性早期乳腺癌患者的化疗率,且具高成本效益。未来,TAILORx、RxPONDER等临床试验将进一步明确ER阳性乳腺癌的化疗获益人群。
[参 考 文 献]
[1] RUTTER C E, YAO X, MANCINI B R, et al. In fl uence of a 21-gene recurrence score assay on chemotherapy delivery in breast cancer[J]. Clin Breast Cancer, 2016, 16(1): 59-62.
[2] COBLEIGH M A, TABESH B, BITTERMAN P, et al. Tumor gene expression and prognosis in breast cancer patients with 10 or more positive lymph nodes[J]. Clin Cancer Res, 2005, 11(24 Pt 1): 8623-8631.
[3] ESTEBAN J B J C M. Tumor gene expression and prognosis in breast cancer: multi-gene RT-PCR assay of paraffin-embedded tissue[Abstract][Z]. 2003850.
[4] PAIK S, SHAK S, TANG G, et al. Multi-gene RT-PCR assay for predicting recurrence in node negative breast cancer patients: NSABP studies B-20 and B-14[Abstract][Z]. 2003.
[5] PAIK S, SHAK S, TANG G, et al. A multigene assay to predict recurrence of tamoxifen-treated, node-negative breast cancer[J]. N Engl J Med, 2004, 351(27): 2817-2826.
[6] HABEL L A, SHAK S, JACOBS M K, et al. A population-based study of tumor gene expression and risk of breast cancer death among lymph node-negative patients[J]. Breast Cancer Res, 2006, 8(3): R25.
[7] MAMOUNAS E P, TANG G, FISHER B, et al. Association between the 21-gene recurrence score assay and risk of locoregional recurrence in node-negative, estrogen receptor-positive breast cancer: results from NSABP B-14 and NSABP B-20[J]. J Clin Oncol, 2010, 28(10): 1677-1683.
[8] DOWSETT M, CUZICK J, WALE C, et al. Prediction of risk of distant recurrence using the 21-gene recurrence score in node-negative and node-positive postmenopausal patients with breast cancer treated with anastrozole or tamoxifen: a TransATAC study[J]. J Clin Oncol, 2010, 28(11): 1829-1834.
[9] GOLDSTEIN L J, GRAY R, BADVE S, et al. Prognostic utility of the 21-gene assay in hormone receptor-positive operable breast cancer compared with classical clinicopathologic features[J]. J Clin Oncol, 2008, 26(25): 4063-4071.
[10] PAIK S, TANG G, SHAK S, et al. Gene expression and benefit of chemotherapy in women with node-negative, estrogen receptor-positive breast cancer[J]. J Clin Oncol, 2006, 24(23): 3726-3734.
[11] GLUZ O, NITZ U, CHRISTGEN M, et al. Prospective WSG phase Ⅲ plan b trial: clinical outcome at 5 year follow up and impact of 21 gene recurrence score result, central/ local-pathological review of grade, ER, PR and Ki-67 in HR+/HER-2-high risk node-negative and -positive breast cancer[J]. Euro J Cancer, 2016, 572: 6.
[12] PAIK S, SHAK S, TANG G, et al. Expression of the 21 genes in the recurrence score assay and tamoxifen clinical bene fi t in the NSABP study B-14 of node negative, estrogen receptor positive breast cancer[J]. J Clin Oncol, 2005, 23(161): 6.
[13] HARRIS L N, ISMAILA N, MCSHANE L M, et al. Use of biomarkers to guide decisions on adjuvant systemic therapy for women with early-stage invasive breast cancer: American Society of Clinical Oncology Clinical Practice Guideline[J]. J Clin Oncol, 2016, 34(10): 1134-1150.
[14] COATES A S, WINER E P, GOLDHIRSCH A, et al. Tailoring therapies--improving the management of early breast cancer: St. Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2015[J]. Ann Oncol, 2015, 26(8): 1533-1546.
[15] ALBAIN K S, BARLOW W E, SHAK S, et al. Prognostic and predictive value of the 21-gene recurrence score assay in postmenopausal women with node-positive, oestrogen-receptor-positive breast cancer on chemotherapy: a retrospective analysis of a randomised trial[J]. Lancet Oncol, 2010, 11(1): 55-65.
[16] PENAULT-LLORCA F M, FILLERON T, ASSELAIN B, et al. Prediction of recurrence with the Oncotype DX recurrence score in node-positive, HR-positive, breast cancer patients treated with adjuvant chemotherapy: Results from PACS01 trial[J]. J Clin Oncol, 2014, 32(suppl 15): 11052.
[17] MAMOUNAS E P, TANG G, PAIK S, et al. Prognostic impact of the 21-gene recurrence score (RS) on disease-free and overall survival of node-positive, ER-positive breast cancer patients (pts) treated with adjuvant chemotherapy: results from NSABP B-28[J]. J Clin Oncol, 2012, 30(suppl 27): 1.
[18] DOWSETT M, CUZICK J, WALE C, et al. Prediction of risk of distant recurrence using the 21-gene recurrence score in node-negative and node-positive postmenopausal patients with breast cancer treated with anastrozole or tamoxifen: a TransATAC study[J]. J Clin Oncol, 2010, 28(11): 1829-1834.
[19] OLIVOTTO I A, BAJDIK C D, RAVDIN P M, et al. Population-based validation of the prognostic model ADJUVANT! for early breast cancer[J]. J Clin Oncol, 2005, 23(12): 2716-2725.
[20] TANG G, SHAK S, PAIK S, et al. Comparison of the prognostic and predictive utilities of the 21-gene recurrence score assay and Adjuvant! for women with node-negative, ER-positive breast cancer: results from NSABP B-14 and NSABP B-20[J]. Breast Cancer Res Treat, 2011, 127(1):133-142.
[21] TANG G, CUZICK J, COSTANTINO J P, et al. Risk of recurrence and chemotherapy benefit for patients with node-negative, estrogen receptor-positive breast cancer: recurrence score alone and integrated with pathologic and clinical factors[J]. J Clin Oncol, 2011, 29(33): 4365-4372.
[22] COBAIN E F, HAYES D F. Indications for prognostic geneexpression pro fi ling in early breast cancer[J]. Curr Treat Options Oncol, 2015, 16(5): 23.
[23] CARDOSO F, VAN’T V L, BOGAERTS J, et al. 70-gene signature as an aid to treatment decisions in early-stage breast cancer[J]. N Engl J Med, 2016, 375(8): 717-729.
[24] NIELSEN T, WALLDEN B, SCHAPER C, et al. Analytical validation of the PAM50-based Prosigna Breast Cancer Prognostic Gene Signature Assay and nCounter Analysis System using formalin-fixed paraffin-embedded breast tumor specimens[J]. BMC Cancer, 2014, 14: 177.
[25] DENKERT C, KRONENWETT R, SCHLAKE W, et al. Decentral gene expression analysis for ER+/HER-2- breast cancer: results of a proficiency testing program for the EndoPredict assay[J]. Virchows Arch, 2012, 460(3): 251-259.
[26] ETHIER J L, AMIR E. The role of the 21-gene recurrence score in breast cancer treatment[J]. Mol Diagn Ther, 2016, 20(4): 307-313.
[27] ROUZIER R, PRONZATO P, CHEREAU E, et al. Multigene assays and molecular markers in breast cancer: systematic review of health economic analyses[J]. Breast Cancer Res Treat, 2013, 139(3): 621-637.
[28] ISSA A M, CHAUDHARI V S, MARCHANT G E. The value of multigene predictors of clinical outcome in breast cancer: an analysis of the evidence[J]. Expert Rev Mol Diagn, 2015, 15(2): 277-286.
[29] AUGUSTOVSKI F, SOTO N, CAPORALE J, et al. Decision-making impact on adjuvant chemotherapy allocation in early node-negative breast cancer with a 21-gene assay: systematic review and meta-analysis[J]. Breast Cancer Res Treat, 2015, 152(3): 611-625.
[30] SPARANO J A, GRAY R J, MAKOWER D F, et al. Prospective validation of a 21-gene expression assay in breast cancer[J]. N Engl J Med, 2015, 373(21): 2005-2014.(收稿日期:2017-02-27 修回日期:2017-04-18)
The application of Oncotype DX 21-gene assay in early-stage ER positive breast cancer
ZHANG Ying, LIU Guangyu
(Department of Breast Surgery, Fudan University Shanghai Cancer Center, Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China)
Several multi-gene assays have been developed to predict the risk of recurrence in patients with early-stage, estrogen receptor (ER) positive breast cancer. Among them, Oncotype DX 21-gene assay is widely applied among node-negative patients because of its unique prediction of therapeutic bene fi t. Although many retrospective studies have proved its prognostic and predictive value in node-positive population, evidence from large prospective clinical trials remains insufficient. When combined with clinicopathological variables, the assay has been shown to impact adjuvant treatment decision making in a cost-e ff ective manner. This article reviewed the available clinical evidence for the prognostic and predictive value, unique advantages, the e ff ect on treatment decision making, cost-e ff ectiveness and contradictories of 21-gene assay in early-stage luminal breast cancer patients.
Breast cancer; Oncotype DX; 21-gene assay; Prognosis; Chemotherapy
LIU Guangyu E-mail: liugy123@yahoo.com
10.19401/j.cnki.1007-3639.2017.08.012
R737.9
A
1007-3639(2017)08-0675-06
柳光宇 E-mail: liugy123@yahoo.com
