滇皖产区铁皮石斛居群SSR分子身份证的构建△
2017-09-21董晓曼袁媛查良平彭代银俞年军王继永赵玉洋蒋超黄璐琦
董晓曼,袁媛,查良平,彭代银,俞年军,王继永,赵玉洋,蒋超,黄璐琦
(1.道地药材国家重点实验室培育基地,中国中医科学院 中药资源中心,北京 100700;2.安徽中医药大学 药学院,安徽 合肥 230012;3.安徽省中医药科学院 中药资源保护与开发研究所,安徽 合肥 230012;4.中国中药公司,北京 100195)
·基础研究·
滇皖产区铁皮石斛居群SSR分子身份证的构建△
董晓曼1,2,袁媛1*,查良平2,3,彭代银2,3,俞年军2,王继永4,赵玉洋1,蒋超1*,黄璐琦1
(1.道地药材国家重点实验室培育基地,中国中医科学院 中药资源中心,北京 100700;2.安徽中医药大学 药学院,安徽 合肥 230012;3.安徽省中医药科学院 中药资源保护与开发研究所,安徽 合肥 230012;4.中国中药公司,北京 100195)
目的:建立滇皖产区铁皮石斛SSR指纹图谱,并构建不同居群的SSR分子身份证。方法:使用生物信息学方法分析铁皮石斛(Dendrobiumofficinale)全基因组SSR(Simple sequence repeat)序列,获得SSR位点,使用Primer Premier 5.0软件设计引物并进行PCR扩增,选择高多态性引物进行遗传多样性分析并建立SSR指纹图谱代码,使用二维码生成器表述铁皮石斛居群的分子身份证。结果:共获得91 653个SSR位点,平均分布距离为15.44 kb。据此开发了75对SSR引物,筛选出32对多态性丰富、带型清晰的引物,对11个滇、皖产区的铁皮石斛居群进行遗传多样性分析,共得到117个多态信息位点,平均每个SSR引物多态信息含量(PIC)为0.62,变化范围为0.22~0.80;铁皮石斛不同居群进行亲缘关系聚类表明11个铁皮石斛居群可分为三支,与种质来源分布相一致。筛选出4对多态性高、带型清晰易于统计的引物组合,建立不同居群铁皮石斛的SSR指纹图谱库和不同居群的分子身份证。结论:SSR分子身份证可为今后铁皮石斛的品种鉴别提供准确、可靠的方法和溯源信息平台。
铁皮石斛;基因组SSR;分子身份证
铁皮石斛DendrobiumofficinaleKimura et Migo是我国传统名贵中药,自2010年起已作为单一品种收录于《中华人民共和国药典》[1]。近年来,由于铁皮石斛野生资源衰竭和种植、加工技术的突破,人工栽培铁皮石斛已占据主导地位。铁皮石斛自然分布范围广[2],生境差异大,种内变异多,其栽培品种种源复杂,变异类型广泛。不同栽培品种的铁皮石斛中氨基酸、多糖及微量元素等含量具有明显差异[3-4],市场上铁皮石斛产量和质量良莠不齐,严重制约了安全、优质和高产铁皮石斛药材的可持续生产。由于各企业均采用组织培养和快繁技术,频繁继代易导致体细胞无性系变异,即使同一品种也存在株间变异,品种内形态差异较大[5],且传统的形态学鉴定也很难对种子、幼苗进行品种鉴定。急需建立铁皮石斛不同栽培变异类型的特异性分子标记,为其栽培引种、生产、流通过程以及产品的追溯和司法仲裁提供技术支撑。
分子身份证(molecular ID,mID)是一种基于DNA电泳图谱的分子代码,通过将品种分子特征数字化后以字符串的形式输出,使结果更加简单明了,包含信息更加全面[6]。分子身份证既能够鉴别生物个体差异,又能检测生物种质特征,已被广泛应用于农作物和果蔬的种质分型、纯度鉴定与种源追溯等[7-9]。由于简单重复序列(Simple Sequence Repeat,SSR)多态性丰富、具共显性、重现性好、在染色体上分布均匀[10],已广泛用于SSR指纹图谱和种质资源分子身份证的构建。
本研究拟利用SSR技术,对云南和安徽地区的11个栽培铁皮石斛居群进行多态性分析,并筛选出重复性高、条带清晰易统计的引物构建铁皮石斛的SSR指纹图谱和分子身份证,为铁皮石斛分子身份证数据库的建立奠定基础。
1 材料与方法
1.1材料
研究材料取自云南省红河市绿春县、安徽省宣城市泾县和六安市霍山县的栽培基地,共188个样品,经安徽中医药大学俞年军教授鉴定为铁皮石斛DendrobiumofficinaleKimura et Migo,凭证标本保存于安徽中医药大学药园,详细信息见表1。
1.2DNA提取
样品采集后硅胶干燥,取20~100mg,使用两步CTAB法[11]提取样品总DNA,并进行DNA浓度和纯度测定,调整终浓度约为50 ng·μL-1用于进一步研究。1.3基因组SSR筛选铁皮石斛全基因组数据来自Liang等的文献[12]。使用SSR搜索程序(http://www.gramene.org/db/markers/ssrtool)搜索已获得的铁皮石斛基因组序列中潜在的2~6bp的SSR,参数设置为:二核苷酸重复≥14bp,三核苷酸重复≥18bp,四、五核苷酸重复≥20bp,六核苷酸重复≥18bp。
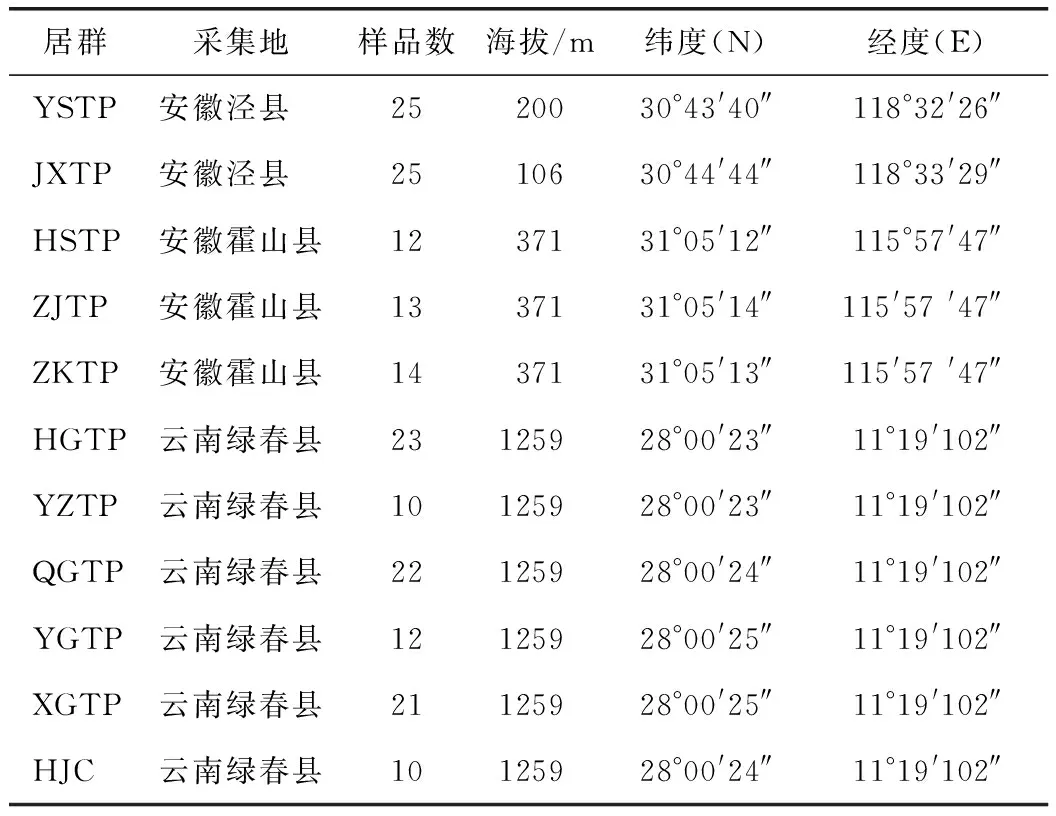
表1 铁皮石斛样品信息表
1.4SSR引物设计
依据SSR侧翼区域序列,应用引物设计软件Primer Premier5.0设计引物。引物设计的原则为:引物长18~25bp, PCR产物长100~250bp,GC含量为40%~60%。引物经BLAST比对,根据结果重点对3′端碱基及上下游引物间隔进行调整,最大限度保证引物3′端碱基与扩增位点相匹配,以及有效扩增长度[13],设计75对引物,由上海生工生物工程技术服务有限公司合成。
1.5PCR扩增及银染检测
PCR反应在ABI公司的9700型PCR扩增仪上进行。PCR反应体系(25μL)为:2.5μL10×PCR buffer,2μL2.5mmol·L-1dNTPs,10μmol·L-1引物各1μL,2.5U rTaq酶[宝生物工程(大连)有限公司],1μL DNA模板。反应程序为:95℃预变性5min;95℃变性40s,52~60℃复性50s,72℃延伸50s,40个循环;72℃延伸10min。产物用10%聚丙烯酰胺凝胶电泳,银染检测[14]。
1.6数据处理
扩增条带在相同迁移率位置上,有带记为“1”,无带记为“0”,用Excel软件统计整理。利用Popgene32软件计算SSR位点的等位基因数(Numberofalleles,Na)、有效等位基因数(Effectivenumberofalleles,Ne)、Nei’s基因多样性指数(Nei’sgenediversity) 、Shannon多样性指数(Shannon’sinformationindex) 和Nei’s遗传相似性系数和遗传距离;用PICCalc软件分析位点多态信息含量(Polymorphisminformationcontent,PIC),PIC计算公式为PIC=1-∑fi2,其中fi为i位点基因频率;并基于非加权组平均法(UnweightedPairGroupMethodwithArithmeticMean,UPGMA)算法对11个居群所有个体进行聚类分析。
1.7指纹图谱构建
参考指纹图谱代码构建方法[15],将挑选的多态性引物按照多态性降序排列,编号为A、B、C……每对SSR引物扩增的多态性条带依据分子量由大到小排列设编号为a、b、c……如样品经引物GD92263扩增后有a、c处条带,无b处条带,则记录为101。记录每份材料经不同SSR引物扩增出现的条带,则每个居群的样品经不同引物扩增后将会形成由字母和阿拉伯数字组成的一系列带型编号,便形成了该居群的SSR指纹图谱代码。
1.8铁皮石斛居群分子身份证建立
结合铁皮石斛不同居群的SSR指纹图谱和样品采集地信息等,构建11个铁皮石斛居群的分子身份证,并利用在线QR二维码生成器(http://tool.oschina.net/qr)以条码表述构建的铁皮石斛居群的身份证。
2 结果与分析
2.1铁皮石斛SSR发掘和特征分析
铁皮石斛基因组1.35Gb,共784830条无冗余的基因组序列,按照设置参数共检索到91653个SSR位点。平均距离为15.44kb,即基因组序列上每15.44kb出现一个SSR位点。在所搜索到的SSR中,二核苷酸重复类型占比例最高(63.97%),三核苷酸重复类型所占比例为26.27%,四、五、六核苷酸重复单元类型所占比例均较低,分别为3.50%、4.72% 和1.54%(见表2)。其中二核苷酸出现频率为六核苷酸出现频率的41.5倍,与忍冬[16]、鸢尾[17]、人参[18]等的研究结果相符,但在部分松属物种[19]中获得的SSR序列以三核苷酸重复为主,这种占优势的重复类型可能与测序方式、筛选SSR参数[16]及待测物种有关。
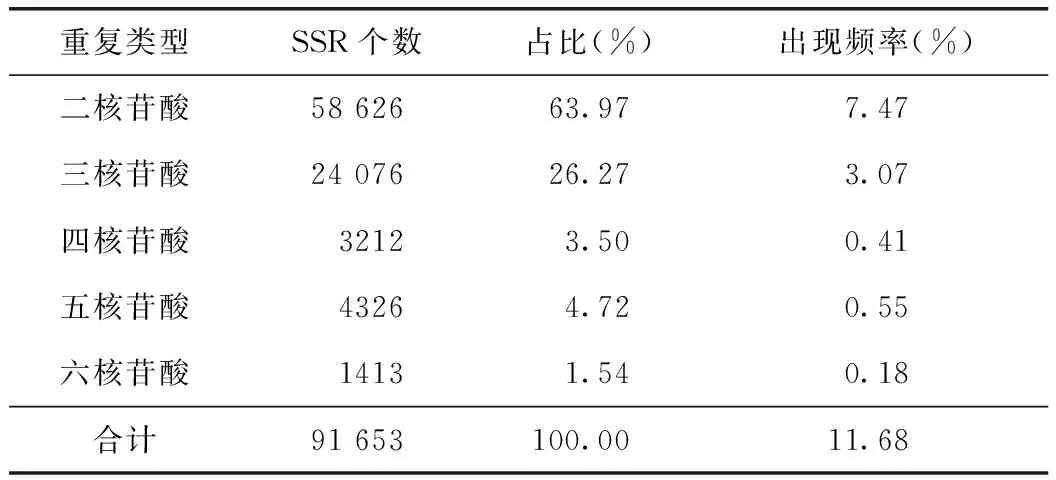
表2 铁皮石斛SSR分布及类型
在各重复类型中,不同重复基元出现的频率也有差异。二核苷酸重复类型中各基元所占比例依次为:AT/TA(24.90%)>AG/CT(18.86%)>TC/GA(15.89%)>AC/GT(3.64%)>TG/CA(1.97%)>CG/GC(0.02%) (见图1),表现出AT优势,与丹参[20]、巧家五针松[21]、思茅松[22]的SSR分析结果相一致。铁皮石斛基因组存在少量CG/GC重复,有研究认为[23]GC重复类型较少是因为基因组DNA中的CpG甲基化,很容易通过脱氨基作用转变为胸腺嘧啶。也有研究[24]指出物种中的GC重复都是较少的,并进一步认为可能与GC重复所形成的DNA结构有关。三核苷酸重复类型共检索出59种,其中AAT/ATT较多(5.75%),其次是ACA/TGT(4.98%),TAA/TTA(4.25%),ATA/TAT(3.36%),TTG/CAA(1.65%)和AAG/CTT(1.13%),未见ACG重复基元,其余47种重复类型均较少。

图1 二核苷酸重复SSR和三核苷酸重复SSR基序类型分析
2.2铁皮石斛SSR引物设计及筛选
利用75对引物初步扩增了每个居群中随机选取的铁皮石斛共11份样品,
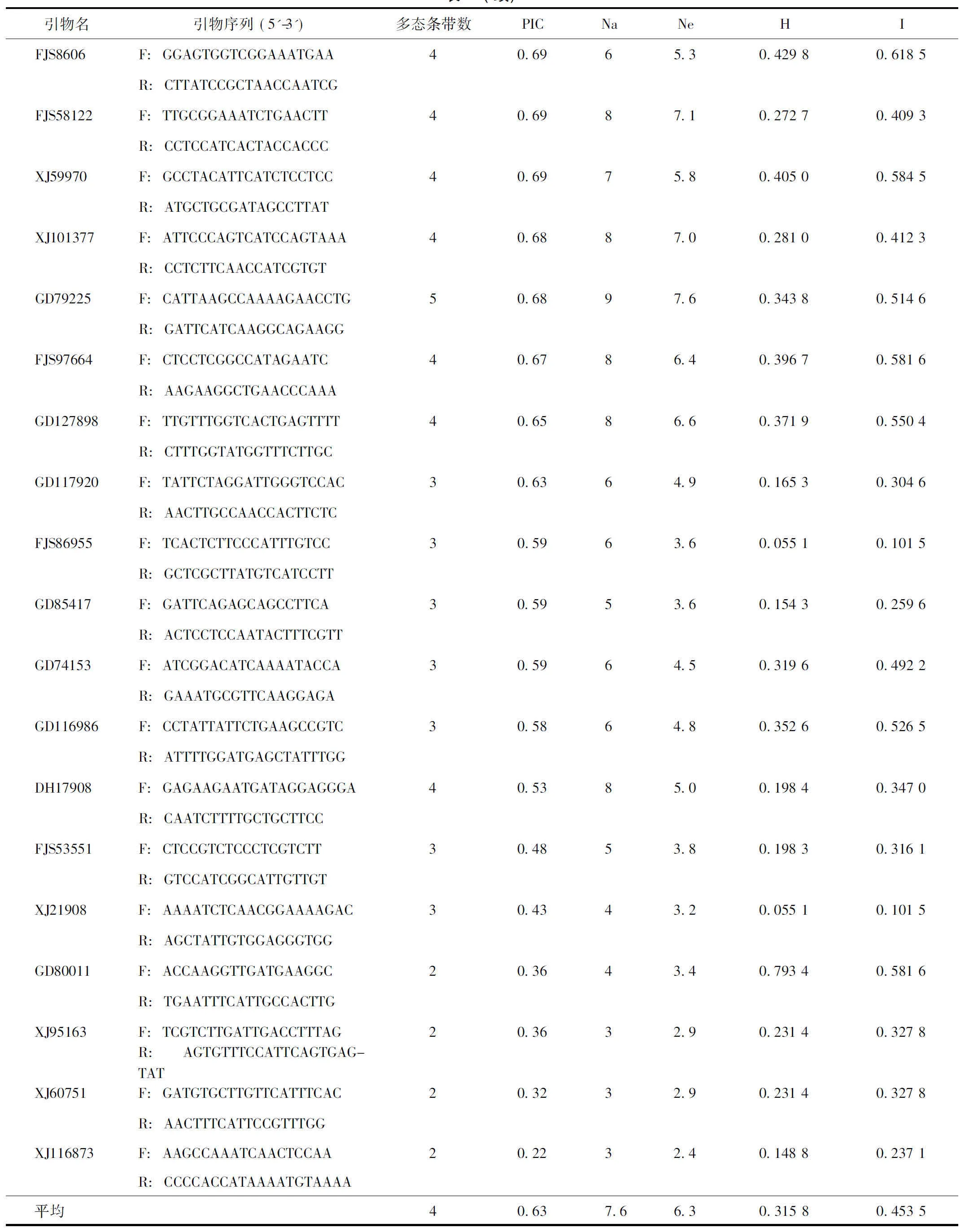
选出扩增良好、带型清晰、且具有多态性的引物32对(见表3),利用多态性引物对11个居群样品基因组DNA进行SSR-PCR扩增,共检测到132个条带,其中多态性条带为117条,每对引物可以检测到2~7条数目不等的多态性条带,平均可检测到4条。每对引物扩增出3~14个等位基因,平均每对引物扩增出7.6个等位基因。每对引物扩增的有效等位基因数为2.4~12,平均每对引物为6.3个。Nei’s基因多样性系数变化范围为0.0551~0.4298,平均为0.3158,有18对引物均高于均值水平;Shannon多样性指数变化范围为0.1015~0.6193,平均为0.4535,有19对引物高于均值水平。
32对SSR引物的多态信息含量平均值为0.62,按照Bostein[25]的理论,其中有26对引物具高度多态性(PIC>0.5),5对具中度多态性(0.25 表3 SSR引物序列信息及多态性情况 表3(续) 注:F.正向引物;R.反向引物;PIC.位点多态信息含量;Na.等位基因数;Ne.有效等位基因数;H.Nei’s 遗传多样性;I.Shannon’s 指数。 2.3基于SSR的遗传多样性分析 根据32对SSR引物扩增形成的带型多样性,对11个供试的铁皮石斛居群进行了遗传相似系数计算和聚类分析(见图2)。结果表明,11个铁皮石斛居群的遗传相似系数范围在0.1121~0.8939,平均遗传相似系数为0.5444。在此基础上,对铁皮石斛不同居群进行亲缘关系聚类,11个铁皮石斛居群可分为三支,第I支包含了于安徽省泾县采集的YSTP和JXTP2个居群,其中YSTP为泾县当地野生铁皮石斛,JXTP为YSTP引种栽培的居群,二者亲缘关系较近;第II支包含了由云南采集的HGTP、HJC、YGTP和YZTP4个居群,均为云南本地品种;而第III支除了由安徽六安采集的ZJTP、ZKTP和HSTP,还包含由云南采集的QGTP和XGTP共5个居群,其中ZJTP、ZKTP和HSTP均为安徽品种,而QGTP和XGTP种质均来源于浙江,地理位置与安徽接近。结果表明,基于SSR多态性的聚类与居群地理种源显著相关,铁皮石斛种内地理位置相近的居群遗传基础相对接近,与丁鸽[26]、苑鹤[27]等对铁皮石斛野生和栽培居群的遗传多样性研究相一致。 图2 基于32对引物的滇皖铁皮石斛UPGMA聚类树 2.4基于SSR构建铁皮石斛主产区居群的分子身份证 从32对多态性引物中挑选重复性好、扩增条带清晰易辨的4对引物,按PIC值降序排列为XJ89800(A),GD92263(B),FJS58122(C)和GD80011(D)进行组合,对铁皮石斛样品进行扩增后,每居群特征电泳图谱见图3;依据设计的指纹图谱构建方法,为每一居群建立了唯一能够区别于其他供试材料的指纹图谱代码,见表4。 利用在线二维码生成器对所有铁皮石斛居群进行QR编码,为每个居群构建了分子身份证(见图4),其中包含了居群名称、物种、SSR指纹图谱和采集地。如图4中YSTP包含“居群名:YSTP;物种:铁皮石斛Dendrobiumofficinale;SSR指纹图谱:A01110B1000C1111D10;栽培地地理信息:安徽省泾县,北纬:30°43′40″,东经:118°32′26″,海拔:200m;种源地:安徽省泾县”信息。 注:泳道1~11分别为YSTP、JXTP、HGTP、YZTP、QGTP、YGTP、HJC、HSTP、ZJTP、ZKTP和XGTP居群。图3 滇皖产区铁皮石斛典型SSR指纹图谱 序号居群SSR指纹1YSTPA01110B1000C1111D102JXTPA11100B1000C0001D003HGTPA11110B1111C1111D114YZTPA01111B1100C1101D105QGTPA01111B1111C1111D106YGTPA01111B1111C1111D117HJCA01111B0111C1111D018HSTPA00111B1001C1101D119ZJTPA10111B1111C1101D1110ZKTPA10101B1111C1111D1111XGTPA01111B0111C0001D10 注:A~D.引物XJ89800、GD92263、FJS58122及GD80011。 图4 滇皖产区11个铁皮石斛居群分子身份证二维条码 遗传多样性是种质资源保护和开发的重要依据,筛选等位变异大的SSR位点对揭示遗传多样性方面有重要的研究价值。与EST-SSR相比,基因组SSR变异更丰富,遗传多样性更高[28-30],适合种内及居群间亲缘关系、分子系统学与遗传多样性研究[31-32]。本研究使用基因组SSR对不同铁皮石斛居群进行遗传多样性研究,其平均等位基因数、平均有效等位基因数、位点平均多态信息含量均较高,表明本研究中的铁皮石斛居群遗传多样性水平较高。11个铁皮石斛居群可聚为三大支,与种质来源而非采集地联系紧密,种质资源地理位置相近的铁皮石斛其遗传关系较近,同时也体现了当今铁皮石斛种质资源相互交流、引进越来越频繁。 铁皮石斛种质鉴定多基于形态学描述,受环境、生长周期等影响,耗时且难以对种子、幼苗进行准确鉴别。基于SSR的分子指纹图谱和分子身份证被认为是品种鉴定理想的标记之一[33],通过构建指纹图谱库和分子身份证,可对铁皮石斛种质、品种乃至个体进行准确鉴定。另一方面,二维码的普及为中药的鉴定与溯源提供了直接的硬件支持[34-35],由于SSR是一种基于条带有无的判定方式,可以直接转换为二维条码而不改变分子指纹图谱的内容,且可添加照片、形态、性状描述、居群、地理信息以方便核对,通过对分子身份证扫描二维条码进行真伪、种质和产地溯源,用于中药流通监管的各个环节,实现数字化监管。 分子身份证的核心是准确、易区分的指纹图谱库。完善的指纹图谱库的构建应全面且具有代表性,不仅需要供试材料来源广泛,对引物的选择也有一定标准。在多态性高的前提下,扩增条带重复性高,清晰易统计也应纳入考虑范围,故而随着种质资源数的扩大,所选用的SSR引物也将不断调整和优化,最终建立囊括所有核心种质的分子身份证。而居群内的个体突变和人工种植中的机械混杂导致的种质混杂等,同一品种铁皮石斛的不同个体在DNA分子水平可能存在微弱差异,表现为同居群不同个体经同一SSR引物扩增后产物位点数不同,可根据中华中医药学会团体标准“T/CACM 010-2016 中药分子鉴定通则”的要求根据样品间差异位点数进行判定。 本研究利用32对多态性引物进行11份铁皮石斛居群的遗传多样性分析,并从中筛选4对多态性好、分辨率高的SSR引物建立各铁皮石斛居群唯一的SSR指纹图谱,结合栽培基地地理位置等信息,以构建铁皮石斛居群的分子身份证,旨在为今后铁皮石斛的品种鉴定提供准确、可靠的方法及溯源信息平台。 致谢:感谢安徽霍山长冲中药材开发有限公司何祥林总经理在样品采集中提供的帮助! [1] 国家药典委员会.中华人民共和国药典:一部[S].北京:中国医药科技出版社,2010:265. [2] 中国科学院中国植物志编辑委员会.中国植物志:第十九卷[M].北京:科学出版社,1999:117. [3] 黎万奎,胡之璧,周吉燕,等.人工栽培铁皮石斛与其他来源铁皮石斛中氨基酸与多糖及微量元素的比较分析[J].上海中医药大学学报,2008,22 (4):80-83. [4] 何铁光,苏江,王灿琴,等.铁皮石斛不同来源材料多糖和氨基酸含量的比较[J].广西农业科学,2007,38(1):32-34. [5] 李光,路娟,陈曦.铁皮石斛产业发展存在的问题与对策[J].中国中药杂志,2013,38(4):469-471. [6] 周骏辉,袁媛,黄璐琦.SSR标记在中药材分子身份证体系构建中的应用[J].中国现代中药,2016,18(10):1233-1236. [7] 段艳凤,刘杰,卞春松,等.中国88个马铃薯审定品种SSR指纹图谱构建与遗传多样性分析[J].作物学报,2009,35(8):1451-1457. [8] 李育强,陈浩东,洪亚辉,等.湘杂棉SSR指纹图谱的构建及应用[J].棉花学报,2009,21(3):175-178. [9] Rojas G,Méndez M A,Muoz C,et al.Identification of a minimal microsatellite marker panel for the fingerprinting of peach and nectarine cultivars[J].Electron J Biotechnol,2008,11(5):245-252. [10]Yuan Y,Long P,Jiang C,et al.Development and characterization of simple sequence repeat (SSR) markers based on a full-length cDNA library ofScutellariabaicalensis[J].Genomics,2015,105(1):61-67. [11]董晓曼,蒋超,袁媛,等.双阻滞位点特异性PCR鉴别铁皮石斛及其近缘物种[J].中国中药杂志,2017,42(5):891-901. [12]Liang Y,Xiao W,Hui L,et al.The Genome ofDendrobiumofficinale,Illuminates the Biology of the Important Traditional Chinese Orchid Herb[J].Mol Plant,2015,8(6):922-934. [13]王学勇,周晓丽,高伟,等.丹参新的EST-SSR分布规律及分子标记的建立[J].中国中药杂志,2011,36(3):289-293. [14]Bassam B J,Caetano-Anollés G,Gresshoff P M.Fast and sensitive silver staining of DNA in polyacrylamide gels[J].Anal Biochem,1991,196:80-83. [15]宋海斌,崔喜波,马鸿艳,等.基于SSR标记的甜瓜品种(系)DNA指纹图谱库的构建[J].中国农业科学,2012,45(13):2676-2689. [16]蒋超,袁媛,刘贵明,等.基于EST-SSR的金银花分子鉴别方法研究[J].药学学报,2012,47(6):803-810. [17]Tang S,Okashah R A,Cordonnier-Pratt M M,et al.EST and EST-SSR marker resources for Iris[J].BMC Plant Biol,2009,9(1):219-228. [18]吴天姝,梁翠,李宏博,等.人参单一基因微卫星标记的分析[J].中国农业科学,2011,44(13):2650-2660. [19]Kong F M, Wang X L, Chen Y N, et al. Characterization of microsatellites in coding genes and functional analysis of these genes in pines[J]. J Nanjing Forest Univ-Nat Sci Ed, 2014,38(2):47-51. [20]徐海滨,钱俊,汪波,等.丹参基因组SSR位点的特征分析及引物开发[J].世界科学技术—中医药现代化,2013,15(3):367-370. [21]阮桢媛,王兵益,欧阳志勤,等.极度濒危植物巧家五针松基因组微卫星特征分析[J].植物研究,2016,36(5):775-781. [22]邓丽丽,李德龙,蔡年辉,等.基于高通量测序的思茅松微卫星位点的特征分析[J].中南林业科技大学学报,2016,36(10):72-77,93. [23]Schorderet D F,Gartler S M.Analysis of CpG suppression in methylated and nonmethylated species[J].Proc Natl Acad Sci,1992,89(3):957-961. [24]Stallings R L.CpG suppression in vertebrate genomes does not account for the rarity of (CpG)n microsatellite repeats[J].Genomics,1992,13(3):890-891. [25]Botstein D,White R L,Skolnick M,et al.Construction of a genetic linkage map in man using restriction fragment length polymorphisms[J].Am J Hum Genet,1980,32(3):314-331. [26]丁鸽,丁小余,沈洁,等.铁皮石斛野生居群遗传多样性的RAPD分析与鉴别[J].药学学报,2005,40(11):68-72. [27]苑鹤,林二培,朱波,等.铁皮石斛人工栽培居群的遗传多样性研究[J].中草药,2011,42(3):566-569. [28]宋跃朋,江锡兵,张曼,等.杨树Genomic-SSR与EST-SSR分子标记遗传差异性分析[J].北京林业大学学报,2010,32(5):1-7. [29]吴根松,张启翔,程汉武,等.梅花EST-SSR与Genomic-SSR的比较研究[J].西北农业学报,2011,20(10):120-125. [30]齐琳洁,龙平,蒋超,等.黄芩基因组SSR分子标记的开发及遗传多样性分析[J].药学学报,2015,50(4):500-505. [31]杨彦伶,张亚东,张新叶.杨树SSR标记在柳树中的通用性分析[J].分子植物育种,2008,6(6):1134-1138. [32]Eujayl I,Sorrells M,Baum M,et al.Assessment of genotypic variation among cultivated durum wheat based on EST-SSRs and genomic-SSRs[J].Euphytica.2001,119(1-2):39-43. [33]Zhang H,Wang H,Guo S,et al.Identification and validation of a core set of microsatellite markers for genetic diversity analysis in watermelon,CitrulluslanatusThunb.Matsum.&Nakai[J].Euphytica,2012,186(2):329-342. [34]辛天怡,李西文,姚辉,等.中药材二维 DNA 条形码流通监管体系研究[J].中国科学:生命科学,2015,45(7):695-702. [35]蔡勇,李西文,倪静云,等.基于二维码的中药质量可追溯系统[J].中药材,2016,39(2):275-280. MolecularIDforPopulationsofDendrobiumofficinaleofYunnanandAnhuiProvinceBasedonSSRMarker DONG Xiaoman1,2,YUAN Yuan1*,ZHA Liangping2,3,PENG Daiyin2,3,YU Nianjun2,WANG Jiyong4,ZHAO Yuyang1,JIANG Chao1*,HUANG Luqi1 (1.StateKeyLaboratoryofDao-diHerbsBreedingBase,NationalResourceCenterforChineseMateriaMedica,ChinaAcademyofChineseMedicalSciences,Beijing100700,China;2.SchoolofPharmacy,AnhuiUniversityofChineseMedicine,Hefei230012,China;3.InstituteofConservationandDevelopmentofTraditionalChineseMedicineResources,AnhuiAcademyofChineseMedicine,Hefei230012,China;4.ChineseTraditionalMedicineCompanyofChina,Beijing100195,China) Objective:To establish a molecular ID(mID)forDendrobiumofficinalerigin from Yunnan and Anhui.Methods:Genome ofD.officinalewas analyzed and SSRs (Simple Sequence Repeats) were isolated.Primers were designed by Primer Premier 5.0 software,high polymorphism primers were isolated and genetic diversity analysis was performed,and thenSSR fingerprinting database and mIDs of 11 populations ofD.officinalewere constructed.Results:A total of 91 653 SSRs were isolated,the average distribution density was 15.44 kb.75 pairs of SSR primers were designed and screened,32 high polymorphismprimer pairs were selected to generate polymorphic fingerprints.The results showed that the 32 pairs of primers could generate 117 polymorphic alleles bands.The average polymorphism information content (PIC)as 0.62 with a range of 0.22-0.80.11 populations ofD.officinalecould be clustered to 3 branches,which accordance with the geographical distribution of its germplasm.Fingerprinting database of 11 populations ofD.officinalewere established with 4 pairs of primers,and in consequence the molecular ID were established for the 11 populations.Conclusion:SSR marker is suitable for construction of DNA fingerprinting database ofD.officinaleand the database could provide reference for population identification ofD.officinale. Dendrobiumofficinale;genomic SSR;molecular ID 中医药行业科研专项(201407003);国家杰出青年科学基金项目(81325023) ] 蒋超,助理研究员,研究方向:中药分子鉴定,E-mail:jiangchao0411@126.com;袁媛,研究员,研究方向:中药资源与分子生药学;E-mail:y_yuan0732@163.com 10.13313/j.issn.1673-4890.2017.5.005 2017-03-22) *[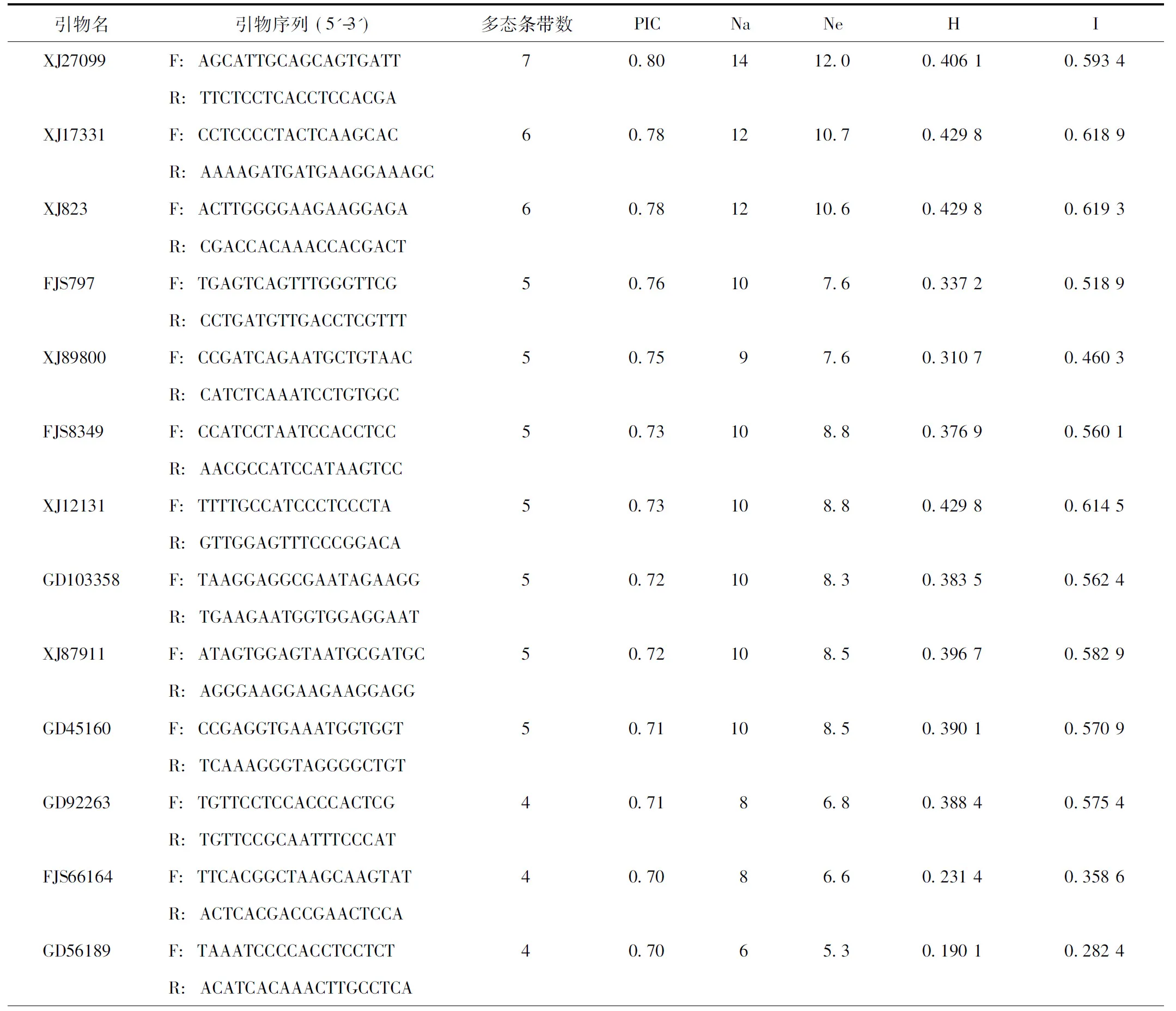




3 讨论与结论
