傣百解体外细胞毒活性评价及其化学成分预实验△
2017-09-21李晓花李海涛金玲钰牛迎凤张丽霞
李晓花,李海涛,金玲钰,牛迎凤,张丽霞
(西双版纳州傣药南药重点实验室,中国医学科学院 北京协和医学院药用植物研究所 云南分所,云南 景洪 666100)
·基础研究·
傣百解体外细胞毒活性评价及其化学成分预实验△
李晓花,李海涛,金玲钰,牛迎凤,张丽霞*
(西双版纳州傣药南药重点实验室,中国医学科学院 北京协和医学院药用植物研究所 云南分所,云南 景洪 666100)
目的:研究傣百解不同溶剂提取物和不同萃取部位的体外抗肿瘤细胞增殖活性,探索活性部位的化学成分。方法:分别以水、50%乙醇水溶液、95%乙醇水溶液3种溶剂对傣百解进行回流提取,采用系统溶剂法对傣百解95%乙醇水溶液提取物进行萃取,采用SRB法测定不同浓度提取物和萃取部位对人胃癌细胞SGC7901、人肝癌细胞HepG2、人宫颈癌细胞Hela、人卵巢癌细胞SKOV3和人胰腺癌细胞SW1990 5种肿瘤细胞增殖的影响;采用试管法、纸反应法等,对傣百解活性部位的化学成分进行初步研究。结果:傣百解抗肿瘤活性部位为乙酸乙酯萃取部位,对SGC7901、HepG2、Hela和SKOV3肿瘤细胞增殖的IC50分别为8.5、20、18.2、12.2 μg·mL-1。乙酸乙酯部位可能含有甾体皂苷、挥发油和有机酸等化学成分。结论:傣百解95%乙醇水溶液提取物的乙酸乙酯萃取部位具有广谱细胞毒活性,化学成分以甾体皂苷为主。
傣百解;细胞毒;预实验
据世界卫生组织报道,癌症是全世界一个主要死亡原因[1]。国家癌症中心发布的《2015中国肿瘤登记年报》统计数据显示,中国每年新增癌症病例约350万,约有250万人因此死亡[2]。中药和民族药是我国传统药的两个重要组成部分,在我国应用历史悠久,具有多靶点、多环节、多效应的作用特点。从传统药物中开发应用于肿瘤等疾病的药物,与化学药物相比,具有不良反应少、不易产生抗药性、有效缓解患者的痛苦、干预性好等优点[3-4]。
傣百解的原植物是萝藦科牛奶菜属植物通光散Marsdeniatenacissima(Roxh.)Moon,但《中国植物志》和《Flora of China》中收载的通光散的描述和插图有误,与傣百解的基原植物是不同种[5]。傣百解傣语称“雅解先打”,意为解百毒的药,在我国西双版纳、德宏等地,以及老挝、缅甸等国家的傣族居住区使用极其广泛[6]。傣百解以根入药,性凉、味苦,入火、土、风塔,具有清火解毒、消肿止痛之功效,常用于咽喉肿痛、口舌生疮、疗疡斑疹、肺热咳嗽、胃脘痛、尿痛、解药食毒;还可用于清除因饮食不洁、用药不当而致的各种不良反应。傣百解为国药准字品种“雅解片”的主要组方中药,同时也是西双版纳傣医院多个院内制剂如百解胶囊、版纳凉剂、雅解嘎罕等的组方中药[7]。傣百解临床用于多种肿瘤的治疗,因此,本文对傣百解不同溶剂提取物及不同萃取部位进行体外抗肿瘤活性筛选,明确傣百解的活性部位,并对其化学成分类型进行鉴别,以期明确傣百解体外细胞毒活性部位、对不同肿瘤细胞的选择抑制活性和可能的活性成分。
1 材料与仪器
1.1 细胞株
人胃癌细胞SGC7901、人肝癌细胞HepG2、人宫颈癌细胞Hela、人卵巢癌细胞SKOV3和人胰腺癌细胞SW1990(中科院上海细胞库)。
1.2 仪器
CA-1390-1型超净工作台(上海净化设备有限公司);CO2细胞培养箱(美国Thermo Forma Scientific(Marietta,OH,United States);倒置显微镜(日本OLYMPUS);BT 124S型十万分之一天平(Sartorius公司);SPECTRA MAX 190酶标仪(Molecular Devices(Sunnyvale CA,USA)。
1.3 试剂与药材
RPMI 1640培养基(Gibco公司);SRB(Sigma-Aldrich,St Louis,Mo,USA);二甲基亚砜[生工生物工程(上海)股份有限公司];胎牛血清(FBS;Gaithersburg,USA);胰蛋白酶(美国Amresco公司);甲醇、乙醇等分析纯试剂(天津大茂化学试剂厂);显色剂均为实验室自配;阳性对照药:消癌平片(陕西科学院制药厂,批号:140225),紫杉醇(大连美伦生物,批号:A0818A)。
植物材料于2014年3月采自云南西双版纳州,经本所张丽霞副研究员鉴定为通光散Marsdeniatenacissima(Roxh.)Moon,材料经过粉碎成粗粉后备用。原标本保存于中国医学科学院药用植物研究所云南分所标本馆(D20100720008)。
2 方法
2.1 傣百解的提取和萃取
2.1.1 不同溶剂提取物的制备 称取傣百解根粉3份,每份50 g,分别加入10倍量的95%乙醇、50%乙醇水溶液和水回流提取3 h,提取液冷却后过滤,减压浓缩,得到95%乙醇水溶液提取物(DBJ-1)、50%乙醇水溶液提取物(DBJ-2)和水提取物(DBJ-3)。以上提取物用于体外抗肿瘤活性试验,明确傣百解的最佳提取溶剂。
2.1.2 95%乙醇水溶液提取物的制备及萃取 傣百解粉末适量,加入10倍量95%乙醇水溶液浸润,回流提取2 h,减压浓缩,得到提取物。提取物用适量蒸馏水混悬后,依次用等量乙酸乙酯、正丁醇萃取,得到乙酸乙酯部位(DBJ-4)、正丁醇部位(DBJ-5)和水部位(DBJ-6)。各极性部位进行体外细胞毒活性试验,明确傣百解具有细胞毒活性的部位。
2.3 实验分组
正常对照组:培养细胞不加药物处理,只加培养液。给药组:分9个剂量组,在培养液中加入傣百解提取物,药液终质量浓度分别为0.1、0.3、1、3、10、33、100、333、1000 μg·mL-1。阳性对照组:培养液中加入含 0.1、0.3、1、3、10、33、100、333、1000 μg·mL-1的阳性对照药。
2.4 SRB法检测不同提取物及极性部位对5种肿瘤细胞增殖的影响
细胞以含10%胎牛血清的培养液培养,使细胞一直处于对数生长期。细胞接种于96孔培养板,密度1~5×104个·mL-1。在37 ℃、5% CO2培养箱预培养24 h,药物设10个浓度,每个浓度设3个复孔,连续作用72 h。药物作用结束后,用三氯乙酸(TCA)固定细胞,清洗后加入SRB工作液,洗涤,用Tris base溶解与蛋白结合的SRB,SPECTRAmax 190细胞标仪565nm波长下测定每个小孔的吸光度(A)值,空白对照孔加20 μL培养液。根据A值,按公式(1)计算细胞生长抑制率[8]。
抑制率(%)=(A对照—A用药)/A对照×100%
用 Graphpad Prism5 软件处理,计算出化合物的 IC50值。
2.5 活性部位化学成分预实验
活性部位用适量乙醇或甲醇溶解,过滤,得到的滤液采用试管法和纸反应法检查黄酮、蒽醌、香豆素、萜、甾体、强心苷、有机酸、酚等类成分[9]。
3 结果
3.1 傣百解不同提取物和萃取部位体外细胞毒活性
各提取物和95%乙醇水溶液提取物的各极性萃取部位的体外细胞毒IC50计算结果见表1,作用48 h后抑制肿瘤细胞增殖效果见图1。
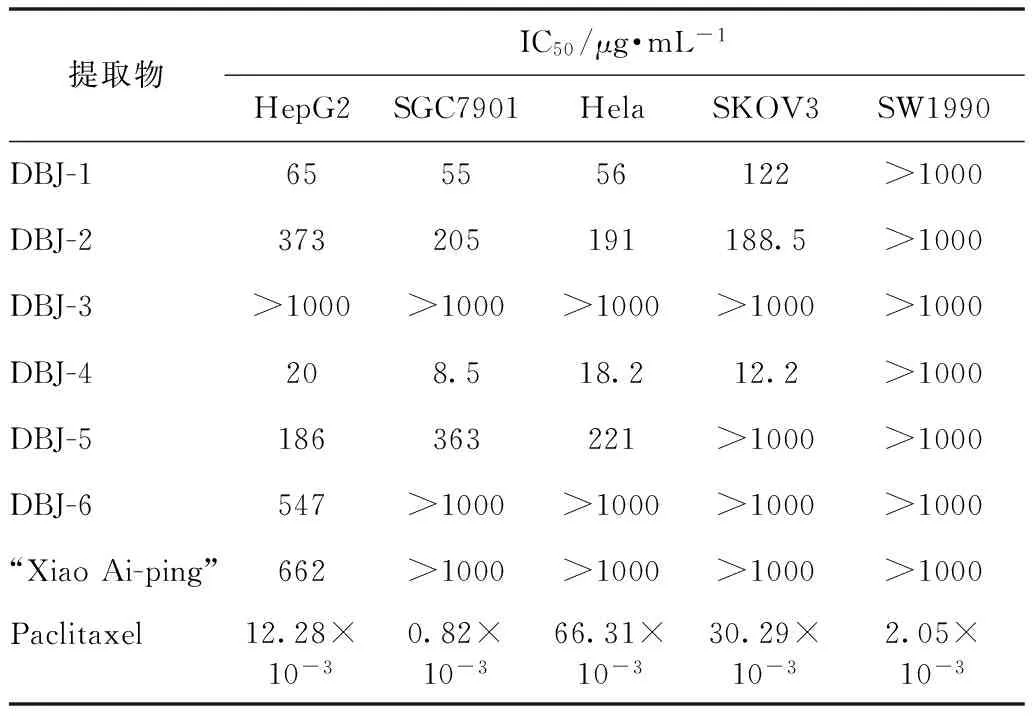
表1 傣百解不同提取物和萃取部位体外细胞毒活性
由以上实验结果可知,傣百解最佳提取溶剂为95%乙醇水溶液,活性部位为95%乙醇水溶液提取物的乙酸乙酯萃取部位。体外细胞毒活性显示,DBJ-4对5种肿瘤细胞株中的4种具有显著抑制作用,作用于HepG2、SGC7901、Hela和SKOV3肿瘤细胞株的IC50分别为20、8.5、18.2、12.2 μg·mL-1。
3.2 DBJ-4化学成分预实验结果
采用试管法、滤纸片法等检测方法,观察实验现象,推测傣百解活性部位中可能存在的化学成分类型,结果显示,DBJ-4中可能含有甾体皂苷、有机酸和强心苷类化合物。
4 讨论
傣百解为傣族传统用药,临床应用广泛,但缺少对傣百解药效物质和药理学等的相关研究。
体外细胞毒活性实验结果表明,各提取物和萃取部位对人胰腺癌细胞SW1990均不显示抑制活性。3种不同溶剂提取物中,傣百解95%乙醇水溶液提取物的体外抗肿瘤活性优于50%乙醇水溶液提取物和水提取物,抑制作用强弱顺序依次为胃癌SGC7901>宫颈癌Hela>肝癌HepG2>卵巢癌SKOV3,IC50分别为55、56、65、122 μg·mL-1;乙酸乙酯萃取部位抑制作用强弱顺序为胃癌SGC7901>卵巢癌SKOV3>宫颈癌Hela>肝癌HepG2,IC50分别为8.5、12.2、18.2、20 μg·mL-1。水提取物、正丁醇部位和水部位对肿瘤细胞增殖无抑制作用。由实验结果可知,傣百解的活性部位具有广谱细胞毒活性。
综上表明,95%乙醇水溶液为傣百解最佳提取溶剂;提取物的乙酸乙酯萃取部位为其活性部位。化学成分预实验表明,傣百解中可能含有甾体皂苷、挥发油和有机酸成分,其中主要成分可能是甾体皂苷。根据文献报道[10],甾体皂苷具有抗肿瘤、抗真菌、防治心血管疾病、降血糖、免疫调节等广泛的药理作用和重要的生物活性。萝藦科植物中的主要化学成分为C21甾体皂苷,具有抑制肿瘤细胞的增殖和侵袭、调节免疫功能、抗生育、抗癫痫、抗氧化和抑制乙酰胆碱酯酶等活性。由此推测,傣药傣百解临床用于肿瘤治疗的有效物质可能为其中含有的甾体皂苷类成分。项目组将继续对傣百解活性部位的化学成分、抗肿瘤活性和作用机制进行研究,进一步阐明傣百解抗肿瘤的物质基础和作用机制。
[1] Stewart B W,Wild C P.World cancer report 2014[M].Lyon:International Agency for Research on Cancer.2014.
[2] 赫捷,陈万清.2015年中国肿瘤登记年报[M].北京:军事医学科学出版社,2015.
[3] 龙晓芝,耿耘,郭晴晴.近年中药抗肿瘤有效成分及作用机制研究进展[J].中华中医药学刊,2015,33(4):862-864.
[4] 张永萍.中药民族药新药研制的选题思路[J].中国民族医药杂志,2012,18(8):37-40.
[5] 李海涛,康利平,郭宝林,等.常用傣药”傣百解”的基原考证[J].中国中药杂志,2014,39(8):1525-1529.
[6] 中国科学院昆明植物所.云南植物志[M].北京:科学出版社,1983:657.
[7] 林艳芳,依专,赵映红.中国傣医药彩色图谱[M].昆明:云南民族出版社,2000:397.
[8] Ahmed H H,Abdrabou A A,Hassan A Z,et al..Phytochemical Analysis and Anti-cancer Investigation of Bswellia serrata Bioactive Constituents invitro[J].Asian Pacific Journal of Cancer Prevention Apjcp,2015,16(6):7179-7188.
[9] 李晓花,牛迎凤,元超,等.傣药倒心盾翅藤化学成分预实验[J].中医药导报,2014,20(5):17-21.
[10]刘星,余江丽,刘敏,等.近10年甾体皂苷的生物活性研究进展[J].中国中药杂志,2015,40(13):2518-2523.
InvitroCytotoxicityActivityandPreliminaryTestforChemicalComponentsfrom“Dai-Bai-Jie”(Marsdeniatenacissima)
LIXiaohua,LIHaitao,JINLingyu,NIUYingfeng,ZHANGLixia*
(KeyLaboratoryofDaiandSouthernmedicineofXishuangbannaDaiAutonomousPrefecture,YunnanBranchInstituteofMedicinalPlant,ChineseAcademyofMedicalSciences,Jinghong,Yunnan666100,China)
Objective:To explore the cytotoxicity activity of different solvent extracts and fractions from “Dai-Bai-Jie”(Marsdeniatenacissima),and identify the chemical components of activity fractions.Methods:“Dai-Bai-Jie” was extracted by water,50% ethanol-aqueous and 95% ethanol-aqueous by reflux method.95% ethanol-aqueous extract were extracted by ethyl acetate andn-butyl alcohol successively.The proliferation of SGC7901,HepG2,Hela,SKOV3 and SW1990 were detected by SRB method,and components of active fraction were studied by tube reaction and paper reaction methods.Results:Ethyl acetate extract was the active fraction,and the IC50were 8.5,20,18.2 and 12.2 μg·mL-1in SGC7901,HepG2,Hela,SKOV3 tumor cells.Steroidal saponins,volatile oil and organic acid may be existed in “Dai-Bai-Jie”.Conclusion:“Dai-Bai-Jie” has broad-spectrum cytotoxicity activity,and the main chemical components are steroidal saponins.
“Dai-Bai-Jie”;cytotoxicity activity;preliminary test
景洪市科技三项费(2303-6140524);中国医学科学院药用植物研究所中央级公益性科研院所基本科研业务专项基金(YZYN-15-01)
] 张丽霞,硕士,副研究员,研究方向:热带药用植物种质资源保护;E-mail:87050233@qq.com
10.13313/j.issn.1673-4890.2017.4.012
2016-06-29)
*[
