麦冬提取工艺多糖变化规律研究
2017-09-21张璐欣周学谦李德坤周大铮杨悦武余伯阳鞠爱春
张璐欣,周学谦,李德坤,周大铮,杨悦武,余伯阳,鞠爱春
(1.中国药科大学,江苏 南京 211198;2.天津市中药注射剂安全性评价企业重点实验室,天津 300402;3.天津天士力之骄药业有限公司,天津 300402)
·中药工业·
麦冬提取工艺多糖变化规律研究
张璐欣1,周学谦2,3,李德坤2,3,周大铮2,3,杨悦武2,3,余伯阳*,鞠爱春2,3*
(1.中国药科大学,江苏 南京 211198;2.天津市中药注射剂安全性评价企业重点实验室,天津 300402;3.天津天士力之骄药业有限公司,天津 300402)
目的:研究麦冬多糖提取时的变化规律。方法:将麦冬药材粉末经水提醇沉后得到的麦冬多糖作为研究对象,适量水溶解后,模拟麦冬提取工艺,通过测定提取过程中分子量分布值、总糖含量、单糖含量的变化,从而得出麦冬多糖按提取工艺提取时的降解规律。结果:发现麦冬多糖在提取时发生了降解,产生了分子量更小的糖。结论:得到的麦冬多糖变化规律,可用于指导生产中麦冬药材的提取,进而稳定麦冬药材的收率,提高生产效益。
麦冬多糖;提取工艺;糖含量;降解规律
麦冬为百合科多年生常绿草本植物,首载于《本草经》,有养阴生津、润肺清心的功能,在养阴药和一些复方中处于极其重要的地位[1-2]。麦冬主要化学成分为甾体皂苷、多糖,还有高异黄酮类、氨基酸等[3-5]。研究发现,麦冬活性多糖可保护心肌细胞,增加小鼠心肌营养血流量,同时还具有抑制心肌缺血造成的自由基生成,增加和清除氧自由基的作用[6-7]。汤军等[8]发现,麦冬多糖可显著增加幼鼠的免疫器官重量,具有良好的免疫增强和刺激作用。目前上市的含有麦冬药材的药品有参麦注射液、生脉饮、益气复脉片剂、口服液等,针对麦冬药材的加工过程均涉及提取工艺。胡毅坚等[9]比较了不同厂家参麦注射液中糖的成分,因其主要为单糖和低聚糖,故采用了苯酚-硫酸法测定含量,发现差异较大;苏彦珍等[10]比较了不同工艺路线制备生脉口服液的区别,设置了低温离心、超滤、醇沉3个工艺组比较,而这3种方法的目的均在于除掉部分多糖。因此,本实验采用了醇沉工艺考察麦冬多糖在提取过程中的降解规律,模拟岳宝森等[11]报道的参麦注射液中麦冬的提取工艺。麦冬中糖类成分较为复杂,因此本实验设计是从整体糖类物质入手,通过模拟参麦注射剂的醇沉工艺,得到麦冬多糖在提取过程中的降解规律,使其能更好地指导生产,提高经济效益。
1 仪器与材料
1.1 仪器
METTLER AL204型万分之一电子分析天平、XS-105 型十万分之一电子天平(瑞士,梅特勒-托利多仪器有限公司);药典筛(浙江上虞市五星冲压筛具厂);KQ-100E型超声清洗器(昆山市超声仪器有限公司);98-1-B型电子恒温电热套(天津市泰斯特仪器有限公司);SPE商品柱(型号PSZG 5006,500 mg·(6 mL)-1,天津博纳艾杰尔科技有限公司);DZG-404SB型电热真空干燥箱(天津市天宇实验仪器有限公司);JJ-1A数显电动搅拌器(金坛市荣华仪器制造有限公司);LongerPump蠕动泵(河北保定兰格恒流泵有限公司);Waters高效液相色谱仪(2695 四元泵、2420 ELSD,美国Waters科技有限公司);SHB-Ⅲ循环水式多用真空泵(长城科工贸有限公司)。
1.2 试剂
高碘酸钠(天津市天大化工实验厂,分析纯);碘化钾、硫代硫酸钠(天津市风船化学试剂科技有限公司,分析纯);无水碳酸钠、硫酸、淀粉(天津市化学试剂三厂,分析纯);基准重铬酸钾(天津市标准科技有限公司,分析纯);氢氧化钠(天津丰川化学试剂有限公司);乙腈(色谱级,默克公司,美国);超纯水(Milli-Q超纯水机)。
果糖、D-无水葡萄糖、蔗糖(中国食品药品检定研究院,批号分别为100231-200303,111507-201303,110833-201506);川麦冬药材由天津天士力之骄药业有限公司提供。
2 方法与结果
2.1 麦冬多糖样品的制备
精密称取2份麦冬药材粉末(过4号筛)50.0 g,分别置3000 mL圆底烧瓶中,加水2000 mL,回流提取1 h,趁热过滤。滤渣加水1000 mL,继续回流提取1 h,趁热过滤,合并滤液。滤液于55 ℃下减压浓缩至140 mL(约1.40 mL·g-1),加入95%乙醇至含醇量约为80%(搅拌速度约550 r·min-1,加醇速度为50 r·min-1),于4 ℃冰箱中放置过夜。次日分离上清液和沉淀后,将沉淀置于电热真空干燥箱中,40 ℃下干燥10 h,即得麦冬多糖样品。
2.2 样品的提取工艺过程及取样
2.2.1 样品的提取工艺 精密称取麦冬样品约50 g,置于烧杯中,13倍量纯化水(650 mL)溶解,于65 ℃下减压浓缩至110 mL,加95%乙醇至含醇量为75%进行一次醇沉(搅拌速度约550 r·min-1,加醇速度为50 r·min-1),4 ℃冰箱中放置过夜。分离的上清液进行减压浓缩至17 mL,加95%乙醇至含醇量为85%进行二次醇沉(搅拌速度约550 r·min-1,加醇速度为50 r·min-1),4 ℃冰箱中放置过夜。分离的上清液加NaOH调节pH至9.0,4 ℃冰箱中放置过夜。分离的上清液加稀盐酸调节pH至6.5~7.0。
2.2.2 提取工艺过程的取样 分别针对多糖样品溶液、一次醇沉、二次醇沉、调碱、调酸的上清液及沉淀取样。
2.3 总糖含量测定方法
采用高碘酸钠滴定法测定上清液及沉淀中的总糖含量。减压浓缩后的上清液与水溶解后的沉淀分别取适量过SPE商品柱,流速约1.0 mL·min-1,纯化水洗脱,收集洗脱液约50 mL于100 mL量瓶中,加水定容,密塞摇匀。精密吸取10 mL至50 mL量瓶中,加水定容,密塞摇匀。精密吸取10 mL待测溶液置500 mL碘量瓶中,分别加NaIO4(约12 mg·mL-1)、水、稀硫酸10.00、50.0、40.0 mL。水浴加热30 min,放冷至室温,加碘化钾2.0 g、水10.0 mL,密塞,摇匀,置暗处反应5 min,用标定好的Na2S2O3溶液滴定,至近终点时加3 mL淀粉指示剂,继续滴定至蓝色消失,记下读数,并将滴定的结果用空白实验校正。每1 mL Na2S2O3溶液(0.1 mol·L-1)相当于葡萄糖1.8 mg。
2.4 单糖含量测定方法
采用高效液相色谱-蒸发光散射检测法(HPLC-ELSD)测定上清液及沉淀中的单糖含量。参考刘雪等[12]用HPLC-ELSD法测定麦冬中的糖含量方法,测定上清液中的单糖含量。分别取适量上清液样品及沉淀样品,分别过SPE柱收集至25 mL量瓶中,纯化水定容,摇匀,过0.45 μm微孔滤膜,即得供试品溶液。
色谱条件:Alltech Prevail TM Carbohydrate ES(250 mm×4.6 mm,5 μm)色谱柱;柱温30 ℃;流动相A(乙腈)-B(水),流速0.8 mL·min-1;进样量10 μL;按表1进行梯度洗脱。2420 ELSD检测器参数的增益、气压、漂移管温度和加热动力级别分别为10、25 psi,65 ℃和60%。
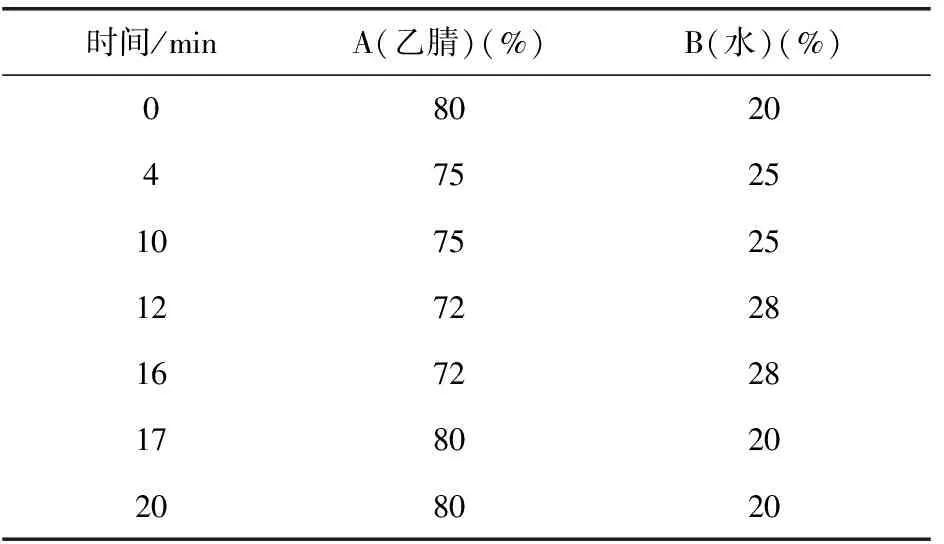
表1 单糖检测梯度洗脱程序
注:该方法已经过方法学验证。
2.5 分子量检测方法
采用HPLC-ELSD测定上清液及沉淀中的分子量。于栋伟[13]、彭菲[14]等均利用HPLC-ELSD测定右旋糖酐分子量和糖苷类大分子物质的分子量,因此本实验参考该方法测定糖的分子量。供试品溶液制备方法同2.4项下方法制备。
色谱条件:Waters Uitrahydrogel TM 250(300 mm×7.8 mm)色谱柱;柱温30 ℃;流动相纯化水;流速0.5 mL·min-1;进样量10 μL,等度洗脱20 min。2420 ELSD检测器参数的增益、气压、漂移管温度和加热动力级别分别为10、25 psi、85 ℃和60%。
2.6 结果与分析
2.6.1 上清液及沉淀总糖含量 取样后的样品按2.3项下总糖含量测定方法进行测定,结果见表2。
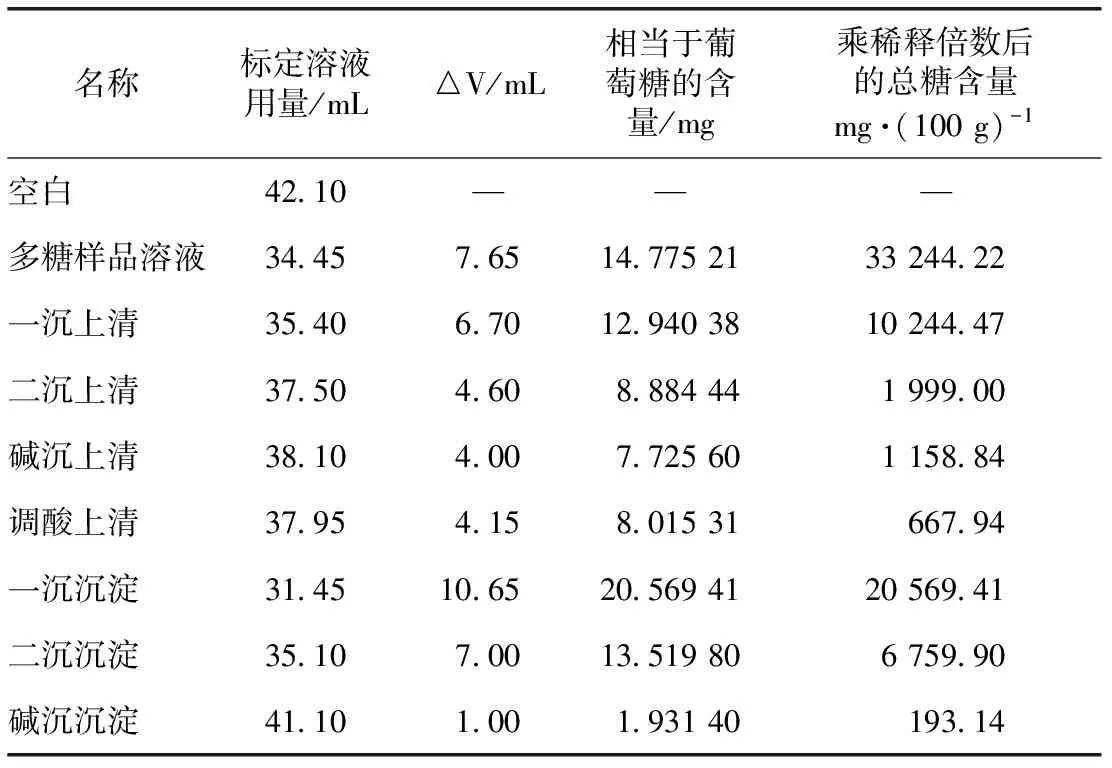
表2 上清液及沉淀总糖含量
注:“—”表示空白样品不能测得的含量结果。
由上表计算可得,所有上清及沉淀样品的糖含量之和为41 592.70,远远大于多糖样品溶液中的糖含量33 244.22,表明多糖样品在提取过程中发生了降解,产生了新的多糖。
2.6.2 上清液及沉淀单糖含量 取样后的样品按2.4项下单糖含量测定方法制备供试品溶液并进行测定,结果见表3。
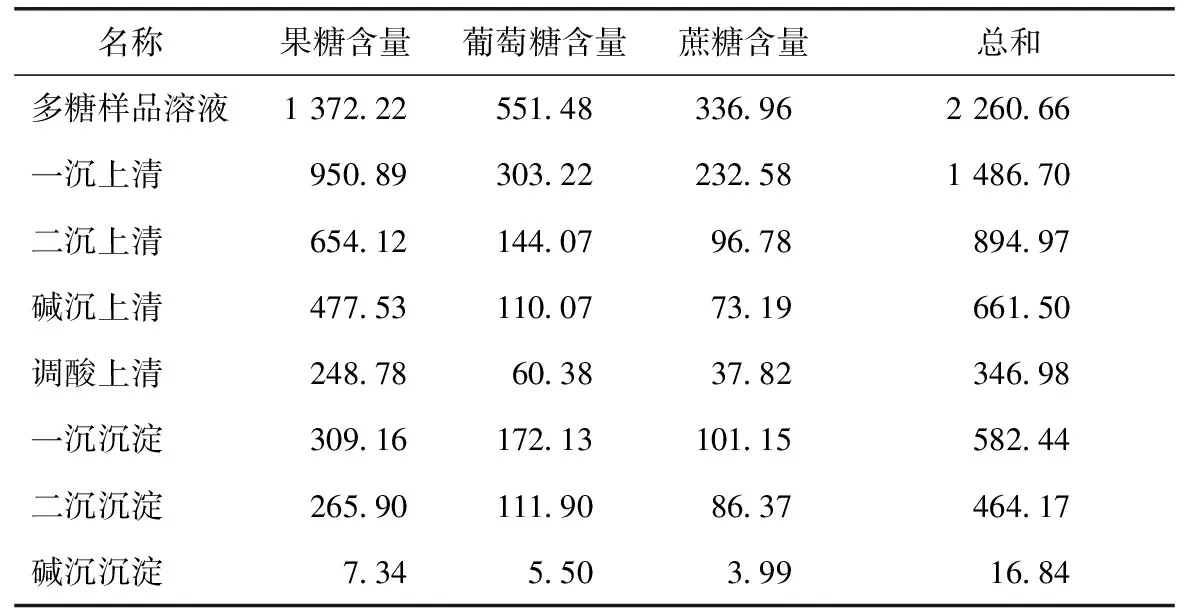
表3 上清液及沉淀单糖含量 mg·(100 g)-1
同2.6.1项下总糖含量的结果分析,所有上清及沉淀样品的糖含量之和为4 453.60,远远大于多糖样品溶液中的糖含量2 260.66,也可认为多糖样品在提取过程中发生了降解,产生了新的单糖。
2.6.3 上清液及沉淀低聚糖含量 麦冬中的糖种类较为复杂,目前能够用液相检测的糖多为单糖、二糖,而低聚糖种类较多,测定单种低聚糖含量不现实,因此本实验针对总低聚糖的含量进行了大概的计算及分析。计算结果见表4。
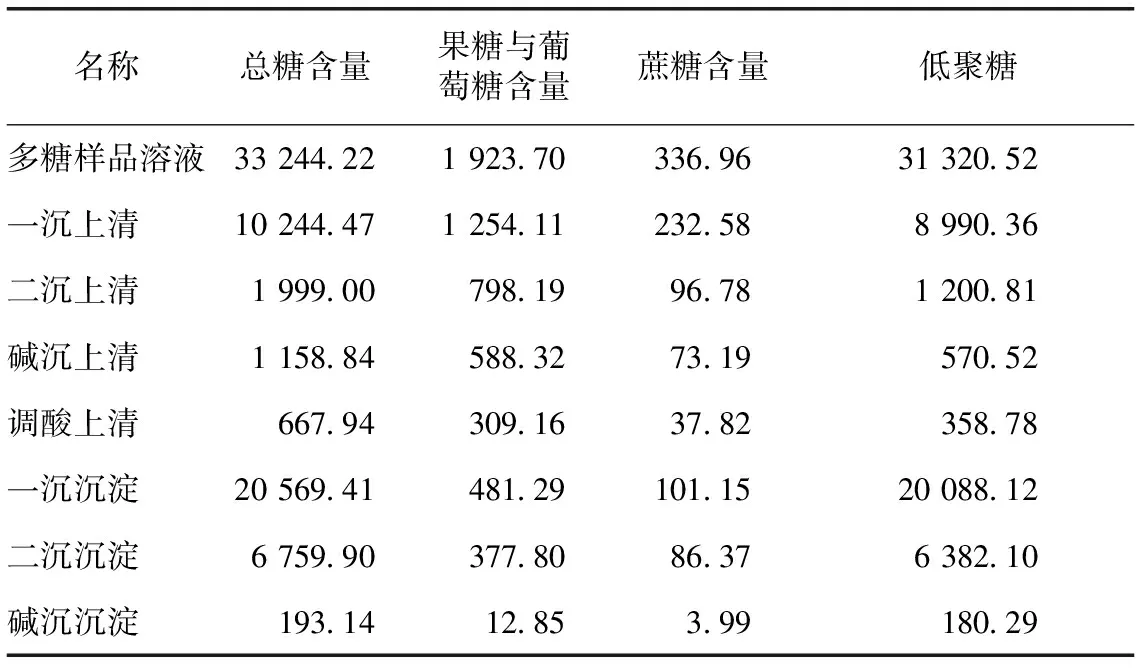
表4 上清液及沉淀低聚糖含量 mg·(100 g)-1
由上表可看出,低聚糖含量在逐渐降低,且减低的越来越少,结合2.6.1和2.6.2中总糖与单糖含量的升高,可认为麦冬多糖在提取过程中的降解是由于浓缩时温度、浓缩时间等综合效应导致了低聚糖的降解。
2.6.4 上清液及沉淀分子量分布值 取样后的样品按2.5项下单糖含量测定方法制备供试品溶液,并进行测定。计算分子量结果时采用右旋糖酐对照品,由于其保留时间与分子量的对数呈线性关系,根据线性方程和保留时间即可计算分子量结果。计算结果见表5。
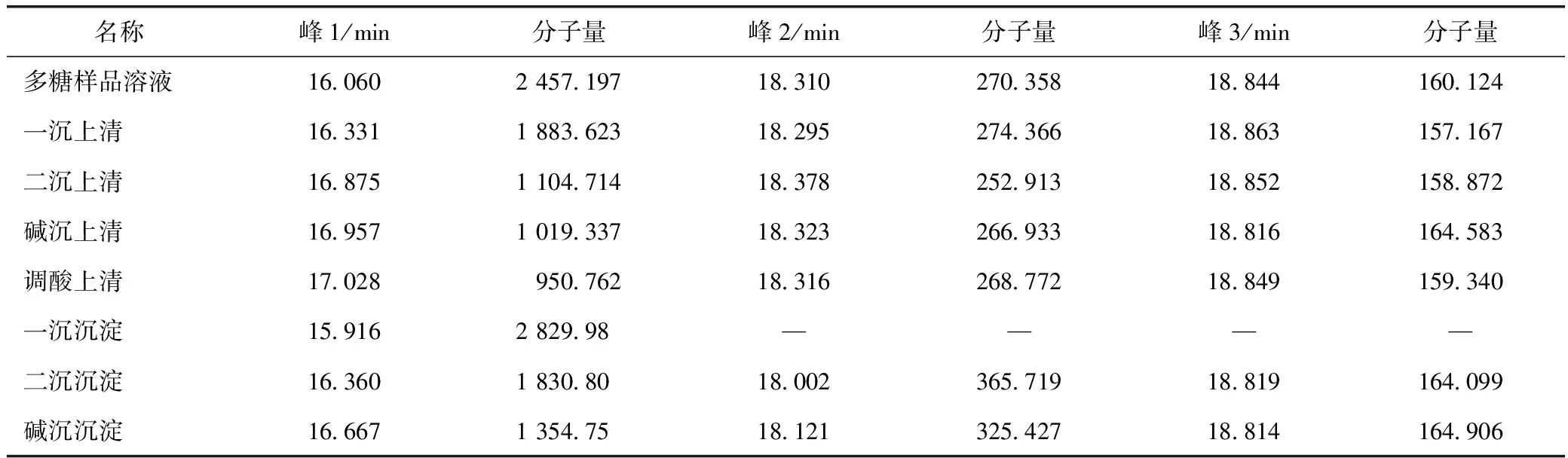
表5 上清液及沉淀分子量
注:“—”表示沉淀样品中未测得分子量分布值。
由上表计算结果可知,不管是上清液还是沉淀中的峰1分子量均逐渐减小,说明多糖在逐渐降解为分子量更小的糖;一沉沉淀未测出峰2、峰3分子量,提示多糖样品溶液在一次浓缩时多糖易降解为分子量更小的多糖。
2.6.5 增加率折线图 为更直观地表明多糖在提取过程中的降解规律,现针对各个工艺环节对下一环节中糖的减少率进行分析,其中横坐标表示工艺流程,纵坐标表示减少率数值。结果如图1,计算数值见表6。
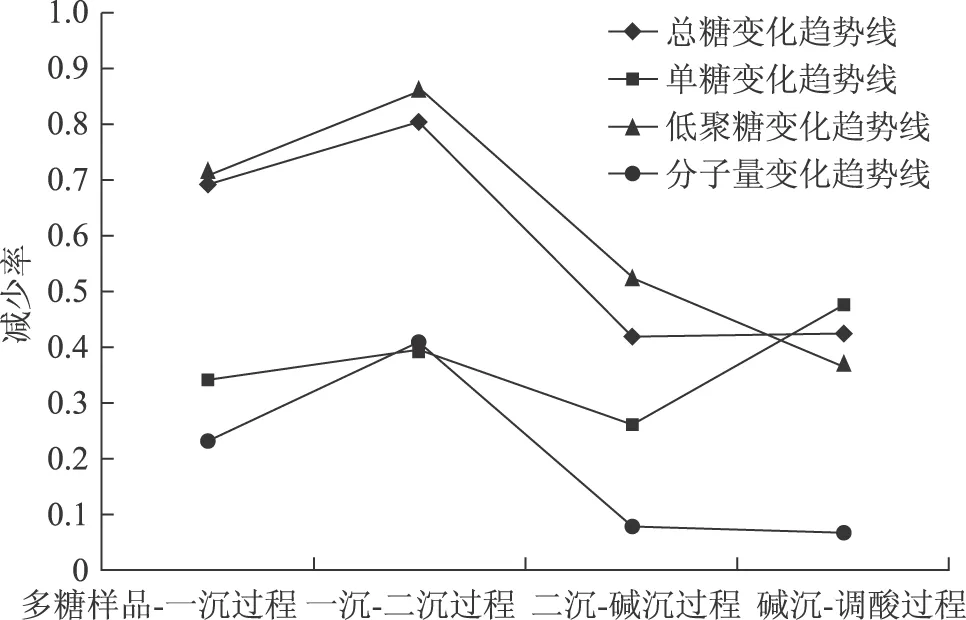
图1 提取过程糖的减少率
由图1可以看出,整个过程4条变化趋势线的斜率(或其绝对值)均有不同的大小,斜率越大表明糖的含量(或分子量)变化越明显,结合表2~4的糖的含量数据,斜率在各个取样点的变化是由于浓缩时原有的多糖发生降解产生了分子量更小的低聚糖,一部分在醇沉时被分离,保留在上清液中的另一部分在浓缩时再次发生降解。

表6 提取过程各指标的减少率 %
由图1可以看出,整个过程4条变化趋势线的斜率(或其绝对值)均不同,斜率越大表明糖的含量(或分子量分布值)变化越明显。
在多糖样品-一沉过程及一沉-二沉过程中,斜率越大表明对应的含量减少的越多。结合一沉沉淀的单糖含量与二沉沉淀的相近(表明能被沉淀的单糖含量相近)、一沉上清液低聚糖含量与二沉上清液的相差很大,表明一次浓缩过程中产生的大多为低聚糖且在一次醇沉中被沉淀除去。
在一沉-二沉过程及二沉-碱沉过程中,斜率绝对值越小表明对应的含量减少的越少。结合二沉上清液的单糖含量与碱沉上清液的相近、二沉上清液的低聚糖含量与碱沉上清液的较上一过程相差小,表明二沉过程中基本将低聚糖沉淀出去了,而单糖仍溶解被保留在上清液(85%乙醇溶液)中,故单糖含量变化最小。
在二沉-碱沉过程及碱沉-调酸过程中,只有单糖和低聚糖的趋势线斜率有明显变化,此时斜率绝对值越大表明含量减少越少。提取工艺过程此部分只有沉淀分离过程,因此只能造成低聚糖和单糖的降低;图1中可发现单糖斜率绝对值变化大于低聚糖,这是由于在沉淀时上清液的单糖被大量包裹随沉淀被分离,而上清液的低聚糖含量已基本除去,加碱沉淀导致水在醇相和水相(沉淀)重新分配,因而出现单糖进入沉淀相,因此低聚糖变化较单糖小。
在整个过程中糖类物质分子量分布值变化趋势线的斜率绝对值先增大后减小,说明糖降解时分子量分布值减小,无降解时无变化。从中也可以看出,浓缩时的温度、时间及酸度是导致低聚糖降解、单糖增加的主要因素。
3 讨论
3.1 多糖的变化规律
多糖样品溶液在一次减压浓缩时使多糖降解,产生了其他分子量更小的多糖,此时降解的糖以分子量稍大的低聚多糖为主,由于一次醇沉将此部分多糖部分沉降分离,导致留在上清液的低聚糖大部分减少;二次减压浓缩时温度的升高仍能使留在上清液中的多糖降解为分子量更小的糖,此时降解的糖种类以单糖及其他小分子糖为主,且在二次醇沉过程中将大部分降解的糖保留在了上清液中;在碱沉过程中,只有沉降分离过程,并无降解过程,因此该部分糖含量会有所降低。
3.2 本研究的意义
麦冬中糖的种类复杂,若针对单体进行详细研究则需要大量提取醇沉得到大量麦冬粗多糖。对麦冬粗多糖进行凝胶分离,此方法虽可行,但仅用一种或几种麦冬多糖指导多糖提取的降解规律未必能代表整体,且耗时耗力,因此对于麦冬中的多糖在提取过程中降解规律的研究只能从整体入手,详细了解糖在每一过程的降解行为才能更全面,因此本实验设计从整体入手,将提取醇沉得到的麦冬多糖样品综合进行考察,研究整体多糖的降解,得到大致的降解规律,以指导生产,更好地应用于麦冬提取。
[1] Zhou Y F,Qi J,Zhu D N,et al.Homoisoflavonoids from Ophiopogon japonicus and Its Oxygen Free Radicals (OFRs) Scavenging Effects[J].Chinese Journal of Natural Medicines,2008,6(3):201-204.
[2] Li N,Zhang J Y,Zeng K W,et al.Anti-inflammatory homoisoflavonoids from the tuberous roots of Ophiopogon japonicas[J].Fitoterapia,2012,83(6):1042-1045.
[3] 黄光辉,孙连娜.麦冬多糖的研究进展[J].现代药物与临床,2012,27(5):523-529.
[4] Liu Y,Liang Y,Zhou Y,et al.Experimental Evidence for Ion Accumulation Time Affecting Qualitative and Quantitative Analysis of Ophiopogons in Ophiopogon Extract by Hybrid Ion Trap Time-of-Flight Mass Spectrometry[J].Chromatographia,2013,76(15/16):949-958.
[5] Xie T,Liang Y,Hao H,et al.Rapid identification of ophiopogonins and ophiopogonones in Ophiopogon japonicus extract with a practical technique of mass defect filtering based on high resolution mass spectrometry[J].Journal of chromatography A,2012,1227(5):234-244.
[6] 周跃华,徐德生,冯怡,等.麦冬提取物对小鼠心肌营养血流量的影响[J].中国实验方剂学杂志,2003,9(1):22-24.
[7] 徐德生,冯怡,周跃华,等.麦冬多糖中抗急性心肌缺血活性部位研究[J].中成药,2004,26(10):832-836.
[8] 汤军,钱华,黄琦,等.麦冬多糖平喘和抗过敏作用研究[J].中国现代应用药学杂志,1999,16(2):16-19.
[9] 胡毅坚,朱素燕.不同厂家参麦注射液成分含量比较[J].浙江中医药大学学报,2010,34(4):598-599.
[10]苏彦珍,孙红月,胡奇芬,等.不同工艺路线制备生脉口服液的比较[J].中国中药,1999,24(2):93-95.
[11]岳宝森,薛利华,董力.参麦注射液制备工艺改进研究[J].陕西中医,2007,28(10):1402-1403.
[12]刘雪,杨会芳,李德坤,等.HPLC-ELSD法测定不同产地麦冬及山麦冬中的果糖[J].中成药,2016,38(4):850-853.
[13]于栋伟,李楠,孙燕,等.高效分子排阻色谱-蒸发光散射检测法测定右旋糖酐分子量及其分布[J].苏州大学学报:医学版,2012,32(5):600-602.
[14]彭菲,叶正良,李德坤,等.HPGPC-ELSD法检测注射用益气复脉(冻干)中糖苷类大分子物质[J].中成药,2014,36(5):1098-1100.
StudyonDegradationRuleofPolysaccharidesinRadixOphiopogonisExtractionProcess
ZHANG Luxin1,ZHOUxueqian2,3,LIDekun2,3,ZHOUDazheng2,3,YANGYuewu2,3,YUBoyang1*,JUAichun2,3*
(1.ChinaPharmaceuticalUniversity,Nanjin211198,China;2.TianjinKeyLaboratoryofSafetyEvaluationEnterpriseofTCMInjections,Tianjin300402,China;3.TianjinTaslyPridePharmaceuticalCo.,Ltd.,Tianjin300402,China)
Objective:To study the degradation ofOphiopogonpolysaccharide in extraction process.Methods:The Radix Ophiopogonis polysaccharide obtained by water extraction and ethanol precipitation later was used as the object of the study.After appropriate amount of water was dissolved,ascertain by measuring the molecular weight,total sugar content in the extraction process.So the degradation of Radix Ophiopogonis polysaccharide in extraction process was studied.Results:Radix Ophiopogonis polysaccharide degradation in the extraction occurred,resulting in a smaller molecular weight saccharides.Conclusion:This degradation ofOphiopogonpolysaccharide in extraction process can guide the production of Radix Ophiopogonis extraction process,so as to stabilize the yield ofOphiopogonjaponicus,improve production efficiency.
Radix Ophiopogonis polysaccharide;extraction process;sugar content;degradation
] 余伯阳,教授,研究方向:生药学,Tel:(025)86185287,E-mail:boyangyu@yahoo.com.cn;鞠爱春,高级工程师,研究方向:中药注射剂工艺及质量控制研究,Tel:(022)86342096,E-mail:juach@tasly.com
10.13313/j.issn.1673-4890.2017.7.021
2016-11-13)
*[
