4B级以上D3胚胎囊胚形成影响因素分析
2017-09-20兖娜娜杨菁徐望明龙文谢青贞苏红李风和罗金漆倩容尹太郎
兖娜娜,杨菁,徐望明,龙文,谢青贞,苏红,李风和,罗金,漆倩容,尹太郎
(武汉大学人民医院生殖中心,武汉 430061)
·临床研究·
4B级以上D3胚胎囊胚形成影响因素分析
兖娜娜,杨菁*,徐望明,龙文,谢青贞,苏红,李风和,罗金,漆倩容,尹太郎
(武汉大学人民医院生殖中心,武汉 430061)
目的探究4B级以上D3胚胎形成囊胚的能力差异,以及差异相关的影响因素分析。方法回顾性分析D3胚胎移植/冷冻后有剩余胚胎继续囊胚培养的949个IVF/ICSI-ET周期的临床资料及继续囊胚培养结局,根据继续囊胚培养的D3胚胎质量分为优质组(≥6B,507周期)和非优质组(4B~5B,442周期),比较两组的囊胚形成率、可利用囊胚形成率、优质囊胚形成率及其他临床和实验室影响因素。结果两组间患者基本资料及临床结局无统计学差异(P>0.05);与优质组相比,非优质组的囊胚形成率(31.44% vs.64.33%)、可利用囊胚形成率(20.36% vs.51.76%)、优质囊胚形成率(7.03% vs.25.93%)均显著降低,差异均有统计学意义(P<0.001);且优质组D5优质囊胚形成率显著高于非优质组(55.93% vs.26.36%,P<0.05);优质组D1 0原核(0PN)构成(17.89% vs.9.73%)、≤10%碎片构成(21.69% vs.9.73%)、胚胎不对称性(28.28% vs.14.95%)显著高于非优质组,而非优质组D1 2PN构成(83.87% vs.77.31%)、>20%碎片构成(34.59% vs.8.87%)显著高于优质组,差异均有统计学意义(P<0.001);在优质组中,年龄≤35岁者囊胚形成率、可利用囊胚形成率、优质囊胚形成率均显著高于年龄>35岁者(P<0.001),而非优质组未见年龄组间的统计学差异(P>0.05);与不对称胚胎相比,优质组对称胚胎的囊胚形成率(68.03% vs.54.95%)、可利用囊胚形成率(55.42% vs.42.49%)、优质囊胚形成率(28.98% vs.18.19%)均显著增加,差异均有统计学意义(P<0.001)。结论不同质量的D3胚胎有不同的发育能力,女方年龄、D1 PN构成、D3胚胎碎片率、胚胎不对称性均影响可利用囊胚及优质囊胚的形成,优质胚胎形成囊胚较快(D5),非优质囊胚形成囊胚较晚(D6)。
D3胚胎; 囊胚形成; 优质囊胚形成; 影响因素
(JReprodMed2017,26(9):851-856)
正常妊娠过程中,受精卵于第5天(D5)末或D6初,以胚泡的形式进入子宫内膜,此时的胚泡相当于体外受精卵培养至D5或D6的囊胚。囊胚移植可以提高子宫与胚胎的同步性,在培养过程中使胚胎进行自我选择,因此可以减少移植数目,降低多胎妊娠率,增加活产率[1]。囊胚的形成受多种因素的影响,如女方年龄、卵裂期细胞形态[2]、培养条件[3]等。本研究通过比较卵裂期不同质量的胚胎进行囊胚培养后的囊胚形成率,分析卵裂期胚胎形成囊胚的发育潜能。
资料与方法
一、研究对象
收集2016年3~6月在我院生殖中心行常规体外受精/卵胞浆内单精子注射-胚胎移植(IVF/ICSI-ET)治疗的所有患者。
纳入标准:(1)首次IVF/ICSI-ET治疗周期;(2)新鲜周期除去移植、冷冻的优质胚胎尚有剩余胚胎进行囊胚培养。经患者知情同意后将剩余胚胎转囊胚培养,继续观察并记录囊胚形成情况,有囊胚形成时根据形成囊胚的质量选择冻存或丢弃。
共纳入949个有剩余囊胚培养的治疗周期,根据D3转入囊胚培养的胚胎质量分为优质组(507个周期)和非优质组(442个周期)。
二、治疗方法回顾
1.促排卵治疗方案及受精方式:使用本中心常规促排卵方案[4]。阴道B超监测到3个或以上直径≥18 mm卵泡时,肌肉注射5 000 U~10 000 U HCG(雪兰诺,瑞士),36 h后在阴道B超监测下采卵。根据男方精子质量决定IVF或ICSI受精方式。
2.胚胎质量评估及移植:根据胚胎形态学评估D3胚胎质量:胚胎碎片率≤20%定义为B级,>20%定义为C级。优质胚胎定义为包含6个或以上均匀一致的卵裂球,且胚胎碎片率<20%者(即≥6B);其余为非优质胚胎,包括包含4个或5个大小不一的卵裂球,且胚胎碎片率>20%的胚胎(即4B~5B)。根据患者年龄、内膜情况以及胚胎质量决定是否行新鲜胚胎移植,移植胚胎数目一般为2~3个。行鲜胚移植的患者移植后肌注黄体酮针剂行黄体支持,并口服戊酸雌二醇。移植后12 d查血β-HCG>10 U/L者,于2周后阴道B超监测到孕囊确定为临床妊娠。
3.囊胚培养、分级:经患者知情同意后,将除外移植、冻存的卵裂期胚胎于Quinns AdvantageTM(SAGE,美国)进行囊胚序贯培养至D5/D6,观察并记录囊胚形成情况。
本中心囊胚评价标准[5]:囊胚发育分I~VI期,内细胞团分为A~C级,滋养层细胞分为A~C级。将D5和D6评分>ⅢCC定义为可利用囊胚,≥ⅢBB定义为优质囊胚。
三、评价指标
根据转入囊胚培养的剩余D3胚胎质量分为优质组(≥6B)和非优质组(4B~5B),收集分析两组患者年龄、不育类型、不育年限、内膜厚度、不孕原因、采卵数、D1原核(PN)数、D3胚胎碎片率、D3胚胎对称性、转入囊胚培养的胚胎数及形成的囊胚数。
判断标准、计算方法:囊胚形成率=形成的囊胚数/转入囊胚培养的胚胎数;可利用囊胚形成率=可利用囊胚数/转入囊胚培养的胚胎数;优质囊胚形成率=优质囊胚数/转入囊胚培养的胚胎数。
四、统计学方法
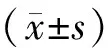
结 果
一、两组患者基本资料
按转入囊胚培养的剩余D3胚胎质量分为优质组和非优质组。优质组包含507个周期,2 896个胚胎转入囊胚培养;非优质组包含442个周期,1 110个胚胎转入囊胚培养。
优质组与非优质组女方年龄、不育类型、不育年限、获卵数、内膜厚度比较均无统计学差异(P>0.05);不育原因包括男性因素、女性因素及不明原因的不育,两组间不育原因构成比无统计学差异(P>0.05)(表1)。
表1 两组患者基本资料 [(-±s),n (%)]
注:*不育原因有重叠的分别计数
二、两组患者D3胚胎实验室指标比较
两组间D1 PN构成比、D3碎片率构成比及胚胎不对称率比较均有统计学差异(P<0.001),优质组0PN构成比(17.89%)显著高于非优质组(9.73%)(P<0.001);优质组碎片率≤10%构成比(21.69%)显著高于非优质组(9.73%),而碎片率>20%构成比(8.87%)显著低于非优质组(34.59)(P<0.001);优质组胚胎不对称率(28.28%)显著高于非优质组(14.95%)(P<0.001)(表2)。

表2 两组患者D3胚胎实验室指标比较 [n (%)]
注:与优质组相比,*P<0.001
三、两组胚胎的囊胚形成情况
优质组共2 896个胚胎转入囊胚培养。囊胚形成率64.33%(1 863/2 896),其中D5形成55.93%,D6形成44.07%;可利用囊胚形成率51.76%(1 499/2 896),其中D5形成65.31%,D6形成34.69%;优质囊胚形成率25.93%(751/2 896),其中D5形成80.29%,D6形成19.71%。
非优质组共1 110个胚胎转入囊胚培养。囊胚形成率31.44%(349/1 110),其中D5形成26.36%,D6形成73.64%;可利用囊胚形成率20.36%(226/1 110),其中D5形成32.74%,D6形成67.26%;优质囊胚形成率7.03%(78/1 110),其中D5形成48.72%,D6形成51.28%。
优质组的囊胚形成率、可利用囊胚形成率、优质囊胚形成率均显著高于非优质组(P<0.001),且D5、D6形成率的构成比均有显著差异(P<0.001),即优质组趋于D5形成囊胚、可利用囊胚及优质囊胚,而非优质组趋于D6形成(表3)。

表3 两组胚胎的囊胚形成情况 [n (%)]
注:与非优质组相比,*P<0.001
四、两组囊胚形成的年龄影响
将优质组与非优质组按女方年龄各分两组:≤35岁组、>35岁组。优质组中≤35岁组与>35岁组相比,囊胚形成率、可利用囊胚形成率及优质囊胚形成率均有统计学差异(P<0.05)。非优质组中两个年龄组间的囊胚形成率、可利用囊胚形成率、优质囊胚形成率均无统计学差异(P>0.05)。优质组与非优质组相比,同一年龄组间囊胚形成率、可利用囊胚形成率、优质囊胚形成率均有显著差异(P<0.05)(表4)。

表4 两组囊胚形成的年龄影响 [n (%)]
注:与优质组年龄>35岁者比较,*P<0.05;与优质组同年龄组比较,#P<0.05
五、胚胎不对称性对囊胚形成的影响
将优质组与非优质组按D3胚胎对称与否各分两组:A组(胚胎对称)、B组(胚胎不对称)。优质组中A组与B组比较,囊胚形成率、可利用囊胚形成率及优质囊胚形成率均有统计学差异(P<0.001)。非优质组中两亚组间的囊胚形成率、可利用囊胚形成率、优质囊胚形成率均无统计学差异(P>0.05)(表5)。
六、两组患者临床结局
优质组507个周期中,共283个移植周期,随访丢失8个,临床妊娠率49.45%(136/275),生化妊娠率6.55%,异位妊娠率4.54%,早期流产率7.14%;非优质组442个周期中,共235个移植周期,随访丢失7个,临床妊娠率45.61%(104/228),生化妊娠率7.02%,异位妊娠率3.33%,早期流产率9.17%。两组临床妊娠率、生化妊娠率、异位妊娠率、早期流产率均无统计学差异(P>0.05)(表6)。
对于鲜胚移植未孕者,由于患者个体差异,其冻胚移植情况及临床结局仍在随访中。

表5 胚胎不对称性对囊胚形成的影响 [n (%)]
注:与优质组B组比较,*P<0.001

表6 两组患者的临床结局比较 [n (%)]
讨 论
囊胚形成受多种因素的影响。随着女性年龄的增高,卵母细胞与胚胎发生染色体异常的概率增大[6]。胚胎染色体异常是妊娠失败的主要原因[7],研究发现许多评分较高的卵裂期胚胎是非整倍体,而整倍体胚胎可表现出较差的形态[8],因此,囊胚培养可使胚胎进一步自我选择,从而提高着床率[9]。本研究纳入了IVF/ICSI-ET周期中有剩余胚胎继续囊胚培养的患者,按照转囊胚培养的D3胚胎质量分为优质组(≥6B)和非优质组(4B~5B),两组患者年龄、不育年限、采卵数、内膜厚度、不育类型、不育原因等均无统计学差异(P>0.05)。而两组剩余胚胎继续培养的囊胚形成差异主要与D1 PN数、卵裂期细胞数、碎片率及胚胎对称性相关。
本研究显示,卵裂期非优质胚胎、优质胚胎继续培养的囊胚形成率、可利用囊胚形成率、优质囊胚形成率均有统计学差异(P<0.05)。这说明随着卵裂速度增加,囊胚形成率、可利用囊胚形成率、优质囊胚形成率将增高。且优质组胚胎趋于D5形成囊胚,非优质胚胎趋于D6形成囊胚,说明发育速度快的胚胎活力更高,其发育成囊胚、优质囊胚的潜能更大。以往研究表明,D3胚胎7~9个细胞时,囊胚形成率最高,这说明卵裂速度过慢或过快都会对囊胚形成产生影响[10]。本研究主要比较卵裂速度增加对囊胚形成率的影响,在以后的研究中可以通过大样本分析,比较本中心继续囊胚培养中不同的卵裂速度对囊胚形成的影响,为囊胚形成的预测提供依据,为患者提供最佳的个体化治疗方案。
有学者应用延时拍摄技术发现胚胎碎片最早从第一次减数分裂开始产生[11],且处于动态变化中。碎片的形成可导致染色体异常,影响囊胚的形成[12]。研究表明,移除碎片可以明显降低Ⅳ期胚胎的凋亡指数,有助于优质囊胚的形成[13]。本研究中非优质组胚胎碎片率较高,并影响囊胚形成。
D3卵裂期胚胎通常用细胞数目、碎片及细胞对称性进行评分。Magdalena[14]综合分析了以往对小鼠胚胎分列模式的研究,发现在小鼠胚胎正常发育的8细胞阶段,卵裂球细胞骨架和细胞表面的成分重排,对称的细胞发生极化,出现顶部和底部,随后16细胞的桑椹胚发生不对称分裂使细胞分别发育成内胚层和外胚层,形成囊胚。本研究中优质组不对称胚胎的囊胚形成率、可利用囊胚形成率及优质囊胚形成率均明显低于对称胚胎(P<0.05),我们推测D3胚胎不对称性的发生可能影响卵裂球细胞骨架的变化趋势和极化,从而影响囊胚的形成;而非优质组不对称胚胎和对称胚胎的囊胚形成率、可利用囊胚形成率及优质囊胚形成率无统计学差异(P>0.05),其原因可能是胚胎发育速度及碎片的产生成为影响囊胚形成的主要因素。
35岁被认为是女性生育力的转折点,随着年龄增加,卵巢卵母细胞的数量和质量都逐渐下降[15]。本研究中,优质组年龄≤35岁的患者周期中,囊胚形成率、可利用囊胚形成率以及优质囊胚形成率略高于年龄>35岁的患者;而非优质组年龄>35岁的患者周期中,囊胚形成率、优质囊胚形成率略高于年龄≤35岁的患者,虽然无统计学差异(P>0.05),仍提示在同一年龄组中,优质组的囊胚形成率、可利用囊胚形成率及优质囊胚形成率均高于非优质组。但年龄>35岁的患者转入囊胚培养的胚胎较少,可能影响囊胚形成结果的比较。
胚胎的卵裂速度及囊胚发育的速度可预测胚胎的着床能力,发育越慢,着床率越低[16-18]。本研究中两组患者的临床结局没有统计学差异(P>0.05),分析原因可能与优质组患者一样,非优质组患者在当周期行胚胎移植时,优先选择优质胚胎,剩余非优质胚胎才转入囊胚培养。
本研究存在一定局限性。优质组与非优质组转入囊胚培养的胚胎数存在差异,这可能影响囊胚形成的比例。综上所述,非优质胚胎仍有发育成囊胚、可利用囊胚及优质囊胚的潜能,但其潜能低于优质胚胎。本研究排除年龄、不育年限、采卵数、内膜厚度、不育类型、不育原因及促排卵方案的差异,分析了卵裂期细胞数、碎片率及胚胎对称性对囊胚形成的影响,结果显示卵裂期胚胎细胞数目、碎片率及胚胎对称性影响可利用囊胚及优质囊胚的形成率。对于没有优质胚胎或优质胚胎少的患者,可考虑选择囊胚培养,以期获得较好的临床结局。
[1] Blake DA,Farquhar CM,Johnson N,et al.Cleavage stage versus blastocyst stage embryo transfer in assisted conception[J/CD].Cochrane Database Syst Rev,2007,(4):CD002118.
[2] Milewski R,Kuc P,Kuczynska A,et al.A predictive model for blastocyst formation based on morphokinetic parameters in time-lapse monitoring of embryo development[J].J Assist Reprod Genet,2015,32:571-579.
[3] De Munck N,Santos-Ribeiro S,Mateizel I,et al.Reduced blastocyst formation in reduced culture volume[J].J Assist Reprod Genet,2015,32:1365-1370.
[4] 余楠,杨菁,赵庆红,等.卵巢低反应患者不同剂量促性腺激素促排卵对体外受精结局的影响[J].中华临床医师杂志(电子版),2012,6:1019-1021.
[5] 尹太郎,夏曦,穆杨,等.体外受精-胚胎移植后生化妊娠的相关危险因素分析[J].医学分子生物学杂志,2014,11:311-317.
[6] Nagaoka SI,Hassold TJ,Hunt PA.Human aneuploidy:mechanisms and new insights into an age-old problem[J].Nat Rev Genet,2012,13:493-504.
[7] Schoolcraft WB,Katz-Jaffe MG.Comprehensive chromosome screening of trophectoderm with vitrification facilitates elective single-embryo transfer for infertile women with advanced maternal age[J].Fertil Steril,2013,100:615-619.
[8] Alfarawati S,Fragouli E,Colls P,et al.The relationship between blastocyst morphology,chromosomal abnormality,and embryo gender[J].Fertil Steril,2011,95:520-524.
[9] Graham J,Han T,Porter R,et al.Day 3 morphology is a poor predictor of blastocyst quality in extended culture[J].Fertil Steril,2000,74:495-497.
[10] Wang F,Kong HJ,Kan QC,et al.Analysis of blastocyst culture of discarded embryos and its significance for establishing human embryonic stem cell lines[J].J Cell Biochem,2012,113:3835-3842.
[11] Mio Y,Maeda K.Time-lapse cinematography of dynamic changes occurring during in vitro development of human embryos[J].Am J Obstet Gynecol,2008,199:660-661.
[12] Munne S,Chen S,Colls P,et al.Maternal age,morphology,development and chromosome abnormalities in over 6000 cleavage-stage embryos[J/OL].Reprod Biomed Online,2007,14:628-634.
[13] Eftekhari-Yazdi P,Valojerdi MR,Ashtiani SK,et al.Effect of fragment removal on blastocyst formation and quality of human embryos[J/OL].Reprod Biomed Online,2006,13:823-832.
[14] Magdalena ZG.Cleavage pattern and emerging asymmetry of the mouse embryo[J].Nat Rev Mol Cell Biol,2005,6:919-928.
[15] Ter Keurst A,Boivin J,Gameiro S.Women's intentions to use fertility preservation to prevent age-related fertility decline[J/OL].Reprod Biomed Online,2016,32:121-131.
[16] 王雪,甄璟然,孙正怡,等.囊胚发育速度对冻融移植结局的影响[J].生殖医学杂志,2014,23:356-360.
[17] 尹太郎,丁锦丽,张怡,等.姐妹胚胎体外形成囊胚的时间、数量与D3胚胎移植结局关系的研究[J].生殖医学杂志,2015,24:639-644.
[18] Barrenetxea G,Lopez DLA,Ganzabal T,et al.Blastocyst culture after repeated failure of cleavage-stage embryo transfers:a comparison of day 5 and day 6 transfers[J].Fertil Steril,2005,83:49-53.
[编辑:罗宏志]
AnalysisofinfluencingfactorsforformingclassIVaboveembryosonDay3
YANNa-na,YANGJing*,XUWang-ming,LONGWen,XIEQing-zhen,SUHong,LIFeng-he,LUOJin,QIQian-rong,YINTai-lang
ReproductiveMedicalCenter,RenminHospitalofWuhanUniversity,WuHan430061
Objective: To analyze the factors affecting the formation of class 4B above embryos on Day 3.
Methods: The clinical data and the outcome of 949 IVF/ICSI-ET cycles in which the remaining embryos continued to be cultured after transferring/freezing Day 3 embryo were analyzed.The cycles were divided into two groups:top quality embryo (≥6B) group (507 cycles) and non-top quality embryo (4B-5B) group (442 cycles) according to the quality of Day3 embryos.The blastulation rate,available blastulation rate,high quality blastulation rate and other clinical and lab factors were compared between the two groups.
Results: There were no significant differences of clinical data and pregnancy outcomes between the two groups (P>0.05).The blastulation rate (31.44% vs.64.33%),available blastulation rate (20.36% vs.51.76%),high quality blastulation rate (7.03% vs.25.93%) in the non-top quality embryo group was significantly lower than that of the top quality embryo group (P<0.001).The rate of blastulation on Day 5 in top quality embryo group (55.93% vs.26.36%) was significantly higher than that in non-top quality embryo group (P<0.05).The constituent ratio of Day1 0PN (17.89% vs.9.73%),fragment≤10% (21.69% vs.9.73%) and embryo asymmetry (28.28% vs.14.95%) in top quality embryo group were significantly higher than that of non-top quality embryo group (P<0.001).And the constituent ratio of D1 2PN (83.87% vs.77.31%),fragment>20% (34.59% vs.8.87%) in non-top quality embryo group were significantly higher than that in top quality embryo group (P<0.001).In the top quality embryo group,the blastulation rate,available blastulation rate,and high quality blastulation rate in ≤35 years group were significantly higher than those in >35 years group (P<0.001),but there were no significant differences in the non-top quality embryo group (P>0.05).In the top quality embryo group,the rate of blastulation (68.03% vs.54.95%),available blastulation (55.42% vs.42.49%),high quality blastulation (28.98% vs.18.19%) in symmetric embryo group was significantly higher than that of asymmetric embryo group (P<0.001).
Conclusions: Different quality D3 embryos have different developmental abilities.Female age,number of D1 PN,D3 fragment rate and embryo symmetry affect the available blastulation rate and high quality blastulation rate.The velocity of blastulation in top quality embryo group (Day 5) was faster than that in non-top quality embryo group (Day 6).
Day3 embryo; Blastulation/blastocyst formation; High quality blastulation; Impact factors
10.3969/j.issn.1004-3845.2017.09.001
2017-01-12;
2017-04-04
国家自然科学基金(81370767,81401276,81571513);湖北省卫生计生委基金项目(WJ2015MA006,WJ2015Q017)
兖娜娜,女,河南周口人,硕士,生殖医学专业.(*
)
