蜜桃酒酿造菌种的筛选
2017-09-20李泽霞王新磊胡铁功王明远
李泽霞,王新磊,胡铁功,王明远
(1.河北衡水老白干酒业股份有限公司,河北衡水053000; 2.河北省白酒酿造工程技术研究中心,河北衡水053000)
蜜桃酒酿造菌种的筛选
李泽霞1,2,王新磊1,2,胡铁功1,2,王明远1,2
(1.河北衡水老白干酒业股份有限公司,河北衡水053000; 2.河北省白酒酿造工程技术研究中心,河北衡水053000)
利用久保蜜桃为原料,采用平板涂布法在其表皮上筛选得到9株酵母菌,分别为HJ2-1、HJ2-2、HJ6-1、HJ6-2、HJ6-3、HJA-1、HJA-2、HJB-1、HJC-1。通过进一步研究这9株酵母的酿造特点、产酒能力及对桃酒理化指标和感官品质的影响,并与葡萄酒高活性干酵母BV818(安琪酵母股份有限公司)进行比较,最终筛选出HJ2-1的发酵产酒能力强,酿造的桃酒酒精度可达13.4%vol,总酸、挥发酸、总糖和干浸出物的含量分别为4.1 g/L、0.24 g/L、1.75 g/L和37.81 g/L;感官特点为微黄透明,桃香怡人,酸甜适口,且稳定性好。该菌株适合大规模生产酿造桃酒。
桃酒; 菌种; 筛选; 发酵; 果酒
在果酒生产中,菌种是发酵的最关键因素,其发酵性能直接影响果酒的质量和产量。同一种原料所用菌种不同,酒质可能有天壤之别[1,11]。良好的发酵菌种具有发酵稳定、产风味物质能力强、不良副产物少等优点[2,12],可通过自然界分离和诱变育种等手段获得[3],另外活性干酵母操作简单、便于保藏[4],选择适宜的干酵母可保证酿造过程中活性干酵母在数量上占相对优势,形成同质性及稳定性的群体[5],有利于发酵过程的控制和稳定果酒的质量,目前在果酒生产中已得到良好的应用[6-8]。基于目前无蜜桃酒专用酿酒酵母现状,本试验从当地盛产的久保蜜桃中筛选得到9株酵母菌,并对这9株酵母的酿造特点和产酒性能进一步筛选,最终获得1株发酵性能优良,产酒质量好的酵母,为蜜桃酒的生产奠定了基础。
1 材料与方法
1.1 材料与试剂
1.1.1 麦芽粉培养基
麦芽粉2%,蛋白胨0.1%,葡萄糖2%,pH6.0。
1.1.2 主要试剂
亚硫酸(分析纯),天津市宏生达化工产品销售有限公司;酸性果胶酶(食品级),郑州瑞佳食品添加剂有限公司;酸性纤维素酶(食品级),郑州瑞佳食品添加剂有限公司。
1.2 仪器与设备
FA1104N分析天平,上海海康电子仪器厂;B4495灭菌锅,上海博讯实业公司;DH系列电热恒温培养箱,天津市泰斯特仪器有限公司;DZKWC恒温水浴锅,北京光明医疗仪器厂;WF-A2000中试榨汁机,浙江省天歌电器有限公司;蒸馏装置,天津市玻璃仪器厂;酒精计,青县计量玻璃仪表厂;WZS 80手持糖度计,上海仪电物理光学仪器有限公司。
1.3 实验方法
1.3.1 菌种筛选[15]
1.3.1.1 初筛
购买当地盛产的久保蜜桃,取桃皮于无菌水中充分振荡,使附着在桃皮上的菌种充分溶于水中。之后将菌液涂布于麦芽粉平板培养基上,以23℃恒温培养24 h,挑取菌落形态不同的菌株进一步分离纯化。
1.3.1.2 复筛
蜜桃酒的酿造流程如下:
蜜桃→洗净擦干→去核,切碎→榨汁→加入亚硫酸、酸性果胶酶、酸性纤维素酶→调酸、调糖→接种→发酵→倒桶→陈酿。
购买熟透完好的久保蜜桃,用刷子将桃毛及泥土清洗干净,用纱布擦干水分。所有用具、用品都用酒精(75%vol)消毒。将蜜桃经机械榨汁后,加入亚硫酸(SO280 mg/L),酸性果胶酶10 mg/L,酸性纤维素酶300 mg/L,静置20 h,柠檬酸调酸至4.0 g/L,白砂糖调糖至23°Bix,按5%接种量接入上述初筛所得菌种,安琪葡萄酒酵母按0.3‰接种,进行桃汁发酵实验[10,13,14]。
1.3.1.3 发酵实验设计
根据首次复筛的结果,挑选香气口味较好的菌株进行二次复筛,针对HJC-1和HJ6-2的口味和发酵特点,进行组合发酵。进一步验证一次复筛结果,最终确定桃酒酿造生产用菌株,实验设计见表1。
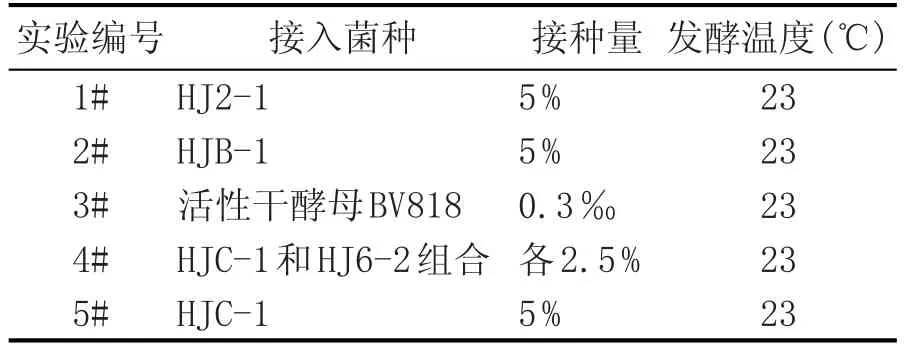
表1 发酵试验设计
发酵结束后,对所得桃酒进行理化分析和感官品评,从感官质量、发酵特性、产酒能力3个方面进行综合评价,选取1株优良的蜜桃酒酿造菌种。
1.3.2 干酵母BV818活化
水(35℃)∶酵母=10∶1,混匀后静置15~25 min,接种即可。
1.3.3 测定方法
酒精度:蒸馏比重法[9];总糖:斐林试剂滴定法[9];总酸及挥发酸:酸碱滴定法[9];干浸出物:密度瓶法[9];感官分析方法:按GB/T 15038—2006《葡萄酒、果酒通用分析方法》进行分析(满分为100分,其中滋味40分,香气30分,外观20分,典型性10分)。
2 结果与分析
2.1 菌种初筛
经分离纯化,得到9株酵母,分别为菌株HJ2-1、HJ2-2、HJ6-1、HJ6-2、HJ6-3、HJA-1、HJA-2、HJB-1、HJC-1。部分菌株形态见图1,其中a、b、c、d分别为HJ2-1、HJ6-1、HJC-1和HJB-1的菌落形态。
2.2 首次复筛
利用上述9株酵母和BV818进行桃汁发酵实验。观察它们的发酵特点,对其发酵所得桃酒进行初步理化分析和感官品评,结果见表2。
由表2可知,从感官特点来看,菌株HJ6-2所酿蜜桃酒香气口味最好,HJ2-1、HJB-1、HJC-1、BV818香气口味较好,而其余菌株较差;从发酵特点来看,HJ6-2发酵缓慢,HJ2-1发酵过程温和,HJB-1发酵较缓慢,HJC-1发酵较快;从产酒能力来看,HJ6-2所得桃酒酒精度最低,HJ2-1、HJB-1、HJC-1和BV818所得桃酒酒精度较高。

表2 不同菌株发酵特点及发酵桃酒理化和感官特点

表3 不同菌种发酵特性
图1 初筛菌株形态
2.3 二次复筛
2.3.1 发酵特性
不同菌种发酵特性见表3。观察各实验组发酵现象,可以看出发酵过程中均经过澄清→浑浊→澄清的过程,但是发酵速率差别较大,2#发酵最慢,起始发酵时间长,经30 d结束发酵,3#发酵最快,仅需10 d发酵结束,1#发酵过程温和利于控制和管理。
2.3.2 理化检测
对发酵所得桃酒进行理化指标的检测,分别测量了酒精度、总酸、挥发酸、总糖和干浸出物含量。检测结果见表4。
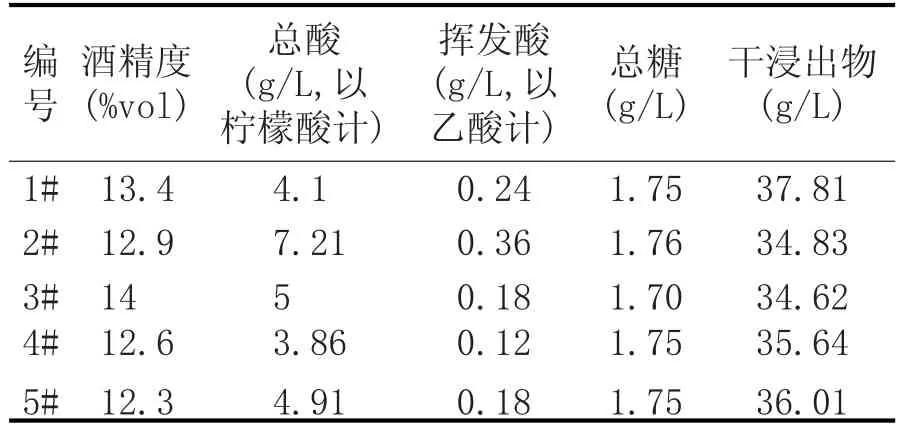
表4 桃酒理化检测结果
由表4可知,所得桃酒酒精度在12.3%vol~14%vol之间,3#活性干酵母发酵所得酒精度最高,1#HJ2-1次之;总糖含量在1.70~1.76 g/L之间,差别不大;干浸出物含量均大于34 g/L;2#总酸和挥发酸都最高,分别达到了7.21 g/L和0.36 g/L;4#总酸和挥发酸均最低,分别为3.86 g/L和0.12 g/L,1#则比较居中。
2.3.3 感官品评
根据GB/T 15038—2006《葡萄酒、果酒通用分析方法》进行感官品评,实行评分的方法对桃酒各项指标进行分析。10名评酒员进行感官品评,取所有评酒员所打分数的平均值,并综合其感官评语。结果见表5。

表5 桃酒感官品评结果
由表5可以得出:从感官品评评分来看,由高到低的顺序为1#>5#>4#>3#>2#;从感官评语来看,1#菌株产酒质量最好。
综合上述发酵特性、理化指标及感官品评结果,选取1#实验菌种HJ2-1用于蜜桃酒发酵。
3 结论
通过初筛、首次复筛、二次复筛,根据菌株产酒质量、产酒能力、菌株的发酵特性、产酒的理化指标,可以看出,1#菌株所产酒质量最好,产酒能力较强,发酵特性温和利于控制和管理,HJ2-1菌株最适合规模化生产酿造桃酒。其发酵特点为:加入菌种后12 h开始发酵,20 d发酵结束。所得桃酒感官特点为:微黄透明,桃香怡人,微酸、微甜,爽口,留香持久。
经过筛选,得到了1株适宜酿造生产桃酒的菌种,为蜜桃酒的酿造生产奠定了基础。
[1]罗安伟,刘兴华,寇莉苹,等.猕猴桃酒用酵母的选育研究[J].中国食品学报,2005,5(3):57-60.
[2]安冬梅,张艳萍.果酒加工工艺的研究进展[J].安徽农业科学,2007,35(19):5859-5860.
[3]何义,林杨,张伟,等.果酒研究进展[J].酿酒科技,2006 (4):91-95.
[4]傅金泉.活性干酵母在酿酒工业的应用[J].中国酿造, 1992(3):7-13.
[5]樊玺,李新榜,郭永亮.活性干酵母与葡萄酒香气[J].中外葡萄与葡萄酒,2002(5):10-11.
[6]王天陆.荔枝果酒酿造工艺研究[J].中国酿造,2008(12):107-109.
[7]张斌,曾新安,陈勇,等.添加复合氨基酸对荔枝酒发酵进程的影响[J].酿酒科技,2008(3):23-25.
[8]郑静.菠萝果酒酿造工艺的研究[J].酿酒,2006,33(5):105-107.
[9]食品工业标准汇编:饮料酒卷[M].北京:中国标准出版社,2001.
[10]DAVIDOVIĆ S M,VELJOVIĆ M S,PANTELIĆ M M, et al.Physicochemical,antioxidant and sensory properties of peach wine made from redhaven cultivar [J].Journal of agricultural and food chemistry,2013, 61:1357-1363.
[11]陈亮,危晴,辛秀兰,等.不同酵母发酵对猕猴桃果酒香气成分的影响[J].食品研究与开发,2015,36(5):100-106.
[12]黎星辰,唐敏,曹琳,等.不同酿酒酵母对猕猴桃酒理化性质、抗氧化能力及感官的影响[J].食品科技,2016,41 (6):16-20.
[13]刘琨毅,王琪,辜义洪,等.二氧化硫在猕猴桃酒中应用效果研究[J].酿酒,2016,43(6):84-87.
[14]刘琨毅,辜义洪,吴冬梅,等.果胶酶在猕猴桃酒中的应用研究[J].酿酒科技,2015(3):69-71.
[15]蒋锡龙,魏彦锋,孙玉霞,等.桃果酒酿酒酵母选育及酿造条件研究[J].食品工业科技,2013,19:156-160.
[16]潘肇仪,周礼红,高燕燕,等.自然发酵生姜猕猴桃酒醅中酵母菌区系分析[J].酿酒科技,2014(4):45-48.
Screening of a Yeast Strain for Peach Wine Production
LI Zexia1,2,WANG Xinlei1,2,HU Tiegong1,2and WANG Mingyuan1,2
(1.Hengshui Laobaigan Liquor Co.Ltd.,Hengshui,Hebei 053000;2.Hebei Liquor-making Engineering Research Center,Hengshui,Hebei 053000,China)
Okubo peach was used as raw material.9 yeast strains were collected from its skin including HJ2-1,HJ2-2,HJ6-1,HJ6-2, HJ6-3,HJA-1,HJA-2,HJB-1 and HJC-1 by the method of plate coating.Through the study on the fermenting characteristics and wine-producing capability of the 9 strains and their effects on physiochemical indexes and sensory quality of peach wine,and the comparison of the 9 strains with high-active dry yeast BV818 from Angel Yeast Co.Ltd.,yeast strain HJ2-1 was finally screened out. Alcohol content in peach wine produced by yeast strain HJ2-1 reached up to 13.4%vol,and the content of total acids,volatile acid, total sugar and dry extract were 4.1 g/L,0.24 g/L,1.75 g/L and 37.81 g/L,respectively.The produced wine was yellowish transparent with enjoyable peach smell and good taste and stability.Such strain was suitable for large-scale production of peach wine.
peach wine;yeast strain;screen;fermentation;fruit wine
TS262.7;TS261.1;TS261.4
A
1001-9286(2017)09-0044-04
10.13746/j.njkj.2017134
2017-05-17
李泽霞(1968-),女,正高级工程师,中国首席白酒品评师,国务院特殊津贴专家,工程硕士校外导师。
优先数字出版时间:2017-06-26;地址:http://kns.cnki.net/kcms/detail/52.1051.TS.20170626.1438.008.html。
