一种神经元轴突变性的量化分析方法
2017-09-20李利生杨斯雷石京山
李利生,陆 阳,杨斯雷,石京山
(1.遵义医学院基础药理教育部重点实验室及特色民族药国际合作联合实验室,贵州 遵义 563099;2.上海交通大学医学院药学系 化学教研室,上海 200025;3.奥林巴斯(中国)有限公司,北京 100015)
技术与方法
一种神经元轴突变性的量化分析方法
李利生1,陆 阳2,杨斯雷3,石京山1
(1.遵义医学院基础药理教育部重点实验室及特色民族药国际合作联合实验室,贵州 遵义 563099;2.上海交通大学医学院药学系 化学教研室,上海 200025;3.奥林巴斯(中国)有限公司,北京 100015)
目的建立一种神经元轴突变性的量化分析方法。方法采用Aβ25-35(10-7、10-6、10-5mol/L)诱导的大鼠原代海马神经元轴突变性模型,经神经元特异性标记蛋白β Ⅲ Tubulin免疫荧光染色获得神经元形态学荧光图像。荧光图像经二维消卷积和二元化处理,将荧光标记的神经元区域转变为黑色并测量其面积,即为神经元总面积。应用ImageJ软件的颗粒分析功能测量轴突变性产生的片段和颗粒面积,并计算其占神经元总面积的百分比,即可获得神经元轴突变性的量化数据,命名为变性指数(degeneration index,DI)。Western blot测定突触后致密蛋白95(postsynaptic density 95,PSD95)和突触素( synaptophysin,SYN)蛋白变化。Pearson法分析DI与PSD95、SYN变化的相关性。结果免疫荧光染色结果显示Aβ25-35可诱导海马神经元轴突变性,DI显著高于对照组并呈剂量依赖性,PSD95和SYN蛋白水平显著降低,与DI变化呈显著正相关。结论本方法可获得准确的神经元轴突变性的量化数据。
神经元;轴突变性;Aβ25-35;变性指数;免疫荧光;消卷积
神经元轴突的功能是将神经冲动通过突触传递到另一个神经元或所支配的细胞上,轴突结构和功能的完整性是神经系统功能的基础。轴突变性是中枢神经系统退行性疾病、外伤、感染、神经系统免疫性疾病的常见形态学表现,是神经系统疾病病理变化的基本特征之一[1],表现为神经元形态改变、线粒体膜电位丢失、轴突转运功能受损、ATP生成减少、钙内流增加、神经丝降解和微管断裂等[2]。在体外实验研究中,常采用贫营养、Aβ、缺氧等措施复制神经元轴突损伤模型。尽管导致轴突变性的原因甚至机制不尽相同,但形态学改变基本一致,表现为轴突断裂、颗粒化,呈念珠样,甚至降解消失并累及胞体[3],通过相差显微成像、银染、免疫组织化学等方法能够清晰地反应变性的轴突的形态改变,也是判断轴突变性的金指标[4],但对轴突变性程度的定量分析尚缺乏准确、快捷、客观的方法,本文详细介绍一种轴突变性的量化分析方法以供同行参考。
1 材料
1.1 动物 SD大鼠,10只,雄雌各半,10 周龄,体重200~250 g。第三军医大学大坪医院动物中心提供,动物生产许可证号:SCXK(渝)2012-0005,用于交配繁殖,出生24 h的健康乳鼠用于实验。SPF级屏障环境饲养,实验动物使用许可证号:SYXK(黔)2014-003。
1.2 药品、试剂及主要仪器设备 Aβ25-35购自美国Sigma公司 (分子式: C45H81N13O14S;分子量:1060.27;纯度: ≥ 97%;产品编号:A4559)。总蛋白提取试剂盒购自北京普利莱基因技术有限公司(产品编号:P1250),Mouse Anti-GAPDH antibody、HRP标记山羊抗兔IgG 、HRP标记山羊抗小鼠IgG 、DAPI和 BCA蛋白定量试剂盒购自上海碧云天生物科技有限公司(产品编号分别为:AG019、A0208、A0216、C1005、P0010),Rabbit polyclonal Anti-postsynaptic density 95(PSD95)antibody(美国Abcam,产品编号:ab18258),Rabbit polyclonal Anti-Synaptophysin(SYN) antibody (美国Abcam,产品编号:ab32594),Mouse monoclonal Anti-beta III Tubulin antibody (美国Abcam,产品编号:ab14545) ,Goat Anti-Mouse IgG H&L (Alexa Fluor®488) secondary antibody (美国Abcam,产品编号:ab150113),ECL免疫印迹化学发光试剂为上海七海生物科技有限公司产品(产品编号:E003-050)。活细胞工作站(日本Olympus公司),CellSens Dimension生命科学图像处理软件 (Version 510,日本Olympus公司),ImageJ(1.44P,美国NIH)。
2 方法
2.1 海马原代神经元培养 SD乳鼠经75%酒精全身皮肤消毒,断头取脑,分离双侧海马,剥离血管及脑膜,置于预冷(4 ℃)的D-hanks液中,剪碎,胰蛋白酶(0.125%)消化(室温)5 min,期间轻柔吹打,400目滤网过滤,180 g离心10 min,DMEM/F12(含10%马血清、10%胎牛血清、1%双抗)培养基重悬并计数。玻片经多聚赖氨酸包被后置于24孔板中,将细胞悬液接种于24孔板于37 ℃,5% CO2环境下爬片培养,细胞密度为105个/孔。2 h后将培养基更换为Neurobasal medium (含2% B27),每48 h换液,培养至第7天即可用于实验。
2.2 复制神经元轴突损伤模型 Aβ25-35溶于双蒸水,并置于37 ℃连续孵育7 d,诱导其形成聚集态,储备液浓度为10-3mol/L。取形态和密度理想的神经元,更换新鲜的培养基并加入聚集态的Aβ25-35,终浓度分别为10-5、10-6、10-7mol/L,继续培养48 h,诱导神经元轴突变性模型。
2.3 轴突变性量化分析方法
2.3.1 免疫荧光法标记神经元 选用神经元特异性标志蛋白β III Tubulin抗体经免疫荧光对海马神经元进行标记[5]。具体方法概述如下:爬片培养的神经元经4%多聚甲醛室温固定20 min,PBS清洗后加入0.3% Triton-X100,室温孵育10 min,PBS清洗后加入山羊血清室温封闭30 min,弃山羊血清后直接滴加Anti-β III Tubulin antibody(1∶1 000)4 °C孵育过夜,PBS清洗后滴加Anti-Mouse IgG H&L (Alexa Fluor®488)荧光二抗,37 ℃避光30 min,PBS清洗后DAPI标记细胞核。荧光显微镜观察并拍照。
2.3.2 消卷积处理 使用CellSens生命科学图像处理软件对2.3.1中获得原始图像进行消卷积处理,具体方法如下:(1)如图1所示,将图像转换为多通道、8位/通道模式。(2)校准图像:采用“交互式校准”模式,并根据比例尺“设置参照距离”,见图2。(3)验证通道参数:调用“生命科学应用”工具中的“验证消卷积通道参数”对话框,进行参数设置。发射波长:根据所选荧光染料确定;球差:物镜经过球差校正者数值为0。 数值孔径:所选物镜的数值孔径标注在物镜侧面。 折射率:根据拍摄图片所使用物镜的介质选择。设置完成后点击“确定”,见图3。(4)消卷积处理:调用“生命科学应用”工具中的“二维消卷积”工具,进行参数设置。应用于:如果是多维图像(时间、多层、多通道),根据实际需要选择处理对象。设置:①算法,二维CI消卷积:更真实反应出原始图像上的荧光强度差异。二维去光晕:更好的反应出荧光表达的位置。本研究分析的目的是计算染色部位的面积,因此使用二维去光晕。②模态,荧光图像选择宽场。 其他方法拍摄的图像选明场。③迭代,数值大小可改变将二维消卷积滤镜应用至图像,通常使用默认值1。④平滑因子,用于处理使用二维消卷积滤镜后得到的图像,减少因背景过高产生的颗粒感。可根据图像效果调整,所有图像须统一该参数。 ⑤平铺重叠:此功能会自动应用。设置完成后点击“确定”,即可生成消卷积处理图像,见图4。(5)将图像转换为灰度、8位/通道模式。
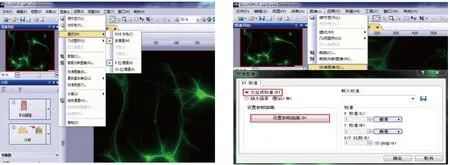
图1 原始图像模式转换为多通道、8位/通道模式 图2 采用交互式校准模式校准图像
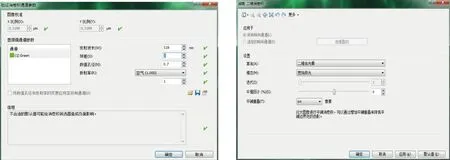
图3 验证消卷积通道参数设置界面 图4 二维消卷积设置界面
2.3.3 测量轴突总面积 使用Image J软件打开上述消卷积处理后的图片,进行“二元化”处理,即将图像上的像素点的灰度值设置为0或255,使图像非黑即白,使荧光着色区域转变为黑色。设定阈值为255即全部黑色区域被选定,测量选定区域面积,即为神经元总面积。
2.3.4 测量变性的轴突面积 使用Image J软件打开上述“二元化”处理后的图片,调用“Analyze particles”工具,设置待测颗粒大小范围,输入数值应为像素的二次方,该项设置对测量结果具有重要影响,需根据所有样本神经元的轴突变性情况进行调整,且所有样本必须采用统一数值范围测量。设定阈值为0,测量选定区域面积,即为变性的轴突面积。
2.3.5 计算轴突变性指数(degeneration index,DI) 计算变性的轴突面积与神经元总面积的比值,即为DI。
2.4 Western blot检测PSD95和SYN蛋白量 收集经Aβ25-35处理的神经元,使用总蛋白提取试剂盒提取总蛋白,热变性(95 ℃,10 min)后经BCA蛋白定量试剂盒测定蛋白含量,统一上样量为20 μg蛋白/泳道,用12% SDS-聚丙烯酰胺凝胶电泳分离蛋白质并转至PVDF膜,5%脱脂奶粉封闭2 h,Mouse Anti-GAPDH antibody(1∶1 000)、Rabbit polyclonal Anti- PSD95 antibody(1∶1 000)或Rabbit polyclonal Anti- SYN antibody(1∶1 000)孵育过夜(4 ℃)。二抗(羊抗兔,1∶1 000;兔抗小鼠,1∶1 000)室温下孵育2 h,ECL发光液孵育2 min,经凝胶成像系统曝光成像,经Image J软件测定条带灰度值,计算目的蛋白与GAPDH条带灰度值之比,即为目的蛋白的相对表达量。
3 结果
3.1 原代海马神经元鉴定 如图5所示,神经元培养1周时可见神经元胞体呈梨形和圆球形,树突短而粗,轴突细而长,末端分支较多,胞核呈圆形,位于细胞中央,为典型的神经元形态学特征。神经元特异性标记蛋白β III Tubulin免疫荧光染色发现着色区域与明场所示的细胞区域基本一致,DAPI标记的细胞核与β III Tubulin阳性细胞胞体重叠率达95%,表明细胞为高纯度的原代海马神经元。
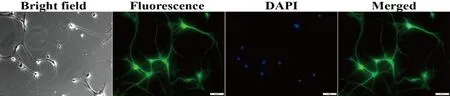
图5 原代海马神经元鉴定(×200,比例尺:50 μm)
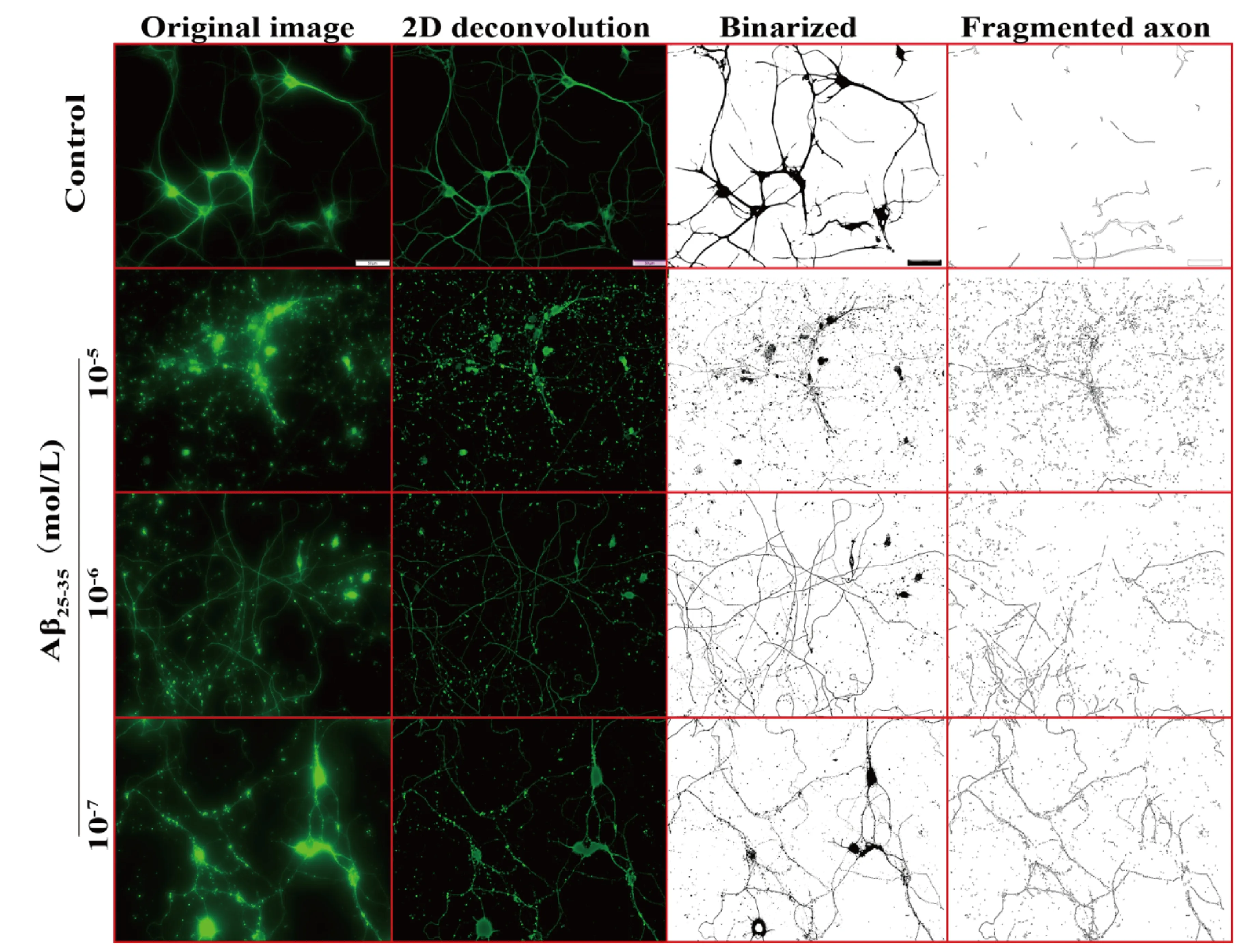
图6 轴突变性量化分析中各处理措施获得的代表性图像(×200,比例尺:50 μm)
3.2 轴突变性量化分析结果 在荧光显微术中,来自焦平面上方或下方区域的漫射光会导致过度曝光、畸变和模糊,如图6所示,由于漫射光使神经元原始图像轮廓模糊、边界不清,无法准确测量荧光区域的面积。经二维消卷积处理后,光晕被消除,图像更加锐利,神经元边界更加清晰,荧光表达的位置更加精确。随后,二元化处理将图像待测区域全部转变为黑色,即荧光区域全部转变为黑色。ImageJ软件的颗粒分析功能可根据设定的颗粒大小圈定待测区域即为变性的轴突面积。Aβ25-35(10-7、10-6、10-5mol/L)作用48 h使轴突断裂、颗粒化,在10-7mol/L剂量时,轴突呈念珠样改变,但轴突的分布走向仍清晰可见,胞体完整。随着Aβ25-35剂量增加,神经元胞体逐渐消失、轴突完全颗粒化,神经元形态无法辨认。量化结果显示,Aβ25-35各剂量组DI均显著高于对照组,且呈剂量依赖性(见图7)。DI变化趋势与形态学显示的轴突变性的严重程度一致。
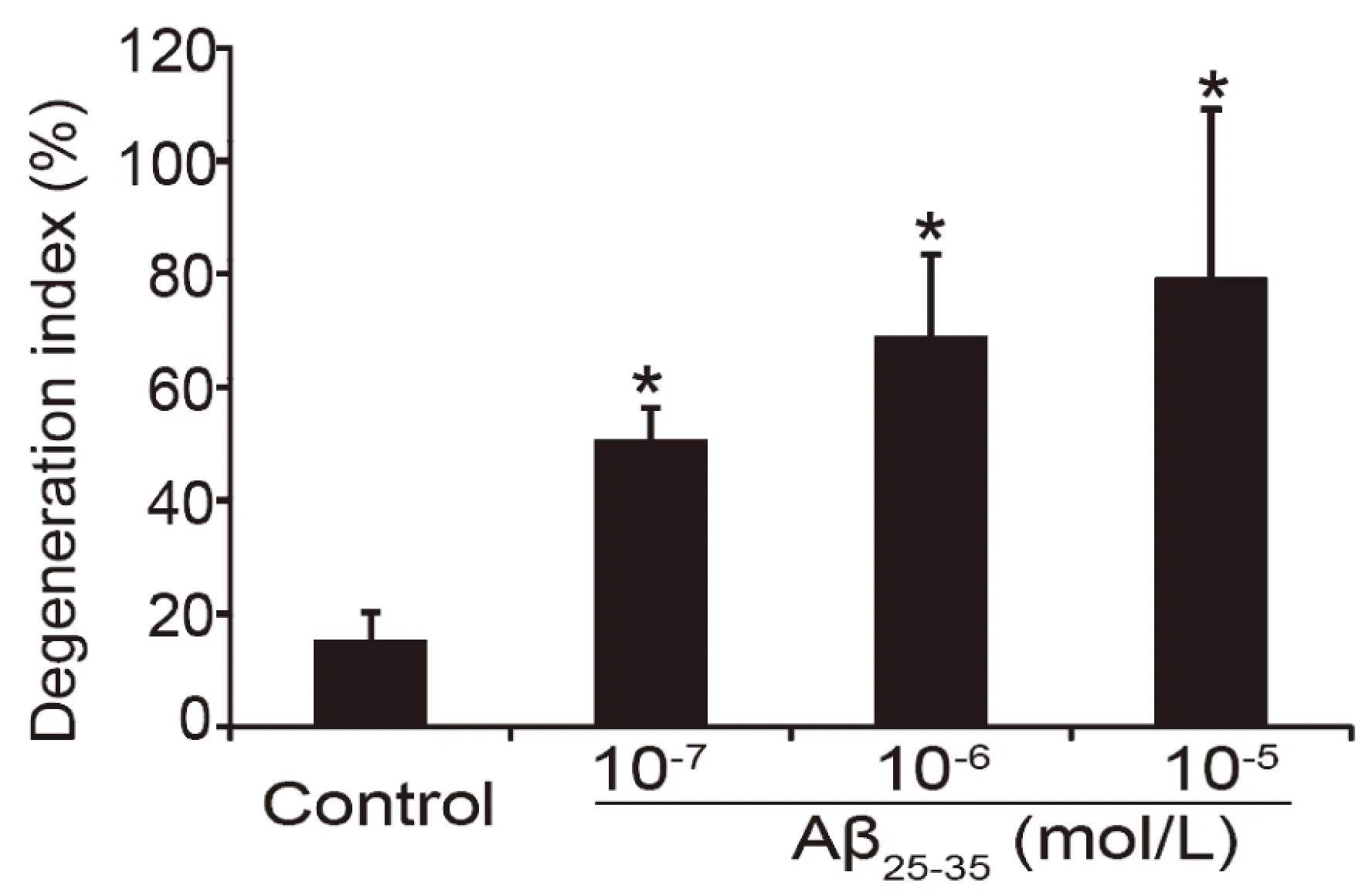
与对照组比较,*P<0.05。 图7 Aβ25-35致海马神经元轴突损伤量化分析统计图
3.3 DI与PSD95及SYN蛋白量相关性分析 Aβ25-35处理组神经元PSD95蛋白量显著降低(P<0.05),且呈现明显的剂量依赖性,SYN蛋白量与PDS95变化一致(见图8)。如表1所示,在Aβ25-35所致的海马神经元轴突损伤模型中,DI与PSD95及SYN蛋白量的变化成显著正相关。
表1 DI与PSD95及SYN蛋白量相关性分析
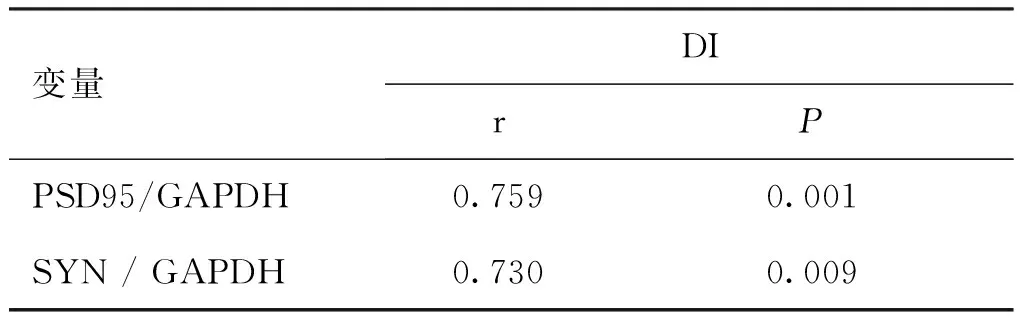
变量DIrPPSD95/GAPDH0.7590.001SYN/GAPDH0.7300.009
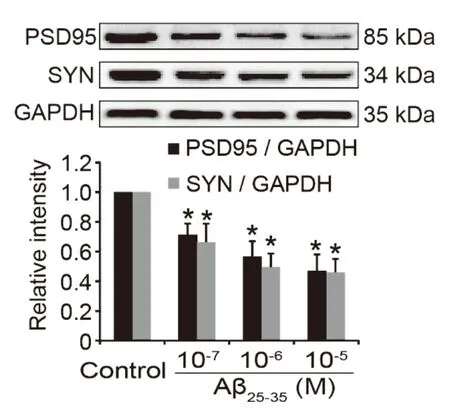
与对照组比较,*P<0.05。 图8 Aβ25-35对海马神经元PSD95和SYN蛋白量的影响
4 讨论
神经元属不可再生细胞,尽管在胚胎或新生儿阶段,中枢神经系统神经元轴突损伤后可再生修复,但发育成熟后由于神经元的再生能力降低和所处环境的抑制,轴突再生困难,特别是当轴突变性波及胞体时,临床治疗更加棘手[6]。因此,研究轴突变性的发生机制及促进再生的治疗措施具有重要的临床意义。
体外培养的原代神经元轴突变性模型被广泛用于轴突变性相关疾病的研究。神经元轴突变性定性方法较多,常采用不同的染色方法如H&E染色、Nissl染色[7]、银染[8]等结合显微成像技术判断是否存在轴突变性并对其严重程度作出主观判断,H&E染色和相差显微成像技术为非神经元特异性方法,无法排除体外培养的细胞中少数非神经元细胞的影响。选择神经元的特异性标记物作为抗原,经免疫荧光染色不仅可以清晰的显示神经元轴突变性情况,而且可以排除培养体系中非神经元细胞的影响[9]。在神经元轴突变性定量分析方面,有报道通过计算轴突变性细胞率、测量轴突长度及分支数量、利用相差显微拍摄技术获得的图像计算DI等定量分析方法[5,9],这些方法均存在较大的缺陷,如轴突变性细胞率不能反映单个细胞轴突变性的程度、神经元密度较大时无法分辨轴突的归属和起止点等。我们结合文献并改进了轴突变性的量化分析方法,该方法具有以下优点:首先,选用神经元特异性标记物对神经元进行荧光标记,既可以清晰的显示轴突变性的形态学改变,又可以提高后续量化分析的特异性,排除非神经元的影响。其次,不必确认变性轴突的归属及轴突的长度,对培养体系中神经元密度的要求不高;再次,采用二维消卷积图像处理技术去除荧光着色区的漫射光,使神经元着色区域边界更加清晰,便于精确测量区域面积。最后,采用ImageJ图像处理软件面积测定功能和颗粒分析功能,实现全自动获取神经元总面积和颗粒化的轴突面积,可避免手动测量的主观因素影响。
PSD95是突触后致密区的骨架蛋白,可锚定膜受体、调节黏附分子、离子通道和谷氨酸受体的定位,参与突触形成和经突触的信号传递[10]。SYN是一种位于突触囊泡膜上的钙结合蛋白,与突触的结构和功能密切相关,是突触发生的标志[11]。当神经元受损时SYN和PSD95表达均明显下降[12]。本实验发现在Aβ25-35所致的海马神经元轴突损伤模型, PSD95和SYN蛋白水平明显降低,且与DI改变呈显著正相关,表明本文介绍的轴突损伤量化分析方法结果是准确的。
总之,本文介绍的轴突变性定量分析方法将免疫荧光染色与CellSens Dimension生命科学图像处理软件、ImageJ图像处理软件相结合,具有免疫荧光的特异性,图像处理软件全自动获取原始数据具有客观性和准确性等优点。
[1] Fang W,Gao G,Zhao H,et al.Role of the Akt/GSK-3β/CRMP-2 pathway in axon degeneration of dopaminergic neurons resulting from MPP+ toxicity [J].Brain Res,2015,1602:9-19.
[2] Neukomm L J,Freeman M R.Diverse cellular and molecular modes of axon degeneration [J].Trends Cell Biol,2014,24(9):515-523.
[3] Lingor P,Koch J C,Tonges L,et al.Axonal degeneration as a therapeutic target in the CNS [J].Cell Tissue Res,2012,349(1):289-311.
[4] 王振宇.中枢神经损伤后轴突变性的研究进展[J].中华神经创伤外科电子杂志,2015,1(1):49-52.
[5] Nikolaev A,McLaughlin T,O Leary D D M,et al.APP binds DR6 to trigger axon pruning and neuron death via distinct caspases [J].Nature,2009,457(7232):981-989.
[6] Apara A,Goldberg J L.Molecular mechanisms of the suppression of axon regeneration by KLF transcription factors [J].Neural Regen Res,2014,9(15):1418-1421.
[7] Adams J H,Doyle D,Ford I,et al.Diffuse axonal injury in head injury:definition,diagnosis and grading [J].Histopathology,1989,15(1):49-59.
[8] Thompson K J,Harley C M,Barthel G M,et al.Plasmon resonance and the imaging of metal-impregnated neurons with the laser scanning confocal microscope [J].eLife,2015,4:1-14.
[9] Alobuia W M,Xia W,Vohra B P S.Axon degeneration is key component of neuronal death in amyloid-β toxicity[J].Neurochemistry International,2013,63(8):782-789.
[10]Savioz A,Leuba G,Vallet P G.A framework to understand the variations of PSD-95 expression in brain aging and in Alzheimer's disease [J].Ageing Res Rev,2014,18:86-94.
[11]余萍萍,王莉,唐凡人,等.白藜芦醇对大鼠脑缺血再灌注损伤后突触素表达的影响[J].解剖学报,2016,47(1):12-17.
[12]金凤,金海,吴芹,等.淫羊藿苷对Aβ25-35诱导的阿尔采末病大鼠海马突触素和突触后密度蛋白95表达的影响[J].中国新药与临床杂志,2014,33 (5):394-398.
(编辑:谭秀荣)
A quantitative analysis method of axonal degeneration
Li Lisheng1,Lu Yang2,Yang Silei3,Shi Jingshan1
(1.Key Laboratory of Basic Pharmacology of Ministry of Education and Joint International Research Laboratory of Ethnomedicine of Ministry of Education,Zunyi Medical University,Zunyi Guizhou 563099,China; 2.Department of Chemistry,Basic Medical Faculty,Shanghai Jiao Tong University School of Medicine,Shanghai,200025,China; 3.OLYMPUS (China) Co.,Ltd.,Beijing 100015,China)
ObjectiveTo establish a quantitative analysis method for axonal degeneration of neurons.MethodsThe axonal degeneration of the primary hippocampus neurons isolated from the neonatal rat was induced by Aβ25-35(10-7,10-6,10-5mol/L).The profile of neurons was visualized by immunofluorescence staining using mouse monoclonal anti-beta III tubulin antibody.The fluorescence image was manipulated by the two dimensional deconvolution and binarization transformation such that pixel intensity of regions corresponding to neurons were converted to black and all the other regions were converted to white .The total number of black pixel was measured as the total neurons area.The particle analyzer module of ImageJ software was used to count the area of the small fragments or particles.The percentage of area of the small fragments or particles in total neurons area was calculated,which was named degeneration index (DI).Western blot was employed to determine the protein levels of postsynaptic density protein 95 (PSD95) and synaptophysin (SYN).Correlation analysis of DI with PSD95 and SYN were executed by Pearson.ResultsThe results of immunofluorescence staining showed that Aβ25-35treatment led to the significant axonal degeneration of the hippocampus neurons,significantly increased DI with a dose-dependence manner and obviously reduced the protein levels of PSD95 and SYN.There was a significant positive correlation between DI and PSD95 and SYN protein levels.ConclusionThis method can be used to obtain accurate quantitative data of axonal degeneration.
neuron; axonal degeneration; Aβ25-35; degeneration index; immunofluorescence; deconvolution
国家自然科学基金资助项目(NO:81473201);贵州省教育厅 “125”重大科技专项(NO:2012012)。
石京山,男,博士,教授,博士生导师,研究方向:神经药理学,E-mail:shijs@zmc.edu.cn。
Q189
A
1000-2715(2017)04-0440-06
[收稿2017-05-16;修回2017-06-12]
