涎腺腺样囊性癌中HIF-1α和BCL-2的表达及意义
2017-09-19鲍合刚王岳君金问森
鲍合刚,肖 亮,孟 刚,王岳君,王 芬,金问森
涎腺腺样囊性癌中HIF-1α和BCL-2的表达及意义
鲍合刚1,肖 亮1,孟 刚2,王岳君3,王 芬1,金问森1
目的分析涎腺腺样囊性癌(salivary adenoid cystic carcinoma, SACC)中HIF-1α和BCL-2的表达水平,探讨两者之间表达的相关性及与临床病理特征的关系。方法采用免疫组化SP法检测56例SACC中HIF-1α和BCL-2的表达,并分析两者的相关性。结果SACC中HIF-1α的阳性率为64.3%,其表达水平与肿瘤TNM分期及来源腺体呈明显相关(P<0.05)。SACC中BCL-2的阳性率为98.2%,其表达水平与HIF-1α呈正相关(P<0.05),且HIF-1α与肿瘤TNM分期之间的相关性依赖于BCL-2的强表达(P<0.05)。结论高表达的HIF-1α和BCL-2可能影响SACC的分期。
涎腺肿瘤;腺样囊性癌;HIF-1α;BCL-2;免疫组织化学
涎腺腺样囊性癌(salivary adenoid cystic carcinoma, SACC)是发生于唾液腺的恶性肿瘤,具有生长缓慢、易复发、早期可出现远处转移等特点,占头颈部恶性肿瘤的3%~5%[1]。在绝大多数的实体肿瘤内存在缺氧微环境,缺氧诱导因子-1α(hypoxia inducible factor-1α, HIF-1α)可在缺氧状态下稳定表达,与HIF-1β结合后,促进下游100种以上的基因转录,其中包括多种与糖酵解和抗凋亡等相关的基因,从而加速肿瘤组织的转移和血管生长,并对治疗产生抵抗作用[2]。有文献报道[3-5],在肺癌、乳腺癌和膀胱癌等多种肿瘤组织中HIF-1α有稳定表达,且其表达水平与患者的预后呈负相关。目前,HIF-1α在SACC中的表达以及与临床病理特征的关系仍存在较大的争议。本实验采用免疫组化SP法检测56例SACC中HIF-1α、BCL-2的表达,探讨两者的相关性及其意义。
1 材料与方法
1.1临床资料收集安徽医科大学第一附属医院病理科2004~2014年存档的SACC患者手术切除标本56例,其中男性16例,女性40例,年龄16~74岁,中位年龄48岁,其他病理特点及临床分期详见表1。
1.2试剂与方法免疫组化采用SP法染色,兔抗人HIF-1α单克隆抗体、兔抗人BCL-2单克隆抗体、SP试剂盒及DAB显色试剂盒,均购自北京中杉金桥公司。实验步骤:石蜡组织块经4 μm厚连续切片,依次脱蜡、水化,柠檬酸盐缓冲液(pH 6.0)高压5 min修复抗原,冷却至室温后,3%过氧化氢浸泡10 min。免疫组化操作步骤严格按试剂盒说明书进行,HIF-1α和BCL-2一抗浓度分别为1 ∶100和1 ∶200,阴性对照以PBS代替一抗。
1.3结果判定以半定量积分法进行阳性结果判断[6]。染色强度评分:无着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。200倍镜下每张切片随机取10个视野,每个视野计数100个细胞,按阳性细胞百分比计分:<10%为1分,10%~50%为2分,51%~80%为3分,>80%为4分。半定量免疫反应积分(immunoreactive score, IRS)为染色强度与阳性细胞百分比的乘积:0~2分为无表达,3~4分为弱表达,6~8分为中表达,9~12分为强表达。
1.4统计学分析采用SPSS 19.0软件进行统计学处理,HIF-1α、BCL-2表达与临床病理特征的相关性采用非参数的Mann-WhitneyU检验和Kruskal-Wallis检验进行分析,通过线性回归分析HIF-1α和BCL-2之间的相关性。另外,以BCL-2表达水平进行分层,采用Wilcoxon检验分析BCL-2的不同表达对HIF-1α与SACC临床病理特征的相关性影响。P<0.05为差异有统计学意义。
2 结果
2.1组织学特征56例SACC依据肿瘤病理亚型分为:筛状型25例(44.6%)、管状型22例(39.3%)和实体型9例(16.1%),发生于小腺体35例(62.5%)、大腺体21例(37.5%),肿瘤无包膜形成,呈浸润性生长。管状型由内侧的立方状细胞和外侧的梭形细胞构成散在或相互吻合的小管构成。实体型主要为椭圆形呈肌上皮细胞分化的肿瘤细胞围成实性细胞巢或宽带状结构。筛状型为最常见的典型结构,由形态单一的梭形细胞组成的细胞巢或条索环绕的多个假囊腔样筛孔呈同心圆排列,似藕的断面,筛孔大小不等,其间散在由立方状细胞组成的小管状结构。
图1HIF-1α在SACC中的表达,SP法:A.弱表达(管状型),B.中等表达(管状型),C.强表达(筛状型)图2BCL-2在SACC中的表达,SP法: A.弱表达(实体型),B.中等表达(管状型),C.强表达(管状型)
2.2HIF-1α、BCL-2在SACC中的表达HIF-1α在SACC中的表达主要定位于胞质和胞核中,呈棕黄色或深棕色颗粒,癌旁正常的腺体组织则未被染色,阳性率为64.3%(36例),其中HIF-1α弱表达为15例(26.8%),中表达为9例(16.1%),强表达为12例(21.4%)(图1)。BCL-2在SACC中的表达主要定位于胞质和胞膜中,呈棕黄色或深棕色颗粒,癌旁正常的腺体组织则未被染色,阳性率为98.2%(55例),其中弱表达为2例(3.6%),中表达为9例(16.1%),强表达为44例(78.6%)(图2)。
2.3HIF-1α和BCL-2与SACC临床病理特征的关系HIF-1α的表达与SACC的临床分期(TNM分期)、来源的腺体呈显著相关,与患者性别、年龄、神经侵犯以及肿瘤病理亚型无关(表1)。BCL-2的表达与SACC临床病理特征无关(表1),但与HIF-1α的表达水平存在显著相关(图3)。

图3 HIF-1α和BCL-2的相关性
散点代表同一标本HIF-1α和BCL-2的IRS,两种蛋白表达的IRS呈显著相关(β=0.236,P<0.05),回归方程:Y=0.36+0.48X(r=0.33,P=0.013)
2.4BCL-2、HIF-1α表达的相关性采用Wilcoxon检验BCL-2表达水平分层,分析BCL-2对HIF-1α和临床分期相关性的影响。结果显示,在BCL-2强表达的SACC中,HIF-1α与临床分期具有明显相关性(Z=2.43,P<0.05);而在非强表达BCL-2的肿瘤患者标本中,HIF-1α与临床分期无显著相关性(Z=0.33,P>0.05)。
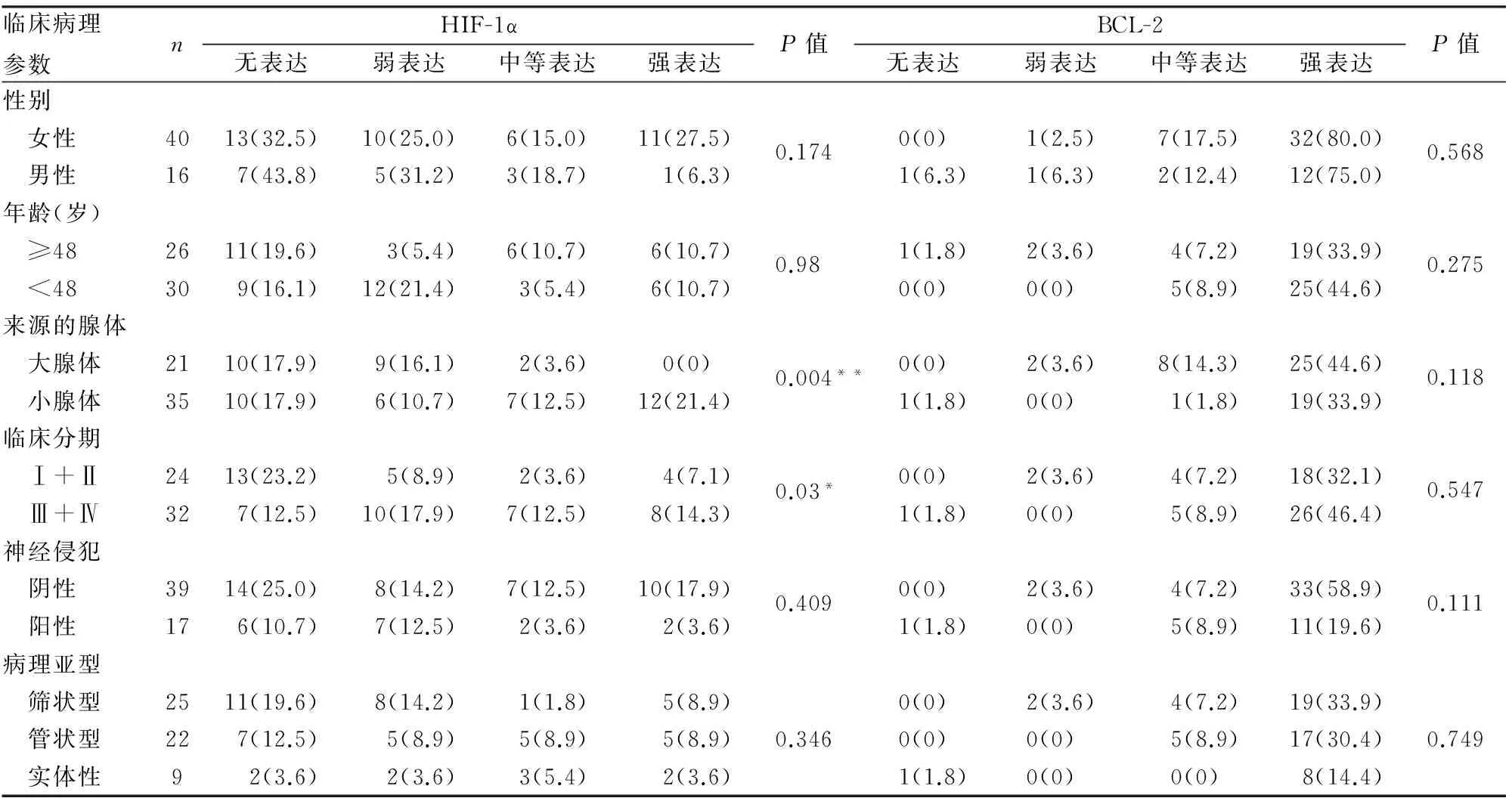
表1 HIF-1α和BCL-2的表达与SACC临床病理特征的关系[n(%)]
**P<0.01,*P<0.05
3 讨论
有文献报道[7-8],SACC好发于女性且发病年龄跨度较大,形成神经侵犯的比例为20%~80%,发生于小腺体多见。本组收集病例符合SACC的上述特点,具有一定的代表性。
在实体肿瘤中,由于肿瘤组织的快速生长,常会在外周富血氧区域和中央坏死区之间形成O2浓度<5%的缺氧细胞层,这些细胞对放、化疗具有明显的抵抗作用,是肿瘤复发、再生长的重要来源,其中HIF-1α的稳定表达是缺氧细胞产生治疗抵抗作用的重要因素之一[9]。研究表明,实体肿瘤组织中HIF-1α的表达水平与肿瘤的恶性程度、疗效以及患者的预后密切相关[10]。然而,SACC中是否存在HIF-1α的稳定表达,以及与临床病理特征间的相关性,文献报道尚存在较大差异。早期文献报道[11],HIF-1α在涎腺肿瘤中表达缺失,2012年Costa等[12]在26例SACC的样本中,发现肿瘤病理标本均表达HIF-1α,但HIF-1α的表达水平与肿瘤的范围、转移以及复发无关。Wang等[13]报道HIF-1α可激活内皮生长因子受体信号途径,促进肿瘤新生血管的产生,进而导致SACC的增殖与生长。本组64.3%的病例表达HIF-1α,且HIF-1α的表达水平与临床分期密切相关,提示SACC中HIF-1α的表达具有一定的普遍性,同时,由于临床分期与肿瘤患者的预后紧密相关[14],HIF-1α的表达水平可能会影响患者的预后,这也与Chen等[15]的报道结果一致。值得注意的是,本组来源于小腺体的SACC具有更高的HIF-1α表达水平。Ko等[16-17]发现,发生于小腺体的SACC患者往往预后较差且复发率较高,本组结果则部分解释该现象的发生机制。目前关于小唾液腺来源的肿瘤组织中HIF-1α 表达变化的分子机制,需要进一步分析。
BCL-2是著名的抗凋亡蛋白,在肿瘤放射生物学领域中,BCL-2蛋白高表达可导致肿瘤对放疗产生抵抗作用[18],并且在缺氧状态下HIF-1α可调节BCL-2的表达[19]。Al-Rawi等[20]报道在几乎所有的涎腺恶性肿瘤中均存在BCL-2高表达,其中以SACC中BCL-2表达水平最高。本组98.2%的病例中存在BCL-2表达,其中BCL-2强表达的样本为78.6%,其表达水平与HIF-1α呈正相关,该相关性在其他实体肿瘤组织中也曾有过报道,如肾细胞瘤、嗅神经母细胞瘤等[6,21]。体外实验结果显示,下调HIF-1α表达水平可降低BCL-2蛋白水平, HIF-1α表达升高则促进BCL-2蛋白的累积[22]。本组进一步分析显示,HIF-1α对SACC临床分期的影响依赖于BCL-2的表达水平,仅在强表达BCL-2的肿瘤中,HIF-1α的表达对临床分期产生影响;反之HIF-1α的表达水平与临床分期则不具有相关性,提示通过HIF-1α介导的BCL-2高表达,可能导致SACC的预后较差,也部分解释该肿瘤具有放疗抵抗性且复发率较高的原因[23]。
[1] Dubal P M, Unsal A A, Chung S Y,etal. Population-based trends in outcomes in adenoid cystic carcinoma of the oral cavity[J]. Am J Otolaryngol, 2016,37(5):398-406.
[2] Jin W S, Kong Z L, Shen Z F,etal. Regulation of hypoxia inducible factor-1α expression by the alteration of redox status in HepG2 cells[J]. J Exp Clin Cancer Res, 2011,30:61.
[3] Wang Q, Hu D F, Rui Y,etal. Prognosis value of HIF-1α expression in patients with non-small cell lung cancer[J]. Gene, 2014,541(2):69-74.
[4] 周炳娟,孙吉瑞,赵文明,等. 乳腺癌分子亚型中HIF-1α和Glut-1表达及其与基底细胞样型乳腺癌的关系[J]. 临床与实验病理学杂志, 2015,31(9):991-995.
[5] Hunter B A, Eustace A, Irlam J J,etal. Expression of hypoxia- inducible factor-1α predicts benefit from hypoxia modification in invasive bladder cancer[J]. Br J Cancer, 2014,111(3):437-443.
[6] Sadlecki P, Bodnar M, Grabiec M,etal. The role of Hypoxia-inducible factor-1 α, glucose transporter-1, (GLUT-1) and carbon anhydrase IX in endometrial cancer patients[J]. Biomed Res Int, 2014,2014:616850.
[7] Dillon P M, Chakraborty S, Moskaluk C A,etal. Adenoid cystic carcinoma: a review of recent advances, molecular targets, and clinical trials[J]. Head Neck, 2016,38(4):620-627.
[8] Amit M, Binenbaum Y, Trejo-Leider L,etal. International collaborative validation of intraneural invasion as a prognostic marker in adenoid cystic carcinoma of the head and neck[J]. Head Neck, 2015,37(7):1038-1045.
[9] Kummar S, Raffeld M, Juwara L,etal. Multihistology, target-driven pilot trial of oral topotecan as an inhibitor of hypoxia-inducible factor-1α in advanced solid tumors[J]. Clin Cancer Res, 2011,17(15):5123-5131.
[10] 陈俊林,赵 驰. 肝细胞癌中RHAMM和HIF-1α的表达及临床意义[J]. 临床与实验病理学杂志, 2014,30(11):1297-1298.
[11] Wijffels K I, Hoogsteen I J, Lok J,etal. No detectable hypoxia in malignant salivary gland tumors: preliminary results[J]. Int J Radiat Oncol Biol Phys, 2009,73(5):1319-1325.
[12] Costa A F, Tasso M G, Mariano F V,etal. Levels and patterns of expression of hypoxia-inducible factor-1α, vascular endothelial growth factor, glucose transporter-1 and CD105 in adenoid cystic carcinomas with high-grade transformation[J]. Histopathology, 2012,60(5):816-825.
[13] Wang W M, Zhao Z L, Zhang W F,etal. Role of hypoxia-inducible factor-1α and CD146 in epidermal growth factor receptor-mediated angiogenesis in salivary gland adenoid cystic carcinoma[J]. Mol Med Rep, 2015,12(3):3432-3438.
[14] Wittekind C. The development of the TNM classification of gastric cancer[J]. Pathol Int, 2015,65(8):399-403.
[15] Chen Z, Wu H, Huang S,etal. Expression of BNIP3 and its correlations to hypoxia-induced autophagy and clinicopathological features in salivary adenoid cystic carcinoma[J]. Cancer Biomark, 2015,15(4):467-475.
[16] Ko Y H, Lee M A, Hong Y S,etal. Prognostic factors affecting the clinical outcome of adenoid cystic carcinoma of the head and neck[J]. Jpn J Clin Oncol, 2007,37(11):805-811.
[17] Shum J W, Chatzistefanou I, Qaisi M,etal. Adenoid cystic carcinoma of the minor salivary glands: a retrospective series of 29 cases and review of the literature[J]. Oral Surg Oral Med Oral Pathol Oral Radiol, 2016,121(3):210-214.
[18] Liu D, Balkin E R, Jia F,etal. Targeted antisense radiotherapy and dose fractionation using a (177) Lu-labeled anti-BCL-2 peptide nucleic acid-peptide conjugate[J]. Nucl Med Biol, 2015, 42(9):704-710.
[19] Sun Y, Xing X, Liu Q,etal. Hypoxia-induced autophagy reduces radiosensitivity by the HIF-1α/miR-210/BCL-2 pathway in colon cancer cells[J]. Int J Oncol, 2015,46(2):750-756.
[20] Al-Rawi N H, Omer H, Al Kawas S. Immunohistochemical analysis of P(53) and BCL-2 in benign and malignant salivary glands tumors[J]. J Oral Pathol Med, 2010,39(1):48-55.
[21] Diensthuber M, Potinius M, Rodt T,etal. Expression of BCL-2 is associated with microvessel density in olfactory neuroblastoma[J]. J Neurooncol, 2008,89(2):131-139.
[22] Liu L, Ning X, Sun L,etal. Hypoxia-inducible factor-1 alpha contributes to hypoxia-induced chemoresistance in gastric cancer[J]. Cancer Sci, 2008,99(1):121-128.
[23] Schulz-Ertner D, Nikoghosyan A, Didinger B,etal. Therapy strategies for locally advanced adenoid cystic carcinomas using modern radiation therapy techniques[J]. Cancer, 2005,104(2):338-344.
ExpressionofHIF-1αandBCL-2insalivaryadenoidcysticcarcinomaanditsclinicalsignificance
BAO He-gang1, XIAO Liang1, MENG Gang2, WANG Yue-jun3, WANG Feng1, JIN Wen-sen1
(1Teaching&ResearchSectionofNuclearMedicine,AnhuiMedicalUniversity,Hefei230032,China;2DepartmentofPathology,theFirstAffiliatedHospitalofAnhuiMedicalUniversity,Hefei230022,China;3DepartmentofPathology,theFourthAffiliatedHospitalofAnhuiMedicalUniversity,Hefei230001,China)
PurposeTo investigate the relationship of HIF-1α, BCL-2 and clinicopathological features in salivary adenoid cystic carcinoma by detecting the levels of two proteins.MethodsImmunohistochemical of SP staining assay was used
to detect the level of HIF-1α and BCL-2 expression in fifty-six section from primary resection of salivary adenoid cystic carcinoma. Furthermore, the correlation between the expressions of two proteins with clinical data was evaluated through differently statistical analysis.ResultsThirty-six samples (64.3%) were found to express HIF-1α. The level of HIF-1α was significantly correlated with TNM stage of tumors and the primary site of salivary adenoid cystic carcinoma (P<0.05). Positive BCL-2 expression was detected in fifty-five cases (98.2%). The level of HIF-1α was positively correlated with that of BCL-2 (P<0.05) and the significant correlation between HIF-1α and TNM stage was dependent upon the strong expression of BCL-2 (P<0.05).ConclusionIt is therefore indicated that the expression of HIF-1α and BCL-2 may influence the clinical stage of salivary adenoid cystic carcinoma.
salivary neoplasm; adenoid cystic carcinoma; HIF-1α; BCL-2; immunohistochemistry
时间:2017-7-18 11:51 网络出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20170718.1151.005.html
国家自然科学基金(U1432124)
1安徽医科大学核医学教研室,合肥 2300322安徽医科大学第一附属医院病理科,合肥 2300223安徽医科大学第四附属医院病理科,合肥 230001
鲍合刚,男,硕士研究生。E-mail: 281611117@qq.com 金问森,男,硕士生导师,教授,通讯作者。E-mail: wensenjn@126.com
R 739.8
:A
:1001-7399(2017)07-0728-05
10.13315/j.cnki.cjcep.2017.07.005
接受日期:2017-05-23
