TNF-α和IL-10基因多态性及其血浆浓度与弥漫大B细胞淋巴瘤的关系
2017-09-19邹红云石雨薇
沈 艳,顾 霞,富 玲,邹红云,石雨薇
·论 著·
TNF-α和IL-10基因多态性及其血浆浓度与弥漫大B细胞淋巴瘤的关系
沈 艳1,顾 霞2,富 玲3,邹红云4,石雨薇5
目的探讨TNF-α和IL-10基因单核苷酸多态性(single nucleotide polymorphisms, SNPs)、血浆浓度与弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma, DLBCL)三者之间的关系。方法采用SNaPshot SNP分型技术检测38例DLBCL患者及77例健康对照者TNF-α和IL-10基因6个位点SNPs,并应用酶联免疫吸附法(enzyme-linked immunosorbent assay, ELISA)测定血浆TNF-α和IL-10浓度。结果DLBCL组血浆IL-10水平明显高于对照组(P<0.05),TNF-α水平在两组间差异无明显相关性(P>0.05)。在8个候选的SNPs位点中,TNF-α-863C/A多态性分布在DLBCL组和对照组间差异有显著性,其中CA/AA基因型携带者罹患DLBCL的风险为CC基因型的2.280倍(95%CI=1.091~4.765,P=0.028),其余7个SNPs多态性分布在两组间差异均无显著性(P>0.05)。在排除患病状况对血浆TNF-α和IL-10水平的影响后,各基因多态性对其相应血浆浓度均无明显影响(P>0.05)。结论TNF-α-863C/A位点多态性与DLBCL易感性有关,IL-10可能在DLBCL发生、发展中起重要作用。
:弥漫大B细胞淋巴瘤;TNF-α;IL-10;单核苷酸多态性;酶联免疫吸附法
细胞因子是一类由活化的淋巴细胞或相关基质细胞分泌的小分子蛋白,具有多种生物学功能,在炎症及免疫反应等方面发挥重要调控作用。近年研究发现多种免疫相关细胞因子及其基因多态性与淋巴瘤发生及预后有关。弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma, DLBCL)是非霍奇金淋巴瘤(non-Hodgkin lymphoma, NHL)最常见亚型,占30%~40%;在组织形态学、免疫表型、遗传学及临床特征上具有高度的异质性[1],其发病机制目前尚不清楚。本文着重探讨细胞因子TNF-α和IL-10基因多态性、血浆浓度与DLBCL之间的相关性及临床意义,以提高认识水平。
1 材料与方法
1.1材料收集新疆医科大学第一、二附属医院2010年1月~2011年12月经病理确诊的 DLBCL患者38例,参照WHO(2008)淋巴组织肿瘤分类标准诊断,根据霍奇金淋巴瘤Ann Arbor分期系统进行分期。对照组为同期健康体检者77例。所有分析对象近半年内未服用过免疫调节剂和激素类药物。
1.2试剂TNF-α和IL-10试剂盒(上海蓝基公司),引物、溴化乙啶、溴酚兰(上海生工公司),DNA提取试剂盒(德国Qiagen公司),PCR反应缓冲液、MgCl2、dNTP、Hotstar TaqDNA聚合酶、SNaPshot Multiplex Kit、5X Sequencing Buffer等(美国ABI公司),PCR Marker(美国NEB公司),HotStarTaq(德国Qiagen公司);主要仪器包括PCR仪及自动测序仪(美国ABI 3130XL)。
1.3方法
1.3.1标本 收集所有病例并抽取外周静脉血5 mL,采用EDTA抗凝,分离血浆,含有单个核细胞的下层成分用DNA抽提试剂盒提取基因组DNA,分装后均于-80 ℃保存。
1.3.2血浆TNF-α和IL-10浓度检测 采用酶联免疫吸附法(enzyme-linked immunosorbent assay, ELISA)法,具体操作严格按试剂盒说明书进行。
1.3.3SNPs检测 采用SNaPshot SNP分析法进行分析。引物序列TNF-α-308G/A和TNF-238G/A:正向5′-TTCTGAAGCCCCTCCCAGTTCT-3′,反向5′-GTTGGGGACACACAAGCATCAA-3′;TNF-α-857C/T:正向5′-GGGGAGATGTGACCACAGCAA-3′,反向5′-ACTC CCTGGGGCCCTCTACAT-3′;TNF-α-863C/A:正向5′-GGGGAAGCAAAGGAGAAGCTGA-3′,反向5′-GC CCTCTACATGGCCCTGTCTT-3′;IL-10-819T/C和IL-10-592A/C:正向5′-TGGTGTACCCTTGTACAGGTGA TG-3′,反向5′-TTTTACTTTCCAGAGACTGGCTTCC-3′;IL-10-1082A/G:正向5′-CCGGTCCTTCCCCAGG TAGA-3′,反向5′-CCATGGAGGCTGGATAGGAGGT-3′;IL-10-3575T/A:正向5′-ATTTTGGAGCAGGGAT GGAAGA-3′,反向5′-GTGAGAAGGCAGGCACCTAT GG-3′。循环条件:95 ℃预变性2 min;94 ℃ 20 s,65~0.5 ℃循环40 s,72 ℃ 90 s,11个循环;94 ℃ 20 s,59 ℃ 30 s,72 ℃ 90 s,24个循环;72 ℃延伸120 s。PCR产物经纯化后参照“ABI PRISM SNaPshot Multipelx”试剂盒说明进行延伸反应,延伸产物经纯化后经ABI 3130XL测序仪进行测序分析。收集的原始数据用GeneMapper 4.0(美国Applied Bio systems)分析。
1.4统计学处理所有数据采用SPSS 17.0软件进行统计学处理。Hardy-Weinberg平衡采用χ2或Fisher精确四表格检验;组间TNF-α和IL-10浓度比较采用方差分析和t检验;SNPs与DLBCL发病风险评估采用非条件逻辑回归分析,分别对患者年龄和种族进行校正;基因型和患病状况(有无患病)对细胞因子浓度的影响用一般线性模型分析。P<0.05为差异有统计学意义。
2 结果
2.1临床特点DLBCL组汉族(23例)、维族(5例)、哈族(3例),年龄32~81岁,平均55.2岁,其中男性19例,女性12例;临床分期:Ⅰ期为2例,Ⅱ期为6例,Ⅲ期为10例,Ⅳ为20例。对照组汉族(54例)、维族(21例)、哈族(2例),年龄20~77岁,平均43.8岁,其中男性42例,女性35例。
2.2细胞因子浓度的组间比较DLBCL组血浆IL-10水平明显高于对照组,差异有统计学意义(P<0.05),而DLBCL组和对照组间血浆TNF-α浓度差异无统计学意义(P>0.05,表1)。
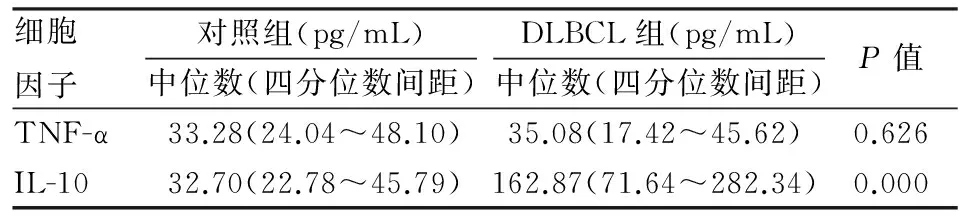
表1 DLBCL组和健康对照组血浆TNF-α和IL-10浓度比较
2.3SNPs与DLBCL的易患性经SNaPshot SNP分析数据,结果显示各基因多态性位点的基因型在本组人群中的分布经检验符合Hardy-Weinberg遗传平衡规律(P>0.05),确认分析样本均达到遗传平衡的群体,具有群体代表性。在8个候选的SNPs中,TNF-α-863C/A多态性分布在DLBCL组和对照组间差异有显著性,其中CA/AA基因型的发病风险是CC基因型的2.280倍(95%CI=1.091~4.765,P=0.028),其余7个SNPs多态性分布在两组间差异均无显著性(P>0.05,表2,图1、2)。
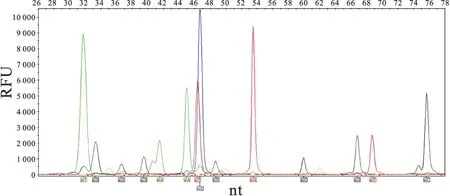
图1 SNaPshot电泳峰型图
橙色峰为SIZE STANDARD,蓝色、绿色、红色、黑色峰分别代表延伸加入ddGTP、ddATP、ddTTP和ddCTP的延伸产物,峰下面标注的为等位基因;若延伸引物是正向的,等位基因则跟延伸加入的碱基一致;若延伸引物是反向的,则跟延伸加入的碱基互补
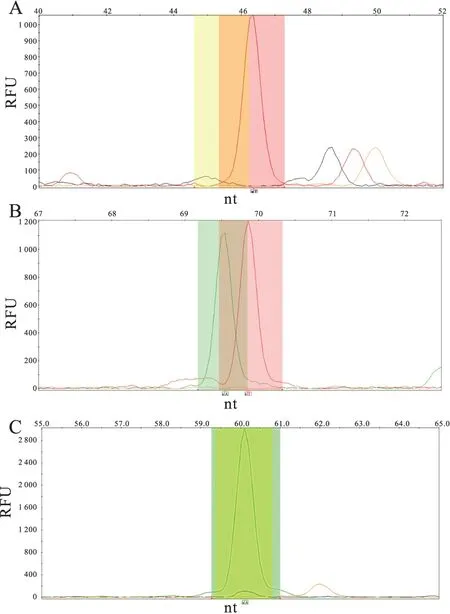
图2 单位点分型图
A.单一红色主峰,代表TT基因型,B.绿色和红色主峰各一个,代表A/T基因型,C.单一绿色主峰,代表AA基因型
2.4基因型和患病状况对细胞因子浓度的影响患病状况对IL-10水平影响显著,而对TNF-α水平影响较小;在排除患病状况对血浆TNF-α和IL-10水平的影响后,各基因多态性对其相应血浆浓度影响较小(P>0.05,表3)。
3 讨论
TNF-α和IL-10是具有广泛生物学效应的细胞因子,在淋巴细胞生长、分化和成熟中发挥重要作用[2-3],其合成受遗传因素(基因多态性)影响。近年TNF-α和IL-10与NHL的关系引起国内外学者们越来越多的关注,包括基因多态性与NHL或一些亚型的发病风险或预后的相关性以及血浆细胞因子水平与NHL发生、发展的关系等。实验由于受检测方法、地域和种族等因素的影响,分析结果尚缺乏一致性。
IL-10由正常B淋巴细胞、肿瘤性B淋巴细胞、单核巨噬细胞等多种细胞分泌[4],能够抑制IL-2和INF-γ的分泌及Th1细胞的活性,使肿瘤细胞逃避机体免疫杀伤,促进肿瘤细胞增殖和播散。本组发现DLBCL组血浆IL-10水平明显增高,与对照组相比差异具有统计学意义,该结果与相关文献报道一致[5-6],进一步证实IL-10与DLBCL发生、发展过程相关。此外,已有报道证实IL-10高表达与DLBCL化疗耐药及不良预后有关[7-8],对临床具有重要指导意义。TNF-α主要由巨噬细胞和淋巴瘤细胞分泌,是调节炎症反应和免疫功能的关键因子,对肿瘤细胞具有促进和抑制双重作用[9]。本组DLBCL中TNF-α虽有增高趋势,但与健康对照组差异无统计学意义,与国内一些文献报道不符,如杨巍巍等[10-11]研究数据显示DLBCL患者血浆TNF-α水平较正常人群显著升高。国外有关血浆TNF-α水平与NHL关系方面的报道较多,但结论亦存在明显不同。如Purdue等[6,12]的2项研究均显示NHL患者血浆TNF-α水平显著增高,且TNF-α高表达人群易患性风险显著升高,两者间呈正相关关系;Conroy等[13]报道TNF-α水平在DLBCL患者无明显增高,两者之间无相关性;Saberi等[14]报道则证实B细胞NHL患者血浆TNF-α水平显著低于正常人群,且TNF-α高水平组罹患淋巴瘤的风险显著降低,即两者呈负相关关系。Gu等[15]通过对大样本量人群进行血浆细胞因子水平检测及其后NHL发病情况的随访发现,高水平TNF-α与NHL发病风险有关,但该相关性因随访时间变长会被削弱,对于抽血取样后随访周期大于5年罹患NHL的病例,两者间无统计学意义。我们认为血浆TNF-α水平与NHL(包括DLBCL)相关性受分析者样本量大小及发病时间长短等因素影响较大,两者之间的关系尚需进一步验证。虽然DLBCL患者血浆中TNF-α水平未见明显增高,但我们前期研究显示它在DLBCL组织中呈高表达[16],推测TNF-α主要通过自分泌和旁分泌在肿瘤局部发挥作用,包括以自分泌方式作用于肿瘤细胞自身和以旁分泌方式影响肿瘤微环境等。

表2 TNF-α和IL-10基因多态性与DLBCL发病风险的相关性
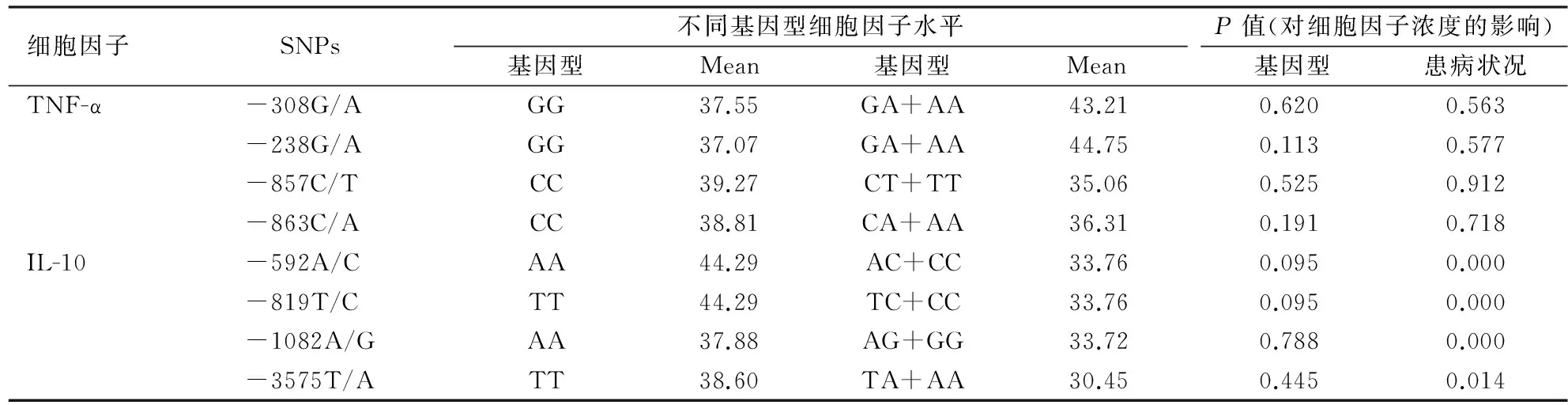
表3 TNF-α和IL-10基因SNPs对相应血浆细胞因子浓度的影响
基因变异如SNPs能够影响NHL患病风险及预后[17-18],且对具有恶性血液系统肿瘤家族史成员影响尤为显著,可使其罹患NHL的风险增高2~3倍[19],提示遗传因素在NHL发病中起重要作用。近年,已有文献报道TNF-α和IL-10基因变异与NHL(包括DLBCL)发病风险有关,可能的机制是这些变异影响基因的表达,进而影响人类对疾病的易感性。但也有部分报道显示它们对NHL发病无明显影响,可能该影响作用因不同人种而不同[20]。本实验显示TNF-α和IL-10的8个SNPs中,仅TNF-α-863C/A与DLBCL发病有关,其中CA/AA基因型的发病风险是CC基因型的2.280倍,而其他SNPs包括研究较多的几个位点如TNF-α-308G/A、IL-10-1082A/G和IL-10-3575T/A与DLBCL发病均无明显相关性。同时,本实验发现各SNPs对其相应细胞因子血浆浓度均无明显影响,推测DLBCL患者IL-10水平增高为复杂的细胞因子网络相互作用及调控结果。
综上所述,TNF-α-863C/A多态性与DLBCL易患性有关;血浆TNF-α水平在患者中无明显增高,提示其可能主要在局部发挥作用,参与肿瘤发生、发展。IL-10在DLBCL患者血浆中显著增高,与肿瘤发生、发展关系密切,可辅助用于病情监测和预后判断。由于本组样本量偏小,需加大样本量或联合多中心分析对实验结果进一步论证。
[1] Swerdlow S, Campo E, Harris H L,etal. WHO classification of tumours of haematopoietic and lymphoid tissues[M]. 4th ed. Lyon: IARC Press, 2008:233-237.
[2] Webb L V, Ley S C, Seddon B. TNF activation of NF-κB is essential for development of single-positive thymocytes[J]. J Exp Med, 2016,213(8):1399-1407.
[3] Kim H S, Lee J H, Han H D,etal. Autocrine stimulation of IL-10 is critical to the enrichment of IL-10-producing CD40hiCD5+ regulatory B cellsinvitroandinvivo[J]. BMB Rep, 2015,48(1):54-59.
[4] Saraiva M, O’Garra A. The regulation of IL-10 production by immune cells[J]. Nat Rev Immunol, 2010,10(3):170-181.
[5] Charbonneau B, Maurer M J, Ansell S M,etal. Pretreatment circulating serum cytokines associated with follicular and diffuse large B-cell lymphoma: a clinic-based case-control study[J]. Cytokine, 2012,60(3):882-889.
[6] Purdue M P, Lan Q, Bagni R,etal. Prediagnostic serum levels of cytokines and other immune markers and risk of non-hodgkin lymphoma[J]. Cancer Res, 2011,71(14):4898-4907.
[7] Lech-Maranda E, Bienvenu J, Broussais-Guillaumot F,etal. Plasma TNF-alpha and IL-10 level-based prognostic model predicts outcome of patients with diffuse large B-Cell lymphoma in different risk groups defined by the International Prognostic Index[J]. Arch Immunol Ther Exp (Warsz ), 2010,58(2):131-141.
[8] 许晓强,张巧花,侯淑玲,等. 弥漫大B细胞淋巴瘤化疗耐药与细胞因子白细胞介素-6、-10水平的相关性[J]. 白血病·淋巴瘤, 2010,19(10):604-606.
[9] Balkwill F. Tumor necrosis factor and cancer[J]. Nat Rev Cancer, 2009,9(5):361-371.
[10] 杨巍巍. 不同类型淋巴瘤患者肿瘤坏死因子的表达意义[J]. 齐齐哈尔医学院学报, 2013,34(4):529-530.
[11] 王思力,方志鸿,黄 耘,等. 肿瘤坏死因子α在不同类型淋巴瘤患者中的表达及其临床预后意义[J]. 中华血液学杂志, 2014,35(12):1107-1110.
[12] Purdue M P, Lan Q, Bagni R,etal. Pre-diagnostic serum levels of cytokines and other immune markers and risk of non-Hodgkin lymphoma[J]. Cancer Res, 2011,71(14):4898-4907.
[13] Conroy S M, Maskarinec G, Morimoto Y,etal. Non-Hodgkin lymphoma and circulating markers of inflammation and adiposity in a nested case-control study: the multiethnic cohort[J]. Cancer Epidemiol Biomarkers Prev, 2013,22(3):337-347.
[14] Saberi H F, Krop E J, Scoccianti C,etal. Plasma cytokines and future risk of non-Hodgkin lymphoma (NHL): a case-control study nested in the Italian European Prospective Investigation into Cancer and Nutrition[J]. Cancer Epidemiol Biomarkers Prev, 2010,19(6):1577-1584.
[15] Gu Y, Shore R E, Arslan A A,etal. Circulating cytokines and risk of B-cell non-Hodgkin lymphoma: a prospective study[J]. Cancer Causes Control, 2010,21(8):1323-1333.
[16] 马 瑞,哈德提·别克米托夫,顾 霞,等. 淋巴瘤组织和血浆中TNF-α表达及其临床意义[J]. 临床与实验病理学杂志, 2011,27(9):939-943.
[17] Kumar V, Matsuo K, Takahashi A,etal. Common variants on 14q32 and 13q12 are associated with DLBCL susceptibility[J]. J Hum Genet, 2011,56(6):436-439.
[18] Tan D E, Foo J N, Bei J X,etal. Genome-wide association study of B cell non-Hodgkin lymphoma identifies 3q27 as a susceptibility locus in the Chinese population[J]. Nat Genet, 2013,45(7):804-807.
[19] Wang S S, Slager S L, Brennan P,etal. Family history of hematopoietic malignancies and risk of non-Hodgkin lymphoma (NHL): a pooled analysis of 10,211 cases and 11,905 controls from the International Lymphoma Epidemiology Consortium (Inter Lymph)[J]. Blood, 2007,109(8):3479-3488.
[20] Zhai K, Ding J, Zhou Y. Different role of tumor necrosis factor-α polymorphism in non-Hodgkin lymphomas among caucasian and asian populations: a meta-analysis[J]. Int J Mol Sci, 2014,15(5):7684-7698.
CorrelationbetweenpolymorphismsinTNF-αandIL-10genesandplasmacincentrationwithdiffuselargeB-celllymphoma
SHEN Yan1, GU Xia2, FU Ling3, ZOU Hong-yun4, SHI Yu-wei5
(1DepartmentofPathology,theFourthAffiliatedHospitalofGugangzhouMedicalUniversity,Guangzhou511447,China;2DepartmentofPathology,theFirstAffiliatedHospitalofGugangzhouMedicalUniversity,Guangzhou510120,China;3DepartmentofHematology,thePeople’sHospitaloftheXinjiangUygurAutonomousRegion,Urumqi830001,China;4ResearchLaboraryofMedicalScience,theGeneralHospitalofUrumqiMilitaryCommand,Urumqi830000,China;5DepartmentofHematology,theSecondAffiliatedHospitalofXinjiangMedicalUniversity,Urumqi830063,China)
PurposeTo explore the association between single nucleotide polymorphisms (SNPs) of TNF-αand IL-10 genes as well as their plasma levels and pathogenesis of diffuse large B-cell lymphoma (DLBCL).MethodsSnapshot SNP genotype technique was used to assess genetic variation in 6 SNPs for TNF-α and IL-10 in 38 DLBCL cases and 77 healthy controls, and enzyme-linked immunosorbent assay (ELISA) was used to measure the plasma concentrations of TNF-α and IL-10 in the above population.ResultsPlasma IL-10 level in DLBCL cases was higher than that in controls (P<0.05), but there was no significant difference in plasma TNF-αlevel between the two groups (P>0.05). Of all the candidate SNPs, the geneotype distribution for TNF-α-863C/A showed significant differences between the case and control groups (P<0.05), and carriers with CA/AA genotypes had more two-fold risks of DLBCL than those with the CC genotype (95%CI=1.091-4.765,P=0.028). However several other candidate SNPs showed no significant difference in the geneotype distributions between the cases and controls (P>0.05). After excluding the effects of disease status on plasma TNF-alpha and IL-10 levels, the polymorphism of each gene had no significant effect on the corresponding plasma concentration (P>0.05).ConclusionTNF-α-863C/A polymorphism may be associated with the risk of DLBCL, and IL-10 play an important role in occurrence and development of DLBCL.
diffuse large B-cell lymphoma; TNF-α; IL-10; single nucleotide polymorphism; enzyme-linked immunosorbent assay
时间:2017-7-18 11:51 网络出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20170718.1151.002.html
国家自然科学基金(30860096)
1广州医科大学附属第四医院病理科,广州 5114472广州医科大学附属第一医院病理科,广州 5101203新疆维吾尔自治区人民医院血液科,乌鲁木齐 8300014兰州军区乌鲁木齐总医院临床医学研究所,乌鲁木齐 8300005新疆医科大学第二附属医院血液科,乌鲁木齐 830063
沈 艳,女,硕士,主治医师。E-mail: alice1977@163.com 顾 霞,女,博士,教授,通讯作者。E-mail: guxia1373@sohu.com
R 733.4
:A
:1001-7399(2017)07-0715-05
10.13315/j.cnki.cjcep.2017.07.002
接受日期:2017-05-03
