腔内导管射频消融联合TACE治疗原发性肝细胞癌门静脉癌栓的疗效观察
2017-09-19陈仲武林征宇张志波陈一平
陈仲武,林征宇,张志波,陈一平,陈 锦
(1.福建医科大学附属第一医院介入科,2.肝胆外科,福建 福州 350005)
腔内导管射频消融联合TACE治疗原发性肝细胞癌门静脉癌栓的疗效观察
陈仲武1*,林征宇1,张志波2,陈一平1,陈 锦1
(1.福建医科大学附属第一医院介入科,2.肝胆外科,福建 福州 350005)
目的评价采用HabibTMVesOpen血管内射频消融导管行经皮穿刺射频消融联合TACE治疗原发性肝细胞癌门静脉癌栓的疗效和安全性。方法选择原发性肝细胞癌合并门静脉主干或主要分支内癌栓患者39例,采用HabibTMVesOpen腔内导管射频消融联合TACE治疗,评价手术成功率、术后并发症、血液指标、甲胎蛋白、门静脉通畅及癌栓的影像学变化情况。结果39例患者手术均顺利完成,未发生血管穿孔、感染、肝脓肿、腹腔出血等与手术相关的并发症;术后2周、4周血常规(白细胞、红细胞、血小板计数)与术前比较差异无统计学意义(P均>0.05);肝功能除总胆红素外,丙氨酸氨基转移酶、天门冬氨酸氨基转移酶、血清白蛋白手术前后比较差异有统计学意义(P均<0.05);甲胎蛋白手术前后比较差异有统计学意义(P<0.05)。术后4周多普勒超声检查提示原堵塞门静脉均有血流通过;术后8周行上腹部增强CT检查或MR检查,提示患者癌栓有不同程度变小或消失。结论采用HabibTMVesOpen血管内射频消融导管经皮穿刺门静脉内癌栓射频消融具有可行性,有望成为治疗原发性肝细胞癌门静脉癌栓的有效手段。
癌,肝细胞;门静脉;血栓形成;导管消融;血管造影术,数字减影
原发性肝癌门静脉癌栓(portal vein tumor thrombus, PVTT)的治疗是现代医学所面临的难题之一。肝癌晚期患者在门静脉内形成癌栓的比例较高,占40.0%~90.2%[1]。PVTT影响肝脏血液供应,可导致肝功能恶化,影响肝癌预后。肝癌合并PVTT患者平均生存时间为2.7~4.0个月[2-5]。射频消融(radiofrequency ablation, RFA)是利用一定频率(460~500 kHz)的电磁波毁损生物体内已发生病变的组织,导致肿瘤组织蛋白质瞬间凝固、变性以及细胞核固缩、碎裂与溶解,使肿瘤细胞发生不可逆性坏死[6-7]。有研究[8]证实HabibTMVesOpen导管与EndoHPB双极RFA导管结构相似,是一种新型的腔内双极RFA导管,具有一定的有效性及安全性。本研究采用腔内HabibTMVesOpen导管进行RFA联合TACE治疗原发性肝细胞癌门静脉癌栓,并评价其疗效。
1 资料与方法
1.1一般资料 收集2015年1月—2016年10月间原发性肝癌合并PVTT患者39例,其中男35例,女4例,年龄29~72岁,平均(54.7±10.4)岁;所有患者的诊断均符合《原发性肝癌诊疗规范》(卫生部2011年版)临床诊断标准[9],且无外科手术适应证或不愿接受手术治疗。
1.2仪器与方法
1.2.1设备与器材 RFA导管HabibTMVesOpen (EMcision Ltd, UK)为经皮经肝一次性使用的双极射频导管,直径5F,长1.1 m,与内部直径不小于2.0 mm的导管鞘和不超过0.014 inch的导丝配合使用;导管远端有2个距离8 mm、长度为5 mm的环状电极,可产生直径不超过2 mm的局灶凝固性坏死。射频发生器(1 500RF generator;RITA Medical Systems Inc,Fremont,CA)传输功率10 W,频率450 kHz,时间2~10 min。
1.2.2方法 常规消毒、铺巾、局部麻醉,在超声引导下,经皮穿刺门静脉,后在DSA引导下置入8F导管鞘,沿0.035 inch泥鳅导丝将5F Cobra导管或椎动脉导管置入脾静脉或肠系膜上静脉造影,以明确癌栓位置和累及范围;再交换入0.014 inch超硬导丝,并沿导丝引入HabibTMVesOpen导管,将导管电极送至癌栓位置,导丝需留在VesOpen导管内,且伸出导管顶端1 cm或2 cm;连接射频发生器进行消融治疗,一般为每20 mm消融2 min。消融结束后撤离射频发生器,推送5F血管成形球囊导管(Cook公司)至癌栓狭窄部位,进行球囊扩张成形术,使球囊充气维持2 min左右,重复1次后撤出球囊导管,将5F Cobra导管置入脾静脉或肠系膜上静脉造影观察门静脉再通情况。如门静脉再通不满意,沿导丝引入内支架释放系统定位于门静脉狭窄段,造影证实后释放内支架。最后缓慢拔出导管,加压覆盖穿刺部位;对所有入选患者同时序贯行TACE治疗肝内肿瘤。
1.3随访 术后2周、4周复查肝功能[丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、血清白蛋白(ALB)、总胆红素(TBIL)]、肾功能[尿素氮(BUN)、肌酐(CR)]、血常规[白细胞(WBC)、红细胞(RBC)、血小板(PLT)]及甲胎蛋白(AFP);术后4周行门静脉多普勒超声检查,术后8周行上腹部增强CT或MR检查,评价门静脉是否通畅及癌栓变化情况。
1.4统计学分析 采用SPSS 17.5统计分析软件。正态分布的计量资料以±s表示;非正态分布的资料以中位数(四分位数间距)表示;AFP值取对数变换、PLT、ALT、AST、TBIL采用开平方根变换,将数据转为正态分布后进一步分析。术前、术后2周和术后4周各参数的差异采用重复测量的方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
39例患者中,PVTT位于右支13例、右支及主干11例、左支7例、左支及主干8例;单发肿瘤30例、2个肿瘤6例、3个肿瘤3例;肿瘤直径<5 cm者9例、≥5 cm者30例;肝功能Child-pugh A级33例、B级6例。所有患者均无远处转移。
患者经门静脉癌栓RFA和TACE后,未发现血管穿孔、感染、肝脓肿、腹腔出血等与手术相关的并发症,11例患者球囊扩张后放置支架,无不良反应,仅出现短暂穿刺区疼痛,成功完成治疗。
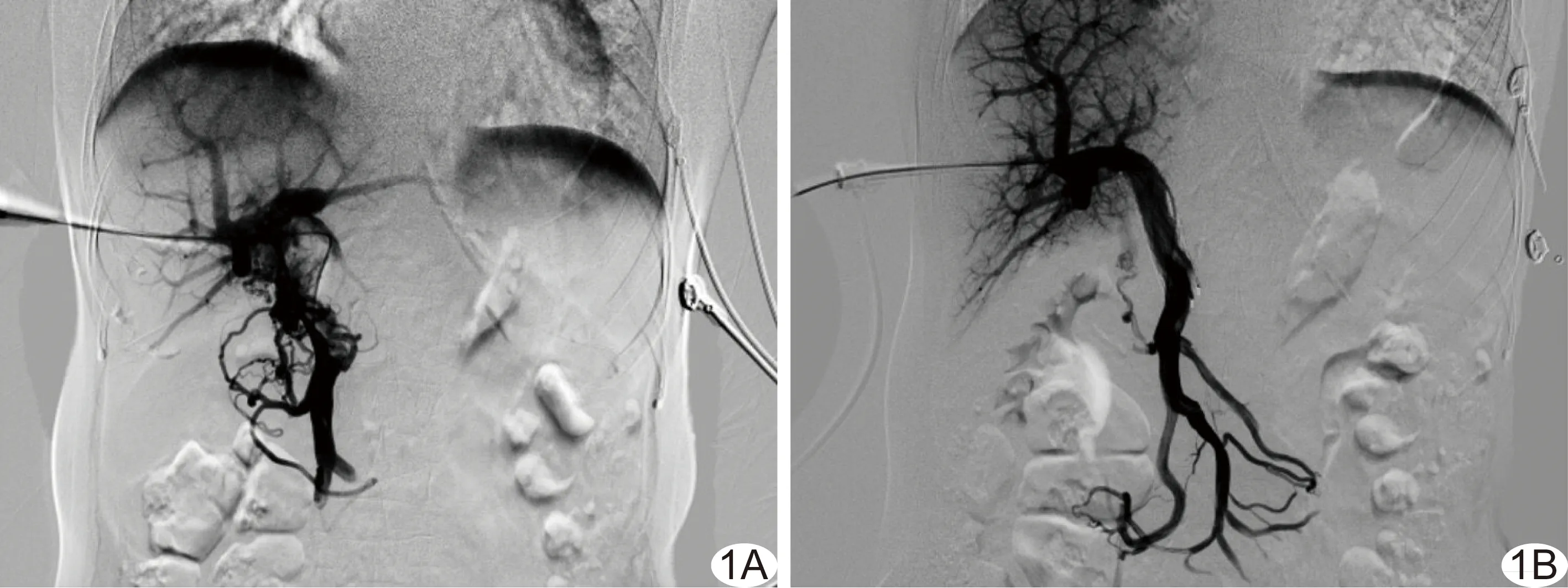
图1 患者女,72岁,原发性肝癌伴门静脉主干癌栓,行门静脉癌栓RFA+内支架植入,术中门静脉直接造影提示内支架通畅,门静脉的血流流速明显增大 A.内支架植入前; B.内支架植入后

图2 患者男,55岁,原发性肝癌伴门静脉右支癌栓,RFA后8周复查上腹部MRI,提示癌栓变小 A.术前MRI图像; B.术后MRI图像 图3 患者女,72岁,门静脉主干癌栓,行AFR+内支架植入术后8周复查上腹部增强CT,显示内支架通畅(支架内均匀强化为血流信号),癌栓消失 A.术前CT图像; B.术后CT图像
术前、术后2周和术后4周,血常规(WBC、RBC、PLT)比较差异无统计学意义(P均>0.05),肝功能除TBIL差异无统计学意义外,ALT、AST、ALB比较均差异有统计学意义(P均<0.05),且术前与术后2周、术后2周与术后4周比较差异均有统计学意义(P均<0.05),术前与术后4周比较差异无统计学意义(P均>0.05);肾功能(BUN、CR)差异有统计学意义(P均<0.05),术前与术后2周差异无统计学意义(P均>0.05),术后2周与术后4周、术前与术后4周比较差异均有统计学意义(P均<0.05);AFP差异有统计学意义(P<0.05),且两两时间点比较差异均有统计学意义(P均<0.05),见表1。
39例患者PVTT行RFA治疗后,即时门静脉造影术显示门静脉血流流速均明显增快(图1)。术后4周多普勒超声检查提示原堵塞门静脉均有血流通过。术后8周行上腹部增强CT或MR检查,结果显示27例患者癌栓不同程度变小(图2),12例患者癌栓消失(图3)。
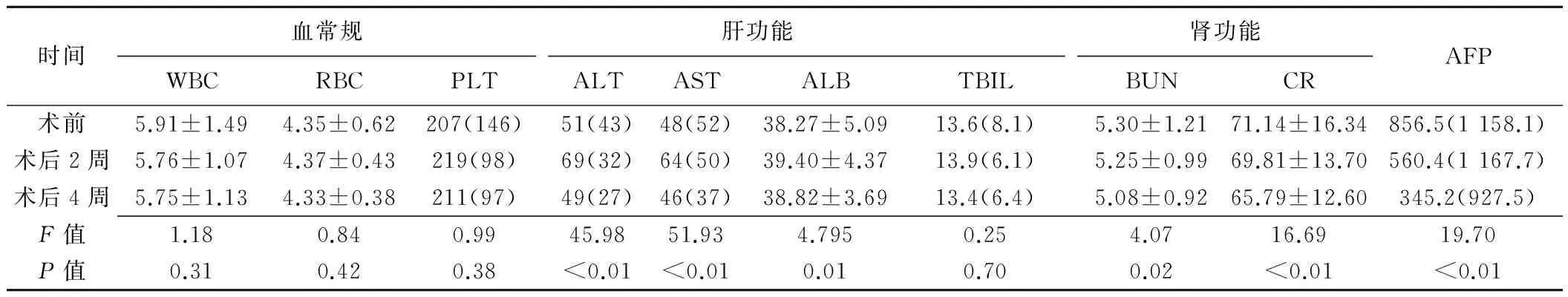
表1 手术前后血液指标变化情况
3 讨论
原发性肝细胞癌发病隐匿,患者就诊时多属晚期,常侵犯门静脉形成癌栓,成为影响原发性肝癌预后的重要因素[10],肝癌伴PVTT患者疗效不显著,死亡率极高。手术切除是目前治疗肝癌伴PVTT的方法之一,但对于门静脉主干内癌栓,手术切除还有争议。此外,TACE加三维适形放射治疗、125I放射性粒子植入[11]、门静脉支架植入等均可治疗PVTT,单纯125I放射性粒子植入可延长患者生存期,但粒子起效时间长;门静脉支架植入也可延长患者生存期,但再堵塞率高;目前尚无一种理想的处理PVTT的有效且可行的方法。
血管内导管RFA联合球囊扩张用于PVTT局部再通是一种PVTT治疗的新方法。本研究采用HabibTMVesOpen双极RFA导管,旨在通过加热杀死肿瘤细胞,在门静脉区形成圆柱形坏死区,从而起到开通门静脉的作用[12-13]。本组病例门静脉内癌栓RFA后,即时门静脉造影术显示门静脉血流流速明显增快。血管内导管RFA主要利用高频交变电流导致细胞内离子快速向相反方向运动的原理,电离运动产生的摩擦力在导管及电极周围的组织均匀产生热量,使该区域的组织凝结。动物实验[14-15]也显示该射频热能可安全地用于血管成形术,且与传统非热能球囊血管成形术相比,外周动脉断面面积明显增大;Lazoura等[16]研究显示,消融导管可安全地用于血管重构以获得更大的腔内直径及血流。血管内导管RFA联合球囊扩张用于PVTT的优点有:①可损坏癌栓并阻止或延缓病变的广泛蔓延;②可改善肝功能,使患者具有接受TACE或外科手术切除的可能性;③可降低门静脉压力,从而降低食管静脉曲张出血的可能性。
Thanos等[15]对肝细胞癌导致的PVTT进行直接RFA,发现消融后16个月门静脉仍保持通畅。Giorgio等[17-18]报道,经皮穿刺RFA治疗肝癌伴PVTT具有高效性、安全性且并发症发生率低等优点;同时也发现采用该方法治疗的患者,存活率有很大提高。另有研究[19]将6例不能手术切除的PVTT患者纳入研究,均成功置入RFA导管并对癌栓进行消融,治疗后DSA示门静脉血流明显改善,术后多普勒超声等影像学检查显示肝脏血流恢复明显,肝功能改善,门静脉内肿瘤缩小,未发现导管消融相关的不良事件,表明经皮门静脉癌栓RFA治疗PVTT安全、可行。
本组对PVTT患者行腔内导管RFA后,即时直接门静脉造影显示肝内门静脉血流改善,39例患者均同时序贯行TACE治疗肝内肿瘤,术中及术后均未出现明显并发症,术后4周多普勒超声检查提示原堵塞门静脉有血流通过,术后8周行上腹部增强CT检查或MR检查,显示癌栓明显变小,甚至消失;术后1周肝功能指标(ALT、AST和ALB)呈一过性损伤,术后4周恢复至术前水平;术后肾功能指标(BUN和CR)较术前降低;术后AFP指标较术前明显下降;提示患者行腔内导管RFA及TACE后,可从一定程度上减轻对患者肝肾功能的影响,使患者的肝肾功能在短时间内得到恢复。
总之,采用HabibTMVesOpen血管内RFA导管行经皮穿刺RFA联合TACE,治疗原发性肝细胞癌PVTT具有一定的疗效,且安全、可靠[5],但还需延长随访时间,加大样本量,以进一步评价其临床长期疗效。
[1] 程树群,吴孟超.肝癌门静脉癌栓临床研究进展和展望.中国微创外科杂志,2007,7(1):6-7.
[2] Yeung YP, Lo CM, Liu CL, et al. Natural history of untreated nonsurgical hepatocellular carcinoma. Am J Gastroenterol, 2005,100(9):1995-2004.
[3] Bruix J, Sheman M. Management of hepatocellular carcinoma. Hepatology, 2005,42(5):1208-1236.
[4] Chok KS, Cheung TT, Chan SC, et al. Surgical outcomes in hepatocellular carcinoma patients with portal vein tumor thrombosis. World J Surg, 2014,38(2):490-496.
[5] Yu TZ, Zhang W, Liu QX, et al. Endovascular brachytherapy combined with portal vein stenting and transarterial chemoembolization improves overall survival of hepatocellular carcinoma patients with main portal vein tumor thrombus. Oncotarget, 2017,8(7):12108-12119.
[6] Ni Y, Mulier S, Miao Y, et al. A review of the general aspects of radiofrequency ablation. Abdom Imaging, 2005,30(4):381-400.
[7] Hou YF, Wei YG, Yang JY, et al. Combined hepatectomy and radiofrequency ablation versus TACE in improving survival of patients with unresectable BCLC stage B HCC. Hepatobiliary Pancreat Dis Int, 2016,15(4):378-385.
[8] Steel AW, Postgate AJ, Khorseandi S, et al. Endoscopically applied radiofrequency ablation appears to be safe in the treatment of malignant biliary obstruction. Gastrointest Endosc, 2011,73(1):149-153.
[9] 中华人民共和国卫生部.原发性肝癌诊疗规范(2011年版).临床肿瘤学杂志,2011,16(10):929-946.
[10] 余梁,吕维富.经肝动脉化疗栓塞术治疗中晚期肝癌的预后因素分析.中国介入影像与治疗学,2015,12(1):14-17.
[11] 宋威,马亦龙,赵昌,等.TACE联合放射性125I粒子植入治疗原发性肝癌合并门静脉癌栓.中国介入影像与治疗学,2016,13(9):526-529.
[12] 张林,付金鑫,宋鹏,等. Habib VesOpen消融导管治疗小型猪模拟门静脉癌栓的安全性研究.介入放射学杂志,2015,24(6):515-519.
[13] Wu TT, Li HC, Zheng F, et al. Percutaneous endovascular radiofrequency ablation for malignant portal obstruction: An initial clinical experience. Cardiovasc Intervent Radiol, 2016,39(7):994-1000.
[14] Sreeram N, Townsend P, Morton DB. Radiofrequency thermal balloon angioplasty in an experimental model of peripheral arterial stenosis. Int J Cardiol, 2000,74(1):25-32.
[15] Thanos L, Sotiropoulou E, Tanteles S, et al. Direct radiofrequency ablation of portal vein tumor thrombus in continuity with hepatocellular carcinoma. J Vasc Interv Radiol, 2010,21(2):285-288.
[16] Lazoura O, Zacharoulis D, Kanavou T, et al. A novel experimental animal model of arterial stenosis based on endovascular radiofrequency energy application. J Invest Surg, 2011,24(3):123-128.
[17] Giorgio A, Di Sarno A, de Stefano G, et al. Hepatocellular carcinoma with cirrhosis: Are patients with neoplastic main portal vein invasion eligible for percutaneous radiofrequency ablation of both the nodule and the portal venous tumor thrombus? AJR Am J Roentgenol, 2009,193(4):948-954.
[18] Giorgio A, Calisti G, Montesarchio L, et al. Hepatocellular carcinoma invading portal venous system in cirrhosis: Long-term results of percutaneous radiofrequency ablation of both the nodule and portal vein tumor thrombus. A case control study. Anticancer Res, 2014,34(11):6785-90.
[19] Mizandari M, Ao G, Zhang Y, et al. Novel percutaneous radiofrequency ablation of portal vein tumor thrombus: Safety and feasibility. Cardiovasc Intervent Radiol, 2013,36(1):245-248.
EvaluationofendovascularradiofrequencyablationcombinedwithTACEintreatmentofportalveintumorthrombusofprimaryhepatocellularcarcinoma
CHENZhongwu1*,LINZhengyu1,ZHANGZhibo2,CHENYiping1,CHENJin1
(1.DepartmentofIntervention, 2.DepartmentofHepatobiliarySurgery,theFirstAffiliatedHospitalofFujianMedicalUniversity,Fuzhou350005,China)
ObjectiveTo evaluate the efficacy and safety of HabibTMVesOpen intravascular radiofrequency catheter percutaneous radiofrequency ablation combined with TACE in the treatment of portal vein tumor thrombus of primary hepatocellular carcinoma.MethodsThirty-nine patients with primary hepatocellular carcinoma complicated with portal vein thrombosis were treated with HabibTMVesOpen intracavitary catheter ablation combined with TACE. The postoperative success rate, complication, blood index, α-fetoprotein (AFP), portal vein patency and tumor thrombus imaging changes were assessed.ResultsAll of 39 patients underwent surgery successfully without occurrence of perforation, infection, hepatapostema, intra-abdominal hemorrhage nor other complications associated with surgery. Blood routine examinations (WBC, RBC, PLT) after 2 weeks and 4 weeks of surgery had no statistical difference compared with those of preoperation. Liver function indexes including ALT, AST, ALB had statistical difference before and after the surgery except for TBIL. AFP had statistical difference before and after surgery. Doppler ultrasonography after 4 weeks showed blood flow in original blocked portal vein. Enhanced CT or MR examinations after 8 weeks on the abdomen, suggested that tumors were shrinked or disappeared.ConclusionRadiofrequency catheter ablation with intracavitary radiofrequency catheter of HabibTMVesOpen is an effective method in the treatment of portal vein tumor thrombus in primary hepatocellular carcinoma.
Carcinoma, hepatocellular; Portal vein; Thrombosis; Catheter ablation; Angiography, digital subtraction
福建省卫生系统中青年骨干人才培养项目(2014-ZQN-JC-18)。
陈仲武(1971—),男,福建福州人,硕士,副主任医师、副教授。研究方向:肿瘤介入治疗。
陈仲武,福建医科大学附属第一医院介入科,350005。E-mail: 708920855@qq.com
2017-03-16 [
] 2017-07-19
10.13929/j.1672-8475.201703021
R735.7; R816
A
1672-8475(2017)09-0525-05
