细胞外膜蛋白酶编码基因prtP对干酪乳杆菌粘附性的影响
2017-09-18,,,,,
,, ,,,
(扬州大学食品科学与工程学院,江苏扬州 225127)
细胞外膜蛋白酶编码基因prtP对干酪乳杆菌粘附性的影响
黄宏轶,黄玲艳,彭景,刘冀婕,孙霁寒,许慧卿*
(扬州大学食品科学与工程学院,江苏扬州 225127)
目的:探究prtP基因与干酪乳杆菌(21858)粘附的相关性。方法:利用λ-Red同源重组方法,构建21858prtP基因缺失突变株,并测定亲本株和突变株的生长曲线、疏水性、自凝聚率、对小肠粘液粘附率及细胞粘附性。结果:亲本株与突变株生长速度相似,突变株疏水率为44.1%,大于亲本株的23.9%;突变株自凝聚率和对肠粘液的粘附率在各时间点均小于亲本株,对细胞的粘附性也小于亲本株。结论:prtP基因与干酪乳杆菌21858粘附性相关,是决定干酪乳杆菌粘附性的重要因子。
干酪乳杆菌,prtP基因,突变株,粘附性
干酪乳杆菌(Lactobacilluscasei)属于乳杆菌属(Lactobacillus),对人体无毒副作用,广泛应用于食品发酵工业和功能性食品开发,特别是功能性乳制品[1-2]。干酪乳杆菌作为益生菌之一,被用作牛奶、酸乳、豆奶、奶油和干酪等乳制品的发酵剂及辅助发酵剂,尤其在干酪中应用较多,是卫生部公布的可用于保健食品的益生菌之一。干酪乳杆菌能够耐受有机体的防御机制,包括唾液、胃酸、胆酸汁等[3],能在肠道内大量定殖,发挥特定的生物学作用,包括降血压、胆固醇,提高人体免疫力,预防癌症和抑制肿瘤生长另外还具有缓解乳糖不耐症、过敏等益生保健作用[4-5]。由于其对人体的有益功能,成为人们关注和研究的焦点。
乳酸菌通过粘附于肠道黏膜形成稳定的生物屏障,从而具有抑制病原菌地入侵和增殖等重要生理功能,因此乳酸菌的粘附性是评价其益生功能的重要指标之一。动物和临床实验都证明只有粘附性好的益生菌才能在肠道内定殖及繁殖,才能发挥特定的益生作用[6]。最新研究发现,在乳酸乳球菌中,细胞外膜的丝氨酸蛋白酶lactocepin能介导乳酸菌的黏附作用[7]。而且在某些益生乳酸菌中,lactocepin对肠道炎性具有良好的抑制作用,能够降解部分炎性细胞因子[8]。因此对这种细胞表面蛋白的深入研究不但可以提高益生菌的益生功能,且可为开发肠道免疫调节制剂提供理论基础。作为乳酸菌重要的胞外水解蛋白酶,lactocepin的蛋白质水解功能已得到较为广泛而深入的研究[6]。根据GenBank信息,lactocepin由位于质粒的基因prtP编码。本文通过λ-Red重组技术,替换干酪乳杆菌的prtP基因,构建干酪乳杆菌prtP基因突变株,通过测定亲本株和突变株的疏水性,自凝聚率及对小肠粘液和细胞的粘附,研究prtP基因对干酪乳杆菌粘附性的影响。
1 材料与方法
1.1材料与仪器
干酪乳杆菌(21858)、质粒pKD3、质粒pKD46、氯霉素抗性基因载体、小鼠脾脏细胞、小鼠巨噬细胞 本实验室保存;PCR引物、琼脂糖 南京生兴生物技术有限公司;Agrarose Gel DNA纯化试剂盒 北京市科学器材公司;ICR小鼠 扬州大学实验动物中心提供,生产许可证号为SCXK(苏)2012-0004;MRS液体培养基 上海中科昆虫生物开发有限公司;氨苄青霉素、氯霉素、Taq酶、marker、6×loading buffer、阿拉伯糖 上海生工生物工程有限公司;DMEM、DMEM/F-12(改良杜氏伊戈尔培养基) 美国Hyclone公司;牛血清(FBS) 南京森贝伽生物科技有限公司;抗生素 上海生物工程有限公司。
AllegrX-22R台式冷冻离心机 BECKMAN COULTER;XB50小型制冰机 南京先欧仪器制造有限公司;Biophotometer plus核酸蛋白测定仪 德国艾本德公司;AllegraX-22R冷冻离心机 美国BECKMAN COULTER公司;Multiporator多功能细胞电穿孔仪 德国Eppendorf公司;数码凝胶图像处理系统 上海天能科技有限公司;GeneAmp9700 PCR仪 美国Applied Biosystems公司。
1.2实验方法
1.2.1 PCR引物的设计 根据Genbank公布的序列,设计扩增prtP基因的特异性引物见表1,用全菌裂解法进行细菌DNA模板的制备。引物由上海生物工程技术服务有限公司合成。

表1 PCR引物Table 1 PCR primers
1.2.2 引物片段的扩增 参考方法[9]通过λ-Red重组系统产生了基因缺失突变株。以质粒pKD3为模板,用长引物P1/P2通过PCR方法扩增氯霉素片段,产物经0.7%的琼脂糖凝胶电泳鉴定正确后,用Agarose Gel DNA纯化试剂盒纯化回收DNA片段,-20 ℃保存。
PCR扩增体系:总量为50 μL的反应体系中加入2×Taq master mix,25 μL;上、下游引物各1 μL;pKD3 10 μL;补无菌超纯水至50 μL,混匀。
PCR扩增参数:94 ℃预变性4 min,94 ℃变性1 min,58 ℃退火1 min,72 ℃延伸1 min 30 s,共30个循环,72 ℃延伸10 min,4 ℃保存。
1.2.3 21858株prtP基因缺失突变株的构建 将质粒pKD46电转入干酪乳杆菌21858以表达重组酶。将PCR扩增的引物片段和含有pKD46的21858感受态细胞混匀,并将混合物加入到预冷的电击杯中,调节电转化仪至电压为2500 V,启动电脉冲进行电转化,电击后迅速加入1 mL预热的MRS培养基,混匀,100 r/min,37 ℃复苏4 h,分别取200 μL涂于含氨苄青霉素和氯霉素的双抗MRS平板上,30 ℃培养过夜,次日挑取含氨苄青霉素和氯霉素双重抗性的菌落,将所得的双抗菌落接种于新鲜的含氨苄青霉素和氯霉素的双抗液体MRS培养基中,30 ℃培养过夜,设计引物P3/P4用PCR进行鉴定,扩增片段大小符合预期结果的即为正确的含氯霉素抗性的prtP基因缺失突变株21858Δ。将上述突变株接种于新鲜液体MRS培养基中,42 ℃培养2 h后,在37 ℃条件下于含氯霉素的抗性MRS平板上划线分离培养,次日对每个单菌落进行氨苄青霉素及氯霉素抗性检测,挑选对氨苄青霉素敏感而具有氯霉素抗性的克隆,得到消除质粒pKD46的重组菌株,称为21858Δ。
1.2.4 21858亲本株和突变株生物学特性
1.2.4.1 细菌生长曲线的测定 参考文献[10]方法,并略作改动,将待测菌株加入100 mL的新鲜MRS液体培养基中(调节OD600=0.050),在37 ℃的恒温培养箱中培养,期间每隔1 h取一次样测OD600值,连续测30 h,MRS培养基作为空白对照。
1.2.4.2 MATH法测定菌株的疏水率 参照文献[11]方法。无菌吸取200 μL 21858和21858Δ菌液于10 mL MRS液体培养基中,37 ℃厌氧培养20 h。取一环培养物划线于MRS固体平板,37 ℃厌氧培养20 h,挑取单菌落接种MRS液体培养基,37 ℃厌氧培养20 h。将21858和21858Δ培养物4000 r/min离心10 min收集菌体,生理盐水洗涤2次,每次10 mL,5000 r/min离心10 min。以生理盐水为空白对照调整受试菌液浓度使A600=1.000,取2 mL调整好浓度的菌悬液,与2 mL二甲苯混合,涡旋2 min,室温静置30 min。取1 mL水相以生理盐水为空白对照组,在600 nm下测定A值并记录,按下式计算细菌表面疏水率(CSH,%)。
CHS(%)=[(A0-At)/A0]×100
其中,A0和At分别是与二甲苯混匀前和各时间点水相在600 nm下测得的A值。
1.2.4.3 菌株自凝聚能力的测定 参考文献[12]方法,将37 ℃厌氧乳酸菌培养物4000 r/min离心10 min收集菌体,用生理盐水洗涤2次,每次10 mL,5000 r/min,离心10 min,以生理盐水为空白对照调整受试菌液浓度使A600=1.000,取4 mL调整好的菌悬液于型号一致的试管中,室温静置,分别在静置1、2、3、4、5 h后吸取1 mL的上层溶液测定600 nm吸光值,记作A1h、A2h、A3h、A4h,A5h,计算乳酸菌自凝聚的百分比。
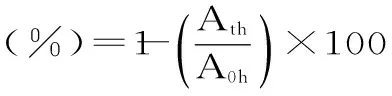
其中:A0 h和At h分别为自凝聚前和各个时间点上层溶液在600 nm下测得的A值。
1.2.4.4 肠粘附实验 参考文献[13-14]方法,略作改动,将不同浓度21858和21858Δ PBS菌悬液各取1 mL于离心管中,8000 r/min离心10 min,弃上清,加1 mL 0.1%结晶紫水溶液,染色50 min,离心收集菌体,PBS洗涤5次,加1 mL柠檬酸盐缓冲溶液重悬,室温静置60 min,测OD600值,建立OD600值与乳酸菌细胞数的标准曲线。
取6~7周龄ICR小鼠,用小鼠固定器固定24 h后解剖,取小肠置于冰面,用无菌PBS缓冲液洗涤小肠三次后,将小肠纵向剪开,用载玻片刮取小肠内表面粘液,加入2倍体积的PBS缓冲液,混匀,12000 r/min,4 ℃离心10 min,弃上清,-20 ℃保存。
取96孔板,每孔加入100 μL小鼠肠黏膜提取液,4 ℃过夜固定。去除未固定的粘液,每孔加入100 μL 1×108CFU/mL的乳酸菌悬液,4 ℃孵育2 h,用250 μL的PBS缓冲液洗涤4次,除去未粘附的乳酸菌,将96孔板置于60 ℃烘箱中30 min,每孔加入100 μL 0.1%结晶紫染色50 min,PBS洗涤5次,加入100 μL的柠檬酸缓冲溶液,室温静置60 min,测OD600值,根据所绘制的标准曲线计算多孔板中粘附的乳酸菌的数量,以粘附的乳酸菌数量与加入乳酸菌数的百分比表示菌株的粘附能力。
1.2.4.5 细胞粘附实验 参考文献[15]并略作改动,将巨噬细胞和脾脏细胞以每孔1 mL(1×106个/mL)细胞悬液加入24孔板中,37 ℃含5% CO2-95%空气培养箱中孵育48 h。待细胞贴壁完全,以无菌PBS洗涤2次,每孔加入1 mL浓度为1×108个CFU/mL的乳酸菌悬液,37 ℃含5% CO2-95%空气培养箱中孵育1 h。用无菌PBS漂洗3次,然后用质量分数为4%多聚甲酸固定30 min,烘干后用结晶紫染色,在倒置显微镜下(10×40倍)观察,最后用数码相机进行拍摄。
1.3数据处理
2 结果与分析
2.1突变株21858Δ的鉴定
如图1所示,根据GenBank公布的干酪乳杆菌的基因序列,分析启动子和开放性阅读框,结果显示基因prtP拥有独立的单个开放阅读框,含有7820 bp个碱基对。插入氯霉素突变后,以突变干酪乳杆菌为模板,用引物P3/P4进行PCR鉴定,得到了1175 bp,与预期结果一致,且突变株可以在含氯霉素的抗性板上生长而亲本株不能生长,与预期结果一致。证实得到的菌株为干酪乳杆菌prtP基因敲除突变株21858Δ。
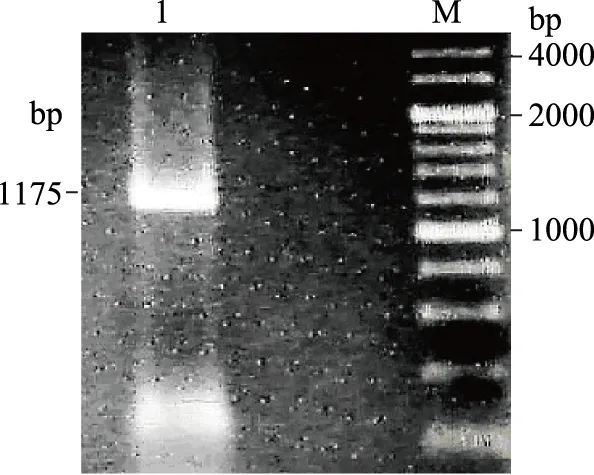
图1 21858Δ的prtP基因PCR扩增Fig.1 PCR amplification of prtP fragment in Δ21858注:1:21858Δ prtP基因片段PCR扩增条带;M:200 bp的Marker。
2.2生长曲线的测定
由图2可见,突变株21858Δ的生长速度与亲本株21858相似,在衰亡期突变株略快,但没有明显差异(p>0.05),说明敲除prtP基因并不影响菌株的生长。
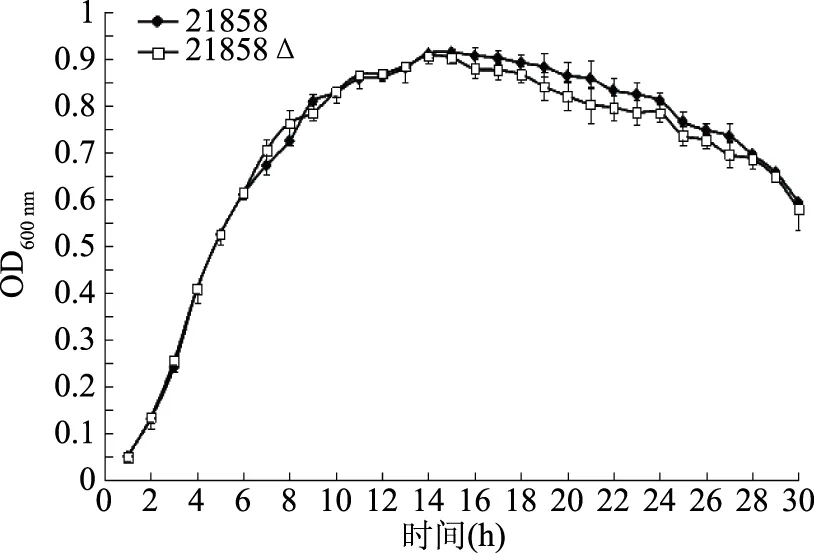
图2 突变株和亲本株的生长曲线Fig.2 The growth curve for 21858 and 21858Δ
2.3疏水率
将菌液与二甲苯等体积混合后,经过振荡、静置。通过计算测得21858Δ的疏水率为44.1%±1.5%,大于21858疏水率23.9%±0.62%,且两者具有显著差异(p<0.05)。疏水率被认为是决定细菌非特异性粘附到生物表面的重要动力,主要是由于其表面具有疏水性质的蛋白质、糖类及其他化合物所赋予的一种表面特性[16]。有研究显示乳酸菌表层蛋白中的疏水性氨基酸使整个菌体表面具有一定的疏水性[17]。一般认为疏水率较高的乳酸菌有着较高的粘附性,疏水率是评价乳酸菌粘附性的重要指标[18]。但由于乳酸菌粘附机制的复杂性,除了疏水作用外还与表面多种成分和结构有关,使得数据间相关性较弱,这可能导致干酪乳杆菌粘附过程中疏水作用并不占主导地位。另外可能由于疏水率的测定方法有多种,方法不同得到的结果也有不同,甚至自相矛盾[19]。本实验提示敲除prtP基因会提高干酪乳杆菌的疏水率,可能由于prtP编码的蛋白酶lactocepin含有亲水基团较多,在这种蛋白酶缺失后反而提升了干酪乳杆菌的疏水率,也可能是因为prtP基因敲除后使得菌株表面更多的疏水基团打开,从而提高了干酪乳杆菌的疏水性。
2.4自凝聚实验
如图3所示,自凝聚实验测定结果显示,各个时间点亲本株的自凝聚率均大于突变株,且时间越长差距越明显。自凝聚率与时间有较好的线性关系,21858自凝聚率和时间的线性方程为y=20.075x-11.601,相关系数为0.9957;21858Δ自凝聚和时间的线性方程为y=10.73x-2.53,相关系数为0.9941。且随着时间延长,两种菌株的自凝聚率都逐渐变大,从第2 h后具有显著差异(p<0.05)。说明敲除prtP基因会降低干酪乳杆菌的自凝聚率。有研究发现菌株的自凝聚能力与其粘附能力密切相关,高凝聚力的菌株一般具有较高的粘附能力,与本实验结果一致[20]。
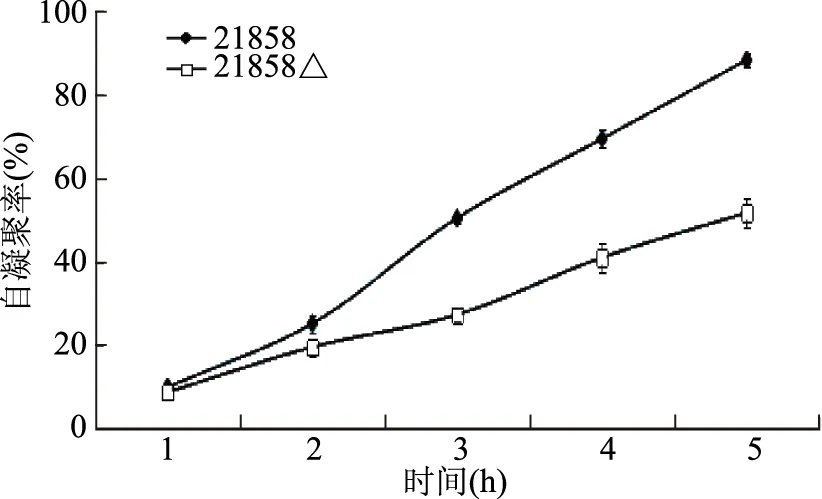
图3 乳酸菌21858和21858Δ的自凝聚率与时间关系Fig.3 The relationship between self-aggregation rate and time of 21858 and 21858Δ
2.5肠黏膜粘附实验
21858浓度与OD600 nm值线性相关(R2=0.9964),线性方程为y=0.0998x-0.0868,其中x为细菌数(×108CFU/mL),y为OD600 nm值。21858Δ浓度与OD600 nm值线性相关(R2=0.9931)线性方程为y=0.1123x-0.0648,其中x为细菌数(×108CFU/mL),y为OD600 nm值。通过以上方程计算乳酸菌小肠粘液粘附率,21858小肠粘液粘附率为4.638%±0.23%,21858Δ小肠粘液粘附率3.665%±0.45%。突变株的粘附性明显低于亲本株(p<0.05)。说明敲除prtP基因明显降低了干酪乳杆菌对小肠粘液的粘附性。
2.6细胞粘附实验
如图4所示为21858(a)和21858Δ(b)对巨噬细胞的黏附作用,图4(a)中菌株对细胞的粘附性明显大于图4(b)。图5为21858(a)和21858Δ(b)对脾脏细胞的粘附作用,21858对脾脏细胞的粘附性明显大于21858Δ。细胞表面的粘附素受体是乳酸菌特异性粘附的主要机制,不同细胞的粘附素受体具有特异性[21],敲除prtP基因明显降低了干酪乳杆菌对巨噬细胞和脾脏细胞的粘附性。这可能是因为prtP基因编码的丝氨酸蛋白酶lactocepin能够与细胞表面的特异性受体相结合,影响干酪乳杆菌的粘附性。这与小肠粘液粘附实验得到的结果一致,提示21858Δ与21858相比对肠粘液和巨噬细胞以及脾脏细胞的粘附性都降低了。
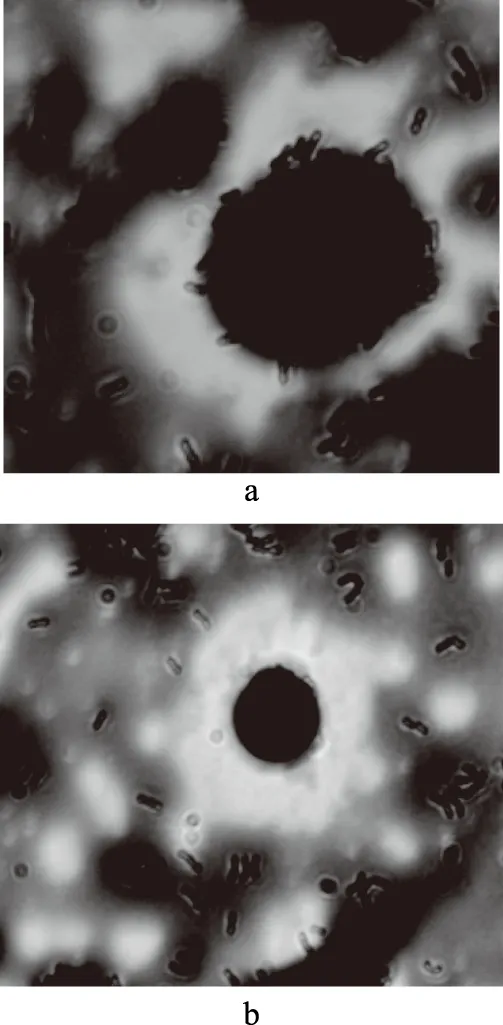
图4 21858(a)和21858Δ(b)对巨噬细胞粘附性Fig.4 The adhesion of 21858(a) and Δ21858(b)on macrophage
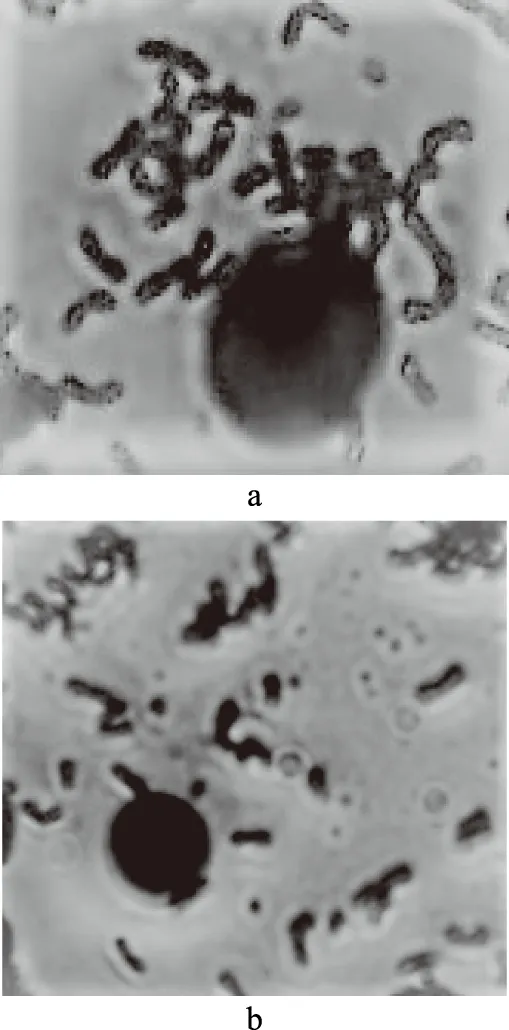
图5 21858(a)和21858Δ(b)对脾脏细胞的粘附性Fig.5 The adhesion of 21858(a) and 21858Δ(b)on spleen cells
3 结论
乳酸菌进入宿主肠道后,最先接触的是肠粘液层,然后才会进入黏液层结合肠上皮细胞。由于乳酸菌粘附机制的复杂性,因此在使用体外模型时要综合考虑对细胞和消化道表面粘液的粘附能力才能反映菌株在宿主内的粘附情况。
本研究通过构建prtP基因缺失的突变株21858Δ,测定其基本生物学特性,发现突变株和亲本株生长曲线类似,说明prtP基因编码的细胞膜蛋白酶lactocepin并不影响菌株的生长。突变株自凝聚率在各个时间点都低于亲本株,且时间越长差距越明显。但本实验中低粘附率的突变株却显示出较高的疏水率,21858Δ的疏水率为44.1%±1.5%,大于21858疏水率23.9%±0.62%。通过小肠粘液粘附实验21858的小肠粘液粘附率4.638%±0.23%,21858Δ的小肠粘液粘附率3.665%±0.45%。且21858Δ对肠粘液的粘附性明显低于21858(p<0.05)。细胞粘附实验也能直观看到在敲除prtP基因后,对巨噬细胞和脾脏细胞的粘附力下降,提示prtP基因编码细胞膜蛋白酶lactocepin对干酪乳杆菌的粘附能力有重要作用。乳酸菌的粘附能力是筛选益生菌的重要标准。接下来,将通过体内粘附实验及免疫学实验进一步确定prtP基因与干酪乳杆菌粘附性的关系并探讨相关免疫机制。
[1]尹胜利,杜鉴,徐晨. 乳酸菌的研究现状及应用[J]. 食品科技,2012,37(9):25-29.
[2]汪建明,赵仁国,肖东光. 高活性干酪乳杆菌粉末发酵剂的初步研究[J]. 天津科学大学学报,2005,20(2):9-13.
[3]高微娟,张富新,魏怡等. 干酪乳杆菌对羊酸奶特性及品质的影响[J]. 陕西师范大学学报:自然科学版,2011,39(1):98-102.
[4]Seegers J.Lactobacillias live vaccine delivery vectors:progress and prospects[J]. Trends Biotechnology,2002,20(12):508-515.
[5]刘桂芳. 嗜酸乳杆菌和干酪乳杆菌β-半乳糖苷酶和蛋白水解活性的研究[D]. 呼和浩特:内蒙古农业大学,2004.
[6]Tuomola EM,Ouwehand AC,Salminen SJ,et al. Chemical,physical and enzymatic pre-treatments of probotcLactobacillialter their adhesion to human intestinal nlocus glycoproteins[J]. International Journal of Food Microbiology,2000,60(1):75-81.
[7]Habimana O,Le Goff C,Juillard V,et al. Positive role of cell wall anchored proteinaseprtPin adhesion ofLactococci[J]. BMC Microbiology,2007,7(1):36.
[8]Von Schillde MA,Hormannsperger G,Weiher M,et al.LactocepinSecreted By Lactobacliius Exert Anti-Inflammatory Effects By Selectively Degrading Proinflammatory Chemokines[J].Cell Host & Microbe,2012,11(4):387-396.
[9]Ling J,Pan H,Gao Q,et al. Aerobactin synthesis genes iucA and iucC contribute to the pathogenicity of avian pathogenicEscherichiacoliO2strain E058[J]. PLos One,2013,8(2):1-10.
[10]冯会贤,梅星星,蒋瑞瑞,等. 禽用乳酸菌的筛选与功能鉴定[J]. 西北农林科技大学学报:自然科学版,2016(9):35-41.
[11]Li X J,Yue L Y,Guan X F,et al. The adhesion of putative probioticLactobacillito cultured epithelial cells and porcine intestinal mucus[J]. Journal of Applied Microbiology,2008,104(4):1082-1091.
[12]Rahman M M,Kim W S,Kumura H,et al. Autoaggregation and surface hydrophobicity ofBifidobacteria[J]. World Journal of Microbiology and Biotechnology,2008,24(8):1593-1598.
[13]Balcazar J L,Vendrell D.Invitrocompetitive adhesion and production of antagonistic compounds by lactic acid bacteria against fish pathogens[J]. Veterinary Microbiology,2007,122(3):373-380.
[14]Vesterlund S,Ouwehand A C,Palttta J,et al. Measurement of bacterial adhesioninvitroevaluation of different methods[J]. Journal of Microbiological Methods,2005,60(2):225-233.
[15]靳彩娟. 高粘附性乳酸菌的筛选、鉴定及表面疏水性特性研究[D]. 扬州:扬州大学,2013:27-28.
[16]Scharzammaretti P,Ubbink J. The Cell Wall of lactic acid bacteria:Surface Constituents and Macromolecular Conformations[J]. Biophysical Journal,2003,85(6):4076.
[17]Carasi P,Trejo F M,Pérez P F,et al. Surface proteins fromLactobacilluskefir,antagonize invitro,cytotoxic effect of Clostridium difficile,toxins[J]. Anaerobe,2012,18(1):135-142.
[18]杨振泉,靳彩娟,张咪,等. 高粘附性戊糖片球菌的筛选、标记及表面疏水性与自凝聚特性[J]. 食品与生物技术学报,2015,34(9):927-933.
[19]Ouwehand A,Kirjavainen P,Grnlund M,et al. Adhesion of probiotic micro-organisms to intestinal mucus[J]. Int Dairy J,1999,9(9):623-630.
[20]Del Re B,Sgorbati B,Miglioli M,et al. Adhesion,autoaggregation and hydrophobicity of 13 strains ofBifidobacteriumlongum[J]. Letters in Applied Microbiology,2000,31(6):438-442.
[21]戴卓捷,杨光明,汪正清. 细菌粘附素的分子结构和装配机制[J]. 微生物学免疫学进展,2001,29(3):55-59.
EffectofextracellularmembraneproteasegeneprtPontheadhesionofLactobacilluscasei
HUANGHong-yi,HUANGLing-yan,PENGJing,LIUJi-jie,SUNJi-han,XUHui-qing*
(School of Food Science and Engineering,Yangzhou University,Yangzhou 225127,China)
Objective:To explore the role of theprtPgene ofLactobacilluscasei(21858)in it’s adhesion. Methods:Using red homologous recombination method to build 21858prtPgene deletion mutant was built. And the growth curve,hydrophobic,auto-aggregation,the rate of intestinal mucus adhesion and the adhesion of cells were measured. Results:The growth curve was similar to the mutant strains. The hydrophobic rate of mutant strains was 44.1% greater than 23.9% of the parent strains. The auto-aggregation rate of mutant strains at each time points were less than the parent plants,and intestinal mucus adhesion rate of mutant strains was less than the parent plants. The adhesion of mutant strains to both cells were less than the parent plants. Conclusion:TheprtPgenes associated withLactobacilluscasei21858 adhesive,is an important factor in determining the adhesion of lactic acid bacteria.
Lactobacilluscasei;prtPgene;mutant strains;adhesion
2017-02-28
黄宏轶(1992-),男,硕士研究生,研究方向:营养与食品卫生学,E-mail:503116150@qq.com。
*通讯作者:许慧卿(1972-),女,博士,副教授,研究方向:食品加工及微生物生物技术,E-mail:yzuxhq@126.com。
国家自然科学基金(31101305);扬州大学大学生创新创业训练计划(x20160929)。
TS252
:A
:1002-0306(2017)16-0083-05
10.13386/j.issn1002-0306.2017.16.017
