蛋氨酸三肽对奶牛乳腺上皮细胞酪蛋白和小肽转运载体基因表达量的影响
2017-09-16郭春利曹琪娜哈斯额尔顿敖长金
郭春利 丹 妮 曹琪娜 哈斯额尔顿 敖长金
(内蒙古农业大学动物科学学院,呼和浩特010018)
蛋氨酸三肽对奶牛乳腺上皮细胞酪蛋白和小肽转运载体基因表达量的影响
郭春利 丹 妮 曹琪娜 哈斯额尔顿 敖长金*
(内蒙古农业大学动物科学学院,呼和浩特010018)
本试验旨在研究蛋氨酸三肽(Met-Met-Met)对奶牛乳腺上皮细胞(BMECs)酪蛋白和小肽转运载体基因表达量的影响。采用酶消化法培养的第3代奶牛乳腺上皮细胞为模型,各处理在培养基中分别添加0(对照)、40、50、60、70和80 μg/mL的蛋氨酸三肽,每个处理5个重复,每个重复1个培养孔,分别培养细胞24、48和72 h,检测奶牛乳腺上皮细胞的相对增殖率,整体试验重复2次,确定最佳培养时间;各处理在培养基中分别添加0(对照)、40、50、60、70和80 μg/mL的蛋氨酸三肽,每个处理3个重复,每个重复1个培养孔,以最佳培养时间培养,用实时定量PCR法检测酪蛋白基因的表达量,确定适宜蛋氨酸三肽浓度,整体试验重复3次;以最佳培养时间和适宜蛋氨酸三肽浓度培养细胞,以未添加蛋氨酸三肽的培养基为对照,每个处理3个重复,每个重复1个培养孔,测定小肽转运载体基因的表达量,整体试验重复3次。结果表明:在培养基中添加蛋氨酸三肽培养奶牛乳腺上皮细胞24 h时,相对增殖率最高;培养基中加入60 μg/mL的蛋氨酸三肽培养细胞24 h,αs1-酪蛋白和β-酪蛋白的基因表达量最高,同时发现奶牛乳腺上皮细胞中小肽转运载体1和小肽转运载体2基因表达量显著高于对照处理(P<0.05)。综上所述,培养基中添加60 μg/mL的蛋氨酸三肽能够提高奶牛乳腺上皮细胞酪蛋白和肽转运载体基因的表达量。
蛋氨酸三肽;奶牛乳腺上皮细胞;酪蛋白;小肽转运载体
乳蛋白是评价牛奶品质的重要指标之一。酪蛋白含量占总乳蛋白含量的80%,它包括αs1-酪蛋白(CSN1S1)、αs2-酪蛋白(CSN1S2)、β-酪蛋白(CSN2)和κ-酪蛋白(CSN3)4种,这4种酪蛋白的比例分别为36.5%~40.7%、9.7%~10.2%、26.8%~30.5%、6.8%~9.7%[1]。前人研究认为游离氨基酸是可以满足动物机体各组织合成代谢的需要[2],但新近的研究发现,在反刍动物体内存在着小肽吸收的过程,其血液循环中的小肽可以参与奶牛乳腺上皮细胞(BMECs)的乳蛋白合成,并在一定程度上弥补了乳腺合成乳蛋白过程中游离氨基酸摄入不足的问题[3]。Backwell等[4]给泌乳奶牛提供以二肽形式结合的组氨酸和相同数量的游离组氨酸,试验结果表明前者可以促进乳腺合成更多的乳蛋白。Wang[5]发现在BMECs培养时加入氨基酸二肽,可以使细胞合成乳蛋白量的提高。高学军等[6]也在培养BMECs的过程中添加了不同浓度的蛋氨酸-蛋氨酸二肽、蛋氨酸-赖氨酸二肽、赖氨酸-赖氨酸二肽和赖氨酸-蛋氨酸二肽,并已证实添加适宜浓度的二肽可以促进CSN2基因和蛋白的表达。
目前已经证明奶牛乳腺组织内存在2种小肽转运载体,即小肽转运载体1(PepT1)和小肽转运载体2(PepT2)[7-8]。这2种载体是根据自身系统内部的定向质子梯度和负膜电位来发挥其转运作用[9-10],它们可以转运大部分二肽和三肽,但一般不能转运3个以上氨基酸残基构成的肽[1,4]。
在BMECs合成乳蛋白的研究过程中,关于第一限制性氨基酸蛋氨酸所组成的二肽已经有了初步的研究,但对蛋氨酸三肽(methionyl-methionyl-methionine,Met-Met-Met)的研究未见报道。所以本试验在BMECs培养过程中添加不同浓度的蛋氨酸三肽,研究其对BMECs相对增殖率、酪蛋白和小肽转运载体基因表达量的影响,以期为提高乳蛋白产量和改善牛奶品质提供理论依据。
1 材料与方法
1.1试验材料
DMEM/F12培养基、Ⅱ型胶原酶、双抗(青霉素-链霉素)、0.25%胰蛋白酶/乙二胺四乙酸(EDTA)、胰岛素转铁蛋白溶液均购自Gibco公司;胎牛血清(FBS)购自BI公司;组织/细胞总RNA提取试剂盒(DP431)购自TIANGE公司;PrimeScriptRTMaster Mix试剂盒、SYBR Premix Ex TaqTMⅡ、ABI PrismTM(KR0390-v8.13)、6×上样缓冲液、DL 2000分子质量标准均购自上海TAKARA公司;氢化可的松购自Sigma公司;噻唑蓝(MTT)、二甲基亚基砜(DMSO)和两性霉素B均购自Amresco公司;磷酸盐缓冲液(DPBS)购自HyClone公司;蛋氨酸三肽由生工生物工程(上海)股份有限公司合成,合成报告显示蛋氨酸三肽纯度为98.10%,相对分子质量为411.61。
主要仪器有:二氧化碳(CO2)恒温培养(HF-240,力康生物医疗科技控股有限公司);倒置显微镜(Olympuse公司);全自动酶标仪(Synergy H4,Bio Tek公司);梯度PCR仪(Veriti Thermal Cycler,Thermo公司);实时定量PCR仪和电泳仪(Bio-Rad公司)。
1.2试验设计
本试验采用单因素完全随机试验设计。各处理在培养基中分别添加0(对照)、40、50、60、70和80 μg/mL的蛋氨酸三肽,每个处理5个重复,每个重复1个培养孔,分别培养细胞24、48和72 h,检测BMECs的相对增殖率(relative growth rate,RGR),整体试验重复2次,确定最佳培养时间;各处理在培养基中分别添加0(对照)、40、50、60、70和80 μg/mL的蛋氨酸三肽,每个处理3个重复,每个重复1个培养孔,以最佳培养时间培养,用实时定量PCR法检测酪蛋白基因的表达量,确定适宜蛋氨酸三肽浓度,整体试验重复3次;以最佳培养时间和适宜蛋氨酸三肽浓度培养细胞,以未添加蛋氨酸三肽的培养基为对照,每个处理3个重复,每个重复1个培养孔,测定小肽转运载体基因的表达量,整体试验重复3次。
1.3BMECs培养方法
BMECs采用酶消化法获得。取健康的荷斯坦奶牛乳腺组织(内蒙古呼和浩特北亚清真冷库),分离去除组织表面,在深层组织剪取约1 cm3的组织块若干,放入预冷的DPBS中。将组织块放入超净台,用DPBS将组织块洗净后,再剪去组织块表层并将去表层的组织块在离心管中剪成糊状,1∶1加入0.5%胶原酶Ⅱ溶液。将消化液和组织混匀后在37 ℃的5% CO2条件下消化1 h,每隔20 min摇晃离心管。消化液用孔径80目的细胞滤网过滤,收集细胞滤液,1 300 r/min离心5 min,弃上清。加入BMECs诱导培养基(每100 mL的DMEM/F12培养基中加入10% FBS、1 mL青霉素-链霉素、0.5 mL胰岛素转铁蛋白、100 μL两性酶素B、100 μL氢化可的松),吹打均匀,转移至25 cm2细胞培养瓶中,于37 ℃的5% CO2的条件下培养。每日观察细胞的生长情况,待细胞生长至85%~95% 融合度时,根据BMECs与奶牛乳腺成纤维细胞对胰蛋白酶消化敏感性不同的特点,纯化BMECs并进行传代。本试验采用第3代传代细胞进行研究。
1.4测试指标与方法
1.4.1 MTT法检测相对增殖率
细胞相对增殖率检测采用MTT法[12]进行,用以判定细胞活力。收集第3代BMECs,用BMECs诱导培养基悬浮细胞,将细胞悬浮液以1×104个/孔的密度接种于96孔培养板(Corning,3599)上,置于37 ℃的5% CO2培养箱中,培养48 h后吸出各孔内培养液,培养基换成无血清的BMECs诱导培养基饥饿培养24 h,添加含不同浓度蛋氨酸三肽的无血清诱导培养基,继续培养24、48、72 h;在培养结束前4 h,每孔加入20 μL MTT(5 mg/mL);4 h后弃上清液,每孔加入150 μL DMSO,振荡10 min后,用全自动酶标仪检测各培养孔的490 nm吸光度(OD490 nm)值。每个处理5个重复,每个重复1个培养孔,整体试验重复2次。相对增殖率计算公式如下:
相对增殖率(%)=(试验处理OD490 nm/对照处理OD490 nm)×100。
1.4.2 实时定量PCR法检测酪蛋白基因表达量
将培养至第3代的BMECs,以2×105个/孔的密度接种于6孔培养板(Corning,3599)上,置于37 ℃的5% CO2培养箱中,培养48 h后吸出各孔内培养液,培养基换成无血清的BMECs诱导培养基饥饿培养24 h,添加含不同浓度蛋氨酸三肽的无血清诱导培养基,每个处理3个重复,每个重复1个培养孔,按照相对增殖率最佳的培养时间进行细胞培养,培养结束后,将细胞总RNA按照组织/细胞总RNA提取试剂盒的方法进行提取,总RNA的完整性和纯度用1%的琼脂糖凝胶电泳和酶标仪进行检测。反转录PCR按照PrimeScriptRTMaster Mix试剂盒的方法进行,得到的cDNA用SYBR Premix Ex TaqTMⅡ试剂盒进行实时定量PCR,反应体系为20 μL,每个重复进行3次PCR检测。以本实验室常用的磷酸甘油醛脱氢酶(GAPDH)作为内参基因,对CSN1S1、CSN1S2、CSN2和CSN3基因的表达量进行测定,引物序列及参数见表1。实时定量PCR的反应程序为:95.0 ℃预变性30 s;95.0 ℃变性30 s;退火温度下30 s;72.0 ℃延伸20 s,40个循环。熔解曲线程序为:70~95 ℃,每6 s升温0.5 ℃,共51个循环,实时定量PCR结果采用2-△△Ct法进行相对定量分析。
1.4.3 实时定量PCR法检测小肽转运载体基因表达量
按照根据相对增殖率得到的最佳培养时间及根据酪蛋白基因表达量得到的适宜蛋氨酸三肽浓度对第3代接种于6孔板的BMECs进行培养,每个处理3个重复,每个重复1个培养孔。培养结束后,进行总RNA提取及反转录。以磷酸甘油醛脱氢酶(GAPDH)作为内参基因,对小肽转运载体(PepT1和PepT2)基因的表达量进行测定,引物序列及参数见表1。实时定量PCR的反应程序及熔解曲线程序同1.4.2,实时定量PCR结果采用2-△△Ct法进行相对定量分析。
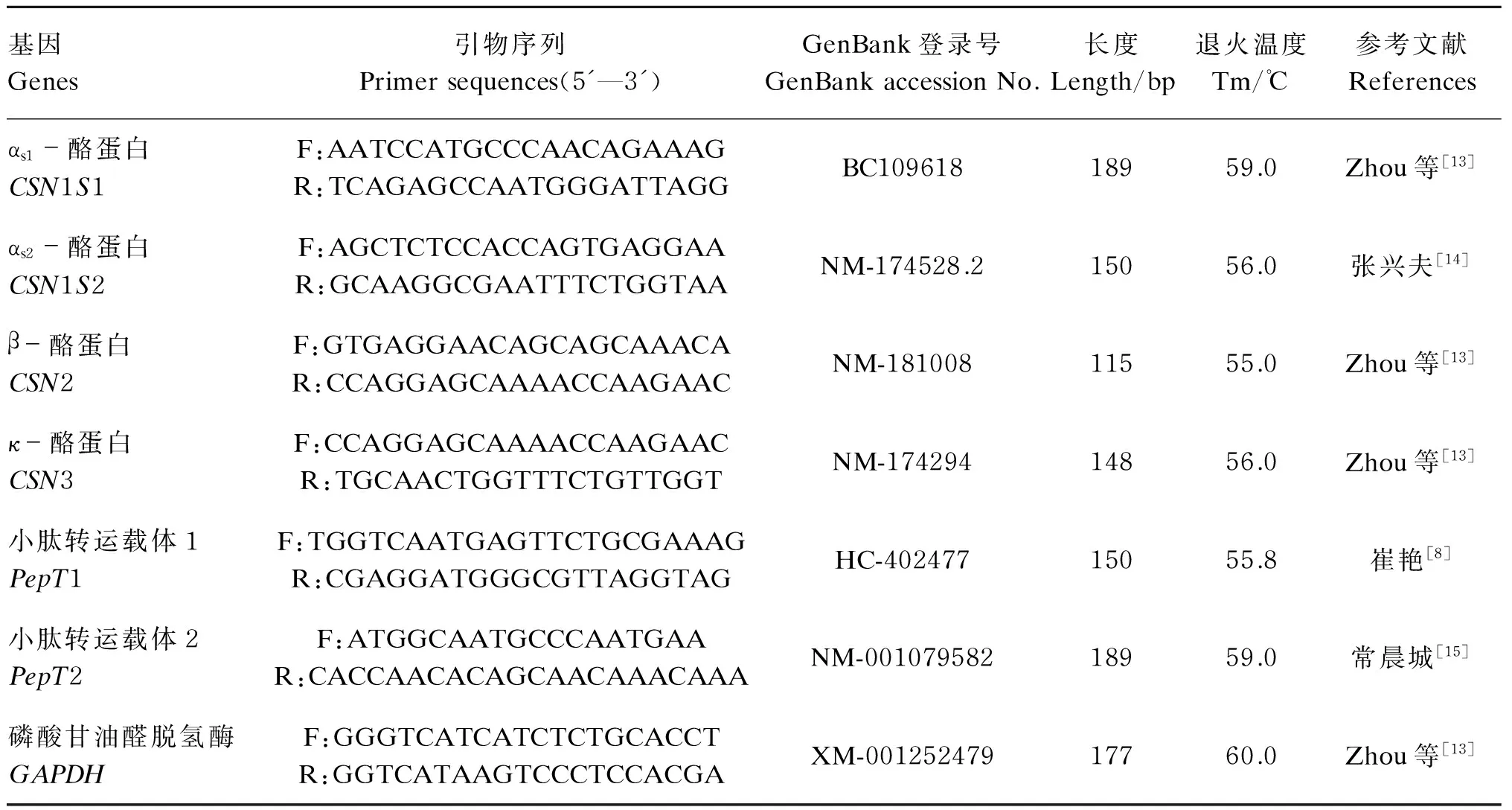
表1 引物序列及参数
F:上游引物;R:下游引物。
F: forward primer; R: reverse primer.
1.5数据统计分析
试验数据采用SAS 9.0软件进行统计,对相对增殖率、酪蛋白基因表达量数据进行方差分析,同时一次线性和二次曲线回归分析;小肽转运载体基因的表达量进行t检验。P<0.05为差异显著。
2 结 果
2.1蛋氨酸三肽浓度与培养时间对BMECs相对增殖率的影响
由表2可知,添加不同浓度的蛋氨酸三肽培养细胞24 h时,相对增殖率随着蛋氨酸三肽浓度的增加呈一次线性变化(P=0.101 2),以50 μg/mL剂量组最高,回归方程为Y=-0.003 47X+1.223 74,R2=0.646 1,式中X表示蛋氨酸三肽浓度,Y表示相对增殖率,回归曲线拟合程度低;当培养48 h时,随着蛋氨酸三肽浓度的升高,相对增殖率呈现先降低后升高的二次曲线变化(P=0.276 2),回归方程为Y=0.000 1X2-0.014 1X+1.375 8,R2=0.723 8,式中X表示蛋氨酸三肽浓度,Y表示相对增殖率,即细胞培养48 h时,BMECs会由于蛋氨酸浓度的升高呈现先抑制后促进生长的变化,但与回归曲线拟合程度较低;当培养72 h时,细胞也随着蛋氨酸三肽浓度的升高呈现与48 h时相同的二次曲线变化趋势(P=0.006 0),回归方程为Y=0.000 1X2-0.006 2X+1.052 4,R2=0.994 0,式中X表示蛋氨酸浓度,Y表示相对增殖率,即当培养72 h时,BMECs会随着蛋氨酸三肽浓度的升高呈现先抑制后促进生长的变化。在培养基中加入50 μg/mL的蛋氨酸三肽培养细胞24 h后,相对增殖率最强,最佳培养时间为24 h。

表2 蛋氨酸三肽浓度与培养时间对BMECs相对增殖率的影响
同行数据肩标相同或无字母表示差异不显著(P>0.05),不同字母表示差异显著(P<0.05)。下表同。
Values in the same column with the same or no letter superscripts mean no significant difference (P>0.05), while with different letter superscripts mean significant difference (P<0.05). The same as below.
2.2蛋氨酸三肽浓度对BMECs酪蛋白基因表达量的影响
由表3可知,培养24 h后,随着蛋氨酸三肽浓度的增加,BMECs内CSN1S1、CSN1S2和CSN2基因的表达量都呈先增加后降低二次曲线趋势变化,回归方程分别为:Y=-0.000 9X2+0.119 4X-2.889 4,R2=0.729 0,P=0.271 0;Y=-0.000 5X2+0.074 0X-1.591 1,R2=0.916 5,P=0.083 5;Y=-0.001 3X2+0.156 6X-3.750 3,R2=0.887 2,P=0.112 8,式中X表示蛋氨酸三肽浓度,Y表示基因表达量;说明CSN1S1、CSN1S2和CSN2基因的表达量与蛋氨酸三肽浓度之间存在剂量依赖关系,但相关并不显著(P>0.05);而CSN3基因的表达量是随着蛋氨酸三肽浓度的增加呈现先降低后升高的变化趋势,回归方程为Y=0.000 7X2-0.084 5X+3.298 3,R2=0.921 1,P=0.078 9,式中X表示蛋氨酸三肽浓度,Y表示基因表达量。综合来看,60 μg/mL对蛋氨酸三肽对酪蛋白基因表达的促进作用较好。
2.3适宜浓度蛋氨酸三肽对BMECs中PepT1和PepT2基因表达量的影响
由表4可知,与对照处理相比,60 μg/mL的蛋氨酸三肽能显著上调PepT1和PepT2的基因表达量(P<0.05)。
3 讨 论
牛奶中90%的乳蛋白是由奶牛乳腺组织以血液中的游离氨基酸为原料合成的,但仍有10%是以氨基酸结合成小肽形式用于乳蛋白的合成[1,4]。小肽在被动物组织吸收利用的过程中主要依赖于其独立的转运载体系统,它是通过氢离子(H+)和钙离子(Ca2+)的逆浓度梯度进行转运的,并且小肽转运载体具有转运速率快、吸收耗能低且不易饱和的优点[16],而氨基酸转运载体根据氨基酸种类不同有不同的转运载体及转运方式,且耗能多载体少[17],因此动物组织对小肽的利用效率在理论上要高于游离氨基酸的利用效率。小肽转运载体主要存在于溶质转运体15(solute carrier 15,SLC15)家族,其中PepT1和PepT2是泌乳动物转运小肽的重要转运体,利用电子梯度逆浓度将大多数二肽、三肽等小肽以及许多拟肽物从胞外转运到胞内[18-19],PepT1是一种广谱的,对底物起着低亲合力、高容量的转运性能的转运载体,而PepT2表现的特性恰恰与PepT1相反,呈现底物亲合力高,低容量的性能[20]。崔艳[8]在BMECs培养的过程中,向培养基中添加苏氨酸-苯丙氨酸-苯丙氨酸(Thr-Phe-Phe)三肽,发现PepT1基因的表达显著增强;同时Zhou等[21-22]通过抑制泌乳奶牛乳腺外植体中PepT2的转运功能,发现乳蛋白合成量显著减少,并且在体外培养的BMECs能摄取苯丙氨酸-苯丙氨酸二肽(Phe-Phe)促进PepT2基因的表达并用于乳蛋白的合成,说明PepT1和PepT2在乳腺摄取小肽的过程中均发挥着重要的作用。
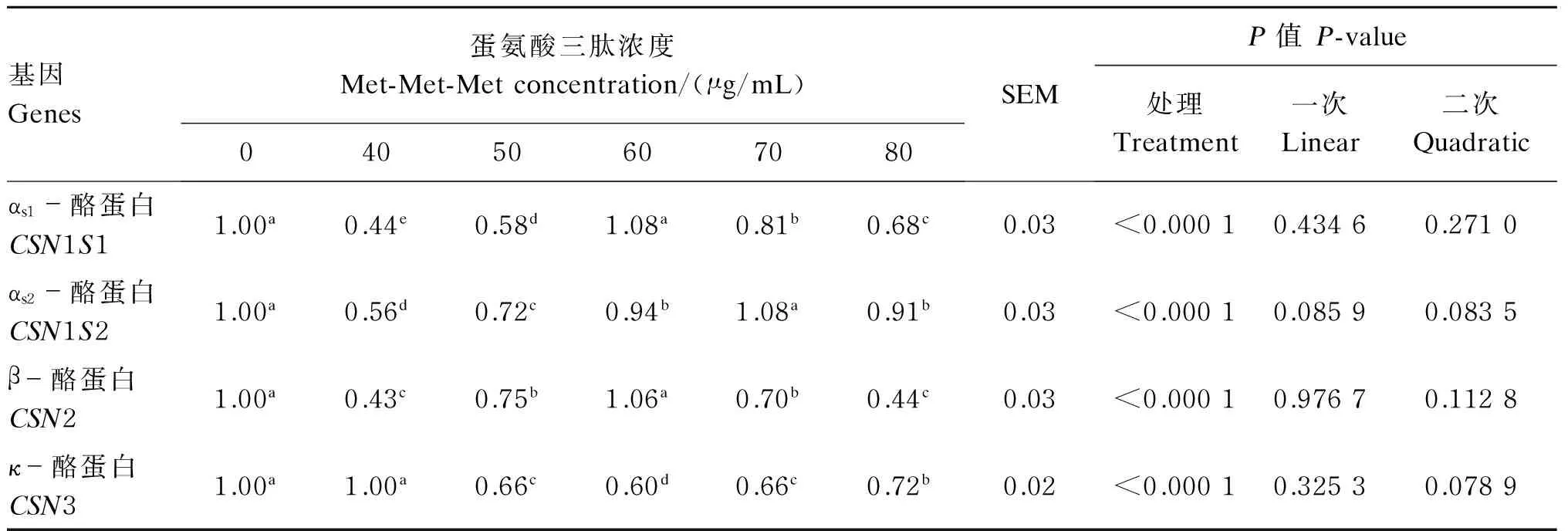
表3 蛋氨酸三肽浓度对BMECs酪蛋白基因表达量的影响

表4 适宜浓度蛋氨酸三肽对BMECs中PepT1和PepT2基因表达量的影响
相对增殖率是用来反映细胞活力和增殖的重要指标。在本研究中发现,蛋氨酸三肽作为酪蛋白合成的前体物时对BMECs活力的调节作用呈浓度依赖关系。当蛋氨酸三肽添加后,随着细胞培养时间的延长,出现不同的细胞增殖变化趋势;在培养24 h时,细胞相对增殖率,即活力最高,这与二肽适宜培养时间不同[23],可能是由于三肽中氨基酸残基个数大于二肽,在进入细胞后加速了细胞增殖代谢的过程,所以长时间的培养细胞可能导致细胞在培养过程中出现营养不足,或因长时间培养的过程中细胞在培养板中生长过多,代谢产生一些不利于细胞增殖的物质而使细胞的生长过程受到抑制。
以最佳培养时间培养细胞,发现蛋氨酸三肽浓度为60 μg/mL时,CSN1S1和CSN2基因表达量最高;当浓度达到70 μg/mL时,CSN1S2基因表达量最高;但CSN3基因呈现先降低后升高的趋势,其原因可能是由于CSN3的主要作用是防止乳蛋白凝集沉淀[24],所以在体外试验中CSN3基因出现了一定程度的下降。本试验结果表明,在培养基中加入不同浓度蛋氨酸三肽培养24 h后,在浓度为60 μg/mL时CSN1S1和CSN2基因的表达量最高,而CSN3基因表达出现抑制,这可能是由于CSN3在合成过程中对蛋氨酸需要量较少,孙康玉[23]在培养BMECs的过程中用蛋氨酸二肽等量替代游离蛋氨酸或替代1/2游离蛋氨酸,CSN3基因表达也均出现抑制,本研究结果与其类似。
小肽的运输主要依赖于PepT1和PepT2 2种小肽转运载体,2种小肽转运载体都有显著的底物特异性,同时具有多个跨膜结构[25-26]。本试验结果表明,适宜浓度的蛋氨酸三肽能促进PepT1和PepT2基因的表达,证明BMECs能够摄取和利用比二肽更长的肽链来合成乳蛋白及细胞增殖所需的骨架蛋白质等,从而达到促进BMECs增殖和酪蛋白合成的目的。然而,BMECs对小肽的具体利用机制以及酪蛋白合成中小肽与游离氨基酸的最优添加比例,都有待于进一步研究,同时其确切的机理仍需进一步探讨。
4 结 论
蛋氨酸三肽能够调节BMECs的增殖,培养基中添加60 μg/mL蛋氨酸三肽培养24 h时对BMECs相对增殖率最高,同时可以促进酪蛋白和2种小肽转运载体基因的表达。证明蛋氨酸三肽可以通过这2种小肽载体转运至细胞内,并参与乳腺细胞中乳蛋白的合成。
[1] FARRELL H M Jr,JIMENEZ-FLORES R,BLECK G T,et al.Nomenclature of the proteins of cows’ milk-sixth revision[J].Journal of Dairy Science,2004,87(6):1641-1674.
[2] PAYNE J W,MICROORGANISMS,NITROGEN S.Transport and utilization of amino acids,peptides,proteins,and related substrates[M].New York:John Wiley and Sons Ltd.,1980.
[3] TAGARI H,WEBB K E,J,THEURER T,et al.Mammary uptake,portal drained visceral flux,and hepatic metabolism of free and peptide-bound amino acids in COWS fed steam-faked or dry rolled sorghum grain diets[J].Journal of Dairy Science,2008,91(2):679-697.
[4] BACKWELL F R,BEQUETTE B J,WILSON D,et al.Evidence for the utilization of peptides for milk protein synthesis in the lactating dairy goatinvivo[J].The American Journal of Physiology,1996,271(4):R955-R960.
[5] WANG S P.Peptides as amino acid sources for the synthesis of secreted proteins by mammary tissue explants and cultured mammary epithelial cells[D].Ph.D.Thesis.Virginia:Virginia Polytechnic Institute and State University,1994.
[6] 高学军,毕微微,林叶,等.四种二肽对奶牛乳腺上皮细胞增殖及β-酪蛋白分泌的影响[J].东北农业大学学报,2013,44(3):16-20.
[7] 周苗苗.奶牛乳腺中小肽的摄取及其在乳蛋白合成中的作用[D].博士学位论文.杭州:浙江大学,2011.
[8] 崔艳.泌乳奶牛乳腺中小肽转运载体的鉴定及其生理特性的研究[D].博士学位论文.呼和浩特:内蒙古农业大学,2015.
[9] LEIBACH F H,GANAPATHY V.Peptide transporters in the intestine and the kidney[J].Annual Review of Nutrition,1996,16(1):99-119.
[10] FEI Y,KANAI Y,NUSSBERGER S,et al.Expression cloning of a mammalian proton-coupled oligopeptide transporter[J].Nature,1994,368(6471):563-566.
[11] MABJEESH S J,KYLE C E,MACRAE J C,et al.Vascular sources of amino acids for milk protein synthesis in goats at two stages of lactation[J].Journal of Dairy Science,2002,85(4):919-929.
[12] 郑勇唐,贲昆龙.测定细胞存活和增殖的MTT方法的建立[J].免疫学杂志,1992,8(4):266-269.
[13] ZHOU Y,AKERS R M,JIANG H.Growth hormone can induce expression of four major milk protein genes in transfected MAC-T cells[J].Journal of Dairy Science,2008,91(1):100-108.
[14] 张兴夫.不同日粮模式对泌乳奶牛乳腺乳蛋白合成影响的研究[D].博士学位论文.呼和浩特:内蒙古农业大学,2013.
[15] 常晨城.蛋氨酸及含蛋氨酸二肽对奶牛乳腺上皮细胞内乳蛋白合成相关基因表达的影响[D].硕士学位论文.呼和浩特:内蒙古农业大学,2015.
[16] GRONEBERG D A,DÖRING F,THEIS S,et al.Peptide transport in the mammary gland:expression and distribution ofPEPT2 mRNA and protein[J].American Journal of Physiology-Endocrinology and Metabolism,2002,282(5):E1172-E1179.
[17] 魏宗友,徐柏林,郝志敏,等.氨基酸转运载体的研究进展[J].中国饲料,2010(13):19-25.
[18] SMITH D E,CLÉMENÇON B,HSDIGER M A.Proton-coupled oligopeptide transporter familySLC15:physiological,pharmacological and pathological implications[J].Molecular Aspects of Medicine,2013,34(2/3):323-336.
[19] NEWSTEAD S,DREW D,CAMERON A D,et al.Crystal structure of a prokaryotic homologue of the mammalian oligopeptide-proton symporters,PepT1 andPepT2[J].The EMBO Journal,2011,30(2):417-426.
[20] 于辉,李华,关绣霞,等.小肽转运载体的分子营养学的研究进展[J].佛山科学技术学院学报:自然科学版,2005,23(3):77-80.
[21] ZHOU M M,WU Y M,LIU H Y,et al.Effects of tripeptides and lactogenic hormones on oligopeptide transporter 2 in bovine mammary gland[J].Journal of Animal Physiology and Animal Nutrition,2010,95(6):781-789.
[22] ZHOU M M,WU Y M,LIU H Y,et al.Effects of phenylalanine and threonine oligopeptides on milk protein synthesis in cultured bovine mammary epithelial cells[J].Journal of Animal Physiology and Animal Nutrition,2015,99(2):215-220.
[23] 孙康玉.小肽对奶牛乳腺细胞乳蛋白合成的影响[D].硕士学位论文.呼和浩特:内蒙古农业大学,2012.
[24] THORN D C,MEEHAN S,SUNDE M,et al.Amyloid fibril formation by bovine milk kappa-casein and its inhibition by the molecular chaperones alpha(S-) and beta-casein[J].Biochemistry,2006,44(51):17027-17036.
[25] TEROVA G CORS,VERRI T,et al.Impact of feed availability onPepT1 mRNA expression levels in sea bass (Dicentrarchuslabrax)[J].Aquaculture,2009,294(3/4):288-299.
[26] CHEN H,PAN Y X,WONG E A,et al.Molecular cloning and functional expression of a chicken intestinal peptide transporter (cPepT1) inXenopusoocytes and Chinese hamster ovary cells[J].Journal of Nutrition,2002,132(3):387-393.
*Corresponding author, professor, E-mail: changjinao@sohu.com
(责任编辑 王智航)
Effects of Methionine Tripeptide on Expression Levels of Casein and Small Peptide Transporters Genes in Bovine Mammary Epithelial Cells
GUO Chunli DAN Ni CAO Qina Khas-Erdene AO Changjin*
(College of Animal Science, Inner Mongolia Agricultural University, Hohhot 010018, China)
This experiment aimed to study the effects of methionine tripeptide (Met-Met-Met) on expression levels casein and small peptide transporters genes in bovine mammary epithelial cells (BMECs). Using BMECs isolated with collagenase digestion method as the model, different concentrations [0 (control), 40, 50, 60, 70 and 80 μg/mL] of Met-Met-Met were added in culture medium in different treatments and cultured for 24, 48, and 72 h, respectively, and each treatment had 5 replicates with 1 culture pore per replicate. The experiment was repeated twice. Relative growth rate was measured to determine the optimal culture time. Different concentrations [0 (control), 40, 50, 60, 70 and 80 μg/mL] of Met-Met-Met were added in culture medium in different treatments and cultured for the optimal time, and each treatment had 3 replicates with 1 culture pore per replicate. The experiment was repeated for three times. Expression levels of casein genes were determined by real-time PCR to determine the optimal Met-Met-Met concentration. Using the optimal culture time and Met-Met-Met concentration to culture cells, and culture medium without Met-Met-Met was used for control. Each treatment had 3 replicates with 1 culture pore per replicate. The experiment was repeated three times. Expression levels of peptide transporter genes were examined. The results showed as follows: relative growth rate was the highest when cells were treated with Met-Met-Met for 24 h; with the suitable culturing time of 24 h, when adding 60 μg/mL Met-Met-Met, expression levels of αs1-casein and β-casein gens were the highest, meanwhile expression levels of small peptide transporter 1 and 2 genes were significantly higher than those in control treatment (P<0.05). To sum up, adding 60 μg/mL of Met-Met-Met can increase expression levels of casein and peptide transporter genes in BMECs.[ChineseJournalofAnimalNutrition,2017,29(9):3159-3166]
methionine tripeptide; bovine mammary epithelial cells; casein; small peptide transporters
10.3969/j.issn.1006-267x.2017.09.018
2017-03-01
国家奶业“973计划”项目(2011CB100803)
郭春利(1992—),女,吉林长春人,硕士研究生,从事奶牛营养研究。E-mail: gclgcl02@foxmail.com
*通信作者:敖长金,教授,博士生导师,E-mail: changjinao@aliyun.com
S823
:A
:1006-267X(2017)09-3159-08
