植物YSL家族基因研究进展
2017-09-16刘元峰李素贞郭晋杰陈景堂
刘元峰 李素贞 郭晋杰 陈景堂
(河北农业大学农学院 国家玉米改良中心河北分中心 河北省作物种质资源实验室,保定 071001)
综述与专论
植物YSL家族基因研究进展
刘元峰 李素贞 郭晋杰 陈景堂
(河北农业大学农学院 国家玉米改良中心河北分中心 河北省作物种质资源实验室,保定 071001)
黄色条纹蛋白(Yellow stripe-like protein,YSL)是广泛存在于植物中的重金属吸收、转运蛋白,主要参与植物Fe3+的吸收及对Fe2+、Zn2+、Cu2+、Ni2+和Mn2+等金属离子的转运。目前,对于黄色条纹蛋白在植物体内的表达模式,亚细胞定位以及突变体等方面的研究揭示了其在植物生长发育过程中的作用。综述了近年来关于YSL基因在植物中的研究进展,旨为研究植物吸收铁的作用机理及生物强化谷物籽粒中的铁含量奠定基础。
铁;黄色条纹蛋白;铁吸收;金属转运体
铁是植物生长发育所必需的微量元素,在植物的呼吸作用、光合作用、蛋白质和核酸的合成及酶促反应中发挥重要的作用[1]。铁缺乏会导致叶绿素合成受阻,表现为新叶黄化,严重时会影响作物的产量和品质。人类缺铁会导致贫血,严重时会引起头晕、心脏病等;孕妇缺铁会影响胎儿智力发育。据统计,全世界有近半数的人口受缺铁影响,特别是在发展中国家的人口中缺铁比较严重[2]。
铁在地壳中含量丰富,但地球上许多生物都存在缺铁现象。据统计,全世界大约30%的土壤是石灰性土壤,约40%的土壤缺铁,植物缺铁黄化已成为严重的植物营养失调问题[3-5]。在通气良好正常pH土壤中,Fe2+和Fe3+的浓度通常不超过10-15mol/L,而植物正常生长所需铁浓度为10-9-10-4mol/L[3,6],土壤中的铁远低于植物所需要的铁量。为吸收土壤中难溶性的铁,植物进化出两种铁的吸收机制。而根据铁吸收机制的不同,植物被划分为机制I和机制II植物[7]。双子叶植物和非禾本科单子叶植物利用机制I从土壤中吸收铁。在缺铁胁迫下,植物首先通过H+-ATPase释放H+至根际以酸化土壤,增加Fe3+的可溶性,进而通过铁氧化还原酶(FRO)将Fe3+还原成Fe2+,最后IRT1将Fe2+转运至细胞内[8]。禾本科植物利用机制II吸收铁。在缺铁胁迫下,禾本科植物在体内合成大量麦根酸(MAs)类物质,并分泌至根际;植物铁载体(PS)麦根酸类物质螯合Fe3+形成复合物,再由黄色条纹蛋白(YSL)将这种复合物转运至细胞内。黄色条纹蛋白ZmYS1首先从玉米基因组中被分离出来,其转运Fe(III)-植物铁载体螯合物,它是多肽转运蛋白家族的一个成员[9,10]。ys1突变体由于不能转运Fe3+-PS复合物而表现出明显的缺铁症状[11]。由此可见,YSL在禾本科植物吸收铁的过程中起着非常重要的作用。虽然非禾本科植物、蕨类植物、裸子植物和苔藓不能合成与利用植物铁载体PS,但是在这些植物中也存在YSL蛋白,YSL主要的生理功能是转运金属与NA的螯合物。已经有一些YSL蛋白转运金属-NA复合物的研究被报道。NA可以与锌、铁、铜、锰、镍等形成复合物,NA对于金属在植物体内的长距离运输是必需的。并且YSL蛋白对于金属-NA复合物的运输也是必需的。综上所述,YSL不论对于禾本科植物还是双子叶植物都具有非常重要的作用。在拟南芥、水稻及大麦等作物中,已报道了一些有关YSL基因的研究(表1)。因此,本文主要对YSL蛋白的发现、结构及功能的研究进行综述,以期为进一步了解植物体内铁吸收及运输的机制提供参考。
1 YSL蛋白的发现
植物缺铁会造成子叶变黄,生长受阻,严重时会导致植物产量和品质下降。禾本科植物在根表面通过一种特定的转运蛋白来吸收Fe3+-PS螯合物[39,40]。早期研究表明,玉米ys1突变体造成植株Fe3+-PS[39,41]和Zn-DMA[42]螯合物吸收系统缺陷。ZmYS1是最早从缺铁的cDNA文库中分离得到的基因,由于其突变体不能转运Fe3+-PS而表现出叶脉变黄,叶片呈黄色条纹状,因此,该基因被命名为yellow stripe(YS)[11,43]。
2 YSL蛋白的结构
通过对YSL家族结构模式的研究发现,YSL家族并没有一致的拓扑结构。使用SOSUI[44]进行预测,显示ZmYS1和HvYS1具有12个跨膜结构域[45]。使用TOPCONS软件[46]预测ZmYS1和HvYS1具有15个跨膜结构域[47]。图1所示SOSUI和TOPCONS预测的ZmYS1拓扑结构图。按照SOSUI模型对ZmYS1与HvYS1结构研究发现,在第6与第7跨膜区之间有一外膜环状可变区。通过评估HvYS1-ZmYS1嵌合体的转运活性表明,第6与第7跨膜区之间的外膜环对于转运底物特异性具有作用[45,48]。通过对拟南芥、水稻和玉米所有YSL蛋白进行分析发现,只有OsYSL17和ZmYSL6的氨基末端位于胞外,其余蛋白的氨基末端都位于胞内。因此,YSL家族真正的拓扑结构仍然不太清楚,还需要进一步研究。
3 YSL家族基因研究现状
YSL蛋白已在多种植物中报道,进化树显示(图2)YSL蛋白可划分为4个亚家族。ZmYS1、OsYSL15、HvYS1、BdYS1A和BdYS1B属于第Ⅰ亚家族,在根中受缺铁诱导,可转运Fe3+-PS螯合物,具有从土壤中吸收铁的功能[12,21,23,27,35]。在第Ⅱ亚家族中,AtYSL4和AtYSL6定位于液泡膜和叶绿体外膜,OsYSL6定位于细胞质,推测YSL蛋白的这一亚家族可能对于金属螯合物在胞内的运输中起着重要作用[19,22,49]。每一类YSL可能具有不同表达模式、亚细胞定位,并且对金属离子具有不同的选择性,这些不同决定了其具有不同的生理功能。
3.1 玉米(Zea mays L.)YSL家族基因的研究
ZmYS1是最早在玉米中被发现的基因,在缺铁条件下,ZmYS1在根和地上部表达上调[11,12,14]。ZmYS1定位于侧根和根冠的表皮细胞及叶肉细胞[12],表明ZmYS1可能参与根中铁的吸收和细胞内的运输。ZmYS1在酵母突变体中能够转运Fe(III)-DMA、Fe(III)-MA、Fe(II)-NA、Zn-DMA、Ni-NA、Cu-MA螯合物[13,14],在爪蟾卵母细胞中,其表达产物也能够介导Fe(III)-DMA、Fe(III)-MA、Fe(II)-NA、Zn-DMA、Cu-MA、Ni-MA、Cd-DMA的转运[13],表明ZmYS1具有广泛的底物转运特异性。关于玉米中其它YSLs基因的表达模式、亚细胞定位及底物选择性等未见报道,所以其它ZmYSLs基因的功能还有待于进一步研究。
3.2 拟南芥(Arabidopsis thaliana)YSL家族基因的研究
尽管双子叶植物不能合成植物铁载体,但在拟南芥中也有关于YSL家族成员的研究。YSL类蛋白在拟南芥中主要参与Fe-NA或Fe-citrate复合物的运输。在拟南芥中共预测到8个YSL基因。缺铁条件下,AtYSL1、AtYSL2和AtYSL3在地上部的表达量均降低[17,18]。高铁条件下,AtYSL1在叶的木质部薄壁组织中表达上调,在花粉粒和幼角果中也有表达。ysl1突变体在地上部积累大量NA,而种子中NA和铁的含量明显要比野生型中的含量低[16]。这些结果表明,AtYSL1可能具有将铁从茎叶转运至种子中的作用[16]。AtYSL3在根部和地上部均有表达,在衰老的莲座叶和茎生叶中表达量最高。ysl1和ysl3突变体植株没有明显的表型,而ysl1ysl3双突变体表现出明显的缺铁症状[17]。ysl1ysl3双突变体在叶中铁的含量减少,而锰、锌和铜的含量增加,种子中
铁、锌和铜的含量降低。ysl1ysl3双突变体影响花粉和胚的发育,表明AtYSL1和AtYSL3参与叶中金属离子的运输及种子中的储存[17]。AtYSL1和AtYSL3能够转运Fe2+-NA螯合物,但同时检测到AtYSL3也具有转运Fe3+-DMA的功能[15]。由于拟南芥不能合成PS,因此猜测AtYSL3也具有转运Fe3+-NA的活性,因为NA在所有植物体内均存在[43]。但在实验中并没有检测到AtYSL3具有转运Fe3+-NA的活性,所以AtYSL3真正的转运底物特异性还需要进一步的研究。AtYSL2在根和地上部的许多细胞中表达,其蛋白定位于维管束薄壁细胞的质膜上,AtYSL2在外源提供Fe2+-NA,Cu2+-NA时能够恢复相应酵母吸收缺陷突变体的生长[18]。AtYSL2在缺锌、缺铁的根及地上部表达下调[50]。以上结果表明,AtYSL2可能参与铁铜在维管束中的运输及锌铁在植物体内的稳态[18,50,51]。AtYSL4和AtYSL6蛋白定位于液泡膜和叶绿体被膜上。在高Mn、高Ni条件下,ysl4和ysl6突变体显示生长缺陷,表明这两种转运蛋白具有对重金属胁迫的响应作用。组成型过表达YSL4或YSL6极大的减弱了植株对缺铁的耐性,同时极大的降低了叶绿体内的铁含量[19,49]。此外,AtYSL4和AtYSL6还是液泡膜蛋白质组的成员[52]。这些结果表明,AtYSL4和AtYSL6可能具有将锰镍转运出液泡及叶绿体进而对铁起到解毒的作用。
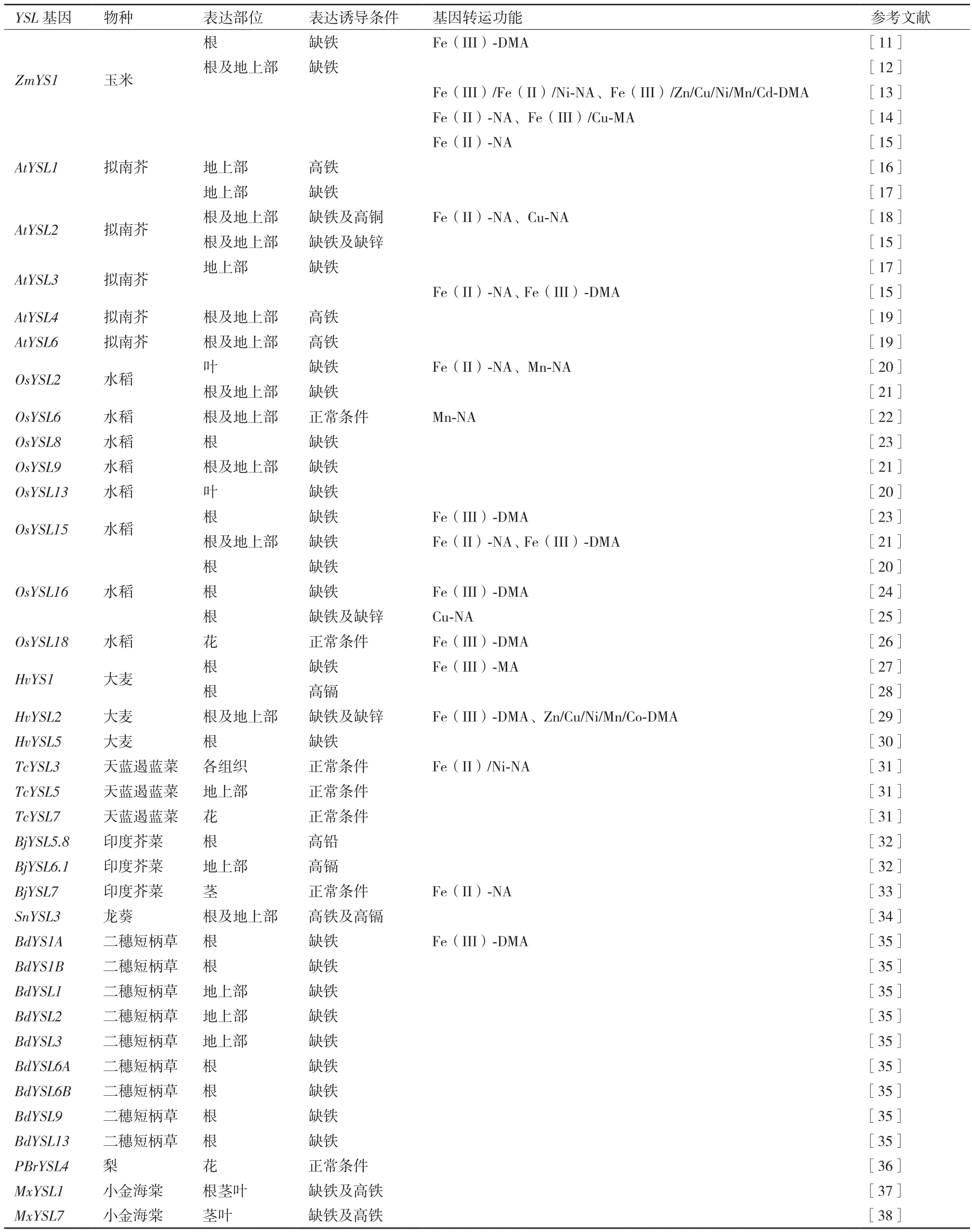
表 1 不同植物 YSL 家族基因及功能
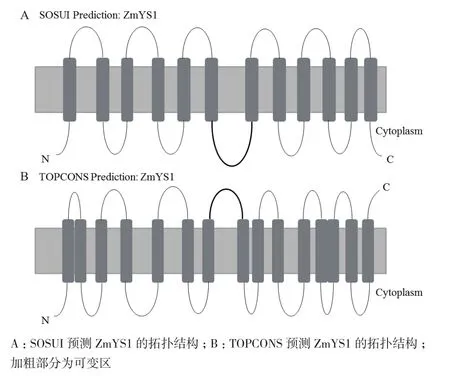
图1 ZmYS1蛋白拓扑结构预测
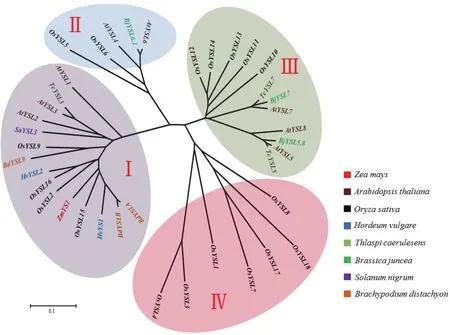
图2 不同物种YSL成员系统发育进化树
3.3 水稻(Oryza sativa)YSL家族基因的研究
在水稻全基因组中共预测出18个YSL家族成员,与ZmYS1序列相似性达到36%-76%[20]。OsYSL2蛋白由674个氨基酸组成,含有14个跨膜结构域。OsYSL2在叶片中受缺铁诱导表达,其蛋白定位于质膜上。GUS染色显示,OsYSL2在根的伴胞、叶及叶鞘韧皮部薄壁细胞中表达量较高,在发育的花和种子中也有表达,OsYSL2可转运Fe2+-NA和Mn2+-NA螯合物,表明OsYSL2可能负责铁锰在韧皮部的运输及将其转运至籽粒中的过程[20,53]。OsYSL6在根及地上部表达,基因敲除后植物在高锰的根及地上部表现生长缓慢,OsYSL6具有转运Mn-NA螯合物的功能,表明OsYSL6参与水稻体内锰的解毒[22]。OsYSL15在缺铁根的表皮、外皮层以及韧皮部细胞中表达,在花和种子中也有表达。其蛋白定位于质膜上,敲除ysl15突变体幼苗表现缺铁黄化,生长受阻,根、地上部及种子中的铁含量减少。过表达OsYSL15可增加叶及种子中的铁含量。此外,OsYSL15可转运Fe3+-DMA和Fe2+-NA螯合物。这些结果表明,OsYSL15对铁在植物体内的吸收、运输及储存具有重要作用[21,23]。OsYSL16和OsYSL18编码Fe3+-DMA转运体,参与铁在植物体内的分布和运输,特别是在生殖器官中铁的运输[24,26,54]。OsYSL16在根表皮细胞和整个植株的维管束中表达,在原节点的维管束中,在老叶的木质部和新叶的韧皮部中均有表达,表明OsYSL16可能通过维管束参与铁的分配[24]。另外,OsYSL16也可以转运Cu-NA,负责水稻体内铜的分布[25]。OsYSL18由679个氨基酸组成,含有13个跨膜结构域,其蛋白定位于质膜上。OsYSL18在植物特定部位表达,包括生殖器官(花粉/花粉管)和营养器官(叶节点/根冠内皮层/韧皮部软组织/叶鞘基部的伴胞细胞),表明OsYSL18参与铁在生殖器官和韧皮部节点中的运输[26]。
3.4 大麦(Hordeum vulgare)YSL家族基因的研究在大麦中,HvYS1在根中受缺铁和高镉诱导表达[28],其蛋白定位于根的表皮细胞[12,27]。HvYS1在爪蟾卵母细胞中能够转运Fe3+-MA螯合物,不能转运Zn2+-MA、Cu2+-MA及Ni2+-MA螯合物。酵母互补实验证明HvYS1具有转运Fe3+-MA的功能[27],表明HvYS1具有专一的底物特异性。在矮牵牛中过表达HvYS1能够增加植株在Fe3+-DMA处理的碱性条件下的耐受性,转基因植株花的颜色也明显更深,表明HvYS1能促进植株在碱性条件下对铁的吸收[55]。最近的研究表明,利用玉米ubiquitin1启动子启动HvYS1在水稻中过表达,过表达植株根、叶、稻壳和种子中铁含量与野生型相比显著增高,在胚乳中锌、锰的含量无明显变化,而铜的含量显著降低。此外,过表达植株在高镉的根、叶及种子中镉的含量也显著降低。这些结果表明,异位过表达HvYS1促进了水稻体内铁的吸收、转运及储存并导致内源金属达到新的平衡[56]。HvYSL2在根和地上部受缺铁诱导,其蛋白定位于根的内皮层,HvYSL2可转运Fe3+-PS,Zn2+-PS,Ni2+-PS,Cu2+-PS,Mn2+-PS,Co2+-PS螯合物[29],可能在大麦体内对于金属离子的运输具有作用。HvYSL5主要在大麦的根中表达,并且受缺铁诱导,时空表达分析发现HvYSL5的表达呈现出昼夜节律,敲除HvYSL5后植物没有表现出明显的表型,推测HvYSL5可能具有瞬时存储铁或植物铁载体的功能[30]。
3.5 超富集植物YSL基因的研究
Gendre等[31]从天蓝遏蓝菜(Thlaspi caerulescens)中克隆出3个YSL基因。TcYSL3在植物各组织中均有表达,TcYSL5在地上部表达量较高,TcYSL7在花中表达量较高。原位杂交实验表明,TcYSL5和TcYSL7在地上部维管组织及根的中柱中表达。酵母互补实验和吸收测定表明,TcYSL3是一个Fe/Ni-NA转运体。
Das等[32]从印度芥菜(Brassica juncea)中克隆了27个YSL基因。BjYSL5.8在缺锌、高铅处理的根中表达上调,而在高镉的根中表达下调,BjYSL6.1在缺铁、高镉地上部表达上调,表明YSLs基因在超富集植物中对金属离子的运输具有作用。Wang等[33]从印度芥菜中克隆到BjYSL7基因,BjYSL7主要在茎中表达,当用Fe、Ni和Cd处理时,BjYSL7的表达量显著增高。BjYSL7可转运Fe2+-NA螯合物。BjYSL7::EGFP融合蛋白定位于洋葱表皮细胞的质膜。在烟草中过表达BjYSL7在镉、镍处理下与野生型相比具有更长的根。镉和镍的含量在过表达植株的地上部增加,铁的含量在地上部和种子中增加,在根中减少。这些结果表明,BjYSL7参与铁、镉和镍向地上部的运输及提高植株对重金属的耐受性。
Feng等[34]从龙葵(Solanum nigrum)中克隆出SnYSL3基因。RNA原位杂交实验表明,SnYSL3主要在根、茎的表皮细胞和维管组织中表达,而在叶的维管组织中mRNA的含量高。在高Cd、高Fe和缺Cu条件下,SnYSL3的表达上调。在酵母中,SnYSL3可转运Fe(II)/Cu/ Zn/Cd-NA复合物。在拟南芥中过表达SnYSL3能降低根中Fe和Mn含量,促进根至地上部的运输。在有Cd条件下,转基因拟南芥自根向地上部转运Fe、Cd的量增加。以上结果表明SnYSL3具有广泛的底物特异性,并且对于应答重金属的胁迫有重要作用,尤其是Fe、Cd。
3.6 其它植物YSL基因的研究
Yordem等[35]在二穗短柄草(Brachypodium distachyon)中鉴定出19个YSL基因。低铁条件下,BdYS1A、BdYS1B、BdYSL6A、BdYSL6B和BdYSL9在根中表达上调,BdYSL1,BdYSL2和BdYSL3在地上部表达下调,而BdYSL13在根中表达下调,BdYS1A可转运Fe3+-DMA螯合物,表明BdYSL可能在植物铁代谢中发挥作用。Yang等[36]从梨(Pyrus bretschneideri)中鉴定出8个YSL基因,在进化树中可分为4组。花粉活性分析表明,低浓度的铁离子有利于梨花粉萌发和花粉管生长。在8个YSL基因中,PBrYSL4在所有组织中高表达。其中,7个YSL基因在梨花粉中表达,PBrYSL4参与铁在花粉中的运输。此外,在高铁处理条件下,PBrYSL4能恢复酵母突变体Δccc1的生长。以上结果表明,PBrYSL4参与梨花粉管生长中的铁运输。刘丽丽等[37,38]从小金海棠(Malus xiaojinenesis)中克隆到MxYSL1和MxYSL7基因,MxYSL1在根、茎、新叶和成熟叶中均有表达,低铁时MxYSL1 在新叶中表达上调,过量铁时MxYSL1在根、茎和成熟叶中诱导增强表达[37]。MxYSL7在茎、新叶和成熟叶中表达,低铁时MxYSL7在新叶中表达上调,过量铁时茎和成熟叶中MxYSL7表达增强[38]。这些结果表明,MxYSL1和MxYSL7可能参与铁从筛管卸载到叶肉细胞及植物体内铁的解毒。
4 结语
近年来,YSL基因在参与植物体内微量元素吸收、转运和保持体内金属离子平衡中的研究取得了一定的进展。并且,YSL表达模式、组织分布以及亚细胞定位等实验的研究,对于阐明其在植物铁吸收和金属螯合物的运输中的功能具有重要作用。此外,对于YSL基因功能的研究将有助于我们筛选到能够用于提高主粮作物微量营养元素含量的功能基因将其应用于农业生产上。例如,在水稻中过表达HvYS1能够增强水稻吸收、转运及储存铁的功能,最终使水稻籽粒中铁的含量提高。并且,HvYS1对铁的吸收和转运是特异的,过表达该基因不会导致其它重金属离子在籽粒中增加。因此HvYS1可用于增加谷物籽粒中的铁含量。同样,过表达OsYSL15可增加水稻叶片及种子中的铁含量。此外,在矮牵牛中过表达HvYS1能够增加植株在碱性条件对缺铁的耐受性。因此,YSLs在提高谷物籽粒中的铁含量及增强植物对缺铁的抗逆性方面是有重要作用的。然而,当前关于YSLs的研究大多还处于对基因表达模式、组织分布以及亚细胞定位等研究的初步阶段,对于YSLs在提高谷物籽粒中铁含量及增强植物对缺铁抗逆性方面的研究还很少。并且,在玉米中除了对ZmYS1基因进行了初步的研究外,关于玉米中其它YSLs基因的功能分析还未见报道。因此,我们对玉米中的YSLs家族基因进行了初步分析,并将进一步对ZmYSLs基因的功能进行研究,为了解玉米中铁吸收及运输的相关作用机理以及培育铁高效的植物新品种提供功能基因及理论依据。
[1] Goyer RA. Nutrition and metal toxicity[J]. American Journal of Clinical Nutrition, 1995, 61(3 Suppl):646s-650s.
[2] Yuan DS, Stearman R, Dancis A, et al. The Menkes/Wilson disease gene homologue in yeast provides copper to a ceruloplasmin-like oxidase required for iron uptake[J]. Proceedings of the National Academy of Sciences of the United States of America, 1995, 92(7):2632-2636.
[3] Guerinot ML, Yi Y. Iron:nutritious, noxious, and not readily available[J]. Plant Physiology, 1994, 104(3):815-820.
[4] Mori S. Iron acquisition by plants[J]. Current Opinion in Plant Biology, 1999, 2(3):250-253.
[5] 云少君, 赵广华. 植物铁代谢及植物铁蛋白结构与功能研究进展[J]. 生命科学, 2012, 24(8):809-816.
[6] Marschner H. Mineral nutrition of higher plants[J]. Journal of Ecology, 1995, 76(4):681-861.
[7] Romheld V, Marschner H. Evidence for a specific uptake system for iron phytosiderophores in roots of grasses[J]. Plant Physiology, 1986, 80(1):175-180.
[8] Eide D, Broderius M, Fett J, et al. A novel iron-regulated metal transporter from plants identified by functional expression in yeast[J]. Proceedings of the National Academy of Sciences of the United States of America, 1996, 93(11):5624-5628.
[9] Yen MR, Tseng YH, Jr SM. Maize Yellow Stripe1, an ironphytosiderophore uptake transporter, is a member of the oligopeptide transporter(OPT)family[J]. Microbiology, 2001, 147(Pt 11):2881-2883.
[10] Lubkowitz M. The OPT family functions in long-distance peptide and metal transport in plants[J]. Genetic Engineering, 2006, 27(3):35-55.
[11] Curie C, Panaviene Z, Loulergue C, et al. Maize yellow stripe1 encodes a membrane protein directly involved in Fe(III)uptake[J]. Nature, 2001, 409(6818):346-349.
[12] Ueno D, Yamaji N, Ma JF. Further characterization of ferricphytosiderophore transporters ZmYS1 and HvYS1 in maize and barley[J]. Journal of Experimental Botany, 2009, 60(12):3513-3520.
[13] Schaaf G, Ludewig U, Erenoglu BE, et al. ZmYS1 functions as a proton-coupled symporter for phytosiderophore- and nicotianaminechelated metals[J]. Journal of Biological Chemistry, 2004, 279(10):9091-9096.
[14] Roberts LA, Pierson AJ, Panaviene Z, et al. Yellow stripe1. Expanded roles for the maize iron-phytosiderophore transporter[J]. Plant Physiology, 2004, 135(1):112-120.
[15] Chu HH, Chiecko J, Punshon T, et al. Successful reproduction requires the function of Arabidopsis Yellow Stripe-Like1 and Yellow Stripe-Like3 metal-nicotianamine transporters in both vegetative and reproductive structures[J]. Plant Physiology, 2010, 154(1):197-210.
[16] Le Jean M, Schikora A, Mari S, et al. A loss-of-function mutation in AtYSL1 reveals its role in iron and nicotianamine seed loading[J]. Plant Journal, 2005, 44(5):769-782.
[17] Waters BM, Chu HH, Didonato RJ, et al. Mutations in Arabidopsis yellow stripe-like1 and yellow stripe-like3 reveal their roles in metal ion homeostasis and loading of metal ions in seeds[J]. Plant Physiology, 2006, 141(4):1446-1458.
[18] DiDonato RJ, Jr. , Roberts LA, Sanderson T, et al. Arabidopsis Yellow Stripe-Like2(YSL2):a metal-regulated gene encoding a plasma membrane transporter of nicotianamine-metal complexes[J]. Plant Journal, 2004, 39(3):403-414.
[19] Divol F, Couch D, Conejero G, et al. The Arabidopsis YELLOW STRIPE LIKE4 and 6 transporters control iron release from the chloroplast[J]. Plant Cell, 2013, 25(3):1040-1055.
[20] Koike S, Inoue H, Mizuno D, et al. OsYSL2 is a rice metalnicotianamine transporter that is regulated by iron and expressed inthe phloem[J]. Plant Journal, 2004, 39(3):415-424.
[21] Lee S, Chiecko JC, Kim SA, et al. Disruption of OsYSL15 leads to iron inefficiency in rice plants[J]. Plant Physiology, 2009, 150(2):786-800.
[22] Sasaki A, Yamaji N, Xia J, et al. OsYSL6 is involved in the detoxification of excess manganese in rice[J]. Plant Physiology, 2011, 157(4):1832-1840.
[23] Inoue H, Kobayashi T, Nozoye T, et al. Rice OsYSL15 is an ironregulated iron(III)-deoxymugineic acid transporter expressed in the roots and is essential for iron uptake in early growth of the seedlings[J]. Journal of Biological Chemistry, 2009, 284(6):3470-3479.
[24] Kakei Y, Ishimaru Y, Kobayashi T, et al. OsYSL16 plays a role in the allocation of iron[J]. Plant Molecular Biology, 2012, 79(6):583-594.
[25] Zheng L, Yamaji N, Yokosho K, et al. YSL16 is a phloem-localized transporter of the copper-nicotianamine complex that is responsible for copper distribution in rice[J]. Plant Cell, 2012, 24(9):3767-3782.
[26] Aoyama T, Kobayashi T, Takahashi M, et al. OsYSL18 is a rice iron(III)-deoxymugineic acid transporter specifically expressed in reproductive organs and phloem of lamina joints[J]. Plant Molecular Biology, 2009, 70(6):681-692.
[27] Murata Y, Ma JF, Yamaji N, et al. A specific transporter for iron(III)-phytosiderophore in barley roots[J]. Plant Journal, 2006, 46(4):563-572.
[28] Hodoshima H, Enomoto Y, Shoji K, et al. Differential regulation of cadmium-inducible expression of iron-deficiency-responsive genes in tobacco and barley[J]. Physiologia Plantarum, 2007, 129(3):622-634.
[29] Araki R, Murata J, Murata Y. A novel barley yellow stripe 1-like transporter(HvYSL2)localized to the root endodermis transports metal-phytosiderophore complexes[J]. Plant and Cell Physiology, 2011, 52(11):1931-1940.
[30] Zheng L, Fujii M, Yamaji N, et al. Isolation and characterization of a barley yellow stripe-like gene, HvYSL5[J]. Plant and Cell Physiology, 2011, 52(5):765-774.
[31] Gendre D, Czernic P, Conejero G, et al. TcYSL3, a member of the YSL gene family from the hyper-accumulator Thlaspi caerulescens, encodes a nicotianamine-Ni/Fe transporter[J]. Plant Journal, 2007, 49(1):1-15.
[32] Das S, Seal A. Isolation and expression analysis of partial sequences of heavy metal transporters from Brassica juncea by coupling high throughput cloning with a molecular fingerprinting technique[J]. Planta, 2011, 234(1):139-156.
[33] Wang JW, Li Y, Zhang YX, et al. Molecular cloning and characterization of a Brassica juncea yellow stripe-like gene, BjYSL7, whose overexpression increases heavy metal tolerance of tobacco[J]. Plant Cell Reports, 2013, 32(5):651-662.
[34] Feng SS, Tan JJ, Zhang YX, et al. Isolation and characterization of a novel cadmium-regulated Yellow Stripe-Like transporter(SnYSL3)in Solanum nigrum[J]. Plant Cell Reports, 2017, 36(2):281-296.
[35] Yordem BK, Conte SS, Ma JF, et al. Brachypodium distachyon as a new model system for understanding iron homeostasis in grasses:phylogenetic and expression analysis of Yellow Stripe-Like(YSL)transporters[J]. Annals of Botany, 2011, 108(5):821-833.
[36] Yang J, Chen J, Chen X, et al. Phylogenetic and expression analysis of pear yellow stripe-like transporters and functional verification of PbrYSL4 in pear pollen[J]. Plant Molecular Biology Reporter, 2016, 34(4):737-747.
[37] 刘丽丽, 许雪峰, 孔瑾, 等. 小金海棠MxYSL1基因的克隆与表达分析[J]. 农业生物技术学报, 2009, 17(2):288-293.
[38] 刘丽丽, 孔谨, 许雪峰, 等. 小金海棠类黄色条纹蛋白基因MxYSL7的克隆与表达分析[J]. 中国农业大学学报, 2008, 13(6):25-30.
[39] Von Wiren N, Mori S, Marschner H, et al. Iron inefficiency in maize mutant ys1(Zea mays L. cv yellow-stripe)is caused by a defect in uptake of iron phytosiderophores[J]. Plant Physiology, 1994, 106(1):71-77.
[40] Von Wiren N, Marschner H, Romheld V. Uptake kinetics of iron-phytosiderophores in two maize genotypes differing in iron efficiency[J]. Physiologia Plantarum, 1995, 93(4):611-616.
[41] Hopkins BG, Jolley VD, Brown JC. Plant utilization of iron solubilized by oat phytosiderophore[J]. Journal of Plant Nutrition, 1992, 15(10):1599-1612.
[42] Von Wiren N, Marschner H, Romheld V. Roots of iron-efficient maize also absorb phytosiderophore-chelated zinc[J]. Plant Physiology, 1996, 111(4):1119-1125.
[43] Von Wiren N, Klair S, Bansal S, et al. Nicotianamine chelates bothFeIII and FeII. Implications for metal transport in plants[J]. Plant Physiology, 1999, 119(3):1107-1114.
[44] Hirokawa T, Boon-Chieng S, Mitaku S. SOSUI:classification and secondary structure prediction system for membrane proteins[J]. Bioinformatics, 1998, 14(4):378-379.
[45] Harada E, Sugase K, Namba K, et al. Structural element responsible for the Fe(III)-phytosiderophore specific transport by HvYS1 transporter in barley[J]. FEBS Letters, 2007, 581(22):4298-4302.
[46] Hennerdal A, Elofsson A. Rapid membrane protein topology prediction[J]. Bioinformatics, 2011, 27(9):1322-1323.
[47] Conte SS, Walker EL. Genetic and biochemical approaches for studying the yellow stripe-like transporter family in plants[J]. Current Topics in Membranes, 2012, 69(69):295-322.
[48] Murata Y, Harada E, Sugase K, et al. Specific transporter for iron(III)-phytosiderophore complex involved in iron uptake by barley roots[J]. Pure and Applied Chemistry, 2008, 80(12):2689-2697.
[49] Conte SS, Chu HH, Rodriguez DC, et al. Arabidopsis thaliana Yellow Stripe1-Like4 and Yellow Stripe1-Like6 localize to internal cellular membranes and are involved in metal ion homeostasis[J]. Frontiers in Plant Science, 2013, 4:283.
[50] Schaaf G, Schikora A, Haberle J, et al. A putative function for the Arabidopsis Fe-Phytosiderophore transporter homolog AtYSL2 in Fe and Zn homeostasis[J]. Plant and Cell Physiology, 2005, 46(5):762-774.
[51] Colangelo EP, Guerinot ML. Put the metal to the petal:metal uptake and transport throughout plants[J]. Current Opinion in Plant Biology, 2006, 9(3):322-330.
[52] Jaquinod M, Villiers F, Kieffer-Jaquinod S, et al. A proteomics dissection of Arabidopsis thaliana vacuoles isolated from cell culture[J]. Molecular and Cellular Proteomics, 2007, 6(3):394-412.
[53] Ishimaru Y, Masuda H, Bashir K, et al. Rice metal-nicotianamine transporter, OsYSL2, is required for the long-distance transport of iron and manganese[J]. Plant Journal, 2010, 62(3):379-390.
[54] Lee S, Ryoo N, Jeon JS, et al. Activation of rice Yellow Stripe1-Like 16(OsYSL16)enhances iron efficiency[J]. Molecules and Cells, 2012, 33(2):117-126.
[55] Murata Y, Itoh Y, Iwashita T, et al. Transgenic petunia with the Iron(III)-Phytosiderophore transporter gene acquires tolerance to iron deficiency in alkaline environments[J]. PloS One, 2015, 10(3):e0120227.
[56] Banakar R, Fernández ÁA, Abadía J, et al. The expression of heterologous Fe(III)phytosiderophore transporter HvYS1 in rice increases Fe uptake, translocation and seed loading and excludes heavy metals by selective Fe transport[J]. Plant Biotechnology Journal, 2017, 15(4):423-432.
(责任编辑 狄艳红)
Research Progress on YSL Transporters Gene Family
LIU Yuan-feng LI Su-zhen GUO Jin-jie CHEN Jing-tang
(Department of Agronomy,Agricultural University of Hebei/Hebei Sub-center of National Maize Improvement Center/Key Laboratory for Crop Germplasm Resources of Hebei,Baoding 071001)
YSL(yellow stripe-like protein)are widely present in plants for the absorption and transporter of heavy metal. They are mainly involved in the absorption of Fe3+and the transport of metal ions such as Fe2+,Zn2+,Cu2+,Ni2+and Mn2+. At present,the research on the expression pattern,subcellular localization and the mutant of YSL in plants reveals its role in plant growth and development. In this paper,the research progress of YSL genes in plants in recent years are reviewed,which aims to lay the foundation for studying the mechanism of plant absorbing iron and the iron content in cereal grains by the biological enhancement.
iron;yellow stripe-like protein;iron acquisition;metal transporter
10.13560/j.cnki.biotech.bull.1985.2017-0375
2017-05-09
国家自然科学基金项目(31671768),河北省研究生创新资助项目(2015-2016)
刘元峰,男,硕士研究生,研究方向:作物遗传育种;E-mail:liuyuanfeng316@163.com
陈景堂,男,博士,教授,研究方向:玉米遗传育种;E-mail:chenjingtang@126.com
