磁小体膜蛋白Mms6功能与应用研究进展
2017-09-16马坤赵宏鑫2李倩王嘉榕孙红宾
马坤赵宏鑫,2李倩王嘉榕孙红宾
(1. 中国科学院强磁场科学中心,合肥 230031;2. 中国科学技术大学生命科学院,合肥 230031)
磁小体膜蛋白Mms6功能与应用研究进展
马坤1赵宏鑫1,2李倩1王嘉榕1孙红宾1
(1. 中国科学院强磁场科学中心,合肥 230031;2. 中国科学技术大学生命科学院,合肥 230031)
磁小体是趋磁细菌的内膜内陷形成的一种特殊生物矿化产物。磁小体在细胞内呈现为链状,外部有一层生物膜包裹,内部是四氧化三铁纳米晶体。这些磁性纳米晶体有着高度均一的尺寸和形貌。目前大量研究结果表明磁小体膜上的蛋白与铁离子的富集、氧化还原反应以及晶体成核、生长有着重要的关系。综述了趋磁细菌从吸收铁离子到矿化形成磁性纳米颗粒过程中,磁小体膜蛋白的功能,重点介绍了六号特殊膜蛋白Mms6的结构特性与功能。同时总结了Mms6作为一种仿生的添加剂在新型磁性纳米材料中的应用,并且讨论了Mms6在磁小体形成中可能的分子调节机制,旨为进一步了解生物矿化机制提供思路。
磁小体;生物矿化;Mms6蛋白;仿生材料合成
磁性纳米材料对于药学和诊断医学的发展有着重要的意义,如应用于磁共振成像的造影剂,细胞分离、环境检测、疫苗药物输送和磁热效应等方面[1-6]。磁性纳米材料能够在生物医学医药领域兴起,最重要的原因是磁性纳米材料在磁场下能够快速、准确地到达靶点或者将修饰后的目的分子分离出来,并且生物毒性低[7]。随着社会的高速发展,高科技领域对于磁性材料的要求越来越高,而磁性纳米材料的尺寸与形貌直接影响其质量,所以发展一种产量高、均一性好的磁性纳米材料合成方法是当今的热点。目前主要化学合成磁性纳米材料的方法各具特色[1],但是都无法同时具备产量大、环境友好、产出的磁性纳米材料形貌均一的优点。而生物界却给磁性纳米材料的合成提供了一个很好的提示[5,8-10]。
生物体中天然存在的磁性纳米颗粒(Fe3O4),最早发现于海洋中的一些无脊椎动物的牙齿中,这种材料帮助它们从岩石上取食藻类。接着科学界又在蜜蜂、鱼类、鸟类等生物体内发现天然形成的磁性纳米晶体[8,11]。尽管这些生物体内磁性纳米晶体的形成机制不明确,但是科学家们推测这些磁性纳米晶体功能类似于指南针,通过地磁场来帮助生物体确定所在位置[12]。在微生物界中,趋磁细菌是一种典型的生物矿化生物,其体内形成磁性纳米颗粒链促使菌体顺着地磁场进行迁移运动。这些磁性纳米晶体外面都包裹着一层生物膜,统称为磁小体。磁小体约由20-50个晶体颗粒组成,晶体粒径在30-100 nm之间。趋磁细菌形成磁小体的生物矿化的过程被严格调控,使得磁小体纳米晶体的数量、尺寸和形态高度统一[4,7-8,13]。目前对于趋磁细菌生物学的研究使人们进一步明确磁小体纳米晶体形成的分子机制,并且进一步拓展磁性纳米材料在生物材料领域中的应用。本文综述了磁小体膜蛋白Mms6的结构特性以及在磁小体形成中可能的分子调节机制,并且总结了Mms6作为一种仿生的添加剂在新型磁性纳米材料中的应用,旨为进一步了解生物矿化机制提供思路。
1 磁小体形成过程及相关膜蛋白
目前普遍认为磁小体是分步形成的,并且是由多种基因参与调控。第一步,趋磁细菌细胞膜内膜内陷为一个内腔,形成磁小体膜(Magnetosome menbrane,MM),为磁小体的生成提供一个无氧气环境。内腔沿着细胞骨架的方向不断的延伸,最后组装形成了一条链。第二步,游离的二价铁离子通过跨膜蛋白MagA等将其运输到内腔中。第三步,聚集的铁离子通过部分的氧化还原在腔体内成核,最后生长成磁性晶体[14-15]。腔体内多种膜蛋白共定位在磁小体膜上,参与调控生物矿化(图1)。这些膜蛋白按照功能分为:铁离子输运蛋白(MagA等)、氧化还原蛋白(MamP等)、磁小体成链蛋白(MamY、MamK等)和调控晶体蛋白(MamA、Mms6等)[16-19]。其中,氧化还原蛋白是磁小体形成的化学基础,调控晶体蛋白是调控磁小体的成核和晶体生长的重要蛋白[16,19]。
MamY是一种膜嵌入蛋白,其N端有两段区域嵌入到膜中,蛋白C端是一个较大胞内的功能域。Tanaka 等[20]通过敲除mamY 基因发现,突变株的磁小体腔体变大,而磁小体纳米晶体变小,又通过荧光MamY-GFP 共定位方法方法发现,MamY在磁小体内膜中紧密贴附在磁小体上。这些结果都暗示了MamY功能是通过调控磁小体腔体的大小,从而调控晶体的尺寸。MamA是近膜四聚体蛋白,具有34个残基组成的重复的结构域(TPR motifs),是趋磁细菌中最保守的磁小体膜蛋白。TPR结构域的功能是促进蛋白与蛋白之间的相互作用,使相关蛋白的富集[21-22]。MamA缺失突变株中[21],细胞膜的内陷和晶体的形成都没有受到影响。通过MamAGFP补偿表达发现,MamA蛋白定位在磁小体链上。Zeytuni等[22]通过对MamA蛋白晶体结构的分析表明,MamA蛋白的TPR区域折叠形成钩状结构。它的功能类似于脚手架蛋白,能够与磁小体膜上Mms16、MspA等蛋白相互作用与提供细胞膜内陷的位点。MagA是一种跨膜蛋白,具有离子泵的功能泵进铁离子,泵出氢离子功能[23]。MamM与MamB蛋白是一种阳离子扩散促进器(Cation diffusion facilitator,CDF)家族蛋白,其结构中有6个高度保守跨膜螺旋,蛋白的N端与C端都在胞内。这类家族蛋白是一种多功能蛋白,除运送铁离子的功能外,还可以参与晶体形成的调节,并且能通过自身PDZ(GLGF 重复序列)结构与与其他膜上的蛋白相互作用,调节其他磁小体膜蛋白的活性[17]。MamP蛋白是铁离子的氧化还原的蛋白,其蛋白N端是跨膜区段,蛋白C端拥有两个类似于细胞色素C的结构域,并且也具有PDZ的结构。MamP主要功能是将富集的三价铁离子还原成二价铁离子[24]。MamK是一种类肌动蛋白,功能是促使磁小体内腔生成细丝,调控磁小体形成链状结构[25-26]。MamJ是一种酸性蛋白质,与MamK相互作用,共同调控磁小体链状物生成[26-27]。
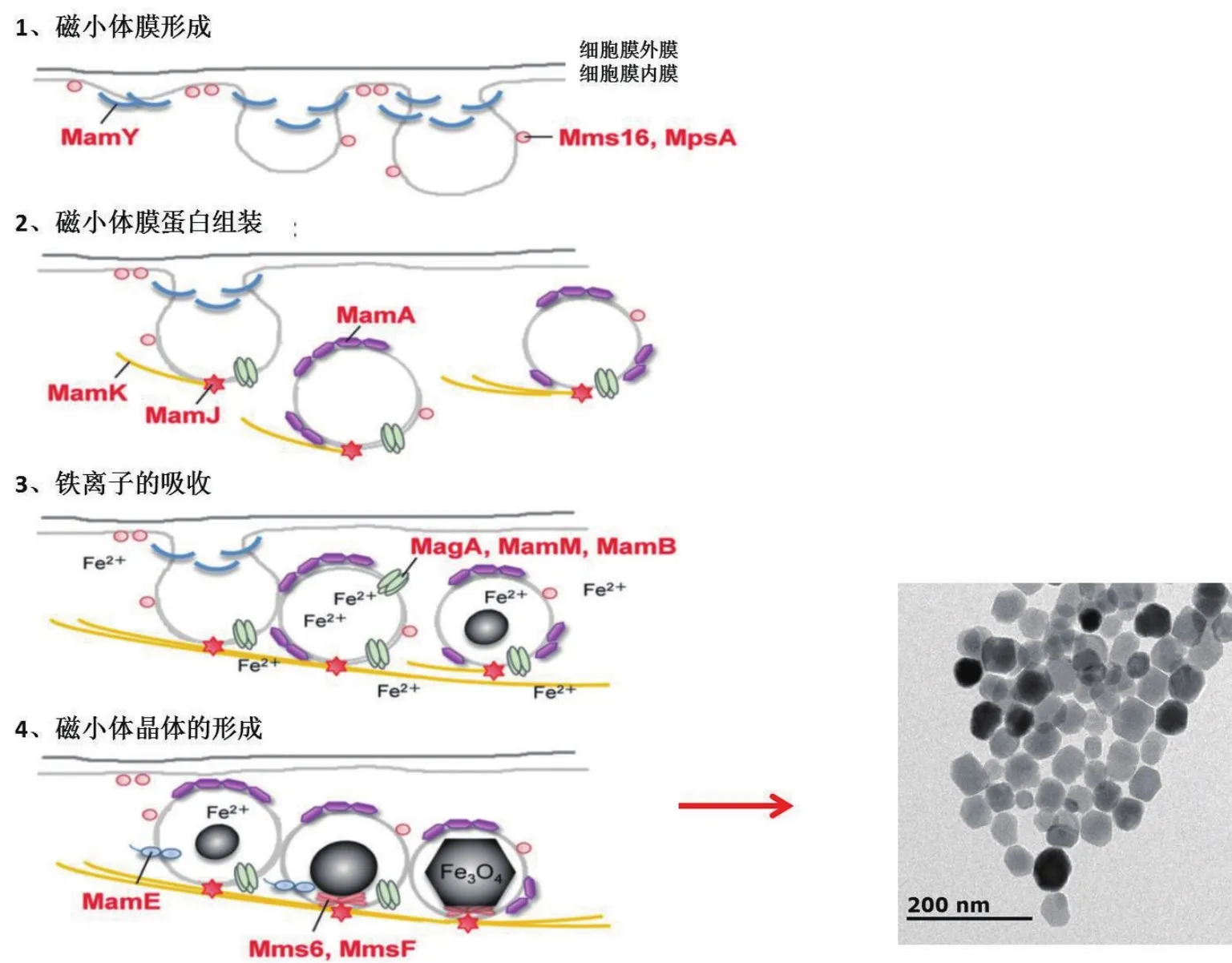
图1 磁小体形成过程预测模型[7](左)与成熟无膜磁小体(右)(本课题组实验结果)
2 磁小体特殊膜蛋白Mms6研究
2.1 Mms6在趋磁细菌体内的功能
研究表明趋磁细菌基因组上4种操纵子mms6、mamGFDC、mamAB和mamXY参与调控磁小体纳米晶体尺寸、形貌[19,28]。Arakaki和Kolinko等[28-29]实验发现缺失这些基因,趋磁细菌将失去形成磁小体的能力,而将这些基因簇整合到其他种类细菌中,这些细菌具有了产生磁小体的能力。其中mms6基因表达的Mms6蛋白在调控晶体形貌中起到至关重要的作用。Mms6是由日本科学家Arakaki 等[30]发现,他们通过去掉磁小体膜,暴露出磁小体纳米晶体,再使用高温处理,释放出了结合在磁小体纳米晶体上的Mms6蛋白。
Mms6蛋白有着很高的保守性,其特征是蛋白序列有一段疏水N端和一段亲水的C端,且N端有重复的GL序列,在pH中性的状态时蛋白带负电,并且仅存在于磁小体膜上,其他生物膜体系中未曾发现[30]。Mms6理论上表达出的蛋白分子量应为15 kD,远大于直接从磁小体上分离出的6 kD。Arakaki[30]认为原始的Mms6蛋白的N端类似于信号肽,被特殊的酶剪切,形成成熟的Mms6蛋白。Tanaka等[19]将趋磁细菌的mms6基因敲除后发现,磁小体纳米晶体形态变窄变长,尺寸的均一性降低,平均晶体直径有接近44%的减小,而野生株和回补mms6基因的突变株形成的磁小体,形状和尺寸是十分统一的。值得一提的是,Murat等[31]构建的mms6缺失株的晶体与野生株平均直径差异只有19%。造成两个课题组实验结果的差异的原因,可能是由于二者敲除基因的方法不一样。Tanaka等使用抗生素DNA序列组件取代了mms6基因,而Murat等使用的两步重组法敲除mms6基因,插入的抗生素DNA序列组件可能会影响到下游基因的表达,间接影响到磁小体的形成。Tanaka等的高分辨电子透射显微镜(TEM)结果表明,野生株的磁小体纳米晶体的长、宽比值接近1.0,具有(100)与(111)晶面,但是缺失株中的磁小体纳米晶体的长宽比值是0.75,且只有(210)、(211)、(311)晶面。他们认为突变株的磁小体(110)晶面的能量过高从而导致晶体不稳定,拉长晶体的长度,最终形成长条形。以上的研究结果都暗示了Mms6蛋白可能识别磁性纳米晶体表面从而调控晶体的生长。
2.2 Mms6在体外的构象
Mms6蛋白具有两亲性,在体外水环境状态下蛋白的疏水区域会自行组装团聚在一起,形成亲水性C末端在外,疏水性N端在内部的微囊状态(micelle)。Wang等[32]使用分子筛的方法得到了自组装成micelle的Mms6,分子量为400 kD,约由20-40个蛋白团聚形成。通过分子筛估算出Mms6 micelle的粒径与Amemiya等[33]的动态光散射(DLS)的实验结果一致,平均粒径为10.2±3 nm。Zhang等[34]使用小角衍射(SAXS)的方法计算得到Mms6 micelle的亲水端的的长度约为1.1±0.2 nm,并且加入一定量的铁离子后,促使较小的micelle聚集形成一个有规则圆盘形态。Kashyap等[35]通过原位透射电镜观察到铁离子与Mms6相互作用并且富集在其表面的过程。值得一提的是实验中Mms6 micelle在电镜中显示出的粒径很大,甚至接近了原来粒径10倍,约为100 nm,推测是铁离子聚集在表面形成沉淀导致粒径变大。本课题组[36]通过高分辨率液体核磁共振(NMR)技术得到了Mms6与Mms6的C末端的25残基在体外状态下的核磁光谱,结果表明二者的光谱极为相似,并且Mms6光谱中只有C末端的17个残基显示出信号。我们认为Mms6的N端紧密包裹导致了没有任何N端残基信号出现,而Mms6的C末端才是蛋白主要的功能区域。以上实验结果都证明Mms6在体外自组装形成micelle,并且只有少量的C末端亲水性残基暴露在micelle表面。
2.3 Mms6蛋白调控磁性晶体形成的机制
Mms6蛋白调控磁小体纳米晶体的具体分子机制至今仍然不明确。从目前的研究进展看,科学界普遍认为Mms6蛋白C末端对磁小体纳米晶体成核、晶体生长有重要作用[30,37-38]。Mms6的C末端富含酸性氨基酸,表面呈现出负电。Arakaki等[30]发现Mms6可以与Fe3+,Ca2+和Mg2+相互作用,却不与Zn2+、Ni2+和Cu2+相互作用。Wang等[32]使用分子筛的方法,得出Mms6与铁离子有着强烈的结合(Kd=10-16mol/L),而且独立的Mms6的C末端21个残基(Mms6C21)也具有与铁离子结合的能力。但是将C末端酸性氨基酸突变为碱性,Mms6几乎没有与铁离子结合能力。Rawlings[39]最新的研究表明,Mms6C20是通过与二价铁离子相互作用推迟了磁性晶体成核,而基本不与三价铁离子相互作用,其中Mms6的C末端的DDVED的区段为与铁离子结合位点。Yamagishi等[40]将趋磁细菌体内Mms6的部分氨基酸残基缺失突变,通过高分辨电子透射显微镜结果来确定Mms6蛋白哪些残基对磁小体形貌起到关键作用。结果表明当Mms6的N端或者C末端特别是DEEVE区域缺失突变后都严重影响了磁小体形成正常的形貌。这些结果都暗示Mms6具有选择性结合金属离子的功能,并且通过与这些离子螯合推迟了晶体成核,达到调控晶体形貌的功能。2.4 Mms6蛋白在磁性纳米材料合成中的应用
磁性纳米材料的尺寸和形貌决定了其物理特性,直接影响到材料的应用[1]。目前较为成熟的合成磁性纳米方法有以下几种:水热法、高温分解法和共沉淀法(表1)。高温法、水热法产出的磁性纳米晶体有着均的尺寸和形貌,但是产量较低,而且反应条件(要求高温高压,大量有机溶液体系)对环境污染巨大。共沉淀法要求技术条件简单,并且水溶液体系对环境污染较小,但是缺点是无法调控形成晶体的形貌。
而利用Mms6模拟生物条件,参与磁性纳米材料合成,可以提高晶体尺寸和形貌的均一性。Arakaki和Prozorov等[30,33,41]将适量Mms6加入铁离子的混合物中,使用共沉淀法合成出的磁性纳米材料,尺寸范围在20-30 nm之间,而没有加入蛋白的对照组,尺寸分布较大,并且形貌不规则;Galloway和Zhang等[42-43]也利用类似的方法合成了形貌均一、矫顽力高的钴、钆掺杂的铁氧化物磁性纳米材料(CoFe2O3、Fe(3-x)GdxO4(x=0.085±0.002))。这些结果都进一步证明Mms6可以调节磁性纳米晶体的形成。Amemiya等[33]使用部分还原法合成磁性纳米颗粒,通过加入适量Mms6,合成出的磁性纳米颗粒也是具有较为统一的尺寸和形貌,粒径大约为20 nm。值得一提的是实验中加入Mms6组合成的晶体形貌特征是立方八面体型,包含了(111)和(100)晶面,与天然的磁小体的形貌很接近,而对未加入蛋白对照组形成的晶体是菱形八面体型,只有(111)晶面(本课题组也重复出类似结果,图2),并且通过检测加入Mms6组合成晶体表面,确定Mms6吸附在晶体表面,所以他们推测Mms6可以特异性结合到磁小体纳米晶体的(100)晶面(图2)。Arakaki和Oestreicher等[44-45]通过细胞荧光共定位、纳米金修饰抗体等方法确认了Mms6可以与磁小体晶体直接的相互作用。本课题组[36]也通过高分辨NMR技术发现Mms6可以特异性识别磁小体晶体,并且特异性的识别位点也是DEEVE区域。这些结果进一步暗示了Mms6不仅在磁小体晶体成核中起到作用,Mms6还可以通过与磁小体晶体晶面相互作用,从而调控磁小体晶体的生长。

表1 磁性纳米材料合成方法比较
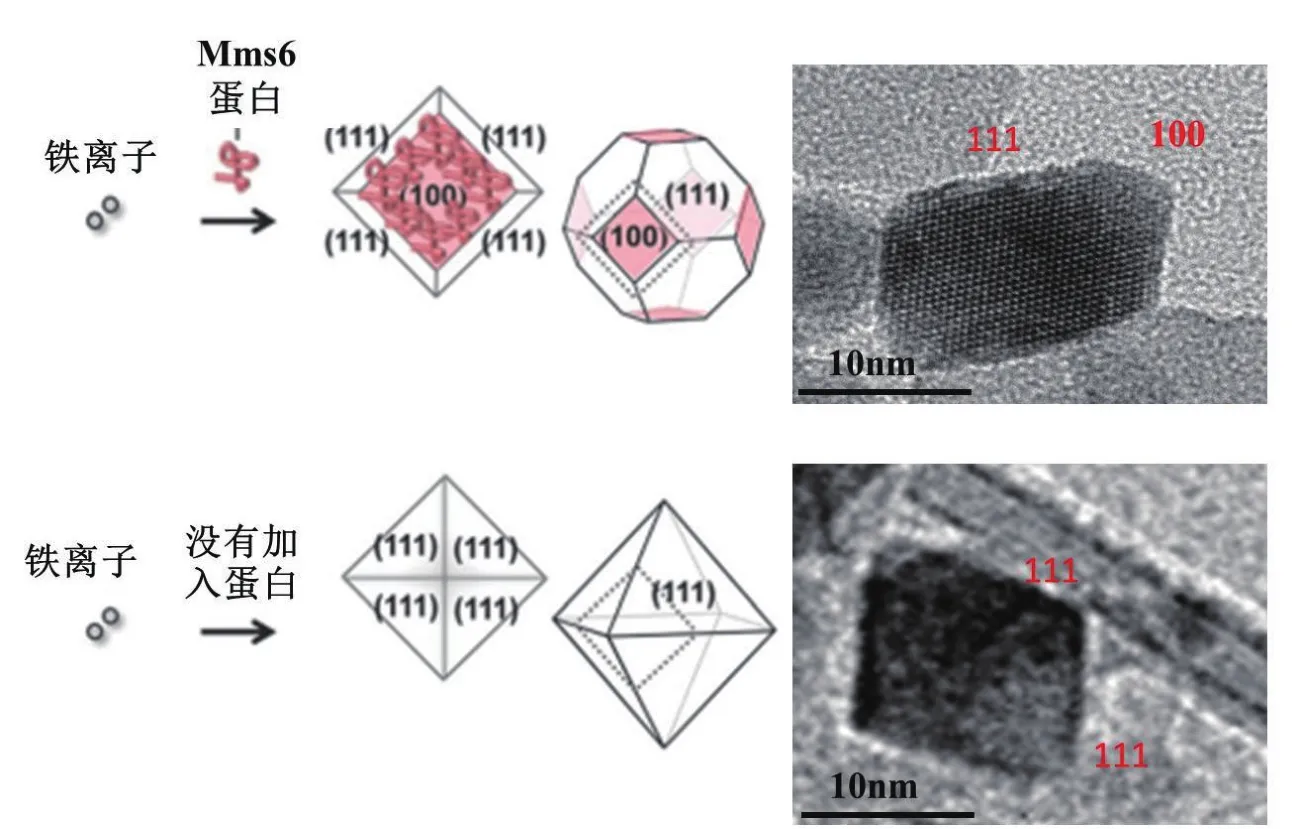
图2 Mms6调控晶体生长的机制假设(左)[33]和四氧化三铁的高分辨透射电镜图(右)(本实验室结果)
由于认为Mms6C末端是主要功能区域,所以科学家推测Mms6C末端可以模拟全长Mms6的功能。Lenders、Prozorov、Arakaki和Wolff等[10,37-38,46]将Mms6C末端超短肽加入合成体系中发现,合成的晶体与加入Mms6组的结果类似。Sommerdijk等[47]进一步使用随机合成不同的碱性小肽、酸性小肽、去调控磁性纳米颗粒的合成,但调控效果并不理想。近年来,科学家们认为Mms6单纯作为添加剂对调控材料合成的影响是有限的,如果将Mms6固定在基地上,那么就可以更加精细、有效的调控磁性纳米材料的合成。Galloway等[48]使用一种软基底材料,通过羧基活化的聚乙烯烷硫醇(PEG-alkanethiols, PEG-COOH),与Mms6的N端反应,将蛋白固定在一个特定平面,自组装形成单一蛋白层(Selfassembled monolayer,SAM),使磁性纳米颗粒能够在Mms6蛋白表面上生长。Bird和Nayak等[49-51]将Mms6N端的一个残基突变成半胱氨酸,并且更改基底为纯金材料,通过激光技术,将Mms6组装到基底的特定表面。这种新型的模板使Mms6结合效率更高,形成的SAM更加规则。通过Mms6自组装形成SAM的模式合成出的磁性纳米颗粒具有较好磁性饱和度,高矫顽力磁性并且反应条件温和,可应用在数据存储材料中[50]。
3 结语
趋磁细菌形成磁小体的生物矿化过程,是复杂的、涉及多种基因和蛋白参与的生理过程,特别是磁小体膜的内陷与磁性纳米晶体成核与生长。大量研究表明,磁小体膜上各种特异性膜蛋白MamA、MamY、MagA、MamM、MamP、MamK、Mms6和MamJ等通过相互协同调控磁小体的形成。其中Mms6是首个被发现参与调控纳米晶体晶型的蛋白,在磁小体纳米晶体的成核与生长过程中都起到重要的作用。随着对Mms6的深入研究,科学界认为不能孤立研究Mms6 C端的功能,其N端的自组装与膜的相互作用对蛋白功能也有影响[50,52]。Bird等[49]发现Mms6在模板上N端自组装形成不同弯曲率micelle也调控纳米晶体的形貌。本课题组[36]也发现Mms6的C末端短肽尽管可以与磁小体晶体有着相互作用,但这种作用没有特异性识别。我们认为Mms6的N端疏水区域对于Mms6蛋白在磁小体膜上的组装排布具有重要作用,这种通过N端的疏水排布使C末端的DEEVE结构域形成正确的取向和空间排布,实现对晶面的识别,达到调控磁小体晶体的功能。近年来,Mms6在生物材料领域得到广泛应用,设计出调控效果好、成本低的人工肽取代Mms6应用在磁性纳米材料合成中,将会成为研究热点。
尽管近几年对Mms6研究和应用有很大突破,但仍有问题未被解决。首先是Mms6结构,由于Mms6自身状态限制,目前研究结果表明Mms6在体外无蛋白构象[36,39,49],那么在体内Mms6是否具有蛋白构象;其次,Mms6蛋白调节磁性纳米晶体具体分子机制仍不明确,是调节晶体成核,还是晶体生长,亦或两者耦合在一起,这个问题仍然存在争论。通过对这些问题的探索,人们会对生物矿化机制会有更深入了解,并且为此类蛋白在生物材料上的应用奠定理论基础。
[1]Lu AH, Salabas EEL, Schüth F. Magnetic nanoparticles:synthesis, protection, functionalization, and applicationn[J]. Angewandte Chemie International Editio, 2007, 46(8):1222-1244.
[2]Goldhawk DE, Rohani R, Sengupta A, et al. Using the magnetosome to model effective gene-based contrast for magnetic resonance imaging[J]. Wiley Interdisciplinary Reviews:Nanomedicine and Nanobiotechnology, 2012, 4(4):378-388.
[3]Tang Y, Wang D, Zhou C, et al. Bacterial magnetic particles as a novel and efficient gene vaccine delivery system[J]. Gene Therapy, 2012, 19(12):1187-1195.
[4]Jimenez-Lopez C, Romanek CS, Bazylinski DA. Magnetite as a prokaryotic biomarker:a review[J]. Journal of Geophysical Research:Biogeosciences, 2010, doi:10.102912009fg00152.
[5]Matsunaga T, Okamura Y, Tanaka T. Biotechnological application of nano-scale engineered bacterial magnetic particles[J]. Journal of Materials Chemistry, 2004, 14(14):2099-2105.
[6]Alphandéry E, Faure S, Seksek O, et al. Chains of magnetosomes extracted from AMB-1 magnetotactic bacteria for application in alternative magnetic field cancer therapy[J]. ACS Nano, 2011, 5(8):6279-6296.
[7]Arakaki A, Nakazawa H, Nemoto M, et al. Formation of magnetite by bacteria and its application[J]. Journal of the Royal Society interface, 2008, 5(26):977-999.
[8]Xu AW, Ma Y, Cölfen H. Biomimetic mineralization[J]. Journal of Materials Chemistry, 2007, 17(5):415-449.
[9] Chiu CY, Ruan L, Huang Y. Biomolecular specificity controlled nanomaterial synthesis[J]. Chemical Society Reviews, 2013, 42(7):2512-2527.
[10]Lenders JJ, Altan CL, Bomans PH, et al. A bioinspired coprecipitation method for the controlled synthesis of magnetite nanoparticles[J]. Crystal Growth & Design, 2014, 14(11):5561-5568.
[11]Diebel CE, Proksch R, Green CR, et al. Magnetite defines a vertebrate magnetoreceptor[J]. Nature, 2000, 406(6793):299-302.
[12]Ueda K, Kusunoki M, Kato M, et al. Magnetic remanences in migratory birds[J]. Journal of the Yamashina Institute for Ornithology, 1982, 14(2-3):166-170.
[13]Yan L, Zhang S, Chen P, et al. Magnetotactic bacteria, magnetosomes and their application[J]. Microbiological Research, 2012, 167(9):507-519.
[14]Komeili A. Molecular mechanisms of compartmentalization and biomineralization in magnetotactic bacteria[J]. FEMSMicrobiology Reviews, 2012, 36(1):232-255.
[15]Schüler D. Genetics and cell biology of magnetosome formation in magnetotactic bacteria[J]. FEMS Microbiology Reviews, 2008, 32(4):654-672.
[16]Nakamura C, Burgess JG, Sode K, et al. An iron-regulated gene, magA, encoding an iron transport protein of Magnetospirillum sp. strain AMB-1[J]. Journal of Biological Chemistry, 1995, 270(47):28392-28396.
[17]Uebe R, Junge K, Henn V, et al. The cation diffusion facilitator proteins MamB and MamM of Magnetospirillum gryphiswaldense have distinct and complex functions, and are involved in magnetite biomineralization and magnetosome membrane assembly[J]. Molecular Microbiology, 2011, 82(4):818-835.
[18]Siponen MI, Adryanczyk G, Ginet N, et al. Magnetochrome:a c-type cytochrome domain specific to magnetotatic bacteria[J]. Biochemical Society transactions, 2012, 40(6):1319-1323.
[19]Tanaka M, Mazuyama E, Arakaki A, et al. MMS6 protein regulates crystal morphology during nano-sized magnetite biomineralization in vivo[J]. Journal of Biological Chemistry, 2011, 286(8):6386-6392.
[20]Tanaka M, Arakaki A, Matsunaga T. Identification and functional characterization of liposome tubulation protein from magnetotactic bacteria[J]. Molecular microbiology, 2010, 76(2):480-488.
[21] Zeytuni N, Ozyamak E, Ben-Harush K, et al. Self-recognition mechanism of MamA, a magnetosome-associated TPR-containing protein, promotes complex assembly[J]. Proceedings of the National Academy of Sciences, 2011, 108(33):E480-E487.
[22]Zeytuni N, Baran D, Davidov G, et al. Inter-phylum structural conservation of the magnetosome-associated TPR-containing protein, MamA[J]. Journal of Structural Biology, 2012, 180(3):479-487.
[23]Zurkiya O, Chan AW, Hu X. MagA is sufficient for producing magnetic nanoparticles in mammalian cells, making it an MRI reporter[J]. Magnetic Resonance in Medicine, 2008, 59(6):1225-1231.
[24] Siponen MI, Legrand P, Widdrat M, et al. Structural insight into magnetochrome-mediated magnetite biomineralization[J]. Nature, 2013, 502(7473):681-684.
[25]Komeili A, Li Z, Newman DK, et al. Magnetosomes are cell membrane invaginations organized by the actin-like protein MamK[J]. Science, 2006, 311(5758):242-245.
[26]Draper O, Byrne ME, Li Z, et al. MamK, a bacterial actin, forms dynamic filaments in vivo that are regulated by the acidic proteins MamJ and LimJ[J]. Molecular Microbiology, 2011, 82(2):342-354.
[27]Scheffel A, Schüler D. The acidic repetitive domain of the Magnetospirillum gryphiswaldense MamJ protein displays hypervariability but is not required for magnetosome chain assembly[J]. Journal of Bacteriology, 2007, 189(17):6437-6446.
[28] Arakaki A, Yamagishi A, Fukuyo A, et al. Co-ordinated functions of Mms proteins define the surface structure of cubo-octahedral magnetite crystals in magnetotactic bacteria[J]. Molecular microbiology, 2014, 93(3):554-567.
[29]Kolinko I, Lohβe A, Borg S, et al. Biosynthesis of magnetic nanostructures in a foreign organism by transfer of bacterial magnetosome gene clusters[J]. Nature Nanotechnology, 2014, 9(3):193-197.
[30]Arakaki A, Webb J, Matsunaga T. A novel protein tightly bound to bacterial magnetic particles in Magnetospirillum magneticum strain AMB-1[J]. Journal of Biological Chemistry, 2003, 278(10):8745-8750.
[31]Murat D, Falahati V, Bertinetti L, et al. The magnetosome membrane protein, MmsF, is a major regulator of magnetite biomineralization in Magnetospirillum magneticum AMB-1[J]. Molecular Microbiology, 2012, 85(4):684-699.
[32]Wang L, Prozorov T, Palo PE, et al. Self-assembly and biphasic iron-binding characteristics of Mms6, a bacterial protein that promotes the formation of superparamagnetic magnetite nanoparticles of uniform size and shape[J]. Biomacromolecules, 2011, 13(1):98-105.
[33]Amemiya Y, Arakaki A, Staniland SS, et al. Controlled formation of magnetite crystal by partial oxidation of ferrous hydroxide in the presence of recombinant magnetotactic bacterial protein Mms6[J]. Biomaterials, 2007, 28(35):5381-5389.
[34]Zhang H, Liu X, Feng S, et al. Morphological transformations in the magnetite biomineralizing protein Mms6 in iron solutions:a small-angle X-ray scattering study[J]. Langmuir, 2015, 31(9):2818-2825.
[35]Kashyap S, Woehl TJ, Liu X, et al. Nucleation of iron oxide nanoparticles mediated by Mms6 protein in situ[J]. ACS Nano,2014, 8(9):9097-9106.
[36]Ma K, Zhao H, Zheng X, et al. NMR studies of the interactions between AMB-1 Mms6 protein and magnetosome Fe3O4nanoparticles[J]. Journal of Materials Chemistry B, 2017, 5(16):2888-2895.
[37]Prozorov T, Palo P, Wang L, et al. Cobalt ferrite nanocrystals:outperforming magnetotactic bacteria[J]. ACS Nano, 2007, 1(3):228-233.
[38] Arakaki A, Masuda F, Amemiya Y, et al. Control of the morphology and size of magnetite particles with peptides mimicking the Mms6 protein from magnetotactic bacteria[J]. Journal of Colloid and Interface Science, 2010, 343(1):65-70.
[39]Rawlings AE, Bramble JP, Hounslow AM, et al. Ferrous iron binding key to Mms6 magnetite biomineralisation:A mechanistic study to understand magnetite formation using pH titration and NMR spectroscopy[J]. Chemistry-A European Journal, 2016, 22(23):7885-7894.
[40]Yamagishi A, Narumiya K, Tanaka M, et al. Core amino acid residues in the morphology-regulating protein, Mms6, for intracellular magnetite biomineralization[J]. Scientific Reports, 2016, 6:35670.
[41]Prozorov T, Mallapragada SK, Narasimhan B, et al. Protein mediated synthesis of uniform superparamagnetic magnetite nanocrystals[J]. Advanced Functional Materials, 2007, 17(6):951-957.
[42]Galloway JM, Arakaki A, Masuda F, et al. Magnetic bacterial protein Mms6 controls morphology, crystallinity and magnetism of cobalt-doped magnetite nanoparticles in vitro[J]. Journal of Materials Chemistry, 2011, 21(39):15244-15254.
[43]Zhang H, Malik V, Mallapragada S, et al. Synthesis and characterization of Gd-doped magnetite nanoparticles[J]. Journal of Magnetism and Magnetic Materials, 2017, 423:386-394.
[44]Arakaki A, Kikuchi D, Tanaka M, et al. Comparative subcellular localization analysis of magnetosome proteins reveals a unique localization behavior of Mms6 protein onto magnetite crystals[J]. Journal of Bacteriology, 2016, 198(20):2794-2802.
[45]Oestreicher Z, Mumper E, Gassman C, et al. Spatial localization of Mms6 during biomineralization of Fe3O4nanocrystals in Magnetospirillum magneticum AMB-1[J]. Journal of Materials Research, 2016, 31(5):527-535.
[46]Wolff A, Frese K, Wi brock M, et al. Influence of the synthetic polypeptide c25-mms6 on cobalt ferrite nanoparticle formation[J]. Journal of Nanoparticle Research, 2012, 14(10):1161.
[47]Lenders JJ, Zope HR, Yamagishi A, et al. Bioinspired magnetite crystallization directed by random copolypeptides[J]. Advanced Functional Materials, 2015, 25(5):711-719.
[48]Galloway JM, Bramble JP, Rawlings AE, et al. Biotemplated magnetic nanoparticle arrays[J]. Small, 2012, 8(2):204-208.
[49]Bird SM, Rawlings AE, Galloway JM, et al. Using a biomimetic membrane surface experiment to investigate the activity of the magnetite biomineralisation protein Mms6[J]. RSC Advances, 2016, 6(9):7356-7363.
[50]Nayak S, Zhang H, Liu X, et al. Protein patterns template arrays of magnetic nanoparticles[J]. RSC Advances, 2016, 6(62):57048-57056.
[51]Bird SM, Galloway JM, Rawlings AE, et al. Taking a hard line with biotemplating:cobalt-doped magnetite magnetic nanoparticle arrays[J]. Nanoscale, 2015, 7(16):7340-7351.
[52]Liu X, Zhang H, Nayak S, et al. Effect of surface hydrophobicity on the function of the immobilized biomineralization protein Mms6[J]. Industrial & Engineering Chemistry Research, 2015, 54(42):10284-10292.
(责任编辑 狄艳红)
Research Progress on the Function and Application of Membrane Protein Mms6 of Magnetosome
MA Kun1ZHAO Hong-xin1,2LI Qian1WANG Jia-rong1SUN Hong-bin1
(1. High Magnetic Field Laboratory,Chinese Academy of Sciences,Hefei 230031;2. College of Life Sciences,University of Science and Technology of China,Hefei 230031)
The magnetosome is a special biomineralized product formed by the invagination of the magnetotactic bacteria(MTB)inner membrane. Magnetosome is composed of membrane-enclosed magnetite crystals ordered into chains along the cell. Moreover,these magnetic nanocrystals are highly homogeneous in size and morphology. The magnetosome membrane protein has been demonstrated to play an important role in the formation of magnetosome with recruitment and redox of iron and regulation of the nucleation and growth of magnetic nanocrystals. This article reviews that the main function of protein in magnetosome membrane in the process of the formation of magnetic nanoparticles from the absorption of iron ions into mineralization. Especially,the article introduces the structure characteristics and functions of the magnetosome membrane special protein 6(Mms6). Furthermore,the article summarizes the application of Mms6,as a biomimic addictive in the new-type magnetic nanomaterials,and discusses its possible mechanism of molecular regulation during the process of the formation of magnetosome,for providing a better understanding of biomineralization.
magnetosome;biomineralization;mms6 protein;biomimeticsynthesis
10.13560/j.cnki.biotech.bull.1985.2017-0170
2017-03-07
国家自然科学基金项目(U1332142)(21372222)
马坤,男,博士研究生,研究方向:蛋白质结构与功能;E-mail:makun@hmfl.ac.cn
孙红宾,男,研究员,研究方向:蛋白质结构与功能;E-mail:hbsun@hmfl.ac.cn
