Nampt抑制剂对乳腺癌细胞化疗增敏作用的研究
2017-09-16周少杰毕铁强秦春新杨小青矫璐宇于浩
周少杰, 毕铁强, 秦春新, 杨小青, 矫璐宇, 于浩
乳腺癌专题
Nampt抑制剂对乳腺癌细胞化疗增敏作用的研究
周少杰, 毕铁强, 秦春新, 杨小青, 矫璐宇, 于浩
目的探讨乳腺癌组织及癌旁正常乳腺组织中烟酰胺磷酸核糖基转移酶(Nampt)的表达,及Nampt抑制剂对乳腺癌细胞生长和化疗增敏的影响。方法采用qRT-PCR法检测乳腺癌组织和癌旁正常组织中Nampt mRNA表达水平,并用噻唑蓝(MTT)实验和软琼脂克隆形成实验检测Nampt抑制剂对乳腺癌细胞生长的影响和对其化疗增敏的作用。结果qRT-PCR结果表明,乳腺癌组织内Nampt mRNA表达高于癌旁正常组织中的表达3.5倍 ,差异有统计学意义(P<0.05)。经FK866干预24 h,细胞的生长没有明显的抑制;但在48 h、72 h后,FK866 (3~30 nmol/L) 干预 MCF-7细胞出现生长的抑制。随FK866的浓度增加,细胞克隆球数逐渐减少,相邻干预浓度的两组间比较,差异有统计学意义(均P<0.01)。结论Nampt抑制剂能影响乳腺癌细胞生长,与细胞毒药物联合应用具有化疗增敏作用。
乳腺肿瘤; 烟酰胺磷酸核糖基转移酶; 细胞存活; 药物疗法; 化疗增敏
化疗是进展期乳腺癌治疗的主要手段之一,化疗通过改变细胞核DNA的化学结构、微管蛋白合成、干扰核酸的合成和转录等抑制肿瘤细胞的生长,其主要目的是使恶性肿瘤细胞在抗肿瘤药物的作用下发生凋亡。而恶性肿瘤细胞对化疗药物耐药性是肿瘤化疗失败的主要原因之一。因此, 提高肿瘤细胞的化疗敏感性,降低耐药性,增加细胞毒抗肿瘤药物的疗效, 从而提高肿瘤患者的生存率, 已成为肿瘤药物治疗中亟待解决的问题之一。肿瘤细胞对化疗药物的耐药性分为内在性和获得性两方面, 研究认为其分子机制涉及多药耐药相关基因表达异常, 癌基因和抑癌基因的表达异常及DNA损伤修复能力改变等多个方面。其中,肿瘤细胞对化疗药物引起的DNA损伤具有修复能力,是化疗耐药的一个重要原因。肿瘤细胞损伤后,DNA修复机制是肿瘤化疗耐药机制研究热点之一,而烟酰胺腺嘌呤二核苷酸(NAD)在DNA修复过程中具有重要作用,烟酰胺磷酸核糖基转移酶(Nampt)是NAD补救合成过程中的限速酶[1]。研究肿瘤细胞抗凋亡、DNA修复过程中的功能因子,将其作为生物靶点,适当的阻断其作用,可成为提高化疗药物效果的一种新方法。本研究中,我们通过PCR方法检测了Nampt在乳腺癌组织及癌旁正常组织中的表达,探讨Nampt抑制剂对乳腺癌细胞生长的影响和对化疗药物敏感性的影响,为后续的研究奠定一定基础。
1 资料和方法
1.1 资料
1.1.1 新鲜乳腺癌组织和癌旁正常组织 12例乳腺癌和癌旁正常组织(距肿瘤边缘≥5 cm)取自2014年5月威海市立医院甲乳外科手术切除的新鲜标本,术中均经组织病理证实,且未做术前放化疗。患者均为女性,年龄29~66岁,平均年龄47岁,术后病理证实均为乳腺浸润性导管癌,分级Ⅰ~Ⅲ级。
1.1.2 人乳腺癌细胞株和实验用药物 人乳腺癌细胞株 MCF-7使用含有10%胎牛血清的DMEM培养基,在37 ℃、5%CO2的饱和湿度条件下培养。Nampt抑制剂FK866(美国Cayman公司),25 mg/ml 5-氟尿嘧啶 (5-FU,天津金耀氨基酸公司)。实验药物在培养基中稀释到设计浓度用于体外实验。
1.2 方法
1.2.1 总RNA提取和实时定量反转录PCR(qRT-PCR) 培养细胞中加入Trizol试剂提取总RNA。然后,通过cDNA合成试剂盒(日本Takara公司)反转录成cDNA。Nampt 产物长度250 bp,正向:5’-AAGAGACTGCTGGCATAGGA-3’;反向:5’-ACCACAGATACAGGCACTGA-3’。GAPDH 产物长度 452 bp,正向:5’-ACCACAGTCCATGCCATCAC-3’;反向:5’-TCCACCACCCTGTTGCTGTA-3’。在iCycler荧光定量PCR仪(美国Bio-Rad公司)中,通过SYBR Premix Ex Taq试剂盒(日本Takara公司)进行qRT-PCR检测目标基因Nampt的表达,PCR重复3次。用管家基因GAPDH mRNA作内参照。
1.2.2 噻唑蓝法(MTT)检测细胞生长 96孔板每孔加细胞悬液100 μl,每孔中种5 000个细胞,每组3个复孔。细胞贴壁后,加入不同浓度的药物,依据实验需要时间进行培养。呈色:每孔加入20 μl MTT溶液,使MTT终浓度为0.5 mg/ml,继续培养3~4 h。小心吸弃孔内培养液。每孔加入150 μl 二甲基亚砜(DMSO),低速振荡10 min,使结晶物充分溶解。在酶联免疫检测仪测量各孔吸光度A值。测定波长490 nm。空白对照(培养基、MTT、DMSO)调零。
1.2.3 软琼脂克隆形成实验 铺0.6%底层胶,制备含有细胞的0.3%上层胶,混匀后加入到底层胶上,放入4 ℃冰箱中10 min使琼脂糖凝胶凝固,放入37 ℃培养箱培养3周。观察克隆数,计数最大径>100 μm的克隆。
1.3 统计学方法
2 结果
2.1 Nampt在乳腺癌组织中的表达
qRT-PCR结果表明,乳腺癌组织内Nampt mRNA表达高于癌旁正常组织中的表达3.5倍 ,差异有统计学意义(P<0.05)。见图1。
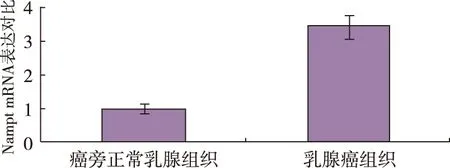
图1 qRT-PCR法检测癌旁正常乳腺组织和乳腺癌组织Nampt mRNA表达对比
2.2 Nampt抑制剂FK866对MCF-7细胞生长的影响
经FK866干预24 h,细胞的生长没有明显的抑制。但在48 h、72 h后,FK866 (3~30 nmol/L) 干预的 MCF-7细胞出现生长的抑制,图2为不同浓度的FK866干预细胞72 h后部分96孔板细胞照片(随浓度增加,细胞生长抑制越明显)。MTT比色法分别于24 h、48 h和72 h检测各组细胞的生长存活率,同细胞浓度组相比,48 h、72 h后细胞生长抑制差异有统计学意义(P<0.01),见图3。

图2 MTT比色法检测前不同浓度的FK866干预细胞72 h后96孔板细胞(FK866浓度分别为0 nmol/L、0.3 nmol/L、3 nmol/L和30 nmol/L,随浓度增加,细胞生长抑制越明显)(HE×200)

图3 24 h、48 h、72 h后,MTT比色法检测FK866对MCF-7细胞生存率的影响
2.3 Nampt抑制剂FK866对 MCF-7细胞克隆集落生长的影响
相同条件下软琼脂中培养3周后,随FK866的浓度增加,细胞克隆球形态逐渐减小,甚至出现细胞凋亡表现(图4)。 FK866 能够抑制 MCF-7细胞克隆集落生长,且与其剂量浓度相关,最低实验浓度0.3 nmol/L即可抑制MCF-7细胞的集落生长,至30 nmol/L,最大径>100 μm的克隆数为0,随FK866的浓度增加,细胞克隆球数逐渐减少,相邻干预浓度的两组间差异有统计学意义(均P<0.01)。见图5。

图4 不同浓度FK866对 MCF-7细胞软琼脂克隆形成的比较(×200)

图5 FK866对 MCF-7细胞软琼脂克隆形成的影响
2.4 FK866对 MCF-7细胞5-FU的化疗敏感性的影响
FK866增加了MCF-7细胞5-FU的化疗敏感性。MCF-7细胞中分别加入5-FU单药和5-FU+FK866 (1 nmol/L) 培养24 h后(单用1 nmol/L剂量浓度的FK866对细胞生长无影响),两组间细胞生存率无差异。培养48 h和72 h后,5-FU+FK866组对细胞生长的抑制较5-FU组更明显;加入FK866组的5-FU的半抑制浓度 (IC50) 更低。见图6,7。

图6 MTT比色法检测48 h 5-FU和5-FU+FK866组细胞的吸光度值

图7 MTT比色法检测72 h 5-FU和5-FU+FK866组细胞的吸光度值
3 讨论
在本研究中,我们发现Nampt在乳腺癌组织中的表达高于其在正常乳腺组织中的表达。Nampt抑制剂FK866 能抑制人乳腺癌细胞的生长和集落形成。由于5-FU联合FK866(1 nmol/L) 对乳腺癌细胞的生长抑制比单用5-FU更明显,而1 nmol/L的FK866对细胞生长无影响,因此认为,FK866 能够增加5-FU对乳腺癌细胞的化疗敏感性。众所周知,肿瘤细胞克隆集落生长是其扩散转移的重要因素,本研究发现, FK866 抑制乳腺癌集落形成的效果与其剂量浓度呈正相关;表明能够阻断Nampt信号通路的抑制剂可能对Nampt高表达的乳腺癌具有治疗意义。
前期的研究发现,在多种肿瘤细胞和肿瘤组织中Nampt高表达[2-4]。其通过调整与细胞粘附功能相关的整合素功能,以促进肿瘤细胞的转移[5]。Nampt是一个在肿瘤发生发展过程中具有重要作用的肿瘤相关基因,其可成为肿瘤治疗新的有效靶点[6-7]。临床上应用的细胞毒药物大多是通过不同形式造成肿瘤细胞DNA损伤,当细胞DNA损伤时,其自身会启动DNA损伤修复机制,维持自身生存,临床上出现化疗不敏感甚至耐受现象。Nampt通过参与DNA修复、调节ERK1/2和p38通路表达MMP-2/9等功能,促进肿瘤细胞的存活和增殖及血管生成[8],且与化疗抵抗相关[9-10]。Nampt抑制剂能够耗竭肿瘤细胞内NAD和抑制糖酵解途径,从而抑制细胞生长[11-12],与破坏DNA的细胞毒药物联合用药,使DNA修复能力受损,加强了细胞毒药物作用效果[13-14]。抗代谢药物5-FU能够通过阻断胸苷酸合成,从而影响DNA链延长、改变DNA稳定性,最终使DNA单链断裂;因此,5-FU和FK866作用于完全不同的靶点途径。本研究中,低剂量的FK866 (1 nmol/L) 增加了乳腺癌对5-FU的化疗敏感性,进一步抑制细胞增殖和诱导凋亡。这种化疗增敏机制可能是因为FK866降低了NAD合成从而增加了5-FU的细胞毒作用。今后的研究中,我们将对Nampt抑制剂对乳腺癌相关蛋白信号通路的影响机制进一步探讨,以期为乳腺癌化疗增敏和靶向治疗策略提供新的线索。
[1] Shackelford RE, Mayhall K, Maxwell NM, et al. Nicotinamide phosphoribosyltransferase in malignancy: a review[J]. Genes Cancer, 2013, 4(11-12): 447-456.
[2] Bi TQ, Che XM. Nampt/PBEF/visfatin and cancer[J]. Cancer Biol Ther, 2010, 10(2): 119-125.
[3] 毕铁强, 周军, 梁文学, 等. 烟酰胺磷酸核糖基转移酶在乳腺癌中的表达及临床意义[J]. 中国肿瘤外科杂志, 2014, 6(4): 218-221.
[4] 龙厚隆, 车向明, 毕铁强, 等. 烟酰胺磷酸核糖转移酶、血管内皮生长因子A在胃癌组织中的表达及临床意义[J]. 中华外科杂志, 2012, 50(9): 839-842.
[5] Santidrian AF, LeBoeuf SE, Wold ED, et al. Nicotinamide phosphoribosyltransferase can affect metastatic activity and cell adhesive functions by regulating integrins in breast cancer[J]. DNA Repair (Amst), 2014, 23: 79-87.
[6] Zhou T, Wang T, Garcia JG. Expression of nicotinamide phosphoribosyltransferase-influenced genes predicts recurrence-free survival in lung and breast cancers[J]. Sci Rep, 2014, 4: 6107.
[7] Roulston A, Shore GC. New strategies to maximize therapeutic opportunities for NAMPT inhibitors in oncology[J]. Molecular & Cellular Oncology, 2015, 3(1): e1052180.
[8] Cea M, Cagnetta A, Fulciniti M, et al. Targeting NAD+ salvage pathway induces autophagy in multiple myeloma cells via mTORC1 and extracellular signal-regulated kinase (ERK1/2) inhibition[J]. Blood, 2012, 120(17): 3519-3529.
[10] Sampath D, Zabka TS, Misner DL, et al. Inhibition of nicotinamide phosphoribosyltransferase (NAMPT) as a therapeutic strategy in cancer[J]. Pharmacol Ther, 2015, 151: 16-31.
[11] Xiao Y, Kwong M, Daemen A, et al. Metabolic Response to NAD Depletion across Cell Lines Is Highly Variable[J]. PLoS ONE, 2016, 11(10): e0164166.
[12] Ju HQ, Zhuang ZN, Li H, et al. Regulation of the Nampt-mediated NAD salvage pathway and its therapeutic implications in pancreatic cancer[J]. Cancer Lett, 2016, 379(1): 1-11.
[13] Shackelford RE, Mayhall K, Maxwell NM, et al. Nicotinamide phosphoribosyltransferase in malignancy: a review[J]. Genes Cancer, 2013, 4(11-12): 447-456.
[14] Barraud M, Garnier J, Loncle C, et al. A pancreatic ductal adenocarcinoma subpopulation is sensitive to FK866, an inhibitor of NAMPT[J]. Oncotarget, 2016, 7(33): 53783-53796.
StudyofNampt-inhibitor-basedchemosensitizationeffectsinbreastcancercells
ZHOUShaojie,BITieqiang,QinChunxin,YANGXiaoqing,JIAOLuyu,YUHao.
(DepartmentofBreastSurgery,WeihaiMunicipalHospital,Weihai264200,China)
BITieqiang,Email: 37400704@qq.com
ObjectiveTo study the expression of nicotinamide phosphoribosyl transferase (Nampt) in breast cancer and investigate the effects of Nampt inhibitor on the growth and chemotherapy sensitivity of breast cancer cells.MethodsNampt mRNA expressions in breast cancer tissues and adjacent normal tissues were detected by qRT-PCR method; the effect of Nampt inhibitor on the growth of breast cancer cells and chemosensitization was detected by methyl thiazolyl tetrazolium (MTT) and soft agar clonogenic assays.ResultsqRT-PCR showed that Nampt in breast cancer tissues was significantly higher than that in adjacent normal breast tissues (3 folds,P<0.05). After 24 h of FK866 intervention, there was no significant inhibition of cell growth, however, after 48 h and 72 h, FK866 (3 ~30 nmol/L) inhibited the proliferation of MCF-7 cells. With the increase of FK866 concentration, the number of cell clones decreased gradually, and there was significant difference between two adjacent intervention concentration groups (allP<0.01).ConclusionsOur findings indicate that Nampt may be a new therapeutic target for breast cancer, and combined therapy of Nampt and cytotoxic drugs has the effect of chemosensitization.
Breast neoplasms; Nicotinamide phosphoribosyl transferase; Cell survival; Drug therapy; Chemosensitization
264200 山东 威海,威海市立医院 甲乳外科
毕铁强, Email: 37400704@qq.com
10.3969/j.issn.1674-4136.2017.03.005
1674-4136(2017)03-0154-04
2017-02-07][本文编辑:李庆]
