初治Ⅳ期乳腺癌原发肿瘤手术研究现状
2017-09-16雷蕾王娴王晓稼
雷蕾, 王娴, 王晓稼
乳腺癌专题
初治Ⅳ期乳腺癌原发肿瘤手术研究现状
雷蕾, 王娴, 王晓稼
虽然晚期初治乳腺癌一直被认为是不可治愈的,但是合理的综合治疗已使部分患者看到了治愈的希望。作者综合大宗回顾性研究和ASCO会议三项前瞻性临床研究的结论,认为在保证全程有序、有效、可持续的系统性全身治疗前提下,年龄<55岁、激素受体阳性、肿瘤负荷轻、局部症状或体征明显的患者可以考虑原发肿瘤手术。对于该类患者是选择先接受原发肿瘤手术还是全身治疗仍然存在争议,而通过合理有效的综合治疗一定可以使患者的预后得到进一步改善。
乳腺肿瘤; 晚期乳腺癌; 原发肿瘤手术; 预后
大约3%~8%的乳腺癌患者在初诊时已有远处转移,而我国这个比例可能更高[1]。有关初诊Ⅳ期乳腺癌是否要对原发灶进行手术,手术方式及手术时机都是近年来乳腺癌领域富有争议的热点问题。虽然晚期乳腺癌到目前为止仍是不可治愈,但是得益于分子分型为基础的分类治疗,晚期乳腺癌也迈入了慢性疾病管理的时代;晚期初治乳腺癌患者中的原发肿瘤处理显著影响了患者的生存质量及临床预后[2],先行全身系统治疗或先行局部手术治疗各有利弊。现将原发肿瘤手术在晚期初治乳腺癌治疗中的研究现状作一综述。
1 原发肿瘤手术治疗晚期初治乳腺癌的理论基础
对晚期乳腺癌患者来说,改善生活质量及延长生存时间是最主要的治疗目标,此外,部分患者甚至有完全治愈的可能。临床实践中,晚期初治乳腺癌的预后可能好于经治的复发转移性乳腺癌,可能原因包括:未经治疗的晚期乳腺癌对系统治疗敏感,而经治的晚期乳腺癌往往更容易产生耐药或肿瘤免疫逃避现象;既往治疗可能改变复发转移灶的肿瘤特性,从而对后续全身治疗的反应性产生影响。但是,与经治乳腺癌不同,晚期初治乳腺癌包含了原发肿瘤处理这一较为特殊的问题。从肿瘤生长和转移相关机制上看,切除原发肿瘤有以下临床意义:①减少肿瘤负荷及循环肿瘤细胞(circulating tumor cell, CTC),有利于改善患者的生存预后[3];②肿瘤存在一种被称为“肿瘤自我供给”的生长模式,即原发灶能释放一些肿瘤细胞,通过循环种植形成转移灶,而转移灶又能通过同样的途径反馈至原发灶,使原发灶释放出恶性程度更高的肿瘤细胞再次促进转移[4];③肿瘤干细胞占原发灶的30%~50%,其特点是对化疗不敏感且具有潜在诱导肿瘤发生远处转移的特质,整个原发肿瘤相当于一个不断招募和增殖多种癌基因的微环境,因此手术及时切除原发肿瘤可能有益于疾病的后期控制[5-6];④切除原发肿瘤有利于重新激活自身免疫系统产生肿瘤免疫活性,增加转移灶对药物或者其他抗肿瘤治疗的敏感性[7]。
2 回顾性研究的临床启示
针对晚期初治乳腺癌原发肿瘤手术有诸多回顾性研究。2008年Cady B等[8]研究指出相较于同期或先行手术者,先行化疗控制后再进行原发肿瘤切除可能有更好的2年总生存率;而影响5年总生存率的因素可能更多的是选择偏倚,如将Ⅲ期患者误诊为Ⅳ期、只有单发转移灶或全身系统性治疗效果特别好等,而非手术。Tan Y等[9]对SEER数据库2004年至2008年经治的10 441例晚期乳腺癌患者生存数据进行分析,按手术范围将患者分为4组:原发灶与转移灶均切除(R0组),仅原发灶切除组,仅转移灶切除组,原发灶与转移灶均未切除组。虽然该项研究由于入组年代较为久远,未涉及HER2状态与抗HER2治疗等重要因素分析,但还是带来一些重要提示,即无论R0组还是仅原发灶切除组均可以显著改善总生存;激素受体(hormonal receptor, HR)阳性患者更能从手术中获益,而对HR阴性患者是否行手术治疗需要谨慎。Harano等[10]回顾性分析了66例接受抗HER2治疗后晚期乳腺癌影响长期生存的因素,其中除HR阳性、肿瘤负荷轻、仅软组织及骨转移外,接受原发灶及转移灶手术切除也与患者的长期生存有关。Yao等[11]针对483例晚期HER2阳性初治Ⅳ期乳腺癌患者的回顾性研究发现约13%的患者在接受抗HER2治疗后能达到无疾病状态,其中接受原发灶切除手术的患者比例比未达到无疾病状态的患者更高(59%比25%,P≤0.001)。Thomas等[12]对SEER数据库中在2010-2012年间确诊的晚期HER2阳性初治Ⅳ期乳腺癌的多因素生存分析发现,原发灶切除手术是影响患者3年总生存率的有利因素之一(HR=0.40,95%CI=0.33~0.49)。此外,患者年龄也是需要考虑的因素之一。Yamada A等[13]的回顾性研究将2 276例患者按年龄分组:≤64岁、65~74岁、 ≥75岁,Ⅲ、Ⅳ期所占比例和乳房切除率在≥75岁组患者中最高,而此组的腋窝淋巴结清扫、保乳术后放疗率以及接受术后化疗率最低,尽管如此,这3组的无远处转移生存或无乳腺癌相关生存结果相似,仅存在局部复发率的差异。该研究间接反映了对于年龄较大且分期较晚的乳腺癌患者,即使接受了相对强度不足的治疗方式或剂量,临床结局将不受太大影响。
综上,部分回顾性研究样本量较大,结果提示原发肿瘤切除也许对晚期乳腺癌的预后产生间接影响,但研究的异质性明显、存在入组条件的选择性偏倚,比如患者年龄、肿瘤负荷、肿瘤生物学行为等[8,14],缺少充分且直接的证据,因此,大多数情况下仍不推荐对无症状的晚期患者进行原发肿瘤切除手术来提高生存[15]。
3 前瞻性研究的临床思考
2016年ASCO会议有三项关于晚期初治是否需要进行乳腺原发肿瘤手术的Ⅲ期前瞻性临床研究。其中土耳其研究为阳性结果,而来自印度和美国的研究为阴性结果(表1)。
土耳其研究(MF 07-01试验,NCT00557986)入组了271例晚期乳腺癌,中位随访18个月时,初始接受手术组与初始接受全身治疗组的中位总生存分别为46和42个月(P>0.05); 至中位随访40个月时手术组患者生存明显提高(46月比37月,HR=0.66);两组的5年生存率分别为41.6%和24.4%,具有显著性差异。研究发现对于肿瘤生物学行为较好的转移性乳腺癌,例如ER+、HER2-、单灶骨转移及年龄<55岁的患者可以从初始接受手术治疗中获益;初始手术治疗组的局部区域进展率大大低于初始全身性治疗组(0.7%比3.6%);值得注意的是,在非预设的亚组分析中,手术延长了单纯骨转移患者的生存期,但却缩短了多发肝或肺转移患者的生存期[16]。
印度研究(Tata Memorial trial, NCT00193778)对350例晚期乳腺癌中位随访23个月发现:接受局部治疗组与无局部治疗组的中位总生存(19.2月比20.5月,P=0.79)及2年总生存率(41.9%比43.0%)差异无统计学意义;虽然局部治疗可延长局部复发时间,但局部治疗可能增加了患者发生远处转移的风险[17]。
美国TBCRC 013研究发现,手术组与未手术组的中位疾病进展时间(time to progression, TTP)没有明显差异(12月比13月,P=0.74);全组85%的患者对一线系统性治疗有反应,该组患者总生存较好、姑息性原发灶切除手术需求度较低,其中一线接受化疗及单个内脏转移的患者更易选择原发灶切除手术,但手术没能带来PFS和OS的额外获益,乳腺肿瘤的分子亚型之间也没能看到生存差异。研究还发现HER2状态与患者年龄仍然是重要的预后因素,提示进一步的亚组分析对研究原发灶手术是否能带来生存获益十分重要[18]。
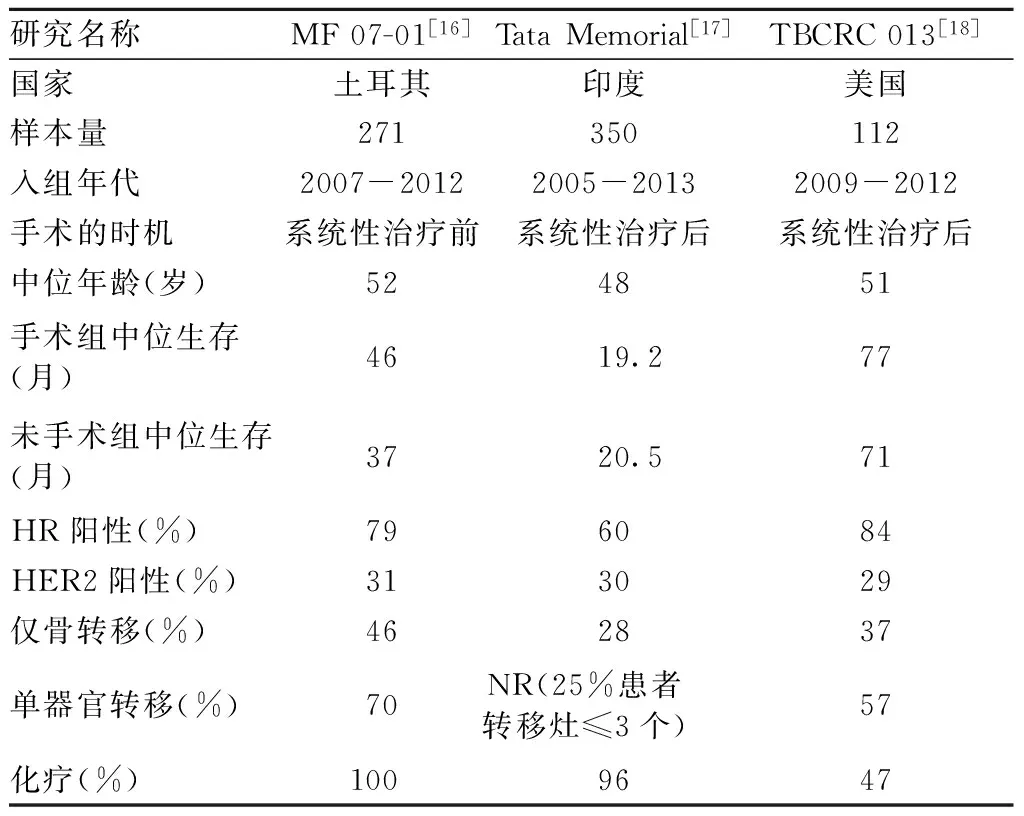
表1 3个已发表的前瞻性随机对照临床试验的研究数据比较
土耳其研究虽然为阳性结果,但是它设计试验组为原发灶手术切除先于全身系统治疗,未考虑手术时机的选择问题,因此,它有别于目前的临床常规;其次,入组病例临床病理特征不均衡是很重要的混杂因素,对照组(仅接受全身治疗)相比治疗组(先手术后全身治疗)具有更多的三阴性亚型(17%比7%)和内脏转移(34%比25%)、更少的单纯骨转移(40%比51%)和孤立性骨转移(24%比34%),也就是说接受先手术后全身治疗组患者的本身预后相对较好,原发灶姑息性切除手术对该组的预后影响其实不能十分明确;其次,两组在中位随访36个月之前的总生存是相似的[19-20],直到40个月时才达到统计学差异,长达40个月后显现的总生存差异不能被完全证明是局部治疗带来的生存获益;最后,在非预设的亚组分析中,手术延长了单纯骨转移患者的生存期,但却缩短了多发肝或肺转移患者的生存期,可以推测对肿瘤负荷大、合并多发内脏转移的患者需要首先接受快速有效的全身治疗进行解救,不加选择、过早地接受局部治疗不仅有可能延误了全身治疗的时机,甚至可能促进疾病恶化、缩短患者的总生存。
印度研究也存在入组偏倚的情况:首先,有16%的HER2阳性患者没有接受抗HER2治疗;对照组(无手术组)大约10%的女性患者为预防感染、出血也接受了乳房切除手术,虽然这些是被研究方案所允许的,但是在样本量不大的情况下这些因素可能会对总的研究终点产生影响;其次,该研究采用的是单侧优效性设计,结果未能达到2.5或3个月的绝对差异或总生存率4%的差异,因此,仅提示了手术组不优于未手术组的预后;最后,由于该研究设计问题,未能对全身治疗无反应或反应不佳的患者是否需要行原发肿瘤手术的问题进行解答。
当然,印度与美国这两项研究都发现手术治疗组出现局部无进展生存事件的风险更低,但远处无进展生存事件的风险更高,这个结果与之前的部分临床前研究结果相似[21-24],推测可能与以下几种机制有关:①手术种植/播散引起的CTC黏附于靶器官血管上皮概率增高;②手术导致免疫抑制;③手术促进新生血管形成;④手术引起炎症损伤[25-26]。因此,我们需要根据患者的肿瘤生物学特性及患者的自身状况,有针对性地给出个体化评估和治疗决策。
4 结语
初始Ⅳ期乳腺癌常常不可治愈,原发肿瘤手术是否能延长生存没有明确的研究结论。虽然大部分回顾性研究的结果支持晚期乳腺癌患者接受原发肿瘤手术,其中不乏得到OS改善的阳性数据,但是入组患者的选择性偏倚及对于系统性治疗数据的不准确分析,使这类结果的证据级别降低。目前已有的前瞻性研究存在入组患者具有较高选择性、手术时机标准不一、随访时间点不同等,其截然不同的结果难以支持研究结论。2017年ASCO年会上,澳大利亚研究者的ABCSG 28/POSYTIVE随机对照临床试验,结果初诊Ⅳ期乳腺癌中,手术序贯系统治疗较单纯系统治疗的生存差,中位OS分别为34.6和54.8个月(但HR=0.691,P=0.267)[27]。总之,Ⅳ期乳腺癌原发灶手术仍然是当前临床研究的热点,根据现有研究结果,经选择的Ⅳ期乳腺癌能够从手术切除中获益,非选择人群则难以获益。未来的研究方向应该是聚焦局部手术获益人群、最佳手术时机和手术方式等,以指导Ⅳ期乳腺癌综合治疗个体化策略,显著提高局部控制率、改善患者生活质量。
[1] Gardishar WJ, Anderson BO, Balassanian R, et al. Breast Cancer Version 2.2015[J]. J Natl Compr Canc Netw, 2015, 13(4):448-475.
[2] Ruiterkamp J, Voogd AC, Bosscha K, et al. Impact of breast surgery on survival in patients with distant metastases at initial presentation: a systematic review of the literature[J]. Breast Cancer Res Treat, 2010, 120(1):9-16.
[3] Budd GT, Cristofanilli M, Ellis MJ, et al. Circulating tumor cells versus imaging-predicting overall survival in metastatic breast cancer[J]. Clin Cancer Res, 2006, 12(21): 6403-6409.
[4] Kim MY, Oskarsson T, Acharyya S, et al. Tumor self-seeding by circulating cancer cells[J]. Cell, 2009, 139(7): 1315-1326.
[5] Chiotaki R, Polioudaki H, Theodoropoulos PA. Cancer stem cells in solid and liquid tissues of breast cancer patients: Characterization and therapeutic perspectives[J]. Curr Cancer Drug Targets, 2015, 15(3): 256-269.
[6] Kakarala M, Wicha MS. Implications of the cancer stem-cell hypothesis for breast cancer prevention and therapy[J]. J Clin Oncol, 2008, 26(17): 2813-2820.
[7] Danna EA, Sinha P, Gilbert M, et al. Surgical removal of primary tumor reverses tumor-induced immunosuppression despite the presence of metastatic disease[J]. Cancer Res, 2004, 64(6): 2205-2211.
[8] Cady B, Nathan NR, Michaelson JS, et al. Matched pair analyses of stage Ⅳ breast cancer with or without resection of primary breast site[J]. Ann Surg Oncol,15(12):3384-3395.
[9] Tan Y, Li X, Chen H,et al. Hormone receptor status may impact the survival benefit of surgery in stage iv breast cancer: a population-based study[J]. Oncotarget, 2016, 7(43):70991-71000.
[10] Harano K, Lei X, Gonzalez-Angulo AM, et al. Clinicopathological and surgical factors associated with long-term survival in patients with HER2-positive metastatic breast cancer[J]. Breast Cancer Res Treat, 2016,159(2):367-374.
[11] Yao Wong, Akshara Singareeka Raghavendra, Christos Hatzis, et al. Long-term survival of de novo stage IV human epidermal growth factor receptor 2 (HER2)-positive breast cancers treated with HER2 targeted therapy[C]. 2017ASCO annual meeting, 1021 Poster Session (Board #13).
[12] Alexandra Thomas, Seema Ahsan Khan, Charles Lynch, et al. Survival by HER2 receptor status in stage IV breast cancer: SEER 2010-2012[C]. 2017ASCO annual meeting, 1032 Poster Session (Board #24).
[13] Yamada A, Narui K, Sugae S, et al. Operation with less adjuvant therapy for elderly breast cancer[J]. J Surg Res, 2016, 204(2):410-417.
[14] Thomas A, Khan SA, Chrischilles EA, et al. Initial Surgery and Survival in Stage IV Breast Cancer in the United States, 1988-2011[J]. JAMA Surg, 2016,151(5):424-431.
[15] Khan SA. Surgical Management of de novo Stage IV Breast Cancer[J]. Semin Radiat Oncol, 2016, 26(1):79-86.
[16] Atilla Soran, Vahit Ozmen, Serdar Ozbas, et al. A randomized controlled trial evaluating resection of the primary breast tumor in women presenting with de novo stage IV breast cancer: Turkish Study (Protocol MF07-01)[J]. J Clin Oncol, 2016, 34(suppl; abstr 1005).
[17] Badwe R, Hawaldar R, Nair N, et al. Locoregional treatment versus no treatment of the primary tumour in metastatic breast cancer: an open-label randomised controlled trial[J]. Lancet Oncol, 2015, 16(13):1380-1388.
[18] King TA, Lyman JP, Gonen M, et al. A prospective analysis of surgery and survival in stage Ⅳ breast cancer (TBCRC 013)[C].presented in translational breast cancer research consortium in 2016 ASCO Annual Meeting.
[19] Soran A, Ozbas S, Kelsey SF, et al. Randomized trial comparing locoregional resection of primary tumor with no surgery in stage Ⅳ breast cancer at the presentation (Protocol MF07-01): a study of Turkish Federation of the National Societies for Breast Diseases[J]. Breast J, 2009, 15(4):399-403.
[20] Soran A, Ozmen V, Osbas S, et al. Early follow up of a randomized trial evaluating resection of the primary breast tumor in women presenting with de novo stage Ⅳbreast cancer; Turkish study (protocol MF07-01) [J]. Cancer Res, 2013, 73(Suppl 24):Abstract S2-03.
[21] Gunduz N, Fisher B, Saffer EA. Effect of surgical removal on the growth and kinetics of residual tumor[J]. Cancer Res, 1979, 39(10): 3861-3865.
[22] Braunsch weiger PG,Ting HL,Schiffer LM.Role of corticosteroid hormones in the control of cell proliferation in residual tumor after surgical cytoreduction[J].Cancer Res,1983,43(12pt1):5801-5807.
[23] Fisher B, Gunduz N, Coyle J, et al. Presence of a growth-stimulating factor in serum following primary tumor removal in mice[J]. Cancer Res, 1989, 49(8): 1996-2001.
[24] Demicheli R, Retsky MW, Swartzendruber DE, et al. Proposal for a new model of breast cancer metastatic development[J]. Ann Oncol, 1997, 8(11): 1075-1080.
[25] Ten Kate M, Hofland LJ, van Grevenstein WM, et al. Influence of proinflammatory cytokines on the adhesion of human colon carcinoma cells to lung microvascular endothelium[J]. Int J Cancer, 2004, 112(6): 943-950.
[26] Benish M, Bartal I, Goldfarb Y, et al. Perioperative use of beta-blockers and COX-2 inhibitors may improve immune competence and reduce the risk of tumor metastasis[J].Ann Surg Oncol, 2008, 15(7): 2042-2052.
[27] Bjelic-Radisic V, Fitzal F,Steger GG, et al. Primary surgery versus no surgery in synchronous metastastic breast cancer: Patient-reported outcomes of the ABCSG 28 Posytive Trial[C].2017 ASCO Annual Meeting Abstracts 1074 Poster Session (Board #66).
Researchsituationofprimarytumorresectionindenovoadvancedbreastcancer
LEILei1,WANGXian2,WANGXiaojia1.
(1.DepartmentofBreastTumorMedicalOncology,ZhejiangCancerHospital,Hangzhou310022,China; 2.DepartmentofMedicalOncology,SirRunRunShawHospitalaffiliatedtoZhejiangUniversitySchoolofMedicineHangzhou310016,China)
WANGXiaojia,Email:wxiaojia0803@163.com
Although de novo advanced breast cancer has long been considered incurable, reasonable comprehensive therapies could led some patients to be cured finally. According to the results of large retrospective studies and three prospective clinical trials presented in American Society of Clinical Oncology (ASCO) conference, on the premise of ensuring of full-ordered course, effective and sustainable systemic treatment, patients with aged <55, hormone receptor positive tumors, light tumor burden, or obvious symptoms or signs of local lesions could be considered to accept the primary tumor resection. For those patients who should accept the primary tumor resection or systemic treatment at first is still controversial, however, reasonable and effective comprehensive therapies should be helpful to improve the prognosis of patients.
Breast Ncoplasms; Advanced breast cancer; Primary lesion resection; Prognosis
国家自然科学基金(No.81572715); 浙江省医药卫生科技计划(No.2015KYB052)
310022 浙江 杭州,浙江省肿瘤医院 乳腺肿瘤内科(雷蕾、王晓稼); 310016 浙江 杭州,浙江大学医学院附属邵逸夫医院 肿瘤内科(王娴)
王晓稼,Email: wxiaojia0803@163.com
10.3969/j.issn.1674-4136.2017.03.002
1674-4136(2017)03-0141-04
2017-06-10][本文编辑:李筱蕾]
