广西平果县岩溶山地不同植物群落的土壤酶活性
2017-09-15欧芷阳申文辉彭玉华庞世龙何琴飞黄小荣
欧芷阳, 申文辉, 彭玉华, 庞世龙, 何琴飞, 黄小荣, 梁 艳
(1.广西林业科学研究院, 南宁 530002; 2.中南林业科技大学, 长沙 410004)
广西平果县岩溶山地不同植物群落的土壤酶活性
欧芷阳1, 申文辉1, 彭玉华1, 庞世龙1, 何琴飞1, 黄小荣1, 梁 艳2
(1.广西林业科学研究院, 南宁 530002; 2.中南林业科技大学, 长沙 410004)
为探讨平果县岩溶山地典型植物群落的土壤酶活性特征,基于调查取样与试验分析,采用相关分析、多重比较以及主成分分析方法,研究了不同植物群落间土壤酶活性的差异,分析了土壤酶活性与土壤化学性质的关系。结果表明:(1) 土壤过氧化氢酶、脲酶及蔗糖酶活性的群落间差异达显著水平,显示不同植物群落对土壤酶活性产生一定影响;(2) 土壤pH值与过氧化氢酶、脲酶间呈极显著正相关(p<0.01),与碱性磷酸酶间呈显著负相关(p<0.05);(3) 4个酶活性与代表土壤肥力的土壤有机质、全氮、全磷、全钾、碱解氮及速效钾之间具有较强的相关性,但速效磷与4个土壤酶之间的相关性均未达显著水平(p>0.05);(4) 过氧化氢酶、脲酶及碱性磷酸酶能敏感反映土壤质量的变化,可作为本区域土壤质量评价的指标。
土壤酶; 喀斯特; 植物群落; 土壤养分; 相关性
土壤酶参与土壤中有机物质的转化过程,对土壤生态系统的物质循环、能量转化产生重要影响。植被通过凋落物的种类、产量及根系分泌物对土壤酶活性产生影响,其土壤酶活性变化与植被物种组成、林龄等因子密切相关。因此,不同植被类型下的土壤酶活性是当前生态学、土壤学及微生物学的研究热点,不少学者围绕不同林龄、林型以及不同演替阶段下土壤酶活性展开了相关研究[1-3],探讨了土壤酶活性与植物生长以及土壤肥力的相关性[4-5]。土壤酶活性还可反映植被恢复措施对土壤的改良作用,不同植被恢复模式下的土壤酶活性也是研究者的关注重点[6-7],这些研究对退化生态系统的恢复具有重要的指导意义。
广西岩溶地貌发育典型,人为干扰下岩溶地区的喀斯特森林普遍出现了退化,部分地段形成了植被稀疏、基岩大面积裸露的石漠化景观。石漠化导致土壤肥力下降、生态环境恶化,植被恢复是进行水土保持与生态恢复的必要措施。土壤酶活性对环境变化响应敏感,其活性变化能客观反映土壤质量的变化状况[8-9],岩溶地区不同生境、不同植被类型以及植被退化或恢复过程下土壤酶活性变化引起了广泛关注[10-13]。然而,这些研究多集中于贵州等省区,对广西石漠化生态恢复过程中土壤酶活性的研究报道较少。平果县是广西岩溶山地面积分布较多的县份之一,也是广西石漠化治理的重点区域。经过多年努力,当地石漠化得到初步遏制、植被得到了一定程度的恢复,但石山植被仍以灌丛、灌木林和疏林地为主,分布着小面积的次生乔木林。尽管研究者对平果岩溶山地的土壤质量、退耕还林的土壤生态效应以及石漠化复合生态系统等开展了相关研究[14-16],但对生态恢复中土壤酶活性的研究未有涉及,哪些酶是土壤肥力维持与改善的关键因子不甚清楚。为此,本文以平果岩溶山地典型植物群落为研究对象,比较不同群落的土壤酶活性,探讨土壤酶活性与土壤养分因子的关系,旨在为研究区域生态恢复效应评价及土壤质量管理提供科学依据。
1 研究区概况
研究区位于广西省平果县喀斯特山地,地处107°21′—107°51′E,23°12′—23°51′N。全境地势北高南低,南北低山丘陵,中部为岩溶地貌。属亚热带季风气候,年平均气温21.5℃,年均降雨量1 359 mm,年平均日照时数1 682 h,年均蒸发量1 572 mm,平均相对湿度80%以上,降雨集中在6—9月。土壤以棕色和黑色石灰土为主,土层浅薄。石山植被以灌丛、灌木、疏林地占较大比例,次生乔木林面积较小。以黄荆(Vitexnegundo)占优势的灌丛主要分布于村庄或公路边,次生乔木林乔木层多以蚬木(Excentrodendronhsienmu)占优势,一些村屯后山分布着小面积的仪花林(Lysidicerhodostegia)。人工植被以任豆(Zeniainsignis)和吊丝竹(Dendrocalamusminor)为主。
2 材料与方法
2.1 样地选择与土样采集
鉴于平果石山区的植被分布现状,2012年4月—6月上旬,对平果岩溶山地的灌丛、灌木、仪花和蚬木林进行调查。乔木、灌木林的调查样方面积为20 m ×20 m,灌丛和灌木调查样方面积为10 m ×10 m。在常规群落学调查的基础上,在每个样方内按S形路线采集土壤样品10~15个。考虑到调查区域土层浅薄,每个样方仅采集0—15 cm表层土壤,混合成约1 kg待测土样带回实验室进行分析。灌丛采集土壤样品数为12个、灌木林9个、仪花林10个、蚬木林12个。同时,利用GPS在样方中心位置记录样地地理坐标等信息。样地基本概况见表1。

表1 样地基本概况
2.2 样品化学分析
土壤化学性质测定:土壤pH值采用酸度计法测定;有机质(SOM)采用重铬酸钾氧化—外加热法测定;全氮(TN)、碱解氮(AN)采用扩散法测定;全磷(TP)采用NaOH熔融—钼锑抗显色—紫外分光光度法;速效磷(AP)采用0.5 mol/L NaHCO3提取—钼锑抗显色—紫外分光光度法;全钾(TK)采用NaOH熔融—火焰光度法;速效钾(AK)采用NH4OAc浸提—火焰光度法测定。分析方法参考《土壤农化分析》[17]。
土壤酶活性测定:脲酶(Urease,URE)活性采用苯酚钠比色法测定;蔗糖酶(Invertase,INV)采用3,5-二硝基水杨酸比色法测定;过氧化氢酶(Catalase,CAT)采用0.1 mol/L KMnO4滴定法测定;碱性磷酸酶(Alkaline phosphatase,APE)采用磷酸苯二钠比色法测定[18-19]。
2.3 数据分析方法
采用Pearson相关系数评价土壤养分因子与土壤酶活性之间的相关关系;采用Kruskal-Wallis检验比较群落间土壤酶活性的差异,采用Duncan多重比较分析组间差异。运用SPSS 19.0软件进行Duncan多重比较及相关分析,STATISTICA 8.0进行Kruskal-Wallis检验和主成分分析。显著性水平为α=0.05。
3 结果与分析
3.1 不同植物群落土壤养分含量
表2为4个植物群落土壤化学性质的测定值。经测定,土壤pH值变幅为6.7~7.3,灌丛土壤pH值显著高于其他3个群落,随群落演替基本呈下降趋势。土壤有机质的变幅为104.00~177.04 g/kg,全氮的变幅为6.26~9.69 g/kg,碱解氮的含量345.88~643.71 mg/kg,以蚬木林最高、仪花林其次。灌丛土壤全磷含量显著高于其他3个群落,但群落间土壤速效磷含量差异不显著(p>0.05)。土壤全钾和速效钾含量均以灌丛群落最高,灌木林其次,仪花林最低(表2)。
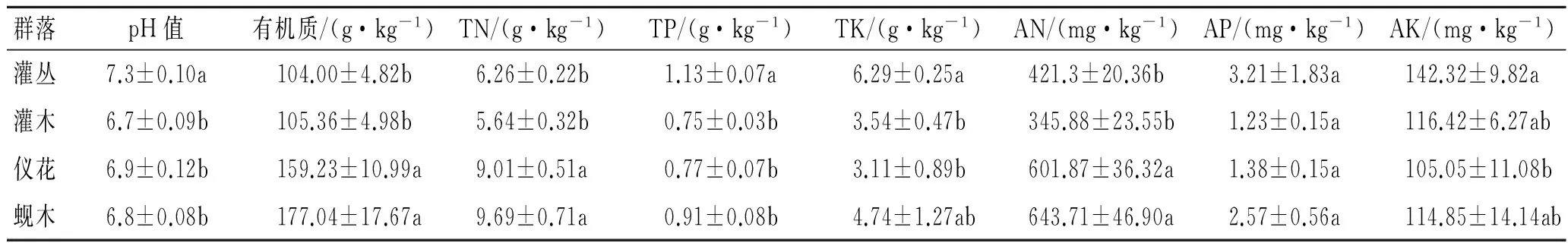
表2 不同群落类型土壤pH值及养分含量
注:表中同列字母不同代表差异显著(p<0.05)。
3.2 不同植物群落土壤酶活性差异分析
Kruskal-Wallis检验显示,过氧化氢酶活性在群落间呈极显著差异(p<0.01),灌丛群落的过氧化氢酶显著高于其他3个群落。群落间碱性磷酸酶活性差异不显著(p=0.1511),以蚬木群落的土壤碱性磷酸酶活性最高,灌丛最低。土壤脲酶活性在群落间呈极显著差异(p<0.01)、蔗糖酶活性差异显著(p<0.05)。灌木群落的土壤脲酶活性显著低于其他3个群落,其蔗糖酶活性则显著高于其他群落(图1)。
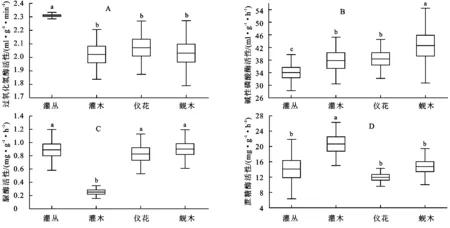
注:不同小写字母表示存在显著差异(p<0.05)。
图1不同植物群落土壤酶活性比较
3.3 土壤酶活性与土壤养分的相关分析
表3显示,除蔗糖酶,土壤pH值与其他3种酶的相关性均达显著水平。过氧化氢酶与土壤全磷、全钾及速效钾之间呈极显著正相关(p<0.01);碱性磷酸酶与土壤有机质、全氮及碱解氮间呈极显著正相关(p<0.01);脲酶与土壤全氮、全磷及碱解氮间呈极显著正相关(p<0.01),与全钾间为显著正相关(p<0.05);蔗糖酶与土壤全磷、碱解氮之间呈显著负相关(p<0.05)。速效磷与4个土壤酶之间呈不显著相关(p>0.05),表明其含量变化受这四种酶活性影响较小。
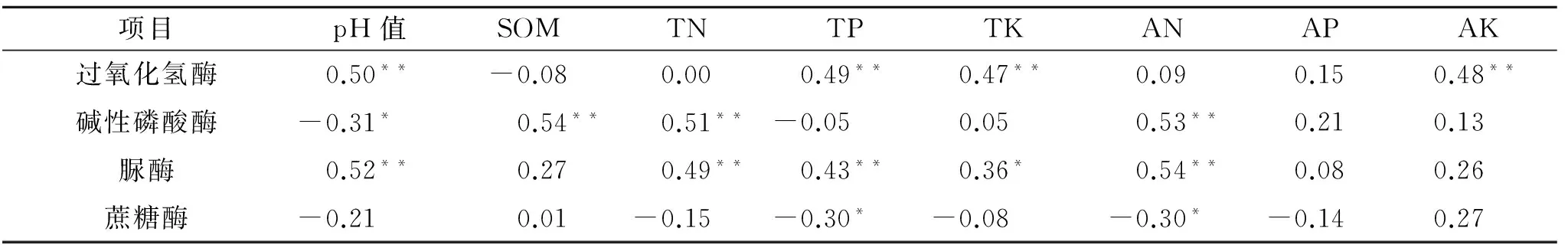
表3 土壤酶活性与土壤养分之间的相关性
注:**表明在0.01水平上极显著相关,*表明在0.05水平上显著相关。
3.4 土壤酶与理化因子的主成分分析
表4为土壤酶与土壤理化因子主成分分析结果。表中显示,特征值大于1.0的主成分有4个,方差累积贡献率为80.6%,能反映绝大部分信息。第一主成分的特征值为4.02,其方差贡献率为33.5%;第二主成分的特征值为2.97,其方差贡献率为24.7%。前两个主成分能解释总变异的58.2%,基本能解释土壤质量的信息。
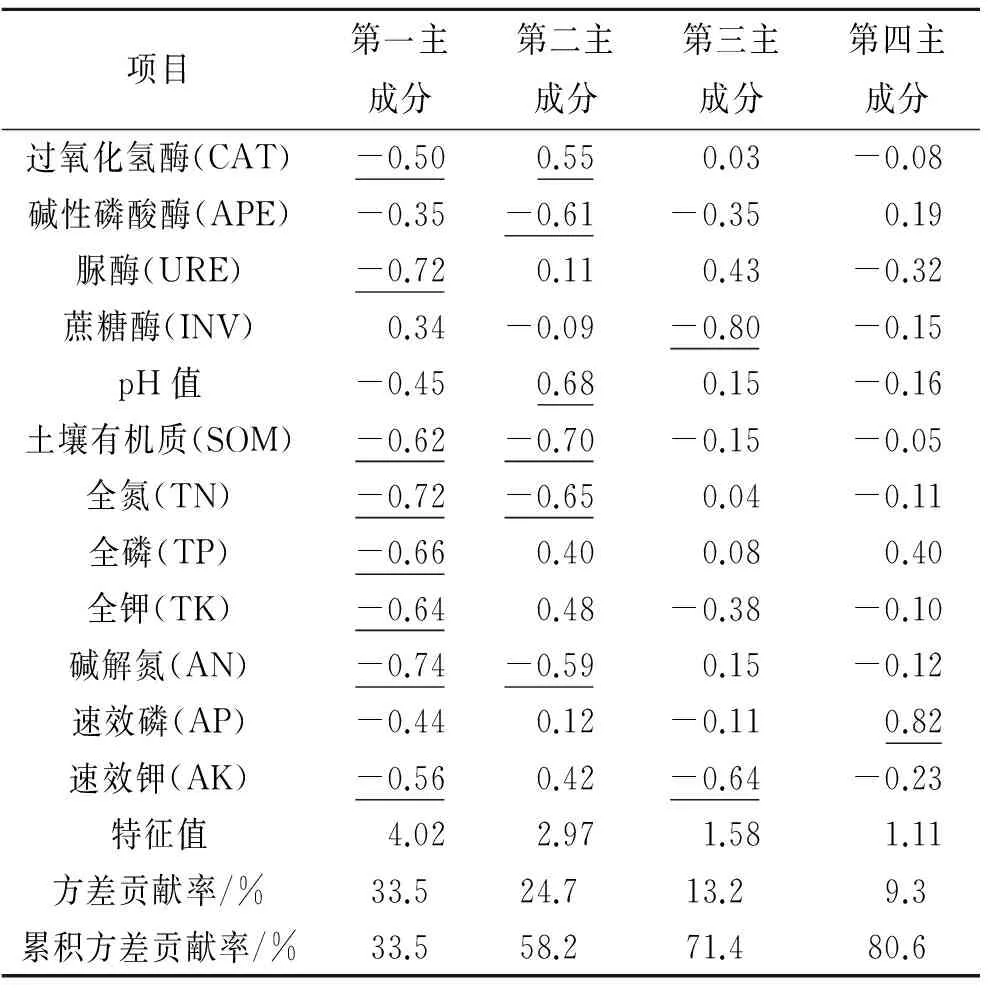
表4 土壤参数的主成分分析矩阵
注:划横线的数字表示该变量的因子载荷绝对值大于0.70。
因子载荷值显示,CAT,URE,SOM,TN,TP,TK,AN和AK等与第一主成分有较强的负相关,第一主成分主要综合了这些因子的变化信息;第二主成分综合了CAT,APE,pH值,SOM,TN和AN等的变化信息(表4)。第一主成分的方差贡献率最大,对土壤质量变化起着主导作用。
4个土壤酶中,URE在第一主成分的载荷绝对值最大,CAT其次;APE在第二主成分的载荷绝对值最大,CAT其次;蔗糖酶在第一、二主成分的载荷值均比较低,与这两个主成分的相关性较弱,其对土壤质量变化的敏感性相对较弱。
4 讨论与结论
(1) 土壤酶是土壤中的生物催化剂,其活性与土壤养分因子间存在相当密切的联系。多数研究显示,各类土壤酶活性与有机质、全氮、碱解氮间呈较强的正相关关系[1,10-11]。但土壤磷、钾与酶之间的关系差异较大,如高寒矮蒿草草甸土壤全钾与过氧化氢酶、碱性磷酸酶之间呈显著负相关[20],而喀斯特峡谷区土壤全钾与这两种酶之间则呈显著正相关[11]。司志国等[21]发现速效磷与过氧化氢酶、过氧化物酶等氧化还原酶类间的相关性达显著水平,与脲酶等水解酶类的相关性不显著;戴凌等[22]也发现土壤速效磷与各类土壤酶活性之间均呈显著正相关,而杨宁等[23]的研究则显示土壤速效磷与研究所涉及土壤酶之间相关性不显著。这些研究结果表明土壤酶活性与土壤养分因子间关系极为复杂。本研究土壤pH值与除与蔗糖酶间的相关性不显著之外,与其他3种酶活性间的相关性均达显著水平;过氧化氢酶、碱性磷酸酶及脲酶分别与土壤有机质、全氮、全磷等肥力因子间有较强的相关性(表3),显示它们与土壤中有机质的分解及氮、磷、钾的活化有密切关系;蔗糖酶与土壤因子间的相关性相对较弱,仅与土壤全磷、碱解氮间呈显著负相关。速效磷与四种酶活性间的相关性不显著,原因可能在于喀斯特山地土壤pH值为中性偏微碱性,因土壤酶促底物与pH值的综合作用,影响了土壤酶参与无机磷的转化过程。
(2) 本文除碱性磷酸酶活性之外,其他3种土壤酶活性的群落间差异均达到了显著水平。其中,灌丛群落的土壤过氧化氢酶活性显著高于其他3个群落,蚬木群落的碱性磷酸酶活性最高,灌木群落的土壤蔗糖酶活性最高、脲酶活性最低(图1)。多数研究显示植物群落间土壤酶活性存在差异[24-25],如陈祖拥等[10]的研究显示原生林地土壤脲酶、过氧化氢酶和碱性磷酸酶活性显著高于灌木及灌草丛,蔗糖酶活性无显著差异;龙健等[26]的研究显示与对照相比,不同造林模式下各类土壤酶活性明显增强。杨小青等[27]也发现在石漠化地区,自然恢复乔木林各类土壤酶活性最强。这些研究结果表明,随着植被向乔木阶段的演替或恢复,土壤酶活性得到增强,这与乔木林凋落物产量及根系分泌物的增加有关。土壤中脲酶直接参与含氮有机化合物的转化,磷酸酶参与有机磷的转化,本研究蚬木林这两种土壤酶活性最高,可能与该林分土壤有机养分含量高、土壤微生物活力和数量高有关。灌木林地蔗糖酶活性高于其他3个群落,结果与陈祖拥等[10]的研究相似,原因在于灌木群落林下植被多样性相对丰富,其根系分泌物刺激了蔗糖酶活性。然而,灌丛群落土壤过氧化氢酶活性显著高于其他3个群落,杨宁等[23]的研究也得出了类似的结论,CAT活性高低主要取决于土壤氧化还原状况。
(3) 上述分析显示,土壤酶活性与土壤养分间密切相关,具有敏感指示土壤肥力变化的特性。因此,研究者将土壤酶作为土壤肥力评价的检测指标[28-29]。如杨宁等[9]发现蔗糖酶和碱性磷酸酶可以敏感地反映植被恢复过程中土壤肥力的变化,可作为衡阳紫色土丘陵坡地土壤质量评价的指标。赵燕娜等[30]认为土壤酶指数可全面反映土壤酶活性随林龄的变化特征,能够作为一种土壤质量评价的方法。针对喀斯特山地的研究中,也有研究者将土壤酶活性纳入了土壤肥力质量综合评价的指标体系中[26,29]。本研究过氧化氢酶、碱性磷酸酶及脲酶与土壤养分含量间具有较强相关性,且过氧化氢酶、脲酶与主成分分析的第一主成分相关性较强,过氧化氢酶及碱性磷酸酶与第二主成分间相关性较强,因此认为这三种酶能敏感反映土壤质量的变化,可作为本区域土壤质量评价的指标。
[1] 张超,刘国彬,薛莛,等.黄土丘陵区不同林龄人工刺槐林土壤酶演变特征[J].林业科学,2010,46(12):23-29.
[2] 司登宇,张金池,陈莉莎,等.浙江省凤阳山不同林分类型土壤酶活性研究[J].水土保持通报,2013,33(6):258-263.
[3] 胡雷,王长庭,王根绪,等.三江源区不同退化演替阶段高寒草甸土壤酶活性和微生物群落结构的变化[J].草业学报,2014,23(3):8-19.
[4] 胡国珠,杨馥宁,谢双喜.黔中地区皂荚生长与不同岩性土壤酶活性的关系[J].南京林业大学学报:自然科学版,2012,36(6):58-62.
[5] 刘成刚,吴永波,薛建辉,等.刺槐滇柏混交林及纯林土壤酶与养分相关性研究[J].土壤通报,2012,43(6):1427-1431.
[6] 王群,夏江宝,张金池,等.黄河三角洲退化刺槐林地不同改造模式下土壤酶活性及养分特征[J].水土保持学报,2012,26(4):133-137.
[7] 王翔,李晋川,岳建英,等.安太堡露天矿复垦地不同人工植被恢复下的土壤酶活性和肥力比较[J].环境科学,2013,34(9):3601-3606.
[8] Fu B J, Liu S L, Chen L D, et al. Soil quality regime in relation to land cover and slope position across a highly modified slope landscape[J]. Ecological Research,2004,19(1):111-118.
[9] 杨宁,邹冬生,杨满元,等.衡阳紫色土丘陵坡地不同植被恢复阶段土壤酶活性特征研究[J].植物营养与肥料学报,2013,19(6):1516-1524.
[10] 陈祖拥,刘方,蒲通达,等.贵州中部喀斯特森林退化过程中土壤酶活性的变化[J].贵州农业科学,2009,37(2):47-51.
[11] 崔晓晓,王纪杰,罗惠宁,等.喀斯特峡谷区植被恢复过程中土壤酶活性的变化[J].南京林业大学学报:自然科学版,2011,25(2):103&107.
[12] 刘成刚,戎宇,薛建辉,等.喀斯特山地不同人工林土壤酶活性与草本层结构特征的关系[J].南京林业大学学报:自然科学版,2011,35(2):99-102.
[13] 符裕红,黄宗胜,喻理飞.岩溶区典型根系地下生境类型中土壤酶活性研究[J].土壤学报,2012,49(6):1202.
[14] 向悟生,李先琨,何成新,等.石漠化山地复合生态系统评价:以广西平果县龙何屯生态重建示范区为例[J].长江流域资源与环境,2007,16(6):826-830.
[15] 于明含,孙保平.广西平果县退耕还林土壤环境效应及生态效益价值估算[J].浙江农业学报,2012,24(1):114-119.
[16] 欧芷阳,申文辉,庞世龙,等.平果喀斯特山地不同植物群落的土壤质量评价[J].生态学杂志,2015,34(10):2771-2777.
[17] 鲍士旦.土壤农化分析[M].北京:中国农业出版社,2000.
[18] 关松荫.土壤酶及研究方法[M].北京:农业出版社,1986.
[19] 李振高,骆永明,滕应.土壤与环境微生物研究法[M].北京:科学出版社,2008.
[20] 王启兰,王溪,王长庭,等.高寒矮嵩草草甸土壤酶活性与土壤性质关系的研究[J].中国草地学报,2010,32(3):51-56.
[21] 司志国,俞小鹏,白玉杰,等.徐州城市绿地表层土壤酶活性及其影响因素[J].中南林业科技大学学报,2013(2):73-76,80.
[22] 戴凌,黄志宏,文丽.长沙市不同森林类型土壤养分含量与土壤酶活性[J].中南林业科技大学学报,2014,34(6):100-105.
[23] 杨宁,杨满元,雷玉兰,等.衡阳紫色土丘陵坡地土壤酶活性对植被恢复的响应[J].生态环境学报,2014,23(4):575-580.
[24] Guan Z J, Luo Q, Chen X, et al. Saline soil enzyme activities of four plant communities in Sangong River basin of Xinjiang, China[J]. Journal of Arid Land, 2014,6(2):164-173.
[25] 杨文彬,耿玉清,王冬梅.漓江水陆交错带不同植被类型的土壤酶活性[J].生态学报,2015,35(14):4604-4612.
[26] 龙健,李娟,江新荣,等.喀斯特石漠化地区不同恢复和重建措施对土壤质量的影响[J].应用生态学报,2006,17(4):615-619.
[27] 杨小青,胡宝清.喀斯特石漠化生态系统恢复演替过程中土壤质量特性研究:以广西都安县澄江小流域为例[J].生态与农村环境学报,2009,25(3):1-5.
[28] Puglisi E, Del Re A A M, Rao M A, et al. Development and validation of numerical indexes integrating enzyme activities of soils[J]. Soil Biology and Biochemistry,2006,38(7):1673-1681.
[29] 刘成刚,薛建辉.喀斯特石漠化山地不同类型人工林土壤的基本性质和综合评价[J].植物生态学报,2011,35(10):1050-1060.
[30] 赵燕娜,廖超英,李晓明,等.毛乌素沙地不同林龄樟子松人工林土壤酶活性变化特征[J].西北林学院学报,2014,29(2):1-5.
SoilEnzymeActivitiesofDifferentPlantCommunitiesinKarstMountainsofPinguoCounty,Guangxi
OU Zhiyang1, SHEN Wenhui1, PENG Yuhua1, PANG Shilong1,HE Qinfei1, HUANG Xiaorong1, LIANG Yan2
(1.GuangxiForestryResearchInstitute,Nanning530002,China;2.CentralSouthUniversityofForestry&Technology,Changsha410004,China)
To study soil enzyme activity characteristics of plant communities under different restoration stages in Pinguo karst moutains, Guangxi, differences of soil enzyme activities among plant communities were analyzed and the correlations between soil enzyme activities and soil chemical properties were also explored through correlation analysis, multiple comparisons and principal component analysis based on field survey and experimental analysis. The results showed that: (1) except soil alkaline phosphatase (APE), the activities of soil catalase (CAT), urease (URE), and invertase (INV) were significant different among plant communities, suggesting that community types have influence on the soil enzyme activities; (2) soil pH value was very significantly positively correlated with CAT and URE (p<0.01), and significantly negatively related to APE(p<0.05); (3) APE, CAT, URE, and INV were strongly associated with soil organic matter, total nitrogen, total phosphorus, total potassium, available nitrogen, and available potassium, but available phosphorus was not significantly correlated with the four parameters (p>0.05); (4) CAT, URE, and APE could be used as the sensitive indicators for dynamic changes of the soil qualities in the study area.
soil enzyme; karst; plant community; soil nutrient; correlation
2016-05-26
:2016-06-11
广西优良用材林资源培育重点实验室开放课题(14B0101);广西林业科技项目(桂林科字[2014]02号)
欧芷阳(1975—),女,广西富川人,博士,高级工程师,主要从事植物生态学研究。E-mail:ozhiyang@126.com
S718.5; S714.2; S154.2
:A
:1005-3409(2017)03-0075-05
