hMTERF3基因真核表达载体的构建与鉴定
2017-09-15孙美涛梅雯杨泽芳丁小倩张若鹏张晓娟熊伟
孙美涛,梅雯,杨泽芳,丁小倩,张若鹏,张晓娟,熊伟*
(1.大理大学基础医学院,云南大理671000;2.大理大学第一附属医院生殖科,云南大理671000;3.大理大学大理教学医院呼吸内科,云南大理671000)
hMTERF3基因真核表达载体的构建与鉴定
孙美涛1,梅雯1,杨泽芳1,丁小倩1,张若鹏2,张晓娟3,熊伟1*
(1.大理大学基础医学院,云南大理671000;2.大理大学第一附属医院生殖科,云南大理671000;3.大理大学大理教学医院呼吸内科,云南大理671000)
目的:构建和鉴定带3×Flag标签的人线粒体转录终止因子3基因(hMTERF3)真核表达载体。方法:根据NCBI数据库中hMTERF3基因序列设计引物,采用聚合酶链式反应从pGEM-hMTERF3重组克隆载体中扩增出hMTERF3基因开放阅读框序列,经HindⅢ和BamHⅠ双酶切后,连接入真核表达载体p3×FLAG-CMV-14的多克隆位点中,构建重组质粒p3×FLAGCMV-hMTERF3,分别用菌落PCR、限制性核酸内切酶分析和DNA序列分析3种方法鉴定重组子。结果:重组质粒p3×FLAGCMV-hMTERF3经双酶切鉴定和菌落PCR鉴定均获得大小为1 254 bp的目的条带,DNA序列分析和Blast序列比对结果表明该序列与GenBank中hMTERF3基因序列的同源性达到100%,插入基因的大小和方向均正确。结论:成功构建了hMTERF3基因的真核表达载体,为进一步研究hMTERF3基因在恶性肿瘤发生发展中的作用奠定了基础。
人线粒体转录终止因子3;真核表达载体;鉴定
线粒体基因的表达调控与线粒体的功能密切相关〔1〕。人类线粒体转录终止因子(human mito⁃chondrial transcription termination factor,hMTERF)是一类由核基因组编码,且能够与线粒体DNA(mi⁃tochondrial DNA,mtDNA)特异结合的单体蛋白质〔2〕。人类MTREF蛋白家族包括4个成员,分别为MTERF1~MTERF4,各成员主要参与线粒体DNA复制、转录、翻译过程的调控〔3〕。目前,线粒体转录终止因子仅在后生动物及植物中存在,在真菌中仍未发现与其同源的蛋白质〔4〕。
hMTERF3(human mitochondrial transcription ter⁃mination factor 3,hMTERF3)基因又被命名为人线粒体转录终止因子结构域1(mitochondrial tran⁃scription termination factor domain containing 1,hM⁃TERFD1)〔5〕。hMTERF3基因位于8号染色体(8q22.1),包含11个外显子〔6〕。研究显示,哺乳动物MTERF3是一种线粒体蛋白质,负调控线粒体的DNA转录水平和能量生成〔7〕。hMTERF3基因拷贝数扩增及其过表达对肝癌、乳腺癌、肺癌和胰腺癌的发生、进展和预后有重要作用,但其在恶性肿瘤的作用机制还不清楚〔8〕。本实验拟利用聚合酶链式反应(polymerase chain reaction,PCR)克隆hMTERF3基因编码序列,构建hMTERF3基因真核表达载体,为进一步研究hMTERF3基因在恶性肿瘤发生发展中的作用机制,以及寻找新的肿瘤基因治疗靶点的研究奠定基础。
1 材料与方法
1.1 细胞株和载体大肠埃希菌DH5α感受态细胞(博迈德生物技术有限公司);重组DNA克隆载体pGEM-hMTERF3(Sino Biological公司);真核表达载体p3×FLAG-CMV-14由云南大学生物化学与分子生物学实验室余敏副教授赠送。
1.2 试剂限制性核酸内切酶HindⅢ、BamHⅠ(大连Takara公司);2×Taq PCR Master Mix(Promega公司);T4 DNA连接酶(Gene Copoeia公司);Trans 2K DNA Maker、6×DNA Loading Buffer、DuRed核酸染料(北京全式金生物技术公司);质粒提取纯化试剂盒(Omega公司);DNA片段回收试剂盒(BioTeke公司);琼脂糖为西班牙进口分装;其余化学试剂均为国产分析纯;PCR引物由昆明硕擎生物技术有限公司合成,DNA测序由上海生工生物工程有限公司完成。
1.3 仪器PCR扩增仪(德国Eppendorf AG公司);BT423S型电子天平(德国Sarturios公司);DYY-12C型电泳仪(北京六一仪器厂);超净工作台(苏州安泰空气技术有限公司);TAZ-84A台式恒温培养箱(上海实验仪器总厂);TGL-16C台式高速离心机(上海安亭科学仪器厂);HH-4恒温水浴锅(上海国华电器有限公司);微量移液器(上海大龙医疗设备有限公司);LDZX-50FA立式压力蒸汽灭菌锅(上海申安医疗器械厂)。
1.4 方法
1.4.1引物设计检索GenBank数据库得到hM⁃TERF3基因(Gene ID:557786089)的转录本,PCR引物设计参照hMTERF3基因序列完整的转录本1(NM_015942.4)。上游引物P1(引入HindⅢ酶切位点):5'-GCGAAGCTTATGGCTTTGTCAGCCCA-3',下游引物P2(引入BamHⅠ酶切位点):5'-GCGGG⁃TACCAAGCGTTTTTAAGAATT-3',下划线部分为酶切位点,之前为保护碱基。预期的DNA扩增片段长度为1 254 bp。
1.4.2hMTERF3基因的PCR扩增和电泳检测以重组克隆质粒pGEM-hMTERF3为模板,用上、下游引物进行PCR扩增hMTERF3基因,反应体系为25 μL,其中模板DNA 1 μL,上游引物和下游引物各1 μL,2×Taq PCR Master Mix 12.5 μL,ddH2O 9.5 μL。反应条件为:95℃预变性3 min,95℃变性30 s,58℃退火30 s,72℃延伸1 min,共30个循环,72℃再延伸5 min。取5 μL PCR扩增产物,1%琼脂糖凝胶电泳,以检测扩增产物的片段大小。
1.4.3 p3×FLAG-CMV-hMTERF3真核载体的构建与PCR鉴定将hMTERF3基因的PCR产物经过回收纯化后,与真核表达质粒p3×FLAG-CMV-14分别用HindⅢ和BamHⅠ双酶切,酶切后用1%琼脂糖凝胶电泳,并经过凝胶回收纯化试剂盒回收酶切产物。将外源目的基因和真核表达载体酶切纯化的产物按照3:1的摩尔比混合,用T4 DNA连接酶16℃连接过夜,转化大肠埃希菌DH5α感受态细胞,然后取200 μL菌液涂布于含氨苄青霉素100 μg∕mL的LB固体培养基中。次日,随机挑取10个单菌落,分别接种于3 mL含50 μg∕mL氨苄青霉素的LB液体培养液中,37℃,200 r∕min振荡培养过夜。取过夜培养的菌液进行菌落PCR扩增以鉴定是否存在插入片段。菌落PCR鉴定引物为P1∕P2,反应体系25 μL,其中菌液1 μL,上游引物和下游引物各1 μL,2×Taq PCR Master Mix 12.5 μL,ddH2O 9.5 μL。反应条件为:95℃预变性5 min,95℃变性30 s,58℃退火30 s,72℃延伸1 min,共30个循环,72℃再延伸5 min。扩增产物取5 μL,1%琼脂糖凝胶电泳检测,以确定扩增产物大小。如果经琼脂糖凝胶电泳显示大小正确则用质粒提取试剂盒提取质粒DNA。
1.4.4 p3×FLAG-CMV-hMTERF3真核表达载体的酶切鉴定和测序鉴定将提取的重组真核表达质粒p3×FLAG-CMV-hMTERF3同时用HindⅢ和BamHⅠ双酶切,进行1%琼脂糖凝胶电泳检测。将酶切鉴定正确的重组真核表达质粒进行测序鉴定,重组质粒的测序引物:上游引物5'-CGCAAAT⁃GGGCGGTAGGCGTG-3',下游引物5'-CCAGCTTG⁃GTTCCCAATAGA-3'。DNA测序工作由上海生工生物工程有限公司完成。
2 结果
2.1hMTERF3基因的PCR产物电泳分析利用PCR从pGEM-hMTERF3克隆载体扩增得到hMTERF3基因完整的开放阅读框(open reading frame,ORF)片段。hMTERF3基因扩增产物经1%琼脂糖凝胶电泳检测,在1 254 bp处可见清晰、单一的的扩增条带,与预期的片段大小一致。见图1。
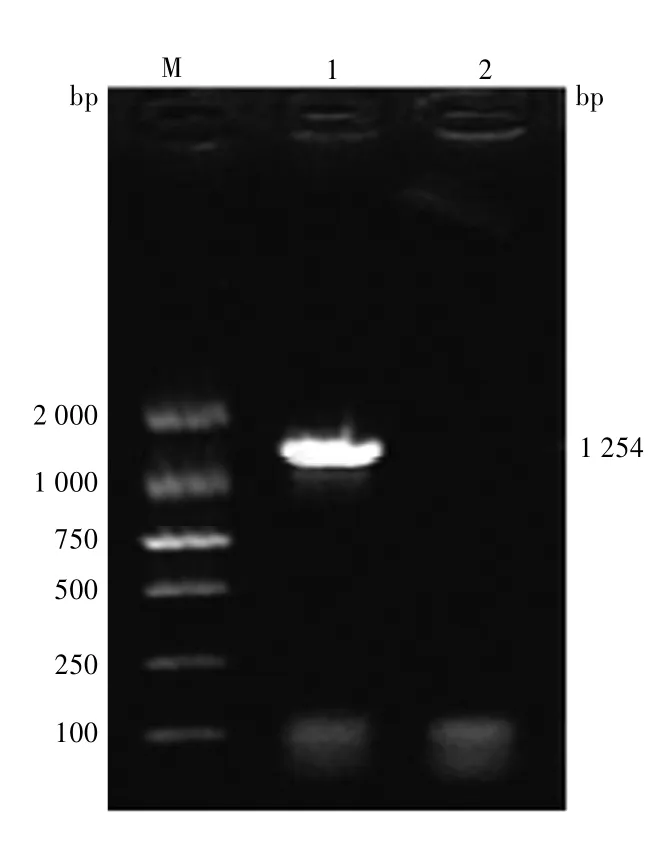
图1 hMTERF3基因PCR扩增产物
2.2 重组质粒p3×FLAG-CMV-hMTERF3的构建目的基因和p3×FLAG-CMV-14空载体经T4 DNA连接酶连接后,转化大肠埃希菌DH5α感受态细胞,挑取单克隆扩大培养,并采用碱裂解法提取重组质粒p3×FLAG-CMV-hMTERF3,用空载体作为对照进行1%琼脂糖凝胶电泳检测。结果显示,提取质粒的质量良好,纯度较高,无蛋白质和RNA的污染。见图2。
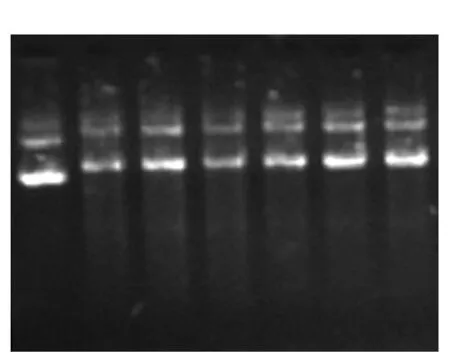
图2 p3×FLAG-CMV-hMTERF3重组质粒电泳图
2.3 重组质粒p3×FLAG-CMV-hMTERF3的鉴定重组表达载体p3×FLAG-CMV-hMTERF3的菌液PCR产物经琼脂糖凝胶电泳,结果显示在1 254 bp处可见一条特异性的目的条带。见图3。提取纯化的重组表达载体p3×FLAG-CMV-hMTERF3经HindⅢ和BamHⅠ双酶切鉴定,琼脂糖凝胶电泳检测可见大小约为6 310 bp的载体条带与1 254 bp的目的条带两个片段。空载体p3×FLAG-CMV-14经上述两个酶双酶切后,仅见一条6 310 bp的载体条带。见图4。
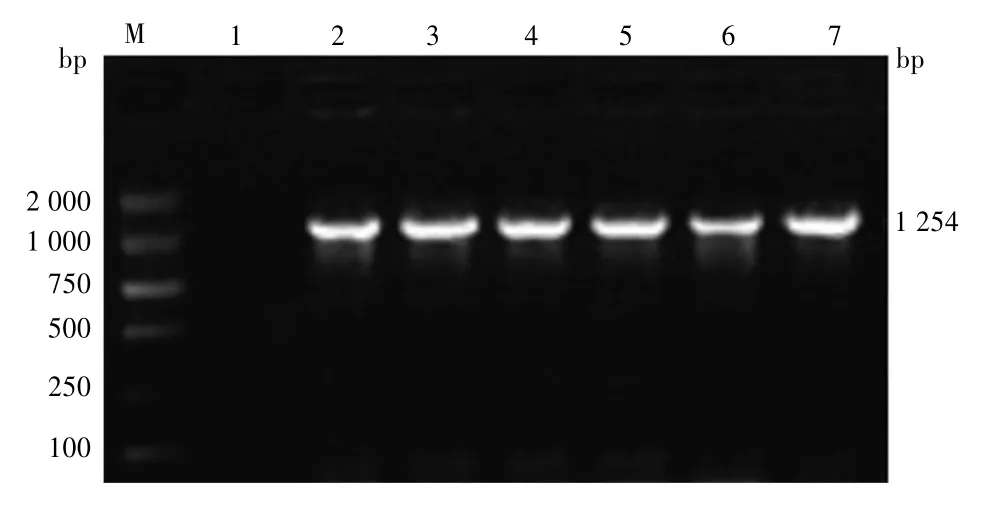
图3 菌液PCR鉴定重组质粒p3×FLAG-CMV-hMTERF3
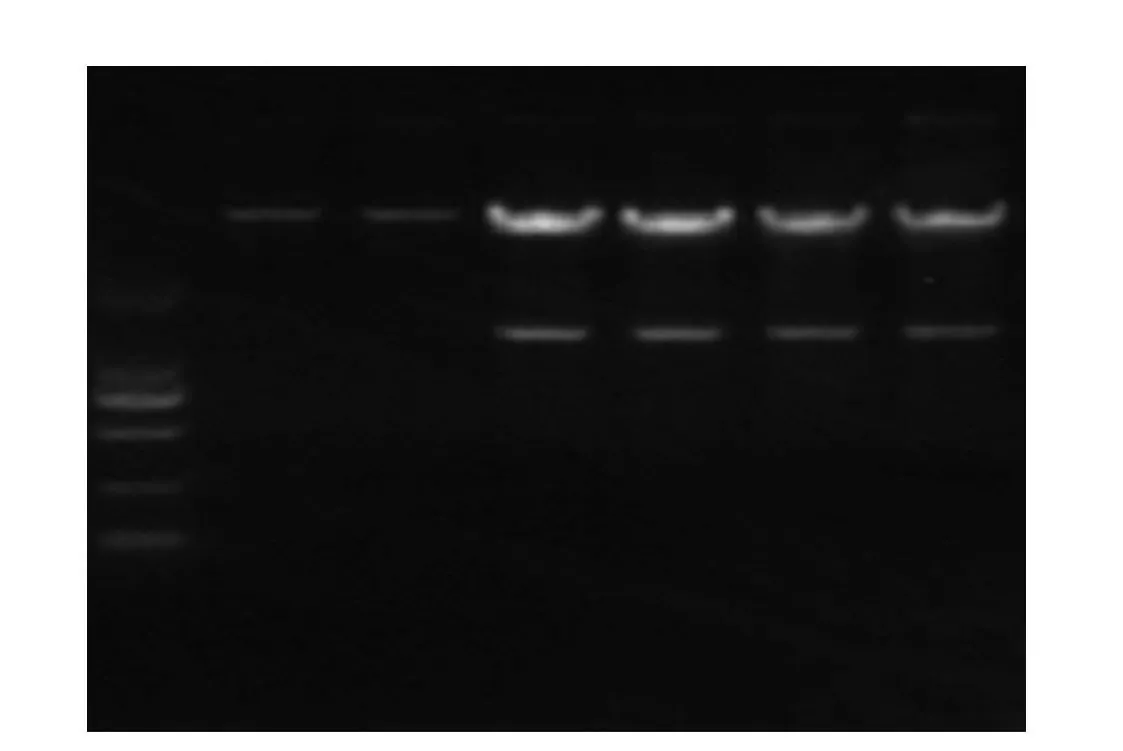
图4 HindⅢ∕BamHⅠ双酶切鉴定重组质粒p3× FLAG-CMV-hMTERF3
2.4 重组质粒p3×FLAG-CMV-hMTERF3的序列分析鉴定对质粒p3×FLAG-CMV-hMTERF3上的多克隆位点内的外源DNA进行序列分析鉴定,测序结果经Blast程序与GenBank检索到的编码序列(NM_ 015942.4)同源性为100%,说明构建的重组质粒正确。见图5。
3 讨论
线粒体是细胞中的重要细胞器,细胞的能量供应来自于线粒体。随着人们对线粒体基因转录机制和人类线粒体疾病的深入研究,对人类MTERF蛋白家族的研究已成为一个热点〔9-10〕。MTERF3基因是MTERF基因超家族中进化最保守的成员,在低等的果蝇到高等的哺乳动物细胞中都存在同源基因〔11〕。hMTERF3基因定位于人类8号染色体(8q22.1),基因全长22 216 bp,含有11个外显子和10个内含子〔6〕。hMTERF3基因编码的蛋白质产物共417个氨基酸,N端1~68个氨基酸为进入线粒体的导肽,其后349个氨基酸为成熟的hMTERF3蛋白。我们在前期研究中,成功地在大肠埃希菌中原核表达和纯化了hMTERF3蛋白,并制备了小鼠抗hMTERF3多克隆抗体。进一步采用细胞免疫荧光的方法证实,hMTERF3蛋白定位在人宫颈癌HeLa细胞的线粒体上〔12〕。WRDENBERG等〔13〕的研究显示,哺乳动物MTERF3不仅负性调节mtDNA转录,而且能通过调节线粒体中核糖体大亚基的组装,影响核糖体的生物合成〔7〕。HYVÄRINEN等用二维琼脂糖凝胶电泳法对mtDNA复制中间体的研究发现,在胚肾293T细胞中过表达hMTERF3能抑制线粒体DNA复制,造成细胞内线粒体DNA拷贝数的下降〔13-14〕。这些结果进一步提示,hMTERF3可能还参与抑制mtDNA复制过程中复制中间体的形成及复制叉的延伸。

图5 Blast程序比对重组质粒p3×FLAG-CMV-hMTERF3部分测序结果
近年来的研究发现,在人类肝癌、胃癌、宫颈癌等多种恶性肿瘤中mtDNA含量和线粒体呼吸链酶活性降低,这提示恶性肿瘤中参与线粒体基因表达调控的蛋白因子可能存在着表达异常〔15-17〕。ZHANG等的研究表明,hMTERF3基因扩增和表达异常与恶性肿瘤发生发展的关系密切〔8〕。但hMTERF3基因在肿瘤细胞中具体作用机制亟待进一步研究。
本实验中使用的p3×FLAG-CMV-14是一个典型的真核表达载体,能在哺乳动物细胞中高效表达外源基因,从而实现目的基因的过表达。构建的真核表达载体为质粒,比病毒载体安全性更高,真核表达载体p3×FLAG-CMV-14含有多克隆位点,便于目的基因插入至载体〔18〕。同时,载体上含有氨苄青霉素抗性基因(Ampr)和新霉素抗性基因(Neor)使得质粒容易筛选,构建好的重组真核表达载体能够稳定在宿主细胞内复制和高效表达。p3×FLAGCMV-14载体上的FLAG标记物是专为标记目的蛋白质设计的多肽标记物,其特点是标记物的序列不是来自任何已知的蛋白质。该标记物是由8个氨基酸组成的多肽,具有亲水性,可以置于外源蛋白质的羧基末端〔19〕。目前,已有商品化的FLAG抗体可识别标记物,方便进行外源蛋白质的检测。通过本实验构建的真核表达质粒,可为下一步研究hMTERF3基因对肿瘤细胞氧化磷酸化活性和恶性生物学行为的影响奠定基础。
〔1〕时多,王璐,周运恒,等.线粒体基因表达的调控及其与某些疾病的关系〔J〕.生命的化学,2006,26(3):250-252.
〔2〕ROBERTI M,POLOSA P L,BRUNI F,et al.The MTERF family proteins:mitochondrial transcription regulators and beyond〔J〕.BiochimBiophysActa,2009,1787(5):303-311.
〔3〕熊伟,余敏,左绍远.线粒体转录终止因子蛋白家族在线粒体基因表达中的调节作用〔J〕.中国生物化学与分子生物学报,2015,31(3):223-231.
〔4〕ROBERTI M,POLOSA P L,BRUNI F,et al.MTERF fac⁃tors:a multifunction protein family〔J〕.Biomol Concepts,2010,1(2):215-224.
〔5〕ROBERTI M,BRUNI F,LOGUERCIO POLOSA P,et al.MTERF3,the most conserved member of the mTERF-fami⁃ly,is a modular factor involved in mitochondrial protein synthesis〔J〕.Biochim Biophys Acta,2006,1757(9∕10):1199-1206.
〔6〕高菁霞.线粒体转录终止因子(mTERF)对细胞增殖影响的研究〔D〕.昆明:云南大学,2007.
〔7〕PARK C B,ASIN-CAYUELA J,CÁMARA Y,et al.MTERF3 is a negative regulator of mammalian mtDNA transcription〔J〕.Cell,2007,130(2):273-285.
〔8〕ZHANG C,WU N,GAO F,et al.MTERFD1 functions as an oncogene〔J〕.Oncotarget,2016,8(10):1-8.
〔9〕BONAWITZ N D,CLAYTON D A,SHADEL G S.Initiation and beyond:multiple functions of the human mitochondrial transcription machinery〔J〕.Mol Cell,2006,24(6):813-825.
〔10〕孙美涛,王昀,李月,等.hMTERF3基因启动区的生物信息学分析〔J〕.大理大学学报,2017,2(2):40-45.
〔11〕MONTOYA J,LÓPEZ-PÉREZ M J,RUIZ-PESINI E.Mi⁃tochondrial DNA transcription and diseases:Past,present and future〔J〕.Biochimica et Biophysica Acta(BBA)-Bioenergetics,2006,1757(9):1179-1189.
〔12〕杨勇琴,张成桂,孙美涛,等.人MTERF3蛋白的原核表达与多克隆抗体制备〔J〕.医学研究生学报,2016,29(10):1020-1025.
〔13〕WREDENBERG A,LAGOUGE M,BRATIC A,et al.MTERF3 regulates mitochondrial ribosome biogenesis in invertebrates and mammals〔J〕.PLoS Genet,2013,9(1):e1003178.
〔14〕HYVÄRINEN A K,POHJOISMÄKI J L,HOLT I J,et al.Overexpression of MTERFD1 or MTERFD3 impairs the completion of mitochondrial DNA replication〔J〕.Mol Biol Rep,2011,38(2):1321-1328.
〔15〕李海霞,张淑兰.线粒体DNA在妇科恶性肿瘤中的研究进展〔J〕.国际妇产科学杂志,2009,36(1):53-55.
〔16〕韩琤波,李凡,杨雪飞,等.胃癌线粒体DNA拷贝量的变化〔J〕.世界华人消化杂志,2004,12(2):258-261.
〔17〕高园,聂鸿靖,杨栋,等.肝癌患者单个核细胞线粒体DNA拷贝数与抗氧化能力的变化〔J〕.中国应用生理学杂志,2016,32(1):1-5.
〔18〕严会文,苏敏,高杰,等.大鼠PAX6基因真核表达载体构建及鉴定〔J〕.贵阳医学院学报,2016,41(3):288-293.
〔19〕张海洋,冯慕华,徐彤,等.人核呼吸因子2基因真核表达载体的构建与鉴定〔J〕.大理学院学报,2014,13(2):37-42.
Construction and Identification of Eukaryotic Expression Vector of Human MTERF3
Sun Meitao1,Mei Wen1,Yang Zefang1,Ding Xiaoqian1,Zhang Ruopeng2,Zhang Xiaojuan3,Xiong Wei1*
(1.Pre-clinical College,Dali University,Dali,Yunnan 671000,China;2.Department of Reproductive Medicine,The First Affiliated Hospital of Dali University,Dali,Yunnan 671000,China;3.Department of Respiratory Medicine,Dali Teaching Hospital of Dali University,Dali,Yunnan 671000,China)
Objective:To construct and identify the eukaryotic expression vector of FLAG-tagged human MTERF3 gene.Methods:The human MTERF3 gene was amplified by Polymerase Chain Reaction(PCR).The recombinant products of the p3×FLAG-CMV-hMTERF3 were gained by T4 DNA ligase connecting MTERF3 gene fragment and eukaryotic expression vector p3×FLAG-CMV-14 with restriction enzymes HindⅢand BamHⅠ.The recombinant pasmid p3×FLAG-CMV-hMTERF3 were identified by colony PCR, double restriction enzyme digest and DNA sequencing.Results:A specific band of 1 254 bp was detected from recombinant plasmid p3×FLAG-CMV-hMTERF3 by digestion of HindⅢand BamHⅠ.The sequencing and identification showed that homology between this sequence and the human MTERF3 gene sequence from GenBank was 100%,and the size and the direction of the inserted gene were right.Conclusion:The eukaryotic expression vector of human MTERF3 was constructed successfully,which may lay the foundation for a further study of the interaction mechanism between behavior of MTERF3 in tumor cells and its development.
human MTERF3;eukaryotic expression vector;identification
Q78
A
2096-2266(2017)08-0018-05
10.3969∕j.issn.2096-2266.2017.08.005
(责任编辑 李杨)
国家自然科学基金资助项目(31601155;81560458);云南省教育厅科学研究基金资助项目(2014Z126);大理大学大学生创新创业计划资助项目(CXCY-X-2016-18);大理大学大学生科研基金资助项目(KYSX201609)
2017-01-04
2017-01-21
孙美涛,硕士研究生,主要从事细胞分子生物学研究.
*通信作者:熊伟,副教授,博士.
